微生物发酵降解豆粕抗营养因子的应用研究
王小明 ,杨艳艳,杨在宾,刘晓明,李兆勇
(1.山东农业大学动物科技学院,泰安 271018;2.北京市饲料工业协会,北京 100193;3.北京科为博生物科技有限公司,北京 100107)
微生物发酵降解豆粕抗营养因子的应用研究
王小明1,杨艳艳2,杨在宾1,刘晓明3,李兆勇3
(1.山东农业大学动物科技学院,泰安 271018;2.北京市饲料工业协会,北京 100193;3.北京科为博生物科技有限公司,北京 100107)
豆粕是饲料工业应用最广泛的植物性蛋白质原料,但由于存在多种抗营养因子,降低了豆粕的利用率。通过微生物发酵处理,可以去除豆粕抗营养因子,提高豆粕营养价值。该文综述了豆粕抗营养因子种类及作用原理,重点论述了微生物发酵降解豆粕抗营养因子的研究进展。
豆粕;抗营养因子;微生物发酵
豆粕目前是饲料工业应用最为广泛的植物性蛋白质饲料资源,具有粗蛋白含量高、氨基酸组成合理、动物消化利用率高等特点,并且含丰富的、能够提高动物免疫力的大豆异黄酮[1]。然而,豆粕中含有多种抗营养因子如胰蛋白酶抑制因子、尿素酶、抗原蛋白等,会降低饲料的营养价值和利用率,对动物体内的某些器官具有破坏作用,且对动物的生理、生长、健康等造成不良影响,从而降低畜禽的生产性能[2]。近年来,豆粕中抗营养因子的消除一直是人们关注的焦点,而微生物发酵处理方法成为目前研究的热点。
1 胰蛋白酶抑制因子
胰蛋白酶抑制因子是对豆粕的利用影响最大的抗营养因子,它是分子量为7.975~21.5 KD的多肽或蛋白质,在豆粕中占有约2%的含量,也称为胰蛋白酶抑制剂。到目前为止,一共发现7~10种不同的胰蛋白酶抑制因子,但研究比较详细的只有2种,一种称为Kunitz类蛋白酶抑制因子(简称KTI),另一种称为Bowan-Birk类蛋白酶抑制因子(简称BBI)[3-4]。其中,KTI含量为1.4%左右,主要抑制动物体内分泌的胰蛋白酶活性;BBI含量为0.6%左右,可同时抑制胰蛋白酶和胰凝乳蛋白酶活性。胰蛋白酶抑制因子,一方面与蛋白酶结合成复合物,降低蛋白酶的活性,进而降低蛋白质的消化率;一方面,作用于动物体的胰腺而引起补偿性反应,造成消化性吸收功能失调,影响消化吸收。
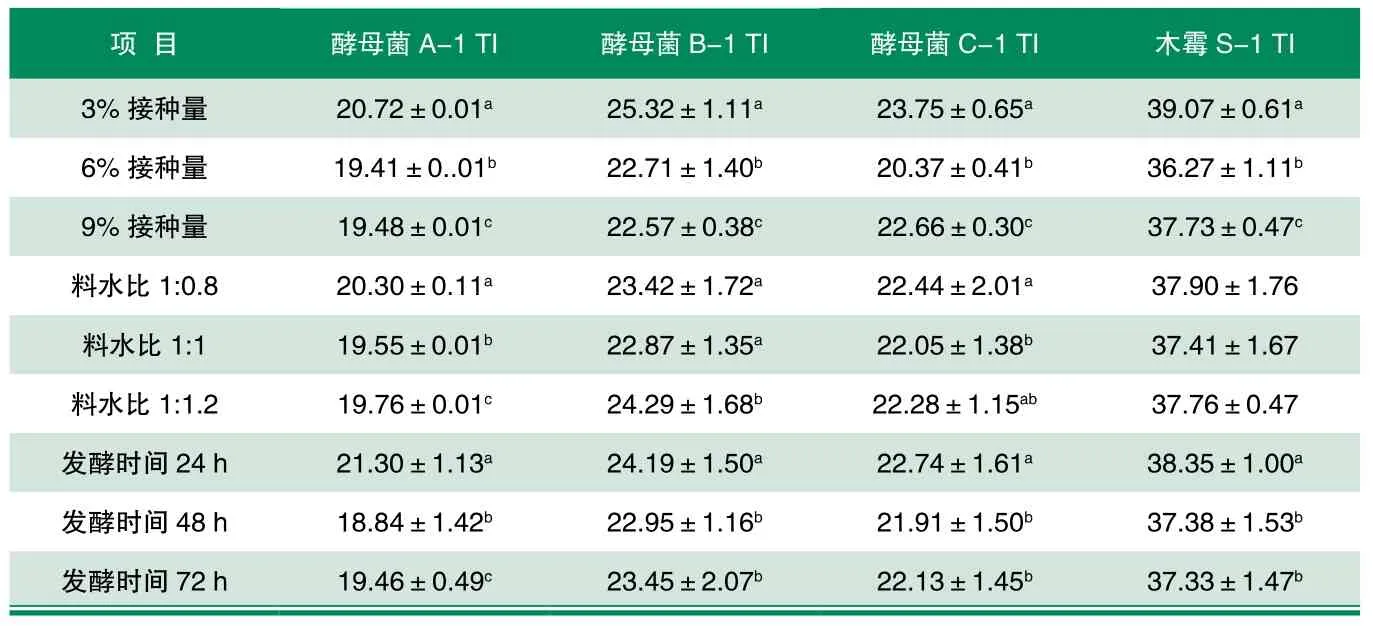
表1 菌种和发酵条件对发酵豆粕中胰蛋白酶抑制因子含量的影响[8]
Hackler等[5]研究认为,大豆产品中胰蛋白酶抑制剂50%以上的活性被消除,才可认为其是安全的。Stale等[6]以乳酸菌发酵豆粉,发现乳酸菌发酵可显著降低大豆制品中胰蛋白酶抑制因子的含量。刘海燕等[7]在乳酸菌发酵豆粕的试验中发现,在发酵72h后,豆粕中胰蛋白酶抑制剂活性仅为发酵前的1%。由表1可以看出[8],在发酵条件不同的情况下,豆粕的胰蛋白酶抑制因子含量有明显的不同。在优化的发酵条件下,豆粕经酵母菌A-1、B-1、C-1和木霉S-1发酵之后,胰蛋白酶抑制因子含量分别降低60.38%、54.11%、57.30%和24.36%,其中酵母菌A-1的降低效果最明显;而用混合菌种发酵豆粕后发现,在最优接种比例条件下,发酵豆粕中的胰蛋白酶抑制因子含量降低了69.42%[8]。刘媛媛等[9]认为,用乳酸菌、酿酒酵母菌和枯草芽孢杆菌混合发酵豆粕,对抗营养因子的降解比较彻底,其中胰蛋白酶抑制因子被完全降解。
2 植酸
植酸是植物性饲料中有机磷的主要存在形式,大豆60%~80%的磷是以植酸的形式存在。大豆中的植酸含量约为2%,是一种很强的络合剂,能与肠胃中的金属离子,形成难溶性的植酸盐络合物,导致必需矿物质元素的利用率降低,阻碍机体对必需矿物元素的生物利用,严重时会影响机体的正常代谢与生殖能力。植酸与蛋白质结合,通过降低蛋白质的营养价值,减少了机体对植物蛋白质的摄取。另外,植酸还能与大豆蛋白或一些酶结合,形成植酸蛋白质/酶复合物,影响蛋白质/酶的生理功能,影响营养物质的消化吸收。
Stale等[6]以乳酸菌发酵豆粉发现,乳酸菌发酵对植酸含量的影响不大仅略有下降。姜丹等[8]在用酵母菌A-1、B-1、C-1和木霉S-1固体菌种发酵豆粕的研究中发现,在发酵条件不同的情况下,豆粕的植酸含量有明显的不同。在优化的发酵条件下,豆粕经酵母菌A-1、B-1、C-1和木霉S-1发酵之后,植酸的含量分别降低了76.08%、81.27%、77.08%和58.39%,其中酵母菌B-1的降低效果最明显;而用混合菌种发酵豆粕发现,在最优接种比例条件下,发酵豆粕中的植酸含量降低 了 84.36%。Hirabayashi和 Yano等[10]研究发现,使用宇佐美曲霉发酵豆粕,得到的发酵豆粕植酸被全部降解。
3 大豆抗原蛋白
大豆中存在4种球蛋白具有抗原性和致敏性,其中最主要的是大豆球蛋白(11S)与三种伴大豆球蛋白(α-conglycinin、β-伴大豆球蛋白(7S)和γ-conglycinin)[11]。动物的免疫系统对大豆抗原蛋白比较敏感,小部分抗原蛋白会穿过小肠上皮细胞间隙或上皮细胞内的空隙完整地进入血液和淋巴,刺激肠道免疫组织,可引起过敏反应和肠黏膜的损害。过敏反应会造成肠道的免疫损伤,引起肠绒毛萎缩、黏膜双糖分解酶的数量及活性下降;降低木糖的吸收率,升高血清中抗大豆免疫球蛋白IgG滴度;使得营养物质和矿物质的转运、吸收紊乱,导致消化不良、腹泻和生长受阻。
程天德等[12]的研究结果表明,利用枯草芽孢杆菌发酵豆粕,可以降解85.39%的大豆抗原蛋白。石慧等[13]利用筛选出的降解能力较强的枯草芽孢杆菌,通过对发酵条件的初步优化,大豆抗原蛋白的降解率可高达90.00%以上。此外,在利用两步发酵法的试验中发现,最终豆粕中的主要抗原蛋白的残留量仅为0.15%[14]。刘海燕等[7]用乳酸菌发酵豆粕的试验结果表明,在乳酸菌和蛋白酶的作用下,豆粕中的7S和11S抗原蛋白被降解成小分子蛋白,去除效果明显,尤其是7S抗原蛋白,在72 h,几乎全部被去除,去除率几乎达到了99.77%,11S抗原蛋白去除效果稍差,但去除率也达到了90%以上。
4 其他抗营养因子
存在豆粕中的还有凝集素、低聚糖、脂肪氧化酶、脲酶等抗营养因子。凝集素在豆粕中的含量约为3%。凝集素是一种蛋白质,在动物肠道中不易被蛋白酶水解,通过与小肠壁上皮细胞表面特异性受体结合,损坏小肠壁刷状缘黏膜结构,干扰消化酶的分泌,降低对营养物质的消化吸收,进而影响蛋白质的利用,使动物的生长受到阻碍甚至停滞[15]。另外,凝集素还对肠壁、肠道细菌及免疫机能产生一定影响,引起肠腔糜烂,微绒毛变短萎缩,肠细胞退化等。豆粕低聚糖是大豆可溶性寡糖的总称,主要成分为水苏糖(4%)、棉籽糖(1%)和蔗糖(5%)等。棉籽糖和水苏糖是半乳糖类的非还原性糖,动物小肠消化液中缺乏α-半乳糖苷酶,故棉籽糖和水苏糖不能被消化而直接进入到动物的大肠中经肠道产气微生物作用,转化成挥发性脂肪酸,然后再产生气体,如CO2、H2、NH3[15]。脂肪氧化酶又称抗维生素因子,约占大豆总蛋白质的2%,是一种含非血红素铁的蛋白质,能专一催化大豆中多元不饱和脂肪酸(亚油酸、亚麻酸)的加氧反应,生成的过氧化物可以破坏与其共存的维生素A、D、E、B12和胡萝卜素等,分解生成醇、酮和醛类等挥发性物质而产生腥味,降低大豆蛋白的效价和营养价值[16-17]。脲酶在豆粕中的含量约为0.02~0.35 U/g,在适当的条件下能被激活变成有毒性的物质,将含氮类的物质分解为氨,从而使蛋白氮的利用率降低,同时氮的积存会引起动物体中毒。致甲状腺肿素在豆粕中的含量是极低的,主要通过影响碘的利用,引起甲状腺的肿大[18-19]。
Stale等[6]以乳酸菌发酵豆粉,发现由于乳酸菌具有较强的α-半乳糖苷酶活性,在发酵过程中,能有效去除水苏糖和棉籽糖。如图1所示[7],随着发酵时间的延长,发酵豆粕中低聚糖的含量逐渐下降。
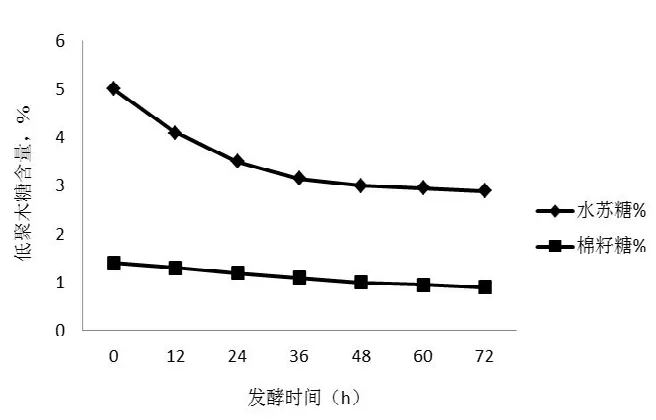
图1 发酵豆粕中低聚糖含量的变化
刘媛媛等[9]认为,用乳酸菌、酿酒酵母菌和枯草芽孢杆菌混合发酵豆粕,对抗营养因子的降解较彻底,其中脂肪氧化酶、大豆凝血素和致甲状腺肿素都被完全降解。
5 小结
综上所述,豆粕作为饲料工业应用最广泛的植物性蛋白质原料,在实际生产中发挥着极其重要的作用,但豆粕中存在的多种抗营养因子,降低了豆粕的营养价值和利用率。微生物发酵法主要是利用微生物对普通豆粕进行发酵处理,而微生物在发酵过程中产生的众多复杂的酶系或活性物质,可以有效分解和破坏豆粕中的抗营养因子,基本上消除抗营养因子的抗营养作用,并且累积有益的代谢产物,提高豆粕的营养价值和利用率,使发酵豆粕在饲料行业中有广阔的发展和应用前景。
总之,随着微生物学、动物营养与饲料科学等学科的不断发展,微生物发酵技术应用于饲料领域将越来越广泛,发酵饲料将是未来饲料行业重点发展的方向。
[1] 陶勇坚,吴志波,李红萍.发酵豆粕的营养特性及作用机制[J].福建畜牧兽医 ,2007,29(4):19-21.
[2] KIERSJL,MEIJERJC,NOUTMJR,et al.Effect of fermented soya beans on diarrhoea and feed efficiency in weaned piglets[J].Journal of Applied Microbiology,2003,95(3):545-552.
[3] 姚晓红,吴逸飞,汤江武,等.微生物混合发酵去除生豆粕中胰蛋白酶抑制剂的研究 [J]. 中国饲料 ,2005,26(24):14-16.
[4] 黄凯,郑田要,朱建华,等.大豆胰蛋白酶抑制剂的研究进展[J].江西农业学报 ,2008,20(8):95-98.
[5] HACKLERLR,BURENJP,STEINKRAUSKH,et al.Effect of heat treatment on nutritive value of soymilk protein fed to weanling rats[J].Journal of Food Science,1965,30(4):723-728.
[6] REFSTIES,SAHLSTRMS,BR THEN E,etal.Lactic acid fermentation eliminates indigestible carbohydrates and antinutritional factors in soybean meal for Atlantic salmon()[J].Aquaculture,2005,246(1):331-345.
[7] 刘海燕.乳酸菌发酵豆粕及其功效研究[D].长春:吉林农业大学,2012.
[8] 姜丹.微生物发酵对豆粕中营养物质和抗营养因子影响的研究[D].长春:吉林大学,2011.
[9] 刘媛媛.微生物发酵豆粕营养特性研究及其对肉仔鸡生长,免疫及消化功能的影响[D].杭州:浙江大学,2006.
[10] HIRABAYASHIM,MATSUIT,YANO H,et al.Fermentation of soybean meal with Aspergillususamii reduces phosphorus excretion in chicks[J].Poultry science,1998,77(4):552-556.
[11] 王春林,陈喜斌,于炎湖,等.大豆中抗营养因子及其处理方法[J].饲料工业 ,2000,21(9):12-14.
[12] 程天德,戴必胜,冯小军.枯草芽孢杆菌蛋白酶水解大豆蛋白的研究[J].中国食品工业,2010(1):60-61.
[13] 石慧,赵述淼,梁运祥.降解大豆抗原蛋白枯草芽孢杆菌的筛选及发酵条件[J]. 湖北农业科学 ,2011,50(10):1969-1971.
[14] 石慧,罗璇,刘艳,等.两步发酵法降解大豆抗原蛋白的研究[J].饲料工业 ,2011,32(3):22-25.
[15]游金明,李德发.大豆抗营养因子研究进展[J].饲料与畜牧:新饲料 ,2007(B09):40-43.
[16] CHRISTOPHER J,PISTORIUS E,AXELROD B.Isolation of an isozyme of soybean lipoxygenase[J].Biochimica Et Biophysica Acta,1970,198(1):12.
[17] MOHRI S, ENDO Y,MATSUDAK,et al.Physiological effects of soybean seed lipoxygenases on insects[J].Agricultural and biological chemistry,1990,54(9):2265-2270.
[18] 丁安林,张艳,常汝镇,等.大豆脂肪氧化酶研究进展[J].大豆科学 ,1995,14(1):67-73.
[19] 傅翠真,徐文英,常汝镇,等.中国大豆脂肪氧化酶类型鉴定及酶活性分析[J]. 华北农学报 ,1996,11(1):25-29.
山东省现代农业产业技术体系生猪创新团队建设项目SDAIT-08-04
王小明(1990-),男,硕士研究生,研究方向:动物营养与饲料科学,E-mail:xmwang29@163.com
杨在宾(1961-),男,教授,博士生导师,研究方向:动物营养与饲料科学,E-mail:yzb204@163.com
2017-07-14)

