高效液相色谱法测定高粱红色素中两种化合物含量
申科敏, 胡晓琴, 韩 春,*
(1.长治医学院 公共卫生与预防医学系, 山西 长治 046000;2.长治市食品药品检验所, 山西 长治 046000;3.长治学院 化学系, 山西 长治 046011)

高效液相色谱法测定高粱红色素中两种化合物含量
申科敏1,2, 胡晓琴3, 韩 春3,*
(1.长治医学院 公共卫生与预防医学系, 山西 长治 046000;2.长治市食品药品检验所, 山西 长治 046000;3.长治学院 化学系, 山西 长治 046011)
建立了HPLC-双波长法测定高粱红色素中槲皮素-7-葡萄糖苷和芹菜素含量的方法。样品经前处理提取溶解后通过高效液相色谱分析,以色谱峰保留时间和紫外可见光谱进行定性。采用C18反相色谱柱,以甲醇为流动相A,1%乙酸溶液为流动相B,梯度洗脱,流速为1.0 mL/min,进样量20 μL,选择486 nm(槲皮素-7-葡萄糖苷)和333 nm(芹菜素)两处波长同时检测,峰面积外标法定量。结果表明,两种化合物质量浓度在10.2~408.0 μg/mL内线性关系良好,相关系数均大于0.999,检出限为2 μg/mL,平均加标回收率为97.3 %~102.8 %,RSD为1.6%~3.9%(n=6)。该方法操作简单,重复性和稳定性好,能满足高粱红色素中槲皮素-7-葡萄糖苷和芹菜素同时测定的要求。
槲皮素-7-葡萄糖苷; 芹菜素; 高粱红色素; 高效液相色谱法
高粱红色素(sorghum pigment)又称高粱红、高粱色素等[1],是从高粱粒和高粱壳中提取的一种天然色素[2-3],主要成分为芹菜素(apigenin;5,7,4′-三羟基黄酮)和槲皮素-7-葡萄糖苷(quercetin-7-glucoside;3,5,3′,4′-四羟基黄酮-7-葡萄糖苷)[4]。食品安全国家标准(GB 2760—2014)规定,高粱红色素可在熟肉制品、果冻、饮料、糕点等各类食品中按生产需要适量使用[5]。
高粱红色素作为一种广泛应用在食品生产行业中的添加剂,目前对高粱红色素的品质性能评价主要依据GB 1886.32—2015《食品安全国家标准 食品添加剂 高粱红中的具体质量指标》[4]。该质量指标中“色价”在评价高粱红色素方面更主要是反映产品着色能力的强弱,不能反映该色素本身的主成分含量水平及原料本身的真伪,所以,应引入主成分含量水平的评价。现有文献主要集中在高粱红色素的提取工艺、理化性质等方面的研究[6-14],未见对高粱红色素组成成分含量测定的报道。本研究建立了一种HPLC-双波长法测定高粱红色素中槲皮素-7-葡萄糖苷和芹菜素两种成分含量的方法,希望为高粱红色素主成分的检测提供科学参考依据,改进高粱红色素的评价方法。
1 实验部分
1.1 材料与试剂
槲皮素-7-葡萄糖苷标准品(含量98%,20 mg/支)、芹菜素标准品(含量98%,25 mg/支),南京景竹生物科技有限公司;高粱红色素(批号:20150718、20151021、20151023、20151024),长治学院化学系自制[15];甲醇(色谱纯),德国Meker公司;无水乙醇(分析纯)、冰乙酸(分析纯),天津市永大化学试剂有限公司;盐酸(优级纯),洛阳市化学试剂厂;超纯水,自制。
1.2 仪器与设备
Waters e2695型高效液相色谱仪(配有Waters 2998二极管阵列检测器(PDA)和Empower色谱工作站),美国Waters公司。
1.3 色谱条件
色谱柱Shim-pack VP-ODS C18(250 mm×4.6 mm,5 um)柱温30 ℃;进样体积20 μL;流速1 mL/min;检测波长:芹菜素(333 nm)、槲皮素-7-葡萄糖苷(486 nm)。流动相A为甲醇,B为1%乙酸溶液。梯度洗脱程序0~7 min,60%A;7~9 min,60%~80%A;9~15 min,80%A;15~16 min,80%~60%A;16~26 min,60%A。
1.4 槲皮素-7-葡萄糖苷标样溶液和高粱红色素供试溶液的制备
1.4.1标准溶液的制备
准确称取槲皮素-7-葡萄糖苷和芹菜素标准品各10.20 mg至10 mL容量瓶中,加乙醇- 盐酸溶液(pH值3.0)溶解、定容摇匀备用;槲皮素-7-葡萄糖苷和芹菜素的质量浓度均为1.02 mg/mL。分别量取标准储备液0.1,0.2,0.5,1.0,2.0,4.0 mL至10.0 mL容量瓶中,用乙醇- 盐酸溶液(pH值3.0)稀释至刻度,摇匀,得芹菜素和槲皮素-7-葡萄糖苷混合系列标准溶液,质量浓度为:10.2,20.4,51.0,102.0,204.0,408.0 μg/mL,按1.3方法进行检测。
1.4.2高粱红色素样品的制备
称取0.5 g高粱红色素于三角瓶中,用100 mL乙醇-盐酸溶液(pH值3.0)于30 ℃超声10 min后真空抽滤,滤液转移到250 mL的容量瓶中定容,取1 mL过0.45 μm的滤膜于试剂瓶中待HPLC检测。
2 结果与分析
2.1 色谱条件优化
2.1.1检测波长的选择
基于1.3中的色谱条件,采用Waters 2998二极管阵列检测器(PDA)对槲皮素-7-葡萄糖苷和芹菜素标准溶液进行200~800 nm全波长扫描,提取两种物质的紫外吸收光谱(见图1)。图1显示,芹菜素在267 nm和333 nm处有吸收峰存在,考虑到333 nm处峰形较宽且规则,有利于芹菜素液相条件下的检测,所以拟选择333 nm作为芹菜素的检测波长[15];槲皮素-7-葡萄糖苷在486 nm处有最大吸收峰,拟选择486 nm作为槲皮素-7-葡萄糖苷的检测波长。

图1 芹菜素和槲皮素-7-葡萄糖苷的紫外吸收光谱Fig.1 Spectrogram of UV absorption of apigenin and quercetin-7-glucoside
2.1.2流动相的选择
为选择较佳检测条件,本实验分别考察了甲醇与水、甲醇与0.1%乙酸水溶液、甲醇与1%乙酸水溶液、乙腈与1%乙酸水溶液等流动相体系对槲皮素-7-葡萄糖苷和芹菜素在C18柱上保留行为的影响。结果发现,甲醇与1%乙酸水溶液为流动相时峰形好,响应高;通过1.3梯度洗脱条件,使样品中指标成分获得了良好的分离度,干扰少,保留时间相对适中。槲皮素-7-葡萄糖苷的保留时间为7.3 min,芹菜素的保留时间为13.1 min,液相色谱见图2、图3。
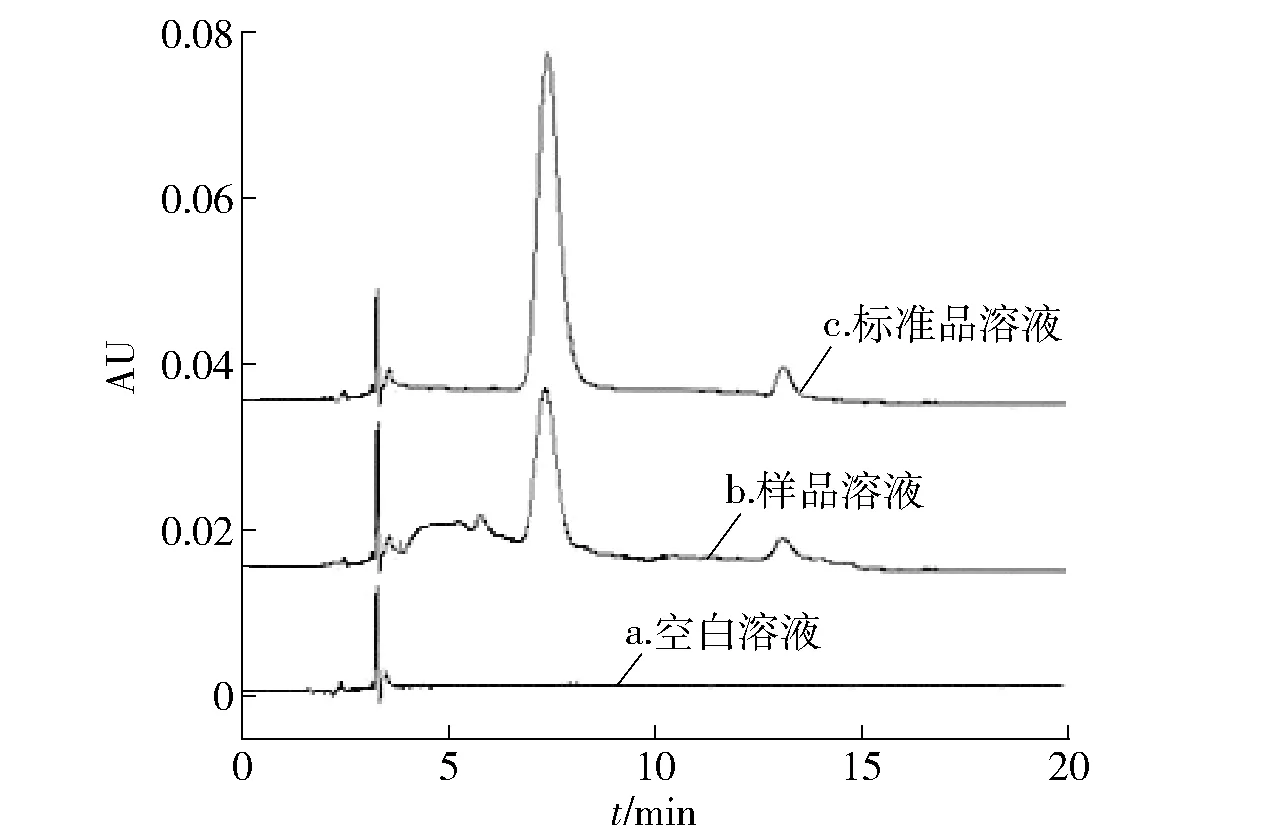
图2 槲皮素-7-葡萄糖苷HPLCFig.2 HPLC chromatograms of quercetin-7-glucoside
2.2 线性范围、检出限及定量限的确定
将1.4.1中系列质量浓度的混标溶液按1.3中色谱条件进样分析,以质量浓度为横坐标(X,μg/mL),
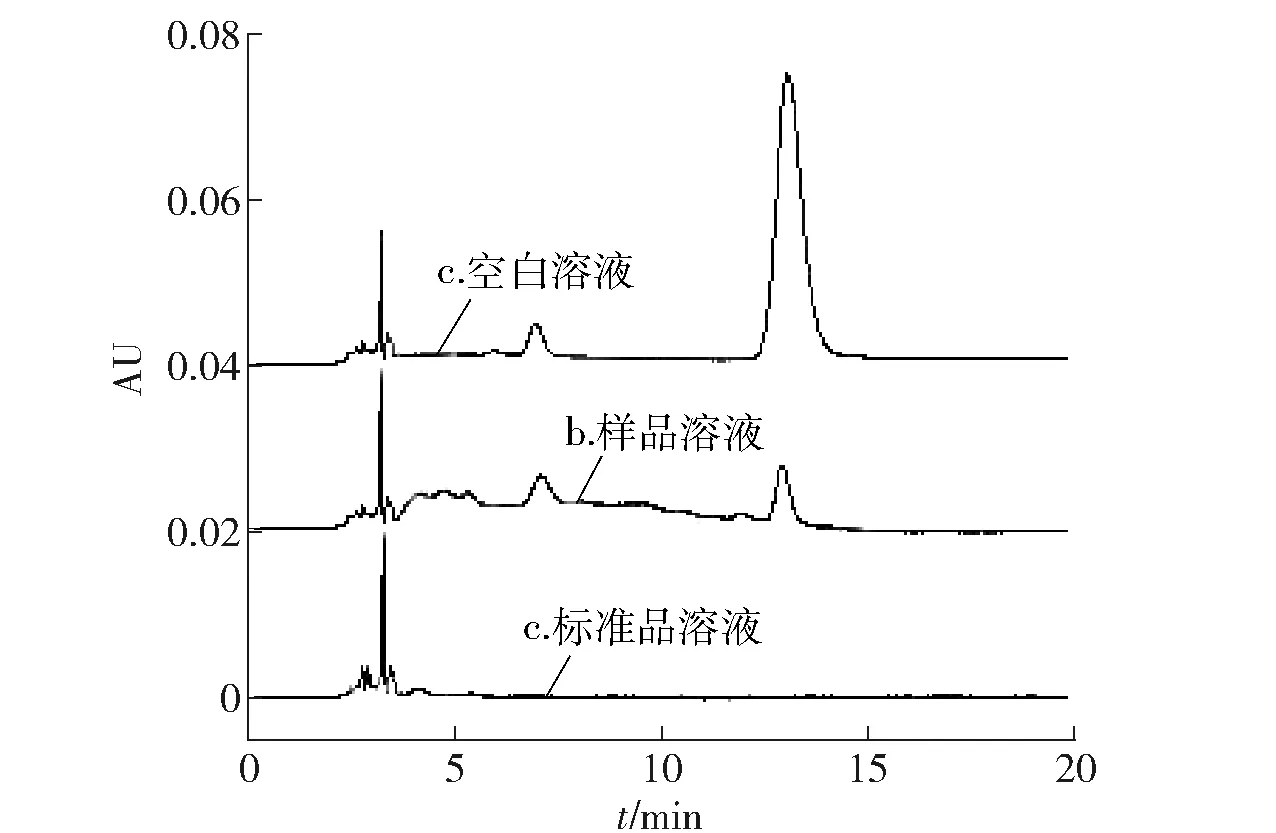
图3 芹菜素HPLCFig.3 HPLC chromatograms of Apigenin
峰面积为纵坐标(Y),进行回归分析;将标准溶液逐步稀释至其响应值为噪音的3倍(S/N=3∶1),所对应的溶液质量浓度为检出限;同时将加标样品经1.4.2中方法前处理,测得响应值为噪音的10倍(即S/N=10∶1),所对应的溶液质量浓度为方法定量限。回归方程、线性范围、相关系数(R2)、检出限和定量限结果见表1。由表1可知,该方法线性良好,线性范围、相关系数、检出限和定量限符合国家标准食品理化检测要求[16]。
2.3 回收率和精密度分析

表1 槲皮素-7-葡萄糖苷和芹菜素回归方程、检测限和定量限
采用加标回收实验,在高粱红色素样品(批号:20150718)中分别加入芹菜素和槲皮素-7-葡萄糖苷各5.00,10.00,100.00 mg/g,按1.4.2进行样品处理,每个浓度水平做6个平行实验,按1.3进行HPLC检测,测定其回收率,结果如表2。表2中在3个不同的水平,槲皮素-7-葡萄糖苷的平均回收率为97.3%~101.5%,其相对标准偏差RSD(n=6)为2.1%~3.1%;芹菜素的平均回收率为101.1%~102.8%,其相对标准偏差RSD(n=6)为1.6%~3.9%,回收率良好,完全满足国家标准食品理化检测要求[16]。
2.4 重复性实验结果
取高粱红色素同一样品(批号:20151021)6份,按1.4.2制备高粱红色素供试样品溶液,按1.3色谱条件测定,记录峰面积,计算芹菜素和槲皮素-7-葡萄糖苷RSD,结果见表3。表3中,芹菜素和槲皮素-7-葡萄糖苷RSD(n=6)分别为0.87%和0.94%,表明该实验方法的重复性良好。
2.5 稳定性实验结果
称量高粱红色素适量粉末(批号:20151023)一份,按1.4.2的样品处理方法制得供试样品溶液,放置0,2,4,6,8,10 h,按1.3色谱条件分别进行测定,记录峰面积,结果见表4。由表4可知,芹菜素和槲皮素-7-葡萄糖苷RSD(n=6)分别为0.62%和0.94%,表明该方法处理的样品溶液在室温条件下放置10 h内稳定。
2.6 实际样品测定结果
采用本方法对长治市周边所采集的3份高粱自制的高粱红色素进行处理和测定,结果见表5。由结果可知,3个批次的高粱红色素样品中槲皮素-7-葡萄糖苷和芹菜素的含量趋于稳定,可推测长治地区生长的高粱制得的高粱红色素所含两成分分别在16.4 mg/g和12.7 mg/g左右。
3 结 论
建立了一种用HPLC测定高粱红色素中槲皮素-7-葡萄糖苷和芹菜素两种主成分含量的方法。采用Shim-pack VP-ODS C18色谱柱,以甲醇-1%乙酸水溶液为流动相进行梯度洗脱,流速为1.0 mL/min,进样量20 μL,柱温为30 ℃,槲皮素-7-葡萄糖苷和芹菜素检测波长分别为486 nm和333 nm。结果表明,槲皮素-7-葡萄糖苷和芹菜素在14 min内出峰,与其他杂质组分能实现很好的分离,在质量浓度为10.2~408.0 μg/mL时,相关系数均大于0.999,平均回收率为97.3%~102.8%,RSD为1.6%~3.9%(n=6),方法检测限为2.0 μg/mL。
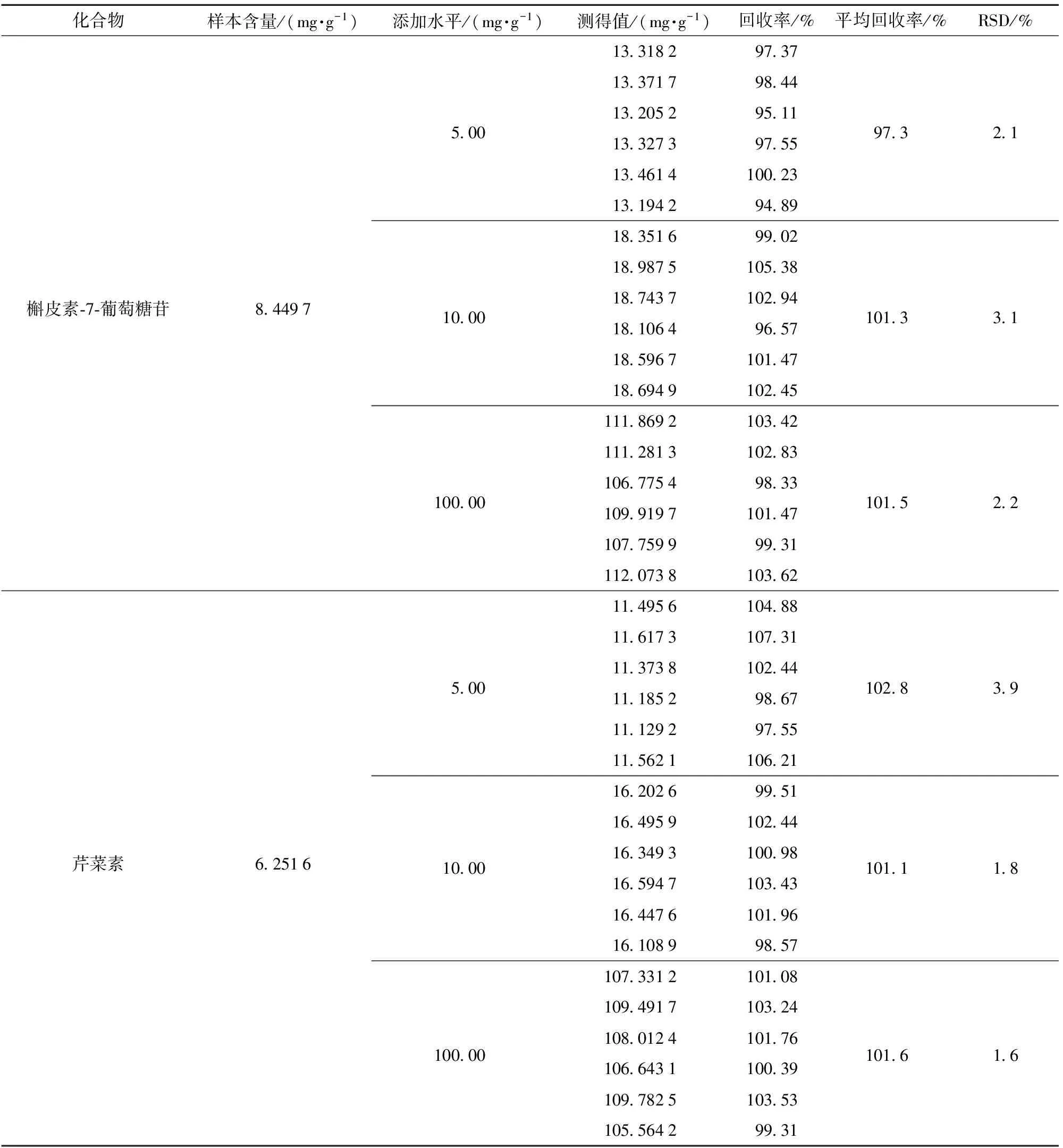
表2 加样回收率和精密度测定结果
n=6

表3 重复性实验结果
n=6

表4 稳定性实验结果
n=6
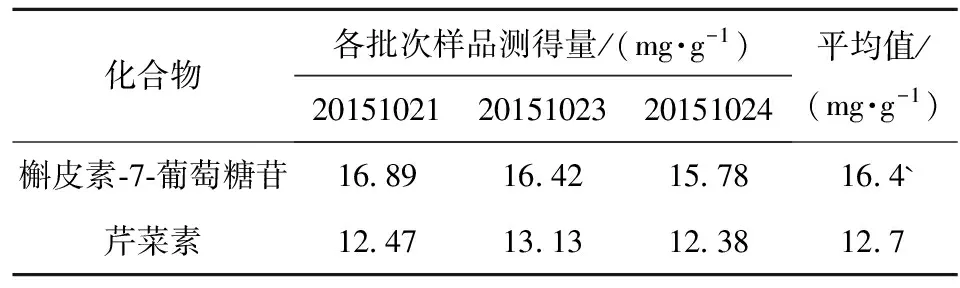
表5 3个批次的高粱红色素两成分含量
[1] 张兆俊, 肖丽娟. 天然色素高粱红开发应用[J]. 粮食与油脂, 2005(5): 40-41.
ZHANG Z J, XIAO L J. Development and utilization of natural pigment kaoliang color[J]. Cereals & Oils, 2005(5): 40-41.
[2] 张爱琴, 方昭希, 娄莉青, 等. 高粱红色色素的初步研究[J]. 食品科学, 1990(11): 27-29.
[3] 张宏宇, 吕玉璋, 李韬. 高粱红色素乙醇提取工艺的研究[J]. 现代食品科技, 2010, 26(3): 300-302.
ZHANG H Y, LÜ Y Z, LI T. Extraction of red pigment from sorghum[J]. Modern Food Science and Technology, 2010, 26(3): 300-302.
[4] 中华人民共和国国家卫生和计划生育委员会. 食品安全国家标准 食品添加剂 高粱红:GB 1886.32—2015[S]. 北京: 中国标准出版社, 2015.
[5] 中华人民共和国国家卫生和计划生育委员会. 食品安全国家标准 食品添加剂使用标准:GB 2760—2014[S]. 北京: 中国标准出版社, 2014.
[6] 王毅民, 李师翁. 天然高粱红色素提取方法与性质的研究[J]. 甘肃科学学报, 1996, 8(2): 82-85.
WANG Y M,LI S W. The studies on the methods of extraction and stability of natural kaoliang red pigment[J]. Journal of Gansu Sciences, 1996, 8(2): 82-85.
[7] 詹嘉红, 蓝宗辉. 李红色素的理化性质及其应用研究[J]. 现代食品科技, 2007, 23(8): 61-63.
ZHAN J H, LAN Z H. Study on physicochemical chara-cterization and application of red pigment fromPrunussalicina[J]. Modern Food Science and Technology, 2007, 23(8): 61-63.
[8] 张海容, 狄文婷, 赵新瑞. 高粱红色素萃取方法的研究[J]. 食品科学, 2006, 27(3): 124-129.
ZHANG H R, DI W T, ZHAO X R. Study on extraction methods for red pigment of sorghum[J]. Food Science, 2006, 27(3): 124-129.
[9] 潘训海. 从高粱中提取红色素的研究[J]. 广州化工, 2013, 41(15): 74-86.
PAN X H. Extraction of red pigment from sorghum[J]. Guangzhou Chemical Industry, 2013, 41(15): 74-86.
[10] 李竹英, 毛绍春, 戴荣珍, 等. 紫黑高粱色素的提取工艺研究[J]. 云南大学学报(自然科学版), 2010, 32(s1): 294-298.
LI Z Y, MAO S C, DAI R Z, et al.Study on extraction method of pigment of purple black sorghum[J]. Journal of Yunnan University(Natural Sciences Edition), 2010, 32(s1): 294-298.
[11] 陈金娥, 刘丽琴, 张海容. 高粱红色素稳定性研究[J]. 食品研究与开发, 2009, 30(1): 189-192.
CHEN J E, LIU L Q, ZHANG H R. Study of stability on red pigment of sorghum[J]. Food Research and Development, 2009, 30(1): 189-192.
[12] 王金亭. 天然高粱红色素研究与应用进展[J]. 粮食与油脂, 2012(11): 7-11.
WANG J T. Research advances on natural red pigment form sorghum bicolor[J]. Cereals and Oils, 2012(11): 7-11.
[13] 毛绍春, 李竹英. 高粱色素含量测定方法的研究[J]. 云南大学学报(自然科学版), 2011, 33(s1): 301-304.
MAO S C, LI Z Y. Study on determination method of content of sorghum pigment[J]. Journal of Yunnan University(Natural Sciences Edition), 2011, 33(s1): 301-304.
[14] 李竹英, 毛绍春, 戴荣珍, 等. 红高粱色素的提取工艺及结构的初步分析[J]. 中国农学通报, 2010, 26(17): 79-85.
LI Z Y, MAO S C, DAI R Z, et al. Extracted method and preliminary structural analysis of red sorghum pigment[J]. Chinese Agricultural Science Bulletin, 2010, 26(17): 79-85.
[15] 田新宇,范翠梅,渠田田, 等. 半枝莲总黄酮中7种成分的含量测定及抗肿瘤活性[J]. 中国实验方剂学杂志,2017, 23(1): 53-59.
TIAN X Y, FAN C M, QU T T, et al. Determination of seven compounds and antitumor activity of total flavonoids from scutellariae barbatae herba[J]. Chinese Journal of Experimental Traditional Medical Formulae, 2017, 23(1): 53-59.
[16] 中国合格评定国家认可中心. 实验室质量控制规范 食品理化检测:GB/T 27404—2008[S]. 北京: 中国标准出版社, 2008.
SimultaneousDeterminationofTwoComponentsinSorghumPigmentbyHPLC
SHEN Kemin1,2, HU Xiaoqin3, HAN Chun3,*
(1.DepartmentofPublicHealthandPreventiveMedicine,ChangzhiMedicalCollege,Changzhi046000,China; 2.ChangzhiInstituteforFoodandDrugControl,Changzhi046000,China; 3.DepartmentofChemistry,ChangzhiUniversity,Changzhi046011,China)
To determine flavonoid compounds of quercetin-7-glucoside and apigenin in sorghum pigment, the method of HPLC-double wavelength was established. Two components were extracted and disolved after pretreatment and determined by the retention time and UV absorption spectra. Then they were analyzed by HPLC on a C18column and detected at the wavelength of 486 nm and 333 nm for quercetin-7-glucoside and apigenin respectively, with a mobile phase of methanol and 1% acetic acid for gradient elution. The velocity of flow was 1.0 mL/min and the injection volume was 20 μL. The components were quantitatively determined by calculating the peak areas. The results showed that the calibration curve was liner in the range of 10.2-408.0 μg/mL with the correlation coefficients of more than 0.999. The detection limit was 2 μg/mg. The average recoveries ranged from 97.3% to 102.8%, and the relative standard deviations (RSD) were 1.6%-3.9% (n=6). The method showed good repeatability, accuracy, and stability and could be applied in the accurate quantification of two flavonoid components in sorghum pigment.
quercetin-7-glucoside; apigenin; sorghum pigment; HPLC
叶红波)
10.3969/j.issn.2095-6002.2017.06.007
2095-6002(2017)06-0042-06
申科敏,胡晓琴,韩春. 高效液相色谱法测定高粱红色素中两种化合物含量[J]. 食品科学技术学报,2017,35(6):42-47.
SHEN Kemin, HU Xiaoqin, HAN Chun. Simultaneous determination of two components in sorghum pigment by HPLC[J]. Journal of Food Science and Technology, 2017,35(6):42-47.
TS202.3; TS207.3
A
2017-02-15
国家自然科学基金青年基金资助项目(21402012);国家自然科学基金资助项目子项目(GJZXM201605)。
申科敏,男,工程师,硕士,主要从事食品质量安全检测方面的研究;*韩 春,女,副教授,博士,主要从事药物合成与分析方面的研究,通信作者。

