直投式发酵剂制备工艺对乳酸菌存活率的影响
任香芸, 何志刚,*, 李维新, 林晓姿, 梁璋成
(1.福建省农业科学院 农业工程技术研究所, 福建 福州 350003;2.福建省农业科学院 福建省农产品(食品)加工重点实验室, 福建 福州 350013)

直投式发酵剂制备工艺对乳酸菌存活率的影响
任香芸1,2, 何志刚1,2,*, 李维新1,2, 林晓姿1,2, 梁璋成1,2
(1.福建省农业科学院 农业工程技术研究所, 福建 福州 350003;2.福建省农业科学院 福建省农产品(食品)加工重点实验室, 福建 福州 350013)
为明确直投式发酵剂制备过程中菌体细胞存活率的变化,选择植物乳杆菌R23为实验菌,采用扫描电镜、透射电镜和正交试验等手段对收集条件、预冻条件和冻干时间等进行研究。结果表明,植物乳杆菌R23优化收集时间为15 h,此时菌量达到最大且活力较高;在优化的离心条件下菌体细胞存活率达92.4%,其中离心力起关键作用;采用梯度预冻即-20,-40,-80 ℃各1,2,3 h,可使物料达到较优冻结效果;发酵剂物料冻干至水质量分数为1.20%时最有利于贮藏。研究在明确菌剂制备关键因素对菌体细胞干预机制的基础上,还获得了适宜的制备条件,对直投式发酵剂的规模化生产具有重要的指导意义。
直投式发酵剂; 细胞存活率; 植物乳杆菌R23; 干预机制; 制备条件
菌种高密度培养、菌体浓缩收集和真空冷冻干燥等过程均是高活力直投式发酵剂(direct vat set,DVS)制备的重要环节[1]。前期研究确定了适宜植物乳杆菌R23高密度增殖的工艺参数,菌量达1.0×1010CFU/mL以上,为后期菌剂制备工艺奠定了良好基础[2]。目前菌体浓缩主要有超滤法和离心法等[3]。超滤法对设备要求较高,条件不易控制,菌种容易被污染;离心虽然对菌体有所损伤,但此法简便、快速、处理量大,菌种纯度容易控制,适用于商业化生产[4]。离心浓缩中菌种活性、离心条件等均可影响菌株对冷冻及干燥的敏感度。目前已有乳酸菌离心分离条件的相关研究[5-6],但各离心因素对细胞活力的具体影响机制尚无实际证据,因此有必要深入探讨影响菌体细胞存活率的主要因子及其干预机制,提高菌体的离心浓缩效果。
真空冷冻干燥过程主要分为预冻、升华干燥和解析干燥3个步骤。预冻是将物料中游离态水冻结成冰的过程,预冻效果对于冻干物质形态的维持非常关键,但相比于其他冻干过程,预冻参数的优化在乳酸菌菌剂制备工艺研究中尤为欠缺。已有研究表明,预冻环节中降温速度、冻结温度和冻结时间都是重要的工艺参数,它们相互作用,共同影响着冻结物质的结晶情况[7]。其中,降温速度是目前研究的焦点,大部分研究认为快速冻结有利于菌体存活,也有研究认为快速冻结或慢速冻结皆有其利弊[8];因此,在保证较高存活率的前提下,需顾及菌剂物理性状和溶解性能等。有关冻结温度和冻结时间的研究相对较少,但其合理选择可保证物料的适度预冻,使干燥后的物料很好地保持原有性质并缩短干燥时间[9]。
研究以植物乳杆菌R23为实验菌,着重对离心浓缩条件及真空冷冻干燥过程的关键参数进行优化,旨在提高冻干菌体细胞存活率,同时改善菌剂理化性状和降低能耗。
1 材料与方法
1.1 材料与试剂
1.1.1菌种
植物乳杆菌(Lactobacillusplantarum) R23,由福建省农产品(食品)加工重点实验室分离、鉴定并保存。
1.1.2培养基
LHR20参见文献[2]。改良TJA培养基参见文献[10]。
1.1.3保护剂配方
甘油2.8%,谷氨酸钠2.1%,海藻糖1.4%,山梨醇0.7%,脱脂乳10%,均为质量分数。
1.1.4主要试剂
脱脂乳粉(优级纯),美国BD公司。
1.2 仪器与设备
SPX-250BS-Ⅱ型生化培养箱,上海新苗医疗器械制造有限公司;ZQLY-180S型立式双层恒温振荡器,上海知楚仪器有限公司;SW-CJ-IFD型单人单面净化工作台,苏州净化设备有限公司;GI54DW型高压灭菌器,美国致微公司;TGL-18C型高速冷冻离心机,上海安亭科学仪器厂;LD PLUS型真空冷冻干燥机,德国Christ公司;HT7700型透射电镜,日立公司;6380LV型扫描电镜,日本电子公司。
1.3 实验方法
1.3.1生长曲线测定
将活化的植物乳杆菌R23接种于LHR20液体培养基中,30 ℃静置培养,每隔3 h取样测定菌量,绘制菌体生长量随时间的变化趋势图。
1.3.2植物乳杆菌R23收集条件优化
选择离心力、离心温度和离心时间为考察对象,以细胞存活率为指标,作L9(34)正交试验,各因素水平如表1。将所得数据用DPS软件进行处理分析,并通过扫描电镜和透射电镜观察菌体超微形态结构,深入探讨主体影响因素对菌体细胞存活率的作用机制。
1.3.3预冻条件对菌体存活率影响的测定
按照V保护剂∶V菌泥=4∶1将保护剂与植物乳杆菌R23菌泥混合、分装,并作以下预冻处理: 1)单温预冻ⅰ为-40 ℃,6 h;2)单温预冻ⅱ为-80 ℃,6 h;3)梯度预冻ⅲ为-20,-40,-80 ℃各1,2,3 h;4)梯度预冻ⅳ为-20,-40,-80 ℃各2 h;5)梯度预冻ⅴ为-20,-40,-80 ℃各3,2,1 h。检测处理前后的活菌量,分析确定适宜的预冻条件。
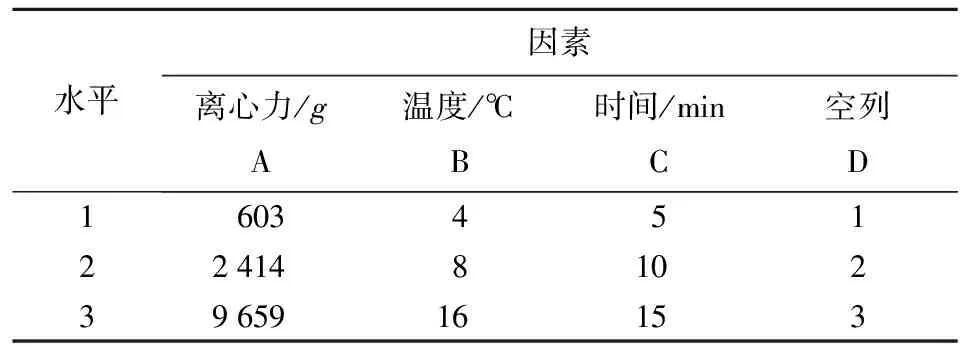
表1 L9(34)正交试验因素水平表
离心力603,2 414,9 659g分别代表的转速为3 000,6 000,9 000 r/min。
1.3.4冻干时间对菌剂水质量分数及菌体存活率影响的测定
在1.3.3基础上,将预冻好的样品放入真空冷冻干燥机,分别于0,5,10,15,24 h取出检测菌量和水质量分数,并以冻干前样品为对照进行菌体存活率计算,分析冻干过程中菌量及水质量分数变化规律。
1.4 计算方法
1.4.1菌量测定方法
采用平板菌落计数法,参照GB 4789.2—2010《食品微生物学检验 菌落总数测定》进行。
1.4.2细胞存活率的计算
菌体细胞存活率的计算,参照文献[11]进行,计算公式见式(1):
细胞存活率=S2/S1×100%。
(1)
式(1)中:S1为处理前活菌总数,CFU/mL;S2为处理后残留活菌数,CFU/mL。
2 结果与分析
2.1 菌种适宜收集时间分析
在优化的培养基与培养条件下,植物乳杆菌R23的生长曲线如图1。0~3 h为菌体生长延滞期,菌量略有下降;3 h后进入对数生长期,15 h后进入稳定期。为获得高菌量且高活力的菌种,宜选择对数生长末期15 h作为R23的收集时间。
2.2 离心条件对菌体收集效果的影响及作用机制
菌体离心收集在保证高浓度菌量的同时,可避免代谢产物乳酸盐等对菌体的毒害。各因素对菌体细胞存活率的影响主次顺序为离心力>温度>时间,其中离心力的影响达显著水平(见表2、表3)。
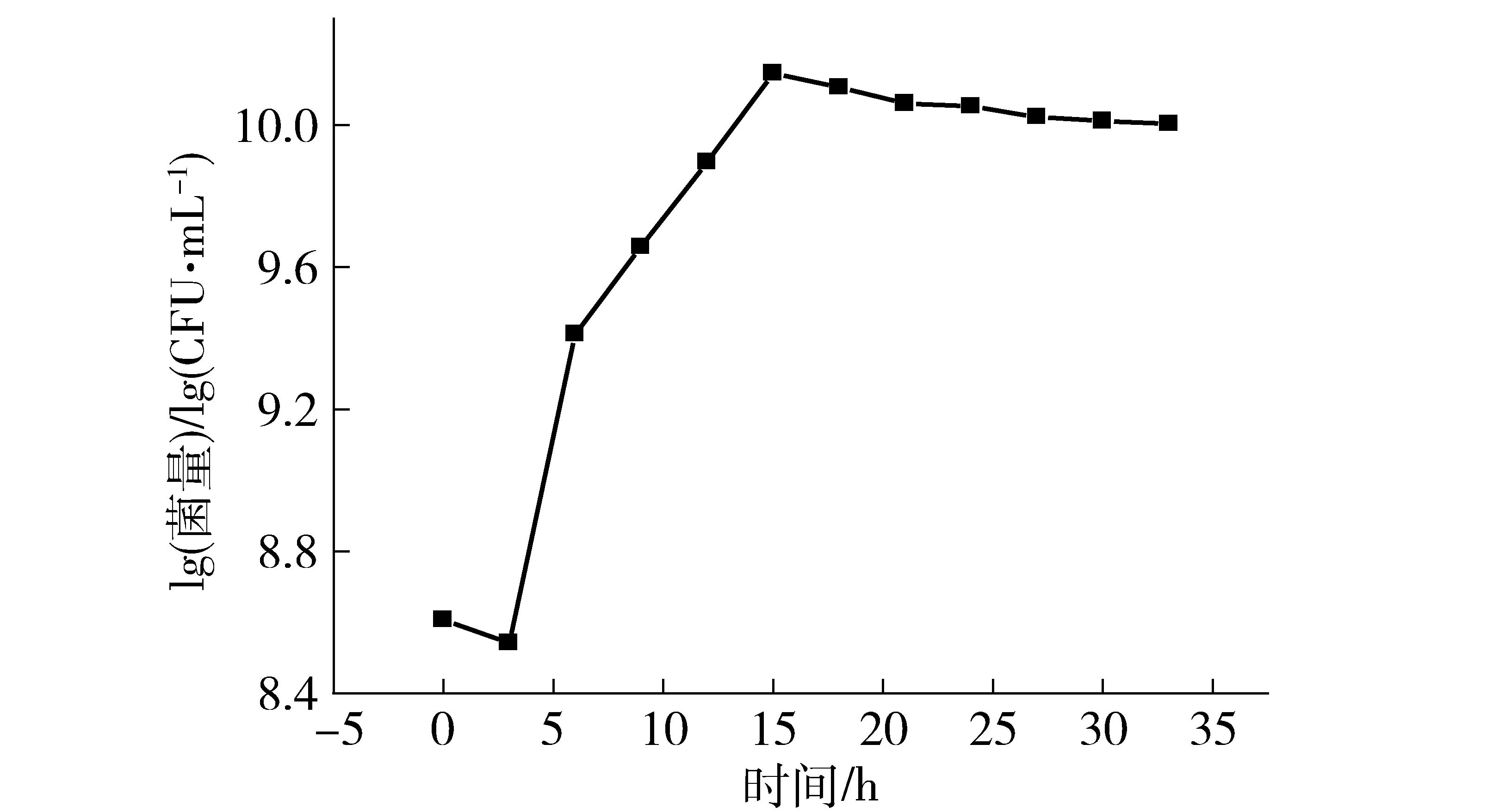
图1 植物乳杆菌R23的生长曲线Fig.1 Growth curve of Lactobacillus plantarum R23
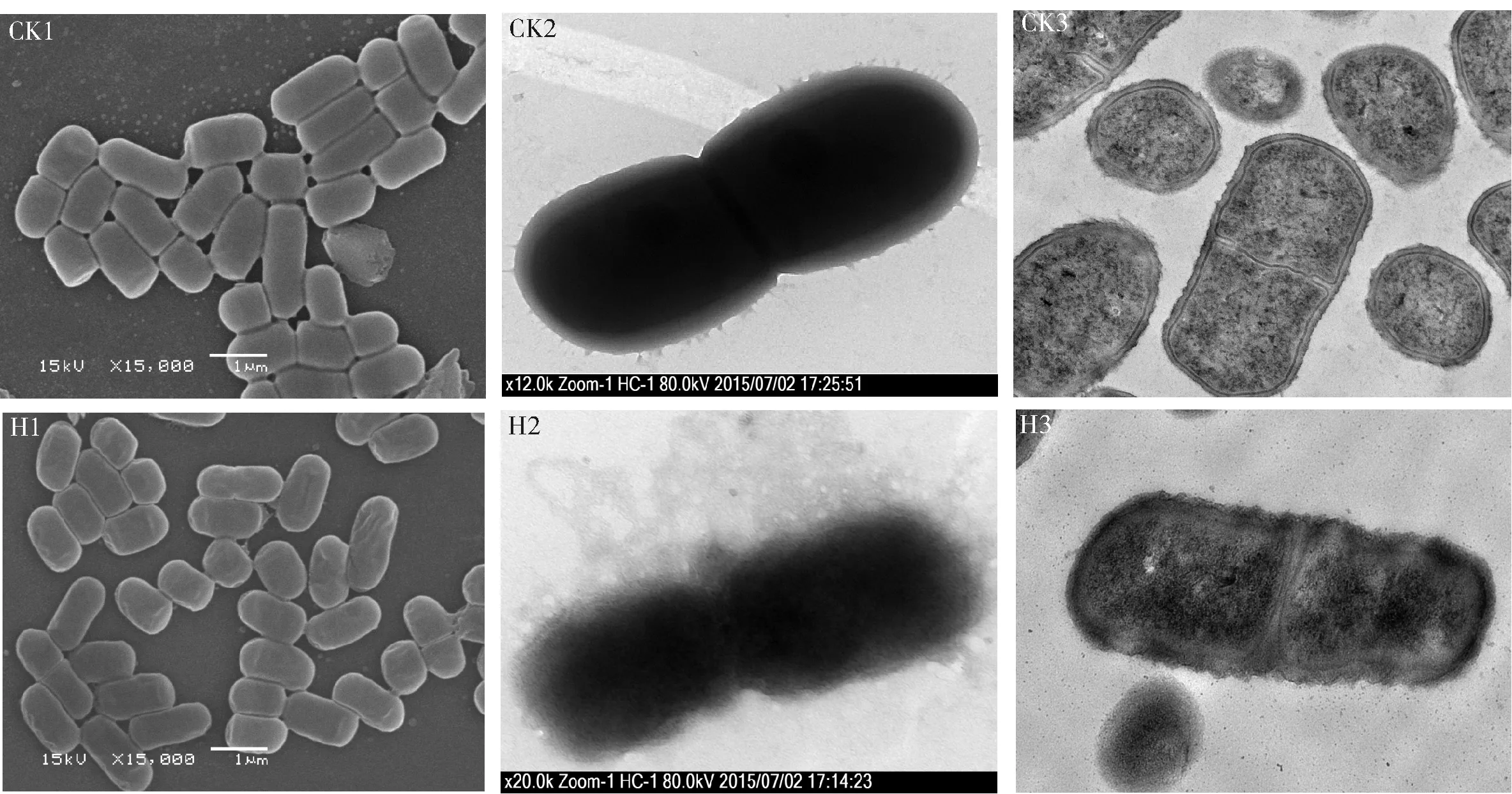
图2 不同离心处理条件下的菌体超微形态Fig.2 Bacterial ultra-morphology of different treatments
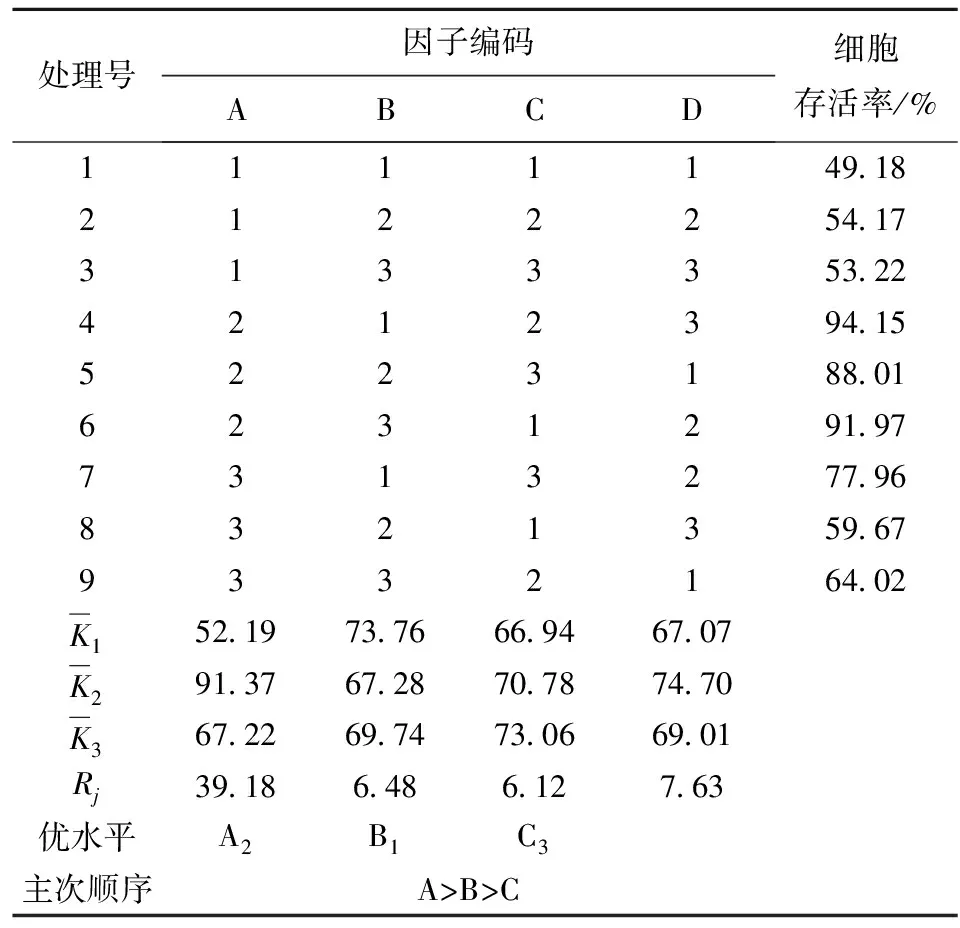
表2 正交试验结果与极差分析
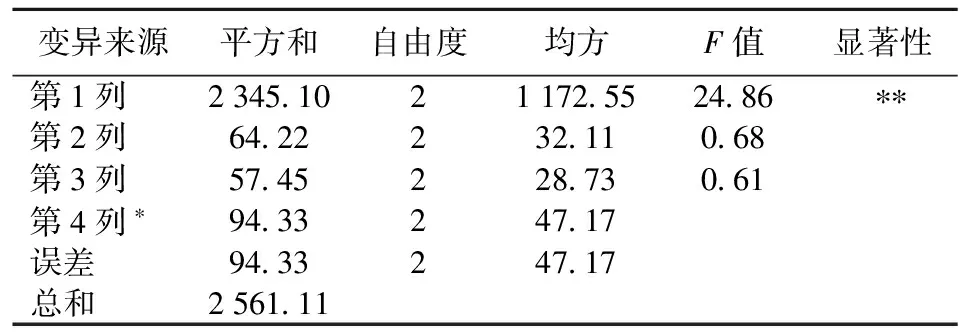
表3 正交试验方差分析
F0.01(2,2)=99,*** ;F0.05(2,2)=19,** ;F0.1(2,2)=9,*。
从实验结果分析得出最佳离心条件为A2B1C3,即离心力2 414g,温度4 ℃,时间15 min。由于温度、时间对细胞存活率的影响均不显著,因此从离心机的能耗角度考虑,宜选择A2B3C1组合,即离心力2 414g,温度16 ℃,时间5 min。
对理论最佳工艺与所选工艺的验证结果表明,2种组合获得的细胞存活率无显著差异,且与正交试验结果一致(见表4)。因此在优化的离心力条件下,可以适当缩短离心时间,提高离心温度,进而降低菌体浓缩成本,简化制备工序。
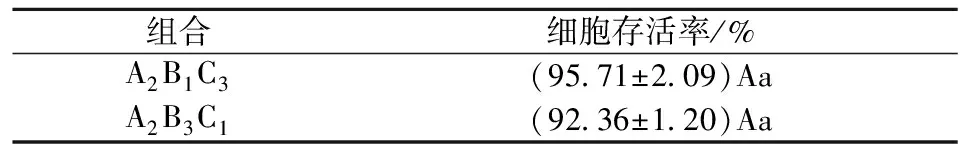
表4 理论最佳工艺与所选工艺验证实验
小写字母表示差异显著,显著值p<0.05;大写字母表示差异极显著,显著值p<0.01;下同。
为充分明确主要影响因子即离心力的作用机制,以2 414g为对照(CK),观察9 659g高速离心处理(H)后菌体的超微形态结构,结果如图2。与对照相比,高速处理后的植物乳杆菌R23细胞变化明显。菌体细胞失去原有的饱满程度,多数细胞表面发生皱缩、坍陷等现象(扫描电镜,CK1与H1);高速处理后,细胞外围包被的一层透明状胞外多糖类物质被不同程度地离散为棉絮状(透射电镜,CK2与H2);菌体表面粗糙度增加,细胞壁、细胞膜出现破裂(透射电镜,CK3与H3)。由此可见,高离心力可导致菌体细胞形态及部分结构的变化,从而影响到菌体的存活。
2.3 预冻条件对菌体存活率的影响
不同预冻处理对菌体细胞存活率的影响如表5。同等时间内,梯度预冻的效果明显优于单温预冻处理;而3种梯度处理中ⅲ的细胞存活率最高,且与其他处理间存在显著差异,提示预冻温度和时间的合理搭配,可在保证物料充分冻结前提下,最大程度减小菌体的机械损伤,预冻效果达到最佳状态。

表5 不同预冻处理条件下菌体细胞存活率
2.4 冻干时间对菌体存活率的影响
菌剂残余水分含量是影响其保藏稳定性的因素之一,不同冻干时间下植物乳杆菌R23菌剂水质量分数和细胞存活率如表6。初步冻干的5 h内水质量分数迅速下降,细胞存活率无显著变化;之后水质量分数基本维持在1.0%左右,细胞存活率极缓慢下降,但仍无显著差异。为保证菌体表面亲水基团受到持续性保护,避免与氧的结合而破坏DNA结构,宜选择10 h为适宜的冻干时间,即菌剂w(水)为1.20%。
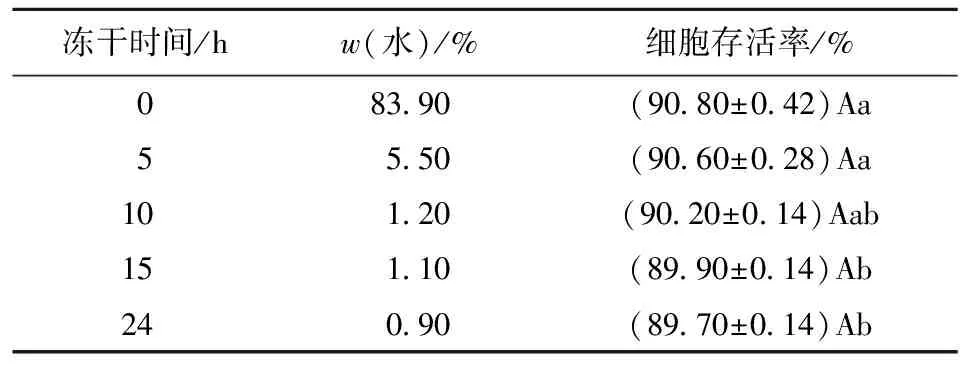
表6 不同冻干时间下菌剂水质量分数及细胞存活率
3 结 论
菌龄直接影响着菌种收集过程中菌体的生存能力,在对数生长末期或稳定初期菌量达到顶峰,胞外多糖等物质也开始大量分泌,菌体细胞显示出较高活性[12-13];而在稳定期末期或衰亡期,细胞内物质外流或营养贫乏导致的细胞饥饿均会使菌体结构发生塌陷甚至死亡[14]。研究选择对数生长末期15 h作为植物乳杆菌R23的收集时间,将最大限度地保证菌体在离心浓缩中的活力。有研究认为,离心强度(离心力和时间)与离心效果成正比[4];研究发现,在以细胞存活率为指标的前提下,这一正比关系需在一定的范围方可成立,离心力与时间过大或过小,均不能获得理想的离心效果,这与吴满刚等[15]对植物乳杆菌L2的研究结果类似。在排除细胞饥饿或内容物外渗的状况下,植物乳杆菌R23细胞存活率的降低,一方面可能是低离心强度下上清液中残留的菌体过多;另一方面可能是高离心力增强了细胞的剪切作用,长时间离心增加了菌体在压力沉降中彼此之间的相互压力,加上不适宜的温度影响,共同导致细胞皱缩、坍陷、胞外物质离散、细胞壁和细胞膜破坏等现象。而细胞皱缩和坍陷皆是由于细胞内外渗透压的不同而出现内容物外渗的结果。另外,有研究认为胞外多糖或荚膜多糖等成分具有耐干燥、黏附、抗氧化[16-17]等作用,此类物质的离散会导致其部分功能丧失;这些均可降低细胞的活性导致菌体死亡率增加。
菌体收集条件的优化及各参数对菌体细胞影响的深入探讨,可为后期DVS菌剂的冻干过程提供高浓度、高活力的菌种,有效降低能耗,对于菌剂的规模化生产具有实际指导意义。在冷冻干燥过程中,物料预冻的最终温度以其共晶点为依据,为保证物料完全冻结,预冻温度要比物料的共晶点低5~10 ℃[18-19]。研究证实乳酸菌的共晶点在-20 ℃左右[20],即-25~-30 ℃可满足乳酸菌冻结的要求。研究中植物乳杆菌R23完全冻结的温度为-40 ℃,提示该菌的共晶点在-20 ℃以下,具体温度尚待实验证实。而梯度预冻优于单温预冻的原因,可能是梯度冻干物质形成的晶体结晶度较好,实现了真正意义上的最佳冻结浓缩状态,菌体得到最大程度的保护。进一步得出,菌体预冻效果是受多因素共同作用的。李代禧等[8]在丙氨酰谷氨酰胺溶液预冻方式对冻干样品影响的研究中,使用多次变温退火预冻方式获得了粒度均一的丙氨酰谷氨酰胺晶体,而梯度降温预冻方式在乳酸菌上的应用鲜有报道。另外,在最佳冻干时间10 h条件下,物料水质量分数略低于常规的研究范围,说明适宜水质量分数大小还要考虑到保护剂组成及菌体特性。同时,在发酵剂的制备中,可通过测定样品的水质量分数来判断冻干终点,简化生产工艺。
[1] COSTA E, USALL J, TEIXIDO N, et al. Effect of protective agents, rehydration media and initial cell concentration on viability ofPantoeaagglomeransstrain CPA-2 subjected to freeze-drying[J]. Journal of Applied Microbiology, 2000, 89(5): 793-800.
[2] 任香芸,何志刚,林晓姿,等.植物乳杆菌R23高效增殖条件优化[J].中国食品学报,2015,15(8):94-100.
REN X Y, HE Z G, LIN X Z, et al. Optimization on high effective proliferation conditions forLactobacillusplantarumR23[J]. Journal of Chinese Institute of Food Science and Technology, 2015, 15(8):94-100.
[3] KONRAD G, KLEINSCHMIDT T, FABER W. Ultrafiltration flux of acid whey obtained by lactic acid fermentation[J]. International Dairy Journal, 2012, 22(1): 73-77.
[4] 谭欢.乳酸菌高效增殖条件的探索及直投式发酵剂的研制[D].长沙:湖南农业大学,2007.
TAN H. Studies on highly effective proliferation conditions of LAB and the processing of direct-to-vat cultures[D]. Changsha: Hunan Agricultural University, 2007.
[5] CARVALHO A S, SILVA J, HO P, et al. Effect of various growth media upon survival during storage of freeze-driedEnterococcusfaecalisandEnterococcusdurans[J]. Journal of Applied Microbiology, 2003, 94(6): 947-952.
[6] 万红兵,田洪涛,马晓燕,等.直投式酸奶发酵剂制备过程中乳酸菌离心分离条件的研究[J].食品工业科技,2006,27(11):69-71,75.
WAN H B, TIAN H T, MA X Y, et al. Study on centri-fugal separation condition ofLactobacillusduring the production of DVS [J]. Food Industry Technology, 2006, 27(11):69-71,75.
[7] 朱亮.预冻在冻干过程中的作用[J].干燥技术与设备,2014,12(1):32-34.
ZHU L. Effects of pre-freezing in the freeze drying process[J].Drying Technology and Equipment, 2014,12(1):32-34.
[8] 李代禧,郭柏松,陶灵刚,等.丙氨酰谷氨酰胺溶液预冻方式对冻干样品结晶度的影响[J].中国药学杂志,2016,51(11):910-914.
LI D X, GUO B S, TAO L G, et al. The effect of pre-freezing method on crystallinity of alanylglutamine[J]. Chinese Journal of Pharmaceuticals, 2016, 51(11):910-914.
[9] DIMITRELLOU D, KANDYLIS P, KOURKOUTAS Y. Effect of cooling rate, freeze-drying, and storage on survival of free and immobilizedLactobacilluscaseiATCC 393[J].LWT-Food Science and Technology, 2016, 69: 468-473.
[10] 任香芸,何志刚,李维新,等.植物乳杆菌R23冻干保护剂的优选[J].中国食品学报,2016(5):115-121.
REN X Y, HE Z G, LI W X, et al. Screening of optimal cryoprotectants forLactobacillusplantarumR23[J]. Journal of Chinese Institute of Food Science and Technology, 2016(5):115-121.
[11] STEGER P, LÜTKEMEYER D. In-line mammalian cell concentration measurement with a bio cell vitality analyzer[C]∥BMC Proceedings. BioMed Central, 2015, 9(9): 64.
[12] 陈志华.ZunongwangiaprofundaSM-A87荚膜多糖显微结构及抗菌肽对枯草芽孢杆菌抑菌机理的原子力显微镜研究[D].济南:山东大学,2013.
CHEN Z H. The microstructures of capsular polysaccharides fromZunongwangiaprofundaSM-A87 and the antimicrobial mechanism of trichokonin VI onBacillussubtilisstudied by atomic force microscopy[D]. Jinan:Shandong University, 2013.
[13] RUAS-MADIEDO P, HUGENHOLTZ J, ZOON P. An overview of the functionality of exopolysaccharides produced by lactic acid bacteria[J]. International Dairy Journal, 2002, 12(2): 163-171.
[14] ALVES C S, MELO M N, FRANQUELIM H G, et al.Escherichiacolicell surface perturbation and disruption induced by antimicrobial peptides BP100 and pepR[J]. Journal of Biological Chemistry, 2010, 285(36): 27536-27544.
[15] 吴满刚,庄涛,王小兰,等.植物乳杆菌增殖培养及其浓缩型冻干发酵剂的制备[J].食品与发酵工业,2014,40(1):73-79.
WU M G, ZHUANG T, WANG X L, et al. Enrichment culture ofLactobacillusplantarumand preparation of concentrated freeze-dried starter [J]. Food and Fermentation Industries, 2014, 40(1):73-79.
[16] TAYLOR C M, ROBERTS I S. Capsular polysaccharides and their role in virulence[M]∥RUSSEL W, HERWALD H. Concepts in Bacterial Virulence. Basel: Karger Publishers, 2004: 55-66.
[17] 李胜杰,陈廷涛,董素琴,等.双歧杆菌胞外多糖生理功能的研究概述[J].天然产物研究与开发,2013,25(3):1600-1606,1613.
LI S J, CHEN Y T, DONG S Q, et al. Research overview on physiological function of exopolysaccharide fromBifidobacterium[J]. Natural Product Research and Development, 2013,25(3):1600-1606,1613.
[18] 谭韩英,仇厚援,陈文学,等.不同冻干辅料对蜂王浆共晶点的影响[J].食品工业科技,2013,34(19):54-56.
TAN H Y, QIU H Y, CHEN W X, et al. Effect royal jelly eutectic point by different freeze-drying excipients[J]. Science and Technology of Food Industry, 2013,34(19):54-56.
[19] 李晓英.真空冷冻干燥工艺中茶树菇共晶点共融点的测定[J].食品研究与开发,2013,34(14):88-90.
LI X Y. Determination of eutectic and co-melting point of agrocybe aegerita[J]. Food Research and Development, 2013,34(14):88-90.
[20] 李云飞,王成芝.真空冻干工艺的几种物料共晶点测定与分析[J].中国农机化,1997,96(2):39-42.
LI Y F, WANG C Z. Determination and analysis of several eutectic points in vacuum freeze-drying process [J]. Chinese Agricultural Mechanization, 1997, 96(2):39-42.
EffectsofDVSPreparationConditionsonCellViabilityofLactobacillus
REN Xiangyun1,2, HE Zhigang1,2,*, LI Weixin1,2, LIN Xiaozi1,2, LIANG Zhangcheng1,2
(1.InstituteofAgriculturalEngineeringTechnology,FujianAcademyofAgriculturalSciences,Fuzhou350003,China; 2.FujianKeyLaboratoryofAgriculturalProduct(Food)Processing,FujianAcademyofAgriculturalSciences,Fuzhou350013,China)
In this study,LactobacillusplantarumR23 was used as the tested bacteria, and the effects of collecting conditions, pre-freezing conditions and freeze-drying time on cell viability were studied by scanning electron microscope,transmission electron microscope,and the orthogonal test. The results showed that the amount of bacteria reached the maximum and higher activity at the 15th hour during the process of incubation, which might be considered as the suitable harvest time. The cell survival could reach 92.4% under optimum conditions, of which the centrifugal force played a key role. The optimum temperature and duration of gradient pre-freezing were -20, -40, -80 ℃ and 1, 2, 3 h, respectively. And the optimum moisture content ofLactobacillusplantarumR23 to be storaged was 1.20%. Based on this study, the interference mechanism of the key factors for DVS preparation on cells was explicited, and the suitable preparation conditions were obtained, which was a guidance to the large scale production of high efficient DVS.
DVS; cell viability;LactobacillusplantarumR23; intervention mechanism; preparation conditions
张逸群)
10.3969/j.issn.2095-6002.2017.06.006
2095-6002(2017)06-0036-06
任香芸,何志刚,李维新,等. 直投式发酵剂制备工艺对乳酸菌存活率的影响[J]. 食品科学技术学报,2017,35(6):36-41.
REN Xiangyun,HE Zhigang,LI Weixin, et al. Effects of DVS preparation conditions on cell viability ofLactobacillus[J]. Journal of Food Science and Technology, 2017,35(6):36-41.
TS201.3; TS201.1; Q939.1
A
2017-04-18
福建省自然科学基金资助项目(2015J01101)。
任香芸,女,助理研究员,硕士,主要从事食品微生物选育及食品发酵方面的研究;*何志刚,男,研究员,主要从事食品发酵与酿造方面的研究,通信作者。

