第二信使环腺苷酸和环鸟苷酸检测方法研究进展
王友升, 王胜杰, 马国为
(北京工商大学 北京食品营养与人类健康高精尖创新中心/食品质量与安全北京实验室/北京市食品添加剂工程技术研究中心, 北京 100048)

第二信使环腺苷酸和环鸟苷酸检测方法研究进展
王友升, 王胜杰, 马国为
(北京工商大学 北京食品营养与人类健康高精尖创新中心/食品质量与安全北京实验室/北京市食品添加剂工程技术研究中心, 北京 100048)
3′,5′-环腺苷酸(cAMP)和3′,5′-环鸟苷酸(cGMP)是真核细胞内常见的调节众多功能的第二信使,最近以cAMP/cGMP信号通路为靶点研发的功能食品也越来越多,因此检测cAMP/cGMP的含量至关重要。介绍了放射性同位素法、均相非放射性同位素法、非均相非同位素法等近年来广泛使用的cAMP/cGMP检测方法的原理及其实际应用情况,分析了各种方法的优缺点及灵敏度。其中,荧光共振能量转移技术、均相时间分辨荧光共振能量转移技术、极化荧光检测技术等均相非放射性同位素法因其操作便捷、特异性强、灵敏度高而适用于cAMP/cGMP的高通量检测。
cAMP; cGMP; 检测方法; 灵敏度
3′,5′-环腺苷酸(cAMP)和3′,5′-环鸟苷酸(cGMP)是细胞内常见的调节众多功能的第二信使,通过开放离子通道来调节基因表达,进而调节众多机体生理功能[1]。据报道,白藜芦醇[2]、茶多酚[3-4]、皂苷、花青素等许多食品功能因子通过直接或间接影响cAMP/cGMP信号通路来发挥其功效。研究对cAMP/cGMP信号通路的影响首先需要检测cAMP/cGMP,因其水平变化对解析相关食品功能因子的作用机理有一定的实际意义,尤其是需要借助高通筛选技术来筛选相关的食品功能因子。
目前检测cAMP和cGMP最常用的是免疫学检测,有时需要乙酰化步骤和放射性标记来提高其灵敏度[5-7]。这些检测方法较灵敏,其检测下限在100 pmol/L以下,但是只能检测给定样品中一种环核苷酸。有些方法使用放射性物质,从安全方面考虑,建议选择可替换的方法检测。有一些基于HPLC的分析方法,通过耦合荧光或光电二极管阵列检测,具有良好的精密度和准确度,但是高样品量和低灵敏度限制了其适用范围。相比而言,其他如临近闪烁分析法、均相时间分辨荧光共振能量转移技术、极化荧光技术、ATP生物发光技术等更加适用于相关食品功能因子的高通量筛选,其主要载体为微孔板,检测速度快,实际消耗量低。因此,在了解不同cAMP/cGMP检测方法的优缺点和适用范围的基础上,根据研究目的寻找一种快速、灵敏、特异性强和可重复的定量检测cAMP/cGMP含量的方法至关重要。
1 放射性同位素法
放射性同位素法主要包括放射免疫技术和临近闪烁分析法。由于放射性同位素法检测结果非常准确、灵敏度比较高,所以放射性同位素检测被认为是“金标准”。
1.1 放射免疫法
放射免疫分析法(radioimmunoassay,RIA)的基本原理是标记放射性核素的抗原或抗体与待测的抗原和抗体结合形成抗原抗体复合物,通过检测抗原抗体复合物的放射性来检测待测样品。冉秋等[8]研究了不同中药成分对帕金森大鼠cAMP和cGMP的影响,结论是不同中药成分能明显使cAMP和cGMP水平恢复正常。隋峰等[9]研究了不同炮制品的大黄对发热大鼠的解热作用,发现大黄的解热作用可能与其能抑制cAMP含量升高有关。
RIA法的优点在于既有放射性同位素的灵敏性,又兼具抗原和抗体反应的特异性,缺点是存在放射性污染。
1.2 临近闪烁分析法
临近闪烁分析法(scintillation proximity assay,SPA)来源于RIA,其测量体系同时存在授予体、接收体、固定授予体- 接收体复合物的含有闪烁剂的载体。当载体表面同时固定授予体和接收体,弱β粒子所发射的射线能够到达载体内的闪烁剂进行能量转移,激发闪烁剂发射光子并被检测器记录[10]。基于SPA原理设计的cAMP/cGMP检测技术有cAMP/cGMP-[125I]Direct Biotrak Assay/SPA,随后又开发了适用于高通量、均相放射性实验的FlashPlate微孔板。Mancinelli等[11]用氨基丁酸处理小鼠胆管细胞,结果氨基丁酸能显著提高小鼠胆管细胞中的cAMP水平。
SPA法的优点是分析过程简单、灵敏度高,可微量化、可自动化检测,被认为是 “金标准”。但SPA法有一些缺点:1)产生大量对人体有害的放射性垃圾;2)放射性同位素的半衰期较短,只有60 d(125I);3)存在明显的交叉干扰现象,主要因为放射性同位素的能量非常高。
2 均相非放射性同位素法
2.1 荧光共振能量转移
荧光共振能量转移(fluorescence resonance energy transfer,FRET)的基本原理是激发态的供体荧光团通过非辐射的方式把能量转移给受体,造成受体的荧光发射增加[12]。基于FRET原理开发的cAMP/cGMP检测技术为AlphaScreen技术,该技术中的供体微珠含有光敏剂分子,光敏剂分子能活化其周围的氧分子,能量转换引起受体微珠在520~620 nm产生荧光信号[13]。AlphaLISA是在Alpha Screen的基础上开发的更适合高通量筛选的技术。Sheng等[14]用佛司可林和胰岛素样肽5处理CHO- RXFP4细胞,佛司可林能促进cAMP含量升高, 胰岛素样肽5可抑制由佛司可林刺激产生的cAMP含量升高,用该方法检测的cAMP含量呈现明显的浓度效应。
AlphaScreen技术优点是具有非放射性、均相的特点,检测快速、稳定,灵敏度更高。缺点是反应体系不能处于强光或是长时间的室内光环境中;其次,某些化合物结合单体氧分子会影响光信号。同其他技术相比,该技术对检测仪器平台有要求。
2.2 均相时间分辨荧光共振能量转移
均相时间分辨荧光共振能量转移(time-resolved fluorescence resonance energy transfer,TR-FRET)的供体是镧系元素,受体是有机染料,二者联合使用[15]。镧系染料与传统的FRET染料比较而言,不完全标记的供体和受体样品在检测时不敏感,因此其准确性较高,信噪比较大。基于TR-FRET原理开发的cAMP/cGMP检测技术有LANCEUltracAMP assay,通过升级TR-FRET技术为homogeneous time resolved fluorescence(HTRF)开发了检测细胞内cAMP/cGMP的方法。
以LANCEUltracAMP assay为例,G蛋白偶联受体(GPCRs)通过激活腺苷酸环化酶(adenylyl cyclase,AC)促进cAMP水平升高。Eu(europium)标记的cAMP示踪物和游离的cAMP竞争性与标记ULightTM染料的cAMP特异性单克隆抗体位点结合。当Eu-cAMP示踪物与单克隆抗体结合,320 nm或者340 nm条件下的激发光能使Eu-cAMP示踪物处于激发态。接着能量通过FRET从Eu-cAMP示踪物转移到单克隆抗体上的ULightTM,在665 nm处能检测到发光。Eu-cAMP示踪物上的剩余能量在615 nm处能检测到发光。在没有游离cAMP存在的条件下,TR-FRET信号最大;当存在游离cAMP 时,Eu(europium)标记的cAMP示踪物和游离的cAMP竞争性与标记ULightTM染料的cAMP特异性单克隆抗体位点结合,TR-FRET信号下降。Pascale等[16]采用TR-FRET方法检测cAMP的S/B比值为44.6,IC50大约在1 nmol/L。Raveh等[17]采用TR-FRET方法检测cAMP水平来反映RGS2蛋白对G蛋白偶联受体信号的影响,检测结果呈明显浓度效应。
均相时间分辨荧光共振能量转移技术的主要优点是检测灵敏和稳定、特异性强、信噪比高,适用于高通量检测。缺点是特异性单克隆抗体较昂贵。
2.3 极化荧光检测
极化荧光检测(fluorescence polarization, FP)是在适当的位置设置起偏器和检偏器,当用荧光物质标记待测样品时,其荧光信号通过该光路时会由弱变强,通过检测偏振荧光强度来定量待测物质[18]。cAMP/cGMP fluorescence polarization(FP) biotrak immunoassay system就是基于FP原理开发的cAMP/cGMP检测技术。
FP的优点是灵敏性较高、稳定性强。缺点是荧光素的荧光寿命太短,会限制其在实验中的应用。
2.4 均相酶免疫分析
均相酶免疫分析法(homogeneous enzyme immunoassay,HEIA)主要包括酶标记的半抗原和非标记的半抗原,它们与限量抗体竞争结合,如果抗体与酶标记的半抗原结合,那么会形成空间位阻,酶的催化能力下降,通过检测体系中底物的吸光度来反映样品中半抗原的含量[19]。基于HEIA开发的cAMP/cGMP检测技术有HitHunter®cAMP。HitHunter®cAMP原理为,β-半乳糖苷酶片段酶供体(ED)与cAMP形成共轭机构,胞内cAMP与ED-cAMP竞争性结合anti-cAMP抗体(Ab)上的结合位点,由于胞内cAMP含量较低,大部分ED-cAMP与cAMP Ab结合,ED-cAMP不能与酶受体(EA)集合。胞内cAMP含量较高时,anti-cAMP抗体结合位点饱和,ED-cAMP补足EA,形成活化酶,活化酶水解其基质形成化学发光。
HEIA技术的优点是体系均相、特异性强、灵敏度高,便于自动化检测,既有抗原和抗体系统的特点,又兼具酶和底物系统的特点;缺点是试剂大多依靠进口,依赖专用仪器、检测成本高。
2.5 生物发光共振能量转移
某些海洋动物体内有共振能量转移现象,其能量供体和受体之间存在非放射性的能量转移,生物发光共振能量转移(bioluminescence resonance energy transfer,BRET)技术就是基于该原理设计的[20]。Prinz等[21]引进了第一个基于蛋白激酶 A(PKA)的cAMP传感器。他们把海肾萤光素酶(Rluc)和两个调控亚基(RI和RII)分别融合在一起,制成两个不同的适合BRET体系的供体蛋白,RI-Rluc和RII-Rluc。受体蛋白由催化亚基和GFP融合而成(GFP-C)。COS7细胞同时转染RI-Rluc和GFP-C,或RII-Rluc和GFP-C来检测活细胞中PKA亚基的相互作用,比较实时条件下PKA-I和PKA-II信号的差异。由于PKA的调控亚基和催化亚基分离依赖于cAMP结合,细胞内cAMP含量升高,BRET信号以剂量依赖的方式下降。
BRET技术的优点是其背景极低,灵敏度高,而且不需外源光激发,分别对能量供体和受体进行定量。缺点是荧光素酶Rluc量子产率较低,限制了高效灵敏BRET技术的开发。
2.6 ATP生物发光法
ATP生物发光法主要包括 ATP 发光试剂、样品预处理和发光检测仪三大部分,萤火虫荧光素酶(firefly luciferase, FL)和荧光素反应会产生的光,通过检测光来定量待测物质含量[22]。基于ATP生物发光技术的cAMP检测技术有cAMP-GloTMAssay。cAMP-GloTMAssay是一种均质的高通量方法,其检测胞内cAMP水平的原理为cAMP通过激活PKA的活性,降低 ATP的含量,其偶联的萤光素酶(luciferase)发光信号降低,用一种测试化合物在一段合适的时间内诱导细胞;诱导后的裂解细胞,释放cAMP,接着加入含有PKA 的 cAMP 检测溶液,然后加入 Kinase-Glo®Reagent 终止 PKA 反应,并用萤光素酶反应检测残余ATP。 该技术的cAMP检测灵敏度为每孔30±5 fmol,重复性较好,Z′ >0.8。
ATP生物发光法简单、快速、高灵敏度,但检测费用较高。
2.7 荧光素酶报告基因检测
荧光素酶(luciferase,Luc)报告基因检测技术中顺式元件活性的变化通过基因活性的变化来反映,一般会把报告基因和特定的顺式反应元件串联表达[23]。目前基于该技术开发的cAMP/cGMP检测有GloSensorTMcAMP/cGMP Assay。GloSensorTM技术将萤火虫萤光素酶经过遗传改造,插入了一个结合cAMP 的蛋白组分。当结合上cAMP 后,萤光素酶构象发生改变,导致光输出的增加。马晓芸等[24]成功构建了cAMP反应元件萤光素酶报告基因载体,用于G蛋白偶联受体 (GPCR) 活性的检测,也为基于GPCR活性的药物高通量筛选提供依据。杨雯[25]构建的新型检测系统CRE-rLuc/NFAT-fLuc能同时检测胞内cAMP和Ca2+水平,通过该检测系统得到的相应已知激动剂的EC50值与报道的文献一致,证明了该方法具有一定灵敏性和可行性。
该技术的优点是具有较高的灵敏度、检测方便,主要优势在于能对细胞的生理化学物质实时定量检测;缺点是会出现背景蛋白表达的不稳定,如果报告蛋白半衰期比较长,会直接影响对目的基因表达的检测。
3 非均相非同位素法
3.1 酶联免疫吸附测定法
酶联免疫吸附测定法(enzyme linked immunosorbent assay,ELISA),其基本原理为特定固相载体的表面结合了抗原或抗体,抗原或抗体和某种酶结合,称为酶标记的抗原或抗体,该酶标抗原或抗体同时兼具酶的活性和抗原或抗体的免疫活性[26]。Henkin等[27]采用酶联免疫试剂盒检测了人腮腺唾液中的cAMP/cGMP含量,通过比较其在不同性别和年龄的味觉和嗅觉障碍病人之间的含量,来阐述其内在关系。
ELISA的优点主要是灵敏、特异,对仪器要求较低,易于推广,对环境友好,反映效果能最大化显示;缺点是操作繁琐,对某些结构类似物的分析检测仍会出现交叉反应,影响检测结果。
3.2 高效液相色谱法
高效液相色谱(high-performance liquid chromatography,HPLC)的原理是当样品在流动相的推动作用下通过固定相时,由于样品中的物质在两相存在不同的分配系数,所以当样品多次分配后就能达到分离。Damme等[28]采用反相高效液相色谱法分析了人体血浆和动物组织中cAMP/cGMP含量。王向红等[29]采用HPLC技术检测了枣果中的cAMP/cGMP含量。
HPLC技术的优点为分离效率高,选择性好,操作自动化,应用范围广; 缺点是分析成本高,液相色谱仪价格及日常维护费用贵。HPLC往往作为分离手段,常与质谱联用进行定量研究。
3.3 液质联用法
液质联用(LC-MS)结合了液相色谱的分离能力与质谱的定性功能,能准确定量和鉴定复杂体系中的组分[30]。Oeckl等[31]建立的LC-MS/MS方法能同时检测cAMP和cGMP,该方法快速、灵敏且具有广泛的适用性。LC-MS/MS法检测极限是50 pmol/L,cAMP和cGMP在0.5~500 nmol/L范围内呈良好的线性关系,组内和组间的精密度和准确度较高,分析时间为3.5 min。为了验证该方法的适用性,用咯哩普兰和扎普司特处理小鼠,咯哩普兰和扎普司特分别是PDE4和PDE5的抑制剂,结果表明,咯哩普兰和托普司特能明显提高cAMP和cGMP的浓度。杨云菲等[32]采用LC-MS/MS方法检测大鼠血浆中的cAMP和cGMP,该方法专一性强,可用于药物代谢机制研究。
液质联用技术结合了液相色谱的高分离能力和质谱提供结构信息的功能,具有高选择性、高灵敏度等优点。缺点是成本较高。
3.4 高效毛细管电泳法
高效毛细管电泳法(high performance capillary electrophoresis,HPCE)采用的分离管道为毛细管道,是根据待检测样品在分配方式上存在的差异,以高压电场作为驱动力的分离技术。
张雅利等[33]采用高效毛细管电泳法分析红枣中cAMP和cGMP的含量,cAMP和cGMP含量分别在2~650 mg·L-1,2~600 mg·L-1范围内线性关系良好(r>0.998);平均回收率为 95.8%,96.2%;RSD分别为2.12%,2.43%,因此高效毛细管电泳法可用于检测红枣中cAMP和cGMP的含量。
高效毛细管电泳法的主要优点是分离效率高且经济环保、时间短、重现性好,最主要的是成本较低;缺点是进样量少,检测窗口小,灵敏度比液相色谱低。
4 结 语
某些食品功能因子的抗氧化、抗肿瘤、降血糖等功效与cAMP/cGMP信号通路密切相关,相关食品功能因子能直接或间接引起cAMP/cGMP信号通路上游或下游信号分子的含量变化,继而调节相关代谢。因此想要解析相关食品功能因子的作用机理,必须首先检测cAMP/cGMP的含量变化。由于基于各种原理开发出的技术优缺点各有不同,在实际操作中,必须对每种方法的优缺点和灵敏度充分了解后才能选择合适的方法,表1总结了cAMP/ cGMP常用检测技术的优缺点及其检测灵敏度。
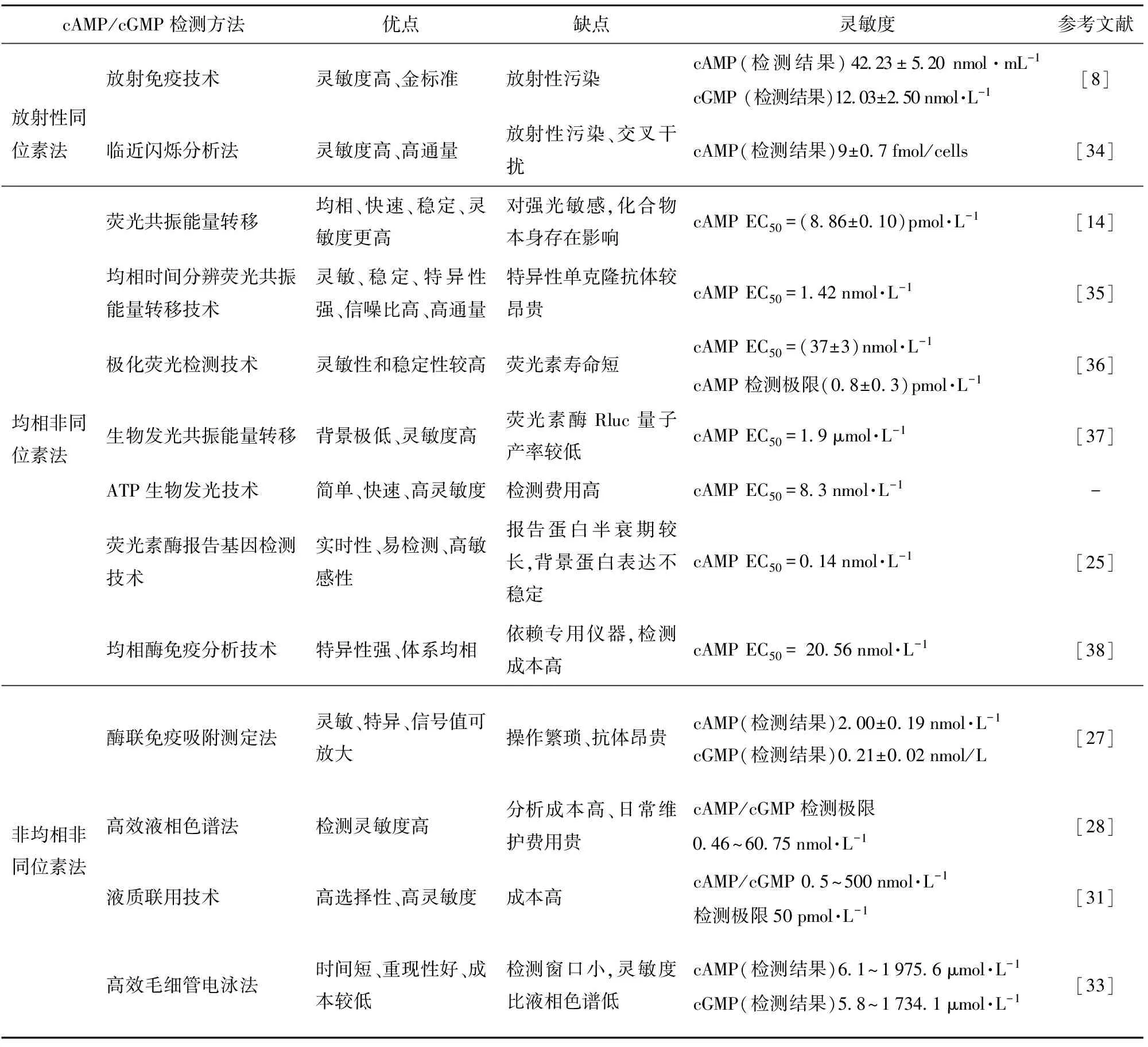
表1 cAMP/cGMP常用检测方法的优缺点及灵敏度比较
为了保证检测效果,必须将两种以上的方法组合进行检测结果的评判。不同的检测方法稳定性和准确性相差较大,灵敏性也是选择检测方法的一个重要标准。对于高通量筛选,应选择信号窗口较大、速度快、操作简单、价格便宜的方法,为保证检测效果,应使用放射性同位素法进行验证。
[1] BURHENNE H, TAPPE K, BESTE K, et al. Quantitation of cyclic nucleotides in mammalian cells and in human urine by high-performance liquid chromatography/mass spectrometry[J]. Bmc Pharmacology, 2011, 11(s1):1-2.
[2] PARK S J, AHMAD F, PHILP A, et al. Resveratrol ameliorates aging-related metabolic phenotypes by inhibiting cAMP phosphodiesterases[J]. Cell, 2012, 148(3): 421-433.
[3] COLLINS Q F, LIU H Y, PI J, et al.Epigallocatcchin-3-gallate(EGGG),a green tea polyphcnol, suppressc hepatic gluconeogcncsis through 5′-AMP-activated protein kinxse[J].Journal of Biological Chemistry, 2007, 282(41): 30143-30149.
[4] MOON H S, CHUNG C S, LEE H G, et al. Inhibitory effect of (-)-epigallocatcchin-3-gallatc on lipid accumulation of 3T3-L1 cells[J].Obesity, 2007, 15(11): 2571-2582.
[5] GIORGI M, D′ANGELO V, ESPOSITO Z, et al. Lowered cAMP and cGMP signalling in the brain during levodopa-induced dyskinesias in hemiparkinsonian rats: new aspects in the pathogenetic mechanisms[J]. European Journal of Neuroscience, 2008, 28(5):941-950.
[6] TORREMANS A, AHNAOU A, VAN H A, et al. Effects of phosphodiesterase 10 inhibition on striatal cyclic AMP and peripheral physiology in rats[J]. Acta Neurobiologiae Experimentalis, 2010, 70(1):13-19.
[7] AN T, AN V H, ROEL S, et al. Selective D1 agonism but not D2 antagonism is reflected in cAMP and cGMP levels in rat CSF[J]. Brain Research Bulletin, 2010, 81(6):549-551.
[8] 冉秋, 何建成. 不同中医治法对帕金森病模型大鼠cAMP、cGMP的影响[J]. 时珍国医国药, 2011, 22(1):244-246.
RAN Q, HE J C. The influence of different therapeutic methods in TCM on cAMP and cGMP of PD rat model rats[J]. Lishizhen Medicine and Materia Medica Research, 2011, 22(1):244-246.
[9] 隋峰, 闫美娟, 林娜,等. 大黄不同炮制品解热作用及机制研究[J]. 中国实验方剂学杂志, 2012, 18(15):167-170.
SUI F, YAN M J, LIN N, et al. Comparative study on antipyretic effects and its mechanisms by four processed Rhei Radix et Rhizoma products[J]. Chinese Journal of Experimental Traditional Medical Formulae, 2012, 18(15):167-170.
[10] 张洪杰.临近闪烁分析技术在生命科学研究中的新进展[J].生物化学与生物物理进展, 2016, 43(3):197-208.
ZHANG H J. Progress of scintillation proximity assay in life science[J]. Progress in Biochemistry and Biophy-sics, 2016, 43(3):197-208.
[11] MANCINELLI R, FRANCHITTO A, GLASER S, et al. GABA induces the differentiation of small into large cholangiocytes by activation of Ca2+/CaMKI-dependent adenylyl cyclase 8[J]. Hepatology, 2013, 58(1):251-263.
[12] 张建伟,陈同生.荧光共振能量转移(FRET)的定量检测及其应用[J].华南师范大学学报(自然科学版), 2012, 44(3):12-17.
ZHANG J W, CHEN T S. Quantitation and application of fluorescence resonance energy transfer(FRET)[J]. Journal of South China Normal University (Natural Science Edition), 2012, 44(3):12-17.
[13] 杨秀颖,张莉,杜冠华.靶向G蛋白偶联受体高通量药物筛选技术研究进展[J]. 中国新药杂志, 2012,21(22):2636-2641.
YANG X Y, ZHANG L, DU G H. Advance in high-throughput drug screening techniques targeting G protein-coupled receptors[J]. Chinese Journal of New Drugs, 2012, 21(22):2636-2641.
[14] SHENG Y A, HUTCHINSON D S, PATIL N, et al. Signal transduction pathways activated by insulin-like peptide 5 (INSL5) at the relaxin family peptide receptor 4 (RXFP4)[J]. British Journal of Pharmacology, 2017,144:1077-1089.
[15] 梁菊, 陈攀, 吴文澜,等. 荧光共振能量转移新技术及其在药物筛选中的应用[J]. 中国药学杂志, 2009,44(13):961-965.
LIANG J, CHEN P, WU W L, et al. New technology of fluorescence resonance energy transfer and its application in drug screening[J]. China Pharm J, 2009,44(13):961-965.
[16] PASCALE G, KJETIL T, GUILLAUME P. Spatiotemporal regulation of cAMP signaling controls the human trophoblast fusion[J]. Frontiers in Pharmacology, 2015, 6:259-261.
[17] RAVEH A, SCHULTZ P J, ASCHERMANN L, et al. Identification of protein kinase C activation as a novel mechanism for RGS2 protein upregulation through phenotypic screening of natural product extracts[J]. Mole-cular Pharmacology, 2014, 86(4):843-852.
[18] 赵晨,张亮,倪原.荧光偏振技术在生命科学中的研究进展[J]. 现代生物医学进展, 2010, 10(16):3154-3156.
ZHAO C, ZHANG L, NI Y. Development of fluorescence polarization in life sciences[J]. Progress in Modern Biomedicine, 2010, 10(16):3154-3156.
[19] 齐谢敏,虞留明,李冬,等.均相酶免疫分析技术在治疗药物监测中的应用[J]. 药学与临床研究, 2015, 23(1):47-50.
QI X M, YU L M, LI D, et al. Enzyme immunoassay and its application in therapeutic drug monitoring[J]. Pharmaceutical and Clinical Research Homogeneous, 2015, 23(1):47-50.
[20] 李雅林,白波,陈京.生物发光共振能量转移技术及其应用[J].中国生物化学与分子生物学报, 2009,25(12):1077-1082.
LI Y L, BAI B, CHEN J. Bioluminescence resonance energy transfer technology and its application[J]. Chinese Journal of Biochemistry and Molecular Biology, 2009,25(12):1077-1082.
[21] PRINZ A, DISKAR M, ERLBRUCH A, et al. Novel, isotype-specific sensors for protein kinase A subunit interaction based on bioluminescence resonance energy transfer (BRET)[J]. Cellular Signalling, 2006, 18(10):1616-1625.
[22] 吴慧清,李程思,吴清平,等.ATP生物发光测定试剂研究进展[J].微生物学通报,2012, 39(11):1661-1667.
WU H Q,LI C S, WU Q P, et al. Reserach progress on ATP bioluminescence reagent[J]. Microbiology China, 2012, 39(11):1661-1667.
[23] FAN F,WOOD K V.Bioluminescent assays for high-throughput screening[J]. Assay and Drug Development Technologies, 2007, 5(1):127-136.
[24] 马晓芸, 于金梅, 卓仁恭,等. cAMP反应元件萤光素酶报告基因载体的构建[J]. 生物技术通讯, 2014,25(1):58-61.
MA X Y, YU J M, ZHUO R G, et al. Construction of cAMP responsive element-containing luciferase reporter vectors[J]. Letters in Biotechnology, 2014,25(1):58-61.
[25] 杨雯. 基于报告基因检测系统的G蛋白偶联受体第二信使cAMP、Ca2+检测方法的建立[D]. 杭州:浙江大学, 2011.
[26] 石超,吕长鑫,冯叙桥,等.酶联免疫吸附技术在食品检测分析中的研究进展[J]. 食品安全质量检测学报, 2014,5(10):3269-3275.
SHI C, LYU C X, FENG X Q, et al. Advances in food determination and analysis of enzyme-linked immunosorbent assay[J]. Journal of Food Safety and Quality, 2014,5(10):3269-3275.
[27] HENKIN R I, VELICU I, PAPATHANASSIU A. cAMP and cGMP in human parotid saliva: relationships to taste and smell dysfunction, gender, and age[J]. American Journal of the Medical Sciences, 2007, 334(6):431-440.
[28] DAMME T V, ZHANG Y, LYNEN F, et al. Determination of cyclic guanosine and cyclic adenosine monophosphate (cGMP and cAMP) in human plasma and animal tissues by solid phase extraction on silica and liquid chromatography-triple quadrupole mass spectrometry[J]. Journal of Chromatography B Analytical Technologies in the Biomedical and Life Sciences, 2012, 909(1):14-21.
[29] 王向红, 桑亚新, 崔同,等. 高效液相色谱法测定枣果中的环核苷酸[J]. 中国食品学报, 2005, 5(3):108-112.
WANG X H, SANG Y X, CUI T, et al.Determination of cyclic-nucleotide in Chinese jujube by HPLC[J]. Journal of Chinese Institute of Food Science and Technology, 2005, 5(3):108-112.
[30] 姜宁, 陈执中. 新的液质联用技术在生物大分子药物中的应用进展[J]. 药物生物技术, 2015,22(2):174-176.
JIANG N,CHEN Z Z.Progress in novel liquid chromatography-mass spectrometry combined technique and its applications in biomacromolecule drugs[J]. Pharmaceutical Biotechnology, 2015,22(2):174-176.
[31] OECKL P, FERGER B. Simultaneous LC-MS/MS analy-sis of the biomarkers cAMP and cGMP in plasma, CSF and brain tissue[J]. Journal of Neuroscience Methods, 2012, 203(2):338-343.
[32] 杨云菲, 于瑞莲, 徐开成,等. LC-MS/MS法同时测定大鼠血浆中cAMP和cGMP浓度的研究[J]. 药物分析杂志, 2015,35(6):1022-1026.
YANG Y F, YU R L, XU K C, et al. Study on simultaneous determination of cAMP and cGMP in rat plasma by LC-MS/MS[J]. Chin J Pharm Anal, 2015,35(6):1022-1026.
[33] 张雅利, 刘长江. 高效毛细管电泳分析红枣中cAMP和cGMP的含量[C]∥第六届全国毛细管电泳及相关微分离分析学术报告会论文集.北京:中科院化学所、中科院物理所, 2004.
[34] HOFMANN B A, SYDOW S, JAHN O, et al. Functional and protein chemical characterization of the N-terminal domain of the rat corticotropin-releasing factor receptor 1[J]. Protein Science, 2001, 10(10):2050-2062.
[35] WALKER C S, HAY D L. Reply to comment on: a second trigeminal CGRP receptor: function and expression of the AMY1 receptor[J]. Annals of Clinical and Translational Neurology, 2015, 2(6):851-859.
[36] KOOL J, VAN MARLE A, HULSCHER S, et al. A flow-through fluorescence polarization detection system for measuring GPCR-Mediated modulation of cAMP production[J]. Journal of Biomolecular Screening, 2007, 12(8):1074-1083.
[37] SPRENGER J U, NIKOLAEV V O. Biophysical techniques for detection of cAMP and cGMP in living cells[J]. International Journal of Molecular Sciences, 2012, 14(4):8025-8046.
[38] HUGHES Z A, NEAL S J, SMITH D L, et al. Negative allosteric modulation of metabotropic glutamate receptor 5 results in broad spectrum activity relevant to treatment resistant depression[J]. Neuropharmacology, 2013, 66(3):202-214.
TechniquesforDetectionofSecondMessengerscAMPandcGMP
WANG Yousheng, WANG Shengjie, MA Guowei
(BeijingAdvancedInnovationCenterforFoodNutritionandHumanHealth/BeijingLaboratoryforFoodQualityandSafety/BeijingEngineeringandTechnologyResearchCenterofFoodAdditives,BeijingTechnologyandBusinessUniversity,Beijing100048,China)
cAMP(cyclic adenosine 3′,5′-monophosphate) and cGMP(cyclic guanosine 3′,5′-monophosphate) are ubiquitous second messengers which regulate myriads of functions in eukaryotic cells, and their signaling pathways are regarded as the popular target in functional food bioactives screening. In this review, we discuss the advantages and disadvantages of techniques such as radioisotope, homogeneous non-radioactive isotope and heterogeneous non-isotopic methods, which are used to measure cAMP and cGMP and describe how these techniques can be applied. The homogeneous non-radioactive isotope methods, including fluorescence resonance energy transfer technology (FRET), homogeneous time-resolved fluorescence resonance energy transfer technology (TR-FRET), polarization fluorescence detection technology (FP), are suitable for cAMP/cGMP high-throughput screening of bioactives for functional food based on its advantages of easy operation, high specificity and sensitivity.
cAMP; cGMP; detection techniques; sensitivity
叶红波)
10.3969/j.issn.2095-6002.2017.06.008
2095-6002(2017)06-0048-07
王友升,王胜杰,马国为.第二信使环腺苷酸和环鸟苷酸检测方法研究进展[J]. 食品科学技术学报,2017,35(6):48-54.
WANG Yousheng,WANG Shengjie,MA Guowei. Techniques for detection of second messengers cAMP and cGMP[J]. Journal of Food Science and Technology, 2017,35(6):48-54.
TS201.4; TS207.3; Q524
A
2016-12-30
国家自然科学基金资助项目(31471626; 32171944)。
王友升,男,教授,博士,主要从事系统生物技术方面的研究。

