乙醇胺和N,N-二甲基乙醇胺改性埃洛石对CO2的吸附行为
赵唯君,张华丽*,严春杰,潘志权
1.武汉工程大学化学与环境工程学院,湖北 武汉 430205;
2.中国地质大学纳米矿物材料及应用教育部工程研究中心,湖北 武汉 430074
乙醇胺和N,N-二甲基乙醇胺改性埃洛石对CO2的吸附行为
赵唯君1,张华丽1*,严春杰2,潘志权1
1.武汉工程大学化学与环境工程学院,湖北 武汉 430205;
2.中国地质大学纳米矿物材料及应用教育部工程研究中心,湖北 武汉 430074
研究了煅烧和混和胺改性后的埃洛石对CO2的吸附研究.分别考察了提纯、煅烧和混合胺改性对埃洛石比表面积的影响.实验结果表明,埃洛石提纯后比表面积为30.11 m2/g;埃洛石经过煅烧后的X射线衍射结果显示,随着温度的增加衍射峰变尖锐,但到300℃以后反而下降,因此选择的煅烧温度为300℃,比表面积达到了37.04 m2/g;测得常温常压下吸附CO2的质量分数为3.141%.用混合胺对其改性,红外光谱结果显示制备成功,其比表面积下降至33.09 m2/g;常温常压下吸附CO2的质量分数为17.21%,远远高于仅煅烧的埃洛石吸附CO2的质量分数.说明吸附二氧化碳在改性埃洛石上的行为主要是化学吸附.
埃洛石;混和胺;改性;CO2吸附
近年来由于大气中的CO2浓度的增加,造成了不可逆转的气候变化[1],而人类活动所造成的CO2大规模排放是其中最主要的原因之一[2].
近年来,捕获分离CO2的方法多种多样,例如膜分离法、吸附法、溶剂吸收法[3-7]等.其中吸附法由于操作简洁,被认为具有极大应用前景的分离方法.目前,固体吸附剂主要有:沸石分子筛[8]、金属有机框架材料(MOFs)[9-12]、氨基修饰材料[13]等.其中,沸石分子筛在常温下能保持较好的吸附量,但其吸附量会因微量水份存在而急剧下降;金属有机框架材料至今仍处于研究阶段,主要原因是制造成本较高;而氨基修饰材料因其操作过程简单,且在水份存在情况下仍具有较高的CO2吸附性,近些年被广泛关注[14-15].
本实验以埃洛石提纯样为基础,先对其进行煅烧处理来增强其比表面积,然后选择乙醇胺和N,N-二甲基乙醇胺对煅烧后埃洛石进行表面改性制备出混合胺改性埃洛石样品.通过X射线衍射(X-ray diffraction,XRD)、扫 描 电 子 显 微 镜(scanning electron microscope,SEM)、比表面 积(brunner-emmet-teller,BET)、傅里叶变换红外光谱学(Fourier transform infraredspectroscopy,FT-IR)、热重法(thermogravimetry,TG)等手段表征了不同阶段材料的物相、形貌、结构以及孔径分布,最后使用热重分析仪测定了混和胺改性材料对CO2的吸附量.
1 实验部分
1.1 仪器与试剂
埃洛石取样于云南临沧的原矿,化学成分分析(质量分数,%)结果如下:Al2O3,40.41;SiO2,58.91;P2O5,0.14;TiO2,0.071;SO3,0.063;Cl,0.039;Na2O,0.032;Fe2O3,0.27;ZrO2,0.017;烧失量,13.无水乙醇、六偏磷酸钠、乙醇胺、N,N-二甲基乙醇胺均为天津市天力化学试剂公司的分析纯试剂.
1.2 埃洛石的提纯
埃洛石原矿中加水配制成质量分数15%固含量的料浆,高速分散机捣浆(转速8 000 r/min,时间1 h);将料浆均匀分散后再过孔径0.045 mm筛后进行湿法筛分;筛下浆料静置6 h,将上层的悬浮液离心分离后可得到沉淀物.95℃的条件下烘干12 h后用万能粉碎机打散后备用;取适量打散后得到的粉体配成一定浓度的悬浮液,调节其pH值,再加入适量分散剂,高速分散机上分散搅拌2 h;将所得的悬浮液于一定转速下离心分离,留取上层物质,抛弃下层沉淀,将上层液再离心5 min,转速3 800 r/min;所得的沉淀在温度为95℃下保持12 h,研磨打散,得到的就是高纯度的0.7 nm埃洛石产品.
1.3 埃洛石的煅烧
取提纯后的埃洛石精矿,在一定温度下煅烧2 h.埃洛石的煅烧是通过高温加剧各微粒的热运动,达到破坏内部结合键的目的,埃洛石的硅氧四面体和铝氧八面体不能够充分地聚合而生成长链,最终生成玻璃相结构,生成具有活性的Al2O3和SiO2.煅烧使埃洛石的微结构和相组成均有变化,部分基团断裂脱落,产生大量的自由端,从而达到实现活化的目的.
1.4 混合胺(乙醇胺和N,N-二甲基乙醇胺)改性埃洛石
在锥形瓶中加入100 mL的无水乙醇,加入2 mL乙醇胺和2 mL N,N-二甲基乙醇胺,将其超声分散20 min,再向该混合液中加入2 g煅烧后的埃洛石样品,于80℃水浴锅中搅拌回流3 h,用真空泵对该混合物进行抽滤,再将所得滤饼置于80℃烘箱中烘干得到产物.
1.5 CO2的吸附性能测试
取一定量待测样品放入样品室.先通入惰性气体N2吹扫60 min,气流量控制在50 mL/min;然后逐渐升温,升温速率为10℃/min,将样品加热到70℃~80℃后在真空中活化2 h,其中真空表显示40 kPa,降温,当系统温度降至室温后,开始注入CO2,气流量为40 mL/min,当压力达标准大气压100 kPa时,真空表指示为0,停止通气,连续吸附2 h,吸收剂基本达到吸附饱和后结束吸附反应.设样品的原始质量为m,第1阶段(抽真空阶段)质量分数降低a,第2阶段(吸附CO2阶段)质量分数增加b,则有:测试样品吸附CO2的质量分数=吸附后的质量m×b/(吸附前的质量m×(1-a))=b/(1-a)×100%.
2 结果与讨论
2.1 埃洛石的提纯
对埃洛石原矿和提纯样做XRD对比(见图1),埃洛石原矿的图谱中除含埃洛石的特征峰之外,可见石英(部分特征峰为0.420 00 nm,0.333 20 nm)、长石(部分特征峰0.377 46 nm,0.346 62 nm,0.421 69 nm)和三水铝石(部分特征峰0.483 40 nm,0.356 20 nm)等杂质的衍射峰.经过提纯后得到了纯度大于98%的埃洛石,其特征峰为0.739 71 nm,0.445 54 nm和0.364 29 nm等位置,云南临沧地区埃洛石属于0.7 nm型埃洛石(0.725 nm~0.740 nm).

图1 原矿和提纯后埃洛石的XRD图Fig.1 XRD patterns of raw and purified halloysite
图2为埃洛石原矿和提纯样的SEM和电场发射扫描电子显微镜(field emission scanning electron microscopy,FESEM)图片.由图片观察可知,提纯前后埃洛石有很大的差别.从图2(a)可知,埃洛石原矿中存在着2 μm左右的六方片状的高岭石,细长的管状埃洛石集束、鳞片状的三水铝石和粒状的石英颗粒.图2(b)提纯后埃洛石呈多层卷曲的管状,其中管体完好,且中空管状结构清晰,管长主要集中在200 nm~800 nm范围内,它们的内径为10 nm~20 nm,外径为20 nm ~80 nm,个别管长可达1 nm~2 μm.

图2 (a)原矿和(b)提纯的埃洛石SEM和FESEM图Fig.2 SEM and FESEM images of(a)raw and(b)purified halloysite
2.2 埃洛石的煅烧
图3为埃洛石在不同温度下煅烧后的XRD图谱,其中a为提纯后的埃洛石X射线衍射图谱,b、c、d、e分别为海泡石经300℃、500℃、700℃、900℃煅烧2 h后的X射线衍射图谱.

图3 煅烧温度对埃洛石XRD图谱的影响Fig.3 Effects of calcination temperatures on XRD patterns of halloysite
从图3的XRD图谱可见,经过300℃煅烧后,埃洛石中的吸附水逸出,其中的纳米孔道进一步疏通,结构变得紧密,使得晶体(001)和(002)面的衍射峰向高角度偏移,并且峰型变得尖锐,相对强度增加;当煅烧温度超过500℃时,已无明显衍射峰,呈现非晶态.因此后续试验选择300℃为煅烧温度.
图4为提纯埃洛石及300℃煅烧2 h后的埃洛石样品的FESEM图片,其中a为埃洛石提纯样的FESEM图片,b为埃洛石经300℃煅烧2 h后样品的FESEM图片.
由扫描电镜分析可知,埃洛石样的表面形貌主要为管状结构,管长0.5 μm~2 μm;300 ℃煅烧时,埃洛石仅脱出吸附水和结晶水,而吸附水和结晶水的脱出不会影响埃洛石的基本结构,其微观形貌变化不大,仍保持管状结构,但管长变短为0.3 μm~1 μm.埃洛石管状结构的断裂导致孔体积以及比表面积增大,从而增强样品的吸附性能,有利于后续试验.
样品的比表面积及孔体积用N2吸附法测定.如表1所示列出了提纯的埃洛石及其300℃下煅烧2 h后样品的孔参数.
对比可知,提纯埃洛石的BET为30.105 4 m2/g,300℃煅烧2 h后埃洛石样品的BET增加为37.037 0 m2/g.精制埃洛石孔体积为0.098 91 cm3/g,经过300℃煅烧2 h后孔体积增加至0.109 6 cm3/g.埃洛石经煅烧后样品的比表面积和孔体积均增加,但是样品的孔径经煅烧后减小.提纯埃洛石的孔径为13.141 5 nm,300℃煅烧2 h后孔径减至11.843 2 nm.结合煅烧后形貌分析,经煅烧后的埃洛石管状形貌断裂,形成更短的管状结构,因此增加了比表面积以及孔体积.还可发现,煅烧样的微孔以及介孔的比表面积和孔体积较之未煅烧的均增加.经煅烧后,在微孔0 nm~2 nm范围内,样品的孔面积从0.338 0 m2/g增至0.643 0 m2/g,孔体积从0.000 161 0 cm3/g增加到0.000 31 cm3/g;在介孔2 nm~50 nm范围内,孔面积从29.394 0 m2/g增加到33.561 0 m2/g,孔体积从0.095 83 cm3/g增加到0.103 7 cm3/g.纳米尺度范围内比表面积、孔体积及孔径均增加,为埃洛石有机改性用于吸附CO2气体提供了良好的条件.

图4 (a)提纯的和(b)煅烧的埃洛石FESEM图Fig.4 FESEM images of(a)purified and(b)calcined halloy site

表1 提纯后及煅烧后的埃洛石孔参数Tab.1 Pole parameters of purified and calcined halloysite

图5 (a)300℃下煅烧和(b)混合胺改性的埃洛石FESEM图片Fig.5 FESEM images of halloysite(a)calcined at 300 ℃ and(b)modified by mixed amine
2.3 混合胺改性埃洛石
图5所示为300℃煅烧2 h后的埃洛石及其混合胺改性样品的FESEM图片.由图可知,埃洛石经混合胺改性后样品形貌没有明显变化.
图6为改性埃洛石红外光谱图,其中曲线a、b、c、d分别表示埃洛石300℃煅烧2 h后、埃洛石300℃煅烧2 h后经混合胺改性、乙醇胺和N,N-二甲基乙醇胺的红外光谱图.
图6中的c谱线观察到在3 500 cm-1~3 150 cm-1范围内的较宽吸收带为HO(CH2)2NH2结构中-NH2的N-H伸缩振动吸收,在1 650 cm-1~1 500 cm-1范围是-NH2的面外弯曲振动吸收峰,2 937 cm-1、2 856 cm-1为-CH2-CH2-中的C-H键的伸缩振动的吸收峰.在图中的d线可知2 850 cm-1~2 700 cm-1范 围 的 吸 收 峰 为 CH3N(CH2CH2OH)2结 构中-CH2N=中-CH2-的振动吸收峰.对比改性前后样品的红外曲线a和b可知,埃洛石经混合胺改性后在 3 122 cm-1、2 931 cm-1、1 573 cm-1处增加了特征吸收峰.其中3 122 cm-1处的吸收峰是由胺基的N-H键的振动吸收峰,2 931 cm-1处的特征吸收峰是-CH2-CH2-中C-H键的伸缩振动的吸收峰,1 573 cm-1处为NH2面内弯曲振动吸收峰.图中改性剂的红外谱线c、d和改性样品的红外曲线b,可知,改性后样品谱线中C-H振动的特征吸收峰与两种改性剂相比较,都发生了一定程度上的偏移.这些红外吸收峰波数的变化,表明改性剂分子接枝到埃洛石表面后,其存在形式或者分子间的排列分布状态与纯改性剂有所不同.上述分析可以证明成功地制备了混合胺改性埃洛石样品.

图6 改性埃洛石的红外光谱图Fig.6 IR spectra of modified halloy site
表2列出了300℃煅烧2 h后埃洛石样及300℃煅烧2 h后埃洛石混合胺改性样的孔参数.煅烧后经混和胺改性后的埃洛石样品的BET数据有所降低,为33.09 m2/g,对比混和胺改性前后样品的孔参数,埃洛石处理后混合胺改性比表面积从37.01 m2/g减小到33.09 m2/g,它的孔体积从0.109 6 cm3/g减小到0.095 37 cm3/g,孔径大小从11.84 nm减小到11.53 nm.结合形貌分析,由于煅烧后管状结构就已经断裂,在此之上混和胺改性后也是如此.在2 nm~50 nm的孔面积分布上从33.56 m2/g减小到30.75 m2/g,但是在0 nm~2 nm的孔面积分布上从0.643 0 m2/g增加到了2.300 m2/g,增加了两倍以上,可见混和胺的改性在介孔2 nm~50 nm范围内略有下降,在对微孔0 nm~2 nm范围内有大幅的提升.而在孔体积分布上,在0nm~2nm范围内孔体积从0.000 310 0 cm3/g增加到 0.001 087 cm3/g,增加了2倍以上,而在2 nm~50 nm范围内的孔体积有略微的下降,从0.103 7 cm3/g下降到了0.091 13 cm3/g.混和胺改性后微孔上的孔面积分布和孔体积分布大幅度提升,同时混合胺负载到煅烧后的埃洛石上后,吸附CO2的方式由物理吸附转为以化学吸附为主,物理吸附为辅,这就为提升CO2的吸附效果提供了很好的条件.

表2 埃洛石300℃煅烧后及混合胺改性后的孔参数Tab.2 Pole parameters of halloysite calcined at 300℃and modified by mixed amine
2.4 CO2的吸附性能测试
图7为300℃煅烧2 h埃洛石样品在试验条件下的测试结果,表示了测试过程中样品的质量变化情况.从图中可以看出,在测试过程的第一阶段,埃洛石经过300℃煅烧2 h后质量百分数下降至95.49%;在第二阶段,样品的质量百分数先是迅速增加到98.49%,此时是吸附CO2的最大吸附量,接下来又不断下降.所以可以计算出300℃煅烧2 h后的埃洛石样在常温常压下吸附CO2的质量分数为:
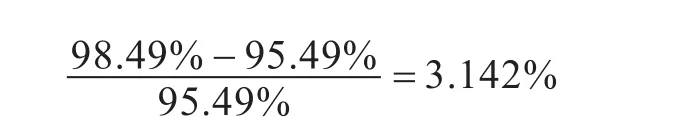
图8所示为300℃煅烧2 h埃洛石混合胺改性样吸附CO2的热重变化曲线.由图可见,在抽真空阶段,样品的质量下降到原始质量的98.86%;在吸附CO2阶段,样品的质量剧烈上升,质量百分数最高上升到115.87%,此时的CO2吸附量达到最大值,之后样品的质量又下降,为先上升后下降再上升的动态变化趋势.
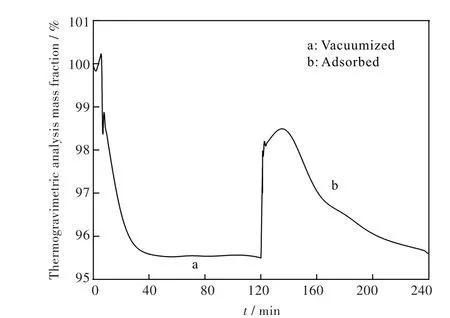
图7 300℃下煅烧的埃洛石CO2吸附的热重曲线Fig.7 TG curve of CO2adsorption on halloysite calcined at 300℃

图8 混合胺改性埃洛石CO2吸附的热重变化曲线Fig.8 TG curve of CO2adsorption on halloysite modified by mixed amine
可以计算出300℃煅烧2 h埃洛石混合胺改性样在常温常压下吸附CO2的质量分数为:

3 结 语
本文将埃洛石原矿提纯后得到了纯度大于98%的埃洛石,BET数据显示提纯后比表面积可达30.11 m2/g.测试不同的煅烧温度,埃洛石在300℃煅烧2 h后吸附水逸出,纳米孔道进一步疏通,相对峰强度增加;当煅烧温度超过500℃时,已无明显衍射峰,呈现非晶态.300℃煅烧2 h的埃洛石样品的比表面积增加至37.04 m2/g,在常温常压下对CO2的吸附量测得为3.142%.
BET的测试结果证明,采用乙醇胺和N,N-二甲基乙醇胺能有效的对埃洛石进行改性,改性后的埃洛石孔面积,孔体积和孔径虽然都有所减小,但是孔面积分布和孔体积分布都增大,同时对CO2的吸附性能明显优于改性前仅煅烧的埃洛石样品,在常温常压下对CO2的吸附量达到17.21%.
[1] FREDERICK W P.Sustainable infrastructure:climate changes and carbon dioxide[J].American Journal of Civil Engineering,2017,5(5):254-267.
[2] JACQUELYNH, DAVID R, MARTIN L,et al.Atmospheric monitoring and detection of fugitive emissions for Enhanced Oil Recovery[J].International Journal of Greenhouse Gas Control,2016,45:1-8.
[3] MERKEL T C,LIN H,WEI X,et al.Power plant post-combustion carbon dioxide capture:an opportunity for membranes[J].Journal of Membrane Science,2010,359(1/2):126-139.
[4] WANG C,LUO H,JIANG D E,et al.Carbon dioxide capture by superbase-derived protic ionic liquids.[J].Angewandte Chemie,2010,49(34):5978.
[5] MANGALAPALLY H P, HASSE H.Pilot plant experiments for post combustion carbon dioxide capture by reactive absorption with novel solvents[J].Energy Procedia,2011,4(1):1-8.
[6] FREEMAN S A,DUGAS R,WAGENER D H V,et al.Carbon dioxide capture with concentrated,aqueous piperazine[J].International Journal of Greenhouse Gas Control,2010,4(2):119-124.
[7] 汪铁林,延斯·克劳斯.二氧化碳捕集中2-氨基-2-甲基-1-丙醇溶剂的热降解[J].武汉工程大学学报,2013,35(10):1-5.WANG T L,JENS K.Thermaldegradation of 2-Amino-2-methyl-1-propanol solvent for carbon dioxide capture[J].Journal of Wuhan Institute of Technology,2013,35(10):1-5.
[8] HARDIE S M L,GARNETT M H,FALLICK A E,et al.Carbon dioxide capture using a zeolite molecular sieve sampling system for isotopic(13C and 14C)studies of respiration[J].Radiocarbon,2005,47(3):441-451.
[9] SUMIDA K,ROGOW D L,MASON J A,et al.Carbon dioxide capture in metal-organic frameworks [J].Chemical Reviews,2012,112(2):724-781.
[10] LI J R,MA Y,MCCARTHY M C,et al.Carbon dioxide capture-related gas adsorption and separation in metal-organic frameworks [J]. Coordination Chemistry Reviews,2011,255(15/16):1791-1823.
[11] YAZAYDIN A Ö,SNURR R Q,PARK T H,et al.Screening ofmetal-organic frameworksforcarbon dioxidecapture from fluegasusinga combined experimental and modeling approach[J].Journal of the American Chemical Society,2009,131(51):18198.
[12] XIANG S,HE Y,ZHANG Z,et al.Microporous metal-organic framework with potential forcarbon dioxide capture at ambient conditions[J].Nature Communications,2012,3(1):954.
[13] WU L, XUE M,QIU S L,etal.Amino-modified MIL-68(In) with enhanced hydrogen and carbon dioxide sorption enthalpy [J]. Microporous &Mesoporous Materials,2012,157:75-81.
[14] MELLO M R,PHANON D,SILVEIRA G Q,et al.Amine-modified MCM-41 mesoporous silica for carbon dioxide capture [J]. Microporous& Mesoporous Materials,2011,143(1):174-179.
[15] ZELENAK V, HALAMOVAD, GABEROVA L,et al.Amine-modified SBA-12 mesoporous silica for carbon dioxide capture:effect of amine basicity on sorption properties[J].Microporous&Mesoporous Materials,2008,116(1/2/3):358-364.
Adsorption Behavior of Carbon Dioxide with Halloysite Modified by Ethanol Amineand N,N-Dimethyl Ethanolamine
ZHAO Weijun1,ZHANG Huali1*,YAN Chunjie2,PAN Zhiquan1
1.School of Chemistry and Environmental Engineering,Wuhan Institute of Technology,Wuhan 430205,China;
2.Nano-Mineral Materials and Application Engineering Research Center of the Ministry of Education,China University of Geosciences,Wuhan 430074,China
The carbon dioxide adsorption capacities of halloysite after calcination and modified by amine were studied.The effects of purification,calcining temperature and mixed amine modification on the specific surface area were inspected.The results show that the specific surface area of purified halloysite is 30.11 m2/g.X-ray diffraction results demonstrate that the diffraction peaks become sharper with calcining temperature increasing.However,the diffraction peaks begin to decrease when the temperature is greater than 300 ℃.As a result,the optimum calcining temperature is set as 300℃and corresponding specific surface area is 37.04 m2/g.The mass fraction of carbon dioxide absorptionon halloysite is 3.141%at ambient temperature and atmospheric pressure.After calcination at 300℃,the halloysite was modified by mixed amine.The infrared spectra show that the modification is successful.The specific surface area decreases to 33.09 m2/g.On the contrary,the mass fraction of carbon dioxide absorption with modified halloysite is 17.21%,which is much higher than that of calcined halloysite,proving that carbon dioxide adsorption behavior on modified halloysite is mainly a chemical process.
halloysite;mixed amine;modifying;CO2adsorption
2017-03-17
赵唯君,硕士研究生.E-mail:592092222@qq.com
*通讯作者:张华丽,博士,副教授.E-mail:zhiqpan@163.com
赵唯君,张华丽,严春杰,等.乙醇胺和N,N-二甲基乙醇胺改性埃洛石对CO2的吸附行为[J].武汉工程大学学报,2017,39(5):420-426.
ZHAO W J,ZHANG H L,YAN C J,et al.Adsorption behavior of carbon dioxide with halloysite modified by ethanol amineand N,N-dimethyl ethanolamine[J].Journal of Wuhan Institute of Technology,2017,39(5):420-426.
TQ028.1+5
A
10.3969/j.issn.1674-2869.2017.05.003
1674-2869(2017)05-0420-07
张 瑞

