针刺对支气管哮喘大鼠肺组织PI3K蛋白表达的影响❋
杨金华,赵 叶,李 双,韩君萍,虞跃跃,樊志忠,崔建美
(华北理工大学,河北 唐山 063000)
【针灸研究】
针刺对支气管哮喘大鼠肺组织PI3K蛋白表达的影响❋
杨金华,赵 叶,李 双,韩君萍,虞跃跃,樊志忠,崔建美△
(华北理工大学,河北 唐山 063000)
目的:探讨针刺对哮喘大鼠肺组织中PI3K蛋白表达的影响。方法:将40 只SPF级雄性SD大鼠按随机数字表法分为空白组、模型组、针刺组和阻断剂组各10只,各组分别给予相应干预后用生理记录仪检测大鼠肺功能的变化,用Western Blot法和免疫组织化学法检测大鼠肺组织PI3K蛋白的表达。结果:呼吸功能测定显示模型组大鼠肺顺应性降低,肺弹性阻力升高,较空白组、针刺组和阻断剂组改变明显;western Blot和免疫组化法检测示模型组PI3K蛋白表达较空白组、针刺组、阻断剂组升高;针刺后PI3K蛋白表达降低,阻断剂组与空白组比较差异无统计学意义。结论:针刺可降低大鼠肺组织中PI3K蛋白表达以减轻气道重塑,改善和恢复肺功能。
针刺;哮喘;PI3K
支气管哮喘(简称哮喘)是临床常见的疑难病和多发病,其发病率和死亡率在全世界范围内呈逐渐增长趋势[1],是危害人类健康的常见疾病之一,目前全球哮喘患者约有3亿人。西医认为,哮喘是由多种细胞(包括气道的炎性细胞和结构细胞)和多种细胞因子、炎性介质参与的气道慢性炎症性疾病。中医认为,哮为痰鸣有声,喘为短气不足以息,哮喘发病主因痰饮伏肺而引发,病机有寒饮伏肺、痰热壅肺、肺脾气虚、肺肾阴虚、心肾阳虚。对哮喘的治疗西医以糖皮质激素抗炎为主,中医多采用针灸、中药等方法改善肺功能。大量研究证实,针灸能避免因服用药物而出现的副作用,对治疗和预防哮喘发作有重要意义,但是针灸疗法发挥治疗作用的机制尚不明确。本实验采用Western Blot法和免疫组化法观察针刺对哮喘大鼠肺组织PI3K蛋白表达的影响,以及针刺对哮喘大鼠肺功能的影响,探讨针刺治疗哮喘的机制。
1 实验材料
1.1 主要试剂与仪器
卵蛋白粉末,PV6000通用性试剂盒,兔来源PI3K第一抗体,DAB染色试剂盒,PVDF膜,LY294002粉末,Western及IP细胞裂解液、磷酸酶抑制剂(100 mmol/L)、BCA蛋白浓度测定试剂盒(增强型)、SDS-PAGE凝胶配制试剂盒、彩色预染蛋白Marker,超敏ECL化学发光试剂盒、兔来源GAPDH第一抗体,辣根过氧化物酶标记的山羊抗兔二抗,Western一抗二抗去除液(强碱性)、一次性无菌针灸针、切片机、光学显微镜、低温高速离心机R134 A、电泳、电转仪;PRO200匀浆机、水平摇床、雾化器、生理记录仪和自制雾化罩。
1.2 实验动物
40只雄性SPF级SD大鼠,体质量100~130 g,购自天津山川红实验动物公司,符合实验动物使用标准(许可证号SYXK 2015-0038),饲养于华北理工大学动物实验中心,环境温度20~25 ℃,湿度60%~70%,通风良好。正常饲料喂养(饲料批号SCXK-(军)2014-0001),饮水为超滤系统处理的无菌水,定期更换垫料。
2 方法
2.1 动物分组及造模
大鼠适应性喂养3 d,按随机数字表法将40只大鼠分为空白组、模型组、针刺组和阻断剂组4组各10只。
哮喘模型制备方法[2]:模型组大鼠腹腔注射含卵蛋白(OVA)1 mg和Al(OH)310 mg的生理盐水1 ml致敏,1周后再次腹腔注射相同成分生理盐水1 ml加强致敏,加强致敏后第2天用1%OVA混悬液雾化吸入激发30 min,隔天1次共14次;空白组参照上述方法,但致敏和激发时均以生理盐水代替;针刺组在模型组的基础上,激发雾化1%OVA混悬液之前30 min进行针刺操作;阻断剂组在模型组基础上,激发雾化1%OVA混悬液之前30 min雾化阻断剂治疗,1 mg/kg以阻断PI3K/AKT通路。
2.2 治疗方法
2.2.1 针刺操作 取穴:取大椎、肺俞(双)、风门(双)。针刺方法:将大鼠置于高台上进行针刺,平补平泻,每次留针20 min,每隔5 min行针1次(以200次/min捻转速度捻针20次为行针1次),隔日针刺1次,共针刺14次。
2.2.2 阻断剂干预 造模期间,阻断剂组大鼠激发雾化1%OVA混悬液之前,先雾化LY294002混悬液30 min,隔天1次共14次。LY294002混悬液配制方法:取2 mg LY294002粉末溶解于200ul的DMSO中,生理盐水定容至6 ml,震荡混匀。
2.3 指标检测方法
2.3.1 气道阻力测定 末次雾化激发之后24 h内测定气道阻力,各组大鼠称重后,用10%的水合氯醛按3.5 ml/kg腹腔注射麻醉。打开RM6.240生物信号采集处理系统,设置相应的指标包括频率、速度等,将大鼠用胶布固定在鼠板上,剪开颈部皮肤,钝性剥离皮下组织,充分暴露气管和食管上段,气管食管插管并固定,气管测呼吸,食管接压力换能器,记录气道阻力R和肺顺应性C,共记录30 min保存波形。每只大鼠图像截取20个波段,保存数据到excel表并进行统计。
2.3.2 免疫组化法检测肺组织PI3K表达水平 制作肺组织切片:各组大鼠用生理记录仪记录完毕后打开腹腔,腹主动脉取血后剪开胸腔,整体取出心肺和气管,清除心脏、气管、大血管和肺门周围结缔组织,剥离肺生理盐水漂洗干净,吸水纸拭干。右肺中叶于4%多聚甲醛固定,剩余右肺于液氮保存。右肺中叶固定超过48 h后,常规石蜡包埋、切片,做成组织切片,其余右肺提取蛋白备用。
免疫组化步骤:65 ℃烤片40 min,室温放置5 min做免疫组化。石蜡切片常规脱蜡至水,放入纯水中2 min;微波修复抗原,修复液枸橼酸盐(自制),高火烧开后中火烧7 min,冷水冷却,PBS 洗3×5 min;组织周围擦干,滴加过氧化氢,室温下孵育15 min,PBS 洗3×5 min;滴加一抗(兔抗大鼠PI3K 单克隆抗体,工作浓度1∶200),置湿盒内4 ℃冰箱过夜,PBS 洗3×5 min;滴加二抗(PV6000试剂盒中B液)置湿盒内,37 ℃恒温箱孵育15 min,PBS 洗3×5 min;切片DAB 显色30 s(显微镜下观察),流水充分冲洗;苏木素复染2 min泡水,盐酸酒精分化13 s,自来水冲洗返蓝30 min;梯度酒精脱水,二甲苯透明,中性树胶封固,光镜观察、扫图,使用Image-pro plus 6.0软件测图片IOD值,结果以平均光密度值(mean density简称MD)IOD/AREA表示。
2.3.3 Western Blot法检测肺组织PI3K表达水平 (1)提取肺组织蛋白:取100 mg肺组织放于5 ml EP管内,手术剪剪碎并用生理盐水清洗肺组织内残留血渍,移液枪吸走生理盐水,加入500 μl Western及IP细胞裂解液和50 μl磷酸酶抑制剂裂解组织,匀浆后4 ℃ 12000 r/min离心10 min,取15 μl上清用于BCA法测定蛋白浓度,剩余上清液取出-80 ℃保存备用。
Western Blot法步骤:按照SDS-PAGE凝胶配制试剂盒说明书制备10%的分离胶和5%的浓缩胶,注入安装好的电泳仪内,每组各取100 μl蛋白与25 μl的5×上样缓冲液混合制备样品,上样到SDS-聚丙烯酰胺凝胶进行电泳,电泳时设置电压为80V,等到Maker跑开后将电压调到120 V,待检测因子相应分子量的位置都完全分开后停止电泳,小心取出凝胶放入转膜缓冲液中进行转膜,电压调至90 V,转膜50 min。5%的脱脂奶粉封闭1 h后,将膜清洗干净,分别用兔来源GAPDH(1∶5000)、PI3K(1∶1000)第一抗体孵育,4 ℃过夜。洗膜后孵育辣根过氧化物酶(HRP)标记的山羊抗兔第二抗体,室温1 h。ECL染色,保存图像条带。
约在110 kD分子量位置上出现阳性条带,即为PI3K蛋白条带;约在37 kD分子量位置上出现阳性条带,即为GAPDH蛋白条带。使用Image-Pro Plus 6.0软件处理条带IOD值,结果以PI3K与内参GAPDH灰度值的比值表示。
2.4 统计学方法

3 结果
3.1 气道阻力测定结果
表1显示,模型组大鼠肺弹性阻力明显高于空白组、针刺组和阻断剂组,3组比较差异有统计学意义(均为P<0.05),而空白组和针刺组、雾化阻断剂组比较差异无统计学意义(均为P>0.05);模型组大鼠肺顺应性明显低于空白组、针刺组和阻断剂组3组比较差异有统计学意义(均为P<0.05),而空白组和针刺组、阻断剂组比较差异无统计学意义(均为P>0.05)。
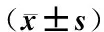
表1 大鼠气道阻力、肺组织PI3K表达结果
注:与空白组比较:▲P<0.05;与模型组比较:△P<0.05
3.2 免疫组化法检测肺组织PI3K蛋白表达结果
图1表1显示,空白组、模型组、针刺组与阻断剂组各组图片平均光密度值MD比较显示,哮喘模型组平均光密度值明显高于空白组、针刺组和阻断剂组,差异有统计学意义(P=0.000<0.05,P=0.000<0.05,P=0.002<0.05),而针刺组、空白组和阻断剂组3组比较差异无统计学意义(P=0.841>0.05,P=0.272>0.05,P=0.197>0.05)。
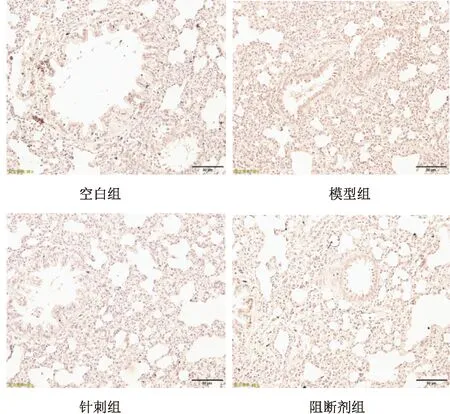
图1 各组大鼠肺组织免疫组化PI3K表达结果(IHC×400)
3.3 Western Blot法检测肺组织PI3K蛋白表达结果
图2表1显示,PI3K蛋白条带IOD值与内参条带的IOD比值显示,模型组明显高于空白组、针刺组和阻断剂组,差异有统计学意义(均为P<0.05);而针刺组与空白组、阻断剂组比较差异无统计学意义(均为P>0.05)。

图2 PI3K在大鼠肺组织中的表达(Western Blot)
4 讨论
哮喘是由多种细胞和细胞因子参与的慢性气道炎症性疾病,属于中医学“哮病”“喘证”范畴,以反复发作的喘息、气促、胸闷或咳嗽等为主要症状,其主要病理特征有慢性气道炎症、气道高反应性、黏液分泌过多和气道重塑[3-4]。其中,气道重塑是哮喘的典型病症,指气道组织结构的病理生理改变,以上皮分离、上皮下纤维化、胶原沉积、气道平滑肌细胞和杯状细胞增生肥大为典型特征,是造成气道不可逆阻塞和气道高反应性的重要原因,也是临床症状加重以及肺功能障碍的重要原因,是顽固性哮喘的重要病理生理基础[5]。
气道重塑是哮喘发病的重要机制,而其主要原因是气道平滑肌细胞ASMC增殖引起的气道平滑肌和气道壁增厚,在哮喘患者和实验动物哮喘模型中普遍存在ASMC增殖。研究表明,PI3K通路在ASMC 增殖中起主要正向调节作用,PI3K可以通过调节ASMC和气道上皮细胞的增殖参与调节气道重塑[6-7]。Scott 等[8]在研究中培养牛的ASMC,探讨PI3K活性与ASMC增殖的关系,运用PI3K抑制剂wortmannin抑制PI3K的活性,同时发现ASMC的DNA有丝分裂也受到抑制,结果表明PI3K的活性越高越能促进气道平滑肌细胞的增殖。莫碧文[9]等研究PI3K在支气管哮喘大鼠气道重塑中的作用,发现哮喘组大鼠气道上皮细胞、气道平滑肌细胞内PI3K P85α的表达明显高于正常对照组,且ASMC数量、气道壁厚度明显增加,表明PI3K信号通路可能通过促进ASMC增殖参与哮喘气道高反应性及气道重构的发病过程。Krymskaya等研究PI3K对AMSC增殖的影响,运用显微注射法把活化的ⅠA型PI3K导入到ASMC内,结果发现气道平滑肌细胞的DNA合成明显增加,表明PI3K能单独刺激ASMC DNA的合成,从而促进ASMC的增殖[10]。
本实验在造模干预完成后,取右肺中叶固定包埋后制作石蜡切片,取右肺下叶提取肺组织蛋白,分别用免疫组织化学法和免疫印迹法(Western Blot)检测大鼠肺组织PI3K的表达量。结果显示,哮喘组大鼠肺组织内PI3K蛋白的表达较高,明显高于正常对照组、针刺组和阻断剂组。同时,哮喘组大鼠的肺弹性阻力较高,肺顺应性较低,提示哮喘组大鼠出现气流受限的症状,针刺和阻断剂干预后,PI3K蛋白的表达降低,肺弹性阻力降低,肺顺应性升高,肺功能有所改善。由于PI3K调节ASMC的增殖参与气道重塑,气道的结构发生病理性改变,气道壁增厚,官腔变窄,故气流受限的症状与PI3K蛋白的含量和活性有关,抑制PI3K的表达可以减轻哮喘的症状。LY294002是PI3K通路的抑制剂,作用于PI3K Pll0β催化亚单位,可抑制PI3K的表达,也可以通过竞争与AT P结合区的结合抑制PI3K途径,且能明显抑制磷脂酞肌醇转换,阻断PI3K途径。从本实验结果分析,针刺组PI3K的表达明显降低接近阻断剂组,针刺组大鼠的肺功能接近正常组,可见针刺能阻断PI3K通路,从而改善哮喘患者的肺功能,减轻哮喘症状。
[1] DINSMOOR R. The rising tide of asthma: A look at what is causing this epidemic[J]. Asthma Mag, 2005, 10(1): 14.
[2] LIN Z R, WANG W G, YAN H M, et al. A method to induce asthma model by OVA in 129Sv mice strain [J]. Chinese Journal of Cell Biology, 2011, 33(9): 964- 968.
[3] NAKAGOME K, NAGATA M. Pathogenesis of airway inflammation in bronchial asthma[J]. Auris Nasus Larynx, 2011, 38(5): 555563.
[4] HOLTAGE ST. Pathogenesis of asthma[J]. Clin Exp Allergy, 2008, 38(6): 872-897.
[5] RHEE C K, KANG J Y, PARK C K, et al. Effect of nilotinib on airway remodeling in a murine model of chronic asthma[J]. Exp Lung Res, 2014, 40(5): 199-210.
[6] LIM D H, CHO J Y, SONG D J, et al. PI3K gamma-deficient mice have reduced levels of allergen-induced eosinophilic inflammation and airway remodeling[J]. Am J Physiol Lung Cell Mol Physiol, 2009, 296: 210-219.
[7] YADAV U C, NAURA A S, AGUILERA-AGUIRRE L, et al. Aldose reductase inhibition prevents allergic airway remodeling through PI3K/AKT /GSK3β pathway in mice[J]. PLoS One, 2013, 8(2): 57442.
[8] SCOTT P H, BELHAM C M, AL-HAFIDH J, et al. A regulatory Role for cAMP in Phosphatidylinositol 3-Kinase/p70 Ribosomal S6 Kinase-Mediated DNA Synthesis in Platelet-Derived-Growth-Factor-Stimulated Bovine Airway Smooth Muscle Cells[J]. Biochem J, 1996, 318(3): 965-971.
[9] 莫碧文, 王昌明, 张珍祥, 等. 磷脂酰肌醇3激酶促进支气管哮喘大鼠气道平滑肌细胞增殖[J]. 基础医学与临床, 2006, 26(5), 489-493.
[10] KRYMSKAYA V P, AMMIT A J, HOFFMAN R K, et al. Activation of class IA PI3K stimulates DNA synthesis in human airway smooth muscle cells[J]. Am J Physiol Lung Cell Mol Physiol, 2001, 280(5): 1009-1018.
RegulationofAcupunctureonPI3KExpressioninTheLungTissuesofAsthmaRats
YANG Jin-hua, ZHAO Ye, LI Shuang, HAN Jun-ping, YU Yue-yue, FAN Zhi-zhong, CUI Jian-mei△
(NorthChinaUniversityofScienceandTechnology,Hebei,Tangshan063000China)
Objective: To examine the mechanism of acupuncture on PI3K expression in the lung tissues of asthmatic rats. Methods: 40 SPF male SD rats were randomly divided into 4 groups with 10 rats in each group. Groups were given accordingly interventions. Physiological recorder is used to inspect the pulmonary function changes,western blot and immunohistochemical method were employed to observe the protein expression of PI3K in the lung tissue of rats. Results:The lung compliance of the asthma model group are decreased with the pulmonary elastic resistance increased comparing with the blank group,acupuncture group and blocking group.Western Blot and immunohistochemical method, The protein expression of PI3K was higher in asthmatic model group than other groups. but there was no statistical difference among the blocking group,the acupuncture group and the blank group. Conclusion:Acupuncture can reduce the protein expression of PI3K in lung tissue of rats to reduce airway remodeling and improve lung function.
Acupuncture; Bronchial asthma; PI3K
国家自然科学基金资助项目(81303046)-ERK1/2通路对哮喘大鼠气道重塑、气道炎症的调控与针刺干预的分子机制研究
杨金华(1989-),女,河北秦皇岛人,医学硕士,从事针灸治疗免疫系统疾病的机制研究。
△通讯作者:崔建美(1978-),女,河北保定人,教授,医学博士,从事针灸治疗免疫系统疾病的机制研究,Tel:0315-3725189,E-mail:cjm2188@126.com。
R 245.9
B
1006-3250(2017)11-1602-03
2017-04-17

