湘东大围山土壤垂直带谱微生物群落特征
马颢榴,宋佳龄,潘 博,张 亮,盛 浩
湖南农业大学土壤研究所,湖南 长沙 410128
湘东大围山土壤垂直带谱微生物群落特征
马颢榴,宋佳龄,潘 博,张 亮,盛 浩*
湖南农业大学土壤研究所,湖南 长沙 410128
土壤微生物是生态系统健康评价的关键生物学指标之一。为了解土壤微生物群落在中山海拔带上的分异规律,本研究选取亚热带湘东大围山花岗岩风化物发育的典型土壤垂直带谱:红壤、黄红壤、黄壤、暗黄棕壤和灌丛草甸土(亚类),采用磷脂脂肪酸(PLFA)技术,研究0~20 cm土壤微生物的PLFA含量、组成和多样性。结果表明,土壤垂直带PLFA种类较为丰富(38 种),PLFA 总量介于 35.01~103.54 nmol·g-1之间,以细菌最高(25.52~78.31 nmol·g-1),其次为放线菌(3.99~12.90 nmol·g-1)和真菌(4.29~12.33 nmol·g-1)。细菌群落中,以革兰氏阴性菌(G-)为主;真菌群落中,以腐生真菌为主。随着海拔升高,微生物PLFA总量、各类群微生物PLFA含量和多样性指数一致升高,显示高海拔地带土壤的微生物数量和多样性更高。此外,真菌与细菌比值(F:B,0.17~0.25)和G+细菌(革兰氏阳性菌)与G-细菌比值(G+:G-,0.52~0.79)以低海拔带的红壤最高,随海拔升高而降低,表明高海拔带土壤微生物群落以细菌、G-群落占优。在湘东大围山土壤垂直带上,各类群的微生物量和多样性随着海拔的升高而升高,可能是山地小气候、pH、有机底物的数量和质量综合作用的结果。
细菌;真菌;放线菌;磷脂脂肪酸法(PLFA);花岗岩;海拔带
土壤微生物种类多、数量大,不仅参与土壤的发生发育,也是土壤养分转化的“发动机”,常被视作土壤肥力和环境健康评价的关键生物指标之一(Morrien et al.,2017)。土壤微生物群落受气候、地形、植被、土壤类型和土地利用方式的强烈影响(Lanzén et al.,2016)。在南方丘岗山区,随海拔升高,气候、植被和土壤呈明显的垂直地带性规律,有关土壤微生物群落在海拔带上的分布格局仍有待深入研究(张于光等,2014;褚海燕等,2017)。磷脂脂肪酸(PLFA)是微生物种、类群的稳定生物标记物,被广泛应用于土壤微生物群落的多样性分析(颜慧等,2006)。研究表明,土壤微生物群落与海拔的关系复杂,不同类群的微生物PLFA含量呈先升高后降低(王淼等,2013;张于光等,2014)、先降低后升高(Djukic et al.,2010;曾清苹等,2015)、单调递增(Wang et al.,2010)、单调递减(吴则焰等,2014)或无明显(张地等,2012)变化规律。土壤微生物在海拔带上的生物地理分异与微生物类群自身特性、土壤环境(如pH、土温和水分)、有机质和凋落物有效性(如氨基糖)密切相关,但关键调控因素仍有待加强研究(Djukic et al.,2010;Zhang et al.,2013;吴则焰等,2014)。因此,刻画海拔带上土壤微生物的群落特征对认清土壤微生物的垂直地带性分异规律及调控机理具有重要意义。
湘东大围山地处中亚热带,山体为元古代早期的花岗岩岩体,主峰海拔1608 m,相对高差达1370 m。从山麓到山顶,分布典型的红壤、黄红壤、黄壤、暗黄棕壤和灌丛草甸土(亚类),成为中亚热带山地土壤性质垂直带分异的理想研究平台。本研究以大围山土壤垂直带为研究对象,采集0~20 cm表层土壤样品,应用磷脂脂肪酸(PLFA)法分析不同海拔带土壤微生物群落特征,为明确土壤微生物群落的垂直地带性分布规律和山地土壤质量评价提供参考。
1 材料与方法
1.1 采样地概况
采样地位于湘东(浏阳市)大围山国家森林公园(114°02′~114°12′E、28°21′~28°26′N),地处东西走向的罗霄山脉北段,最高峰七星岭海拔为 1608 m,最低点花门电站海拔仅230 m(马欣等,2015)。区域地貌属中山地貌,中亚热带山地湿润气候(年均温11~17 ℃,年降水量1200~2000 mm,无霜期243 d)(于青漪等,2014)。在中、低海拔带,原生地带性破坏严重,仅残存松、杉人工林,毛竹林和次生灌丛。1000~1200 m 海拔为落叶阔叶林,1400~1600 m为黄山松,>1600 m主要分布芒草。土壤垂直带谱如下:600~800 m为红壤、800~1100 m为黄壤、1100~1300 m为黄棕壤、>1300 m为灌丛草甸土。
2016年5月,按土壤亚类,沿山麓至山顶选取典型的红壤、黄红壤、黄壤、暗黄棕壤和灌丛草甸土设置样地,样地概况参见表1。
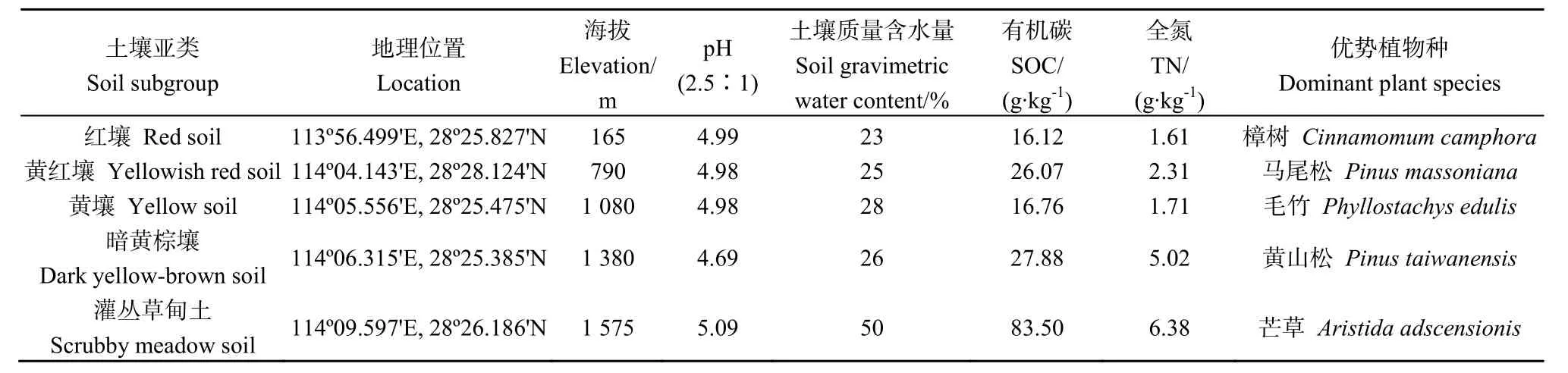
表1 大围山不同海拔带样地和土壤性质概况Table1 Basic situation of sites along an elevation transect in Daweishan Mount
1.2 样品采集和室内分析
在5个海拔带随机设置3个面积为20 m×20 m的标准样地,在样地中随机选取 8~15个样点,采集0~20 cm土层土壤样品,混合均匀,置于保鲜盒中保存。新鲜土壤样品带回室内后,迅速剔除砾石、动植物残体等土壤异物,过2 mm筛,-20 ℃冷冻,一周内测定PLFA。
PLFA的分离和提取采用修正的Bligh-Dyer方法(Bligh et al.,1959;Zelles et al.,1992):(1)提取:称取相当于8 g干土的新鲜土壤,采用色谱纯氯仿、甲醇、磷缓冲液按2∶1∶0.8比例混合,浸提液在<25 ℃下振荡 2 h(285 r·min-1)后离心 10 min(3500 r·min-1),收集上层离心液,如此反复提取后加入磷酸盐缓冲液和氯仿各12 mL,于黑暗中静置12 h,吸取下层溶液,在30~32 ℃水浴锅中用氮气吹干。(2)分离:取1000 μL CHCl3转移浓缩的磷脂至萃取小柱,小柱中加5 mL氯仿用于洗去中性脂,并加5 mL丙酮洗去糖性脂(冲洗2次),用1 mL甲醇冲洗萃取小柱底部,收集5 mL甲醇淋洗液,加入4 μL C19∶0内标,在32 ℃水浴锅中用氮气吹干。(3)甲脂化:用1 mL甲醇-甲苯混合液(体积比为1:1)和1 mL 0.2 mol·L-1氢氧化钾溶解干燥的磷脂样品,于37 ℃水浴中加热15 min,加入0.3 mL 1 mol·L-1醋酸溶液、2 mL正己烷、2 mL超纯水,低速振荡(120 r·min-1)10 min,吸取上层正己烷溶液,氮气吹干,加入200 μL正己烷冲洗试管,将溶液吸入萃取小柱中保存。使用Agilent 6850气相色谱仪(FID检测器)测定脂肪酸。土壤微生物磷脂脂肪酸分类方法参考Willers et al.(2015),并进行适当修正(姚晓东等,2016)。
土壤理化性质测定:土壤pH采用电位法;土壤质量含水量采用烘干法;土壤有机碳(SOC)采用高温外热重铬酸钾氧化-容量法;土壤全氮(TN)采取半微量凯氏法(鲁如坤,2000)。
1.3 数据计算和分析
运用 Excel 2010计算不同海拔土壤微生物PLFA绝对含量、相对含量以及真菌与细菌比值(F:B)、革兰氏阳性菌与阴性菌比值(G+:G-)和多样性指数(吴则焰等,2014;曾清苹等,2015)并绘图。
2 结果
2.1 不同海拔带土壤微生物的群落组成
土壤微生物 PLFA 的绝对含量介于 35.01~103.54 nmol·g-1之间,土壤微生物总生物量和各类群生物量总体上随海拔升高呈升高趋势,在1380 m的暗黄棕壤样地达到峰值(表2)。细菌PLFA绝对含量最高,介于25.52~78.31 nmol·g-1之间,其次为真菌(4.29~12.33 nmol·g-1)和放线菌(3.99~12.90 nmol·g-1)。土壤 G-细菌 PLFA 的绝对含量(11.58~39.85 nmol·g-1)高于 G+细菌(8.02~20.89 nmol·g-1)。假单胞菌的PLFA绝对含量高于硫酸盐还 原菌,二者分 别 介于 7.91~26.94 nmol·g-1、2.58~7.28 nmol·g-1之间。真菌以腐生真菌为主,其中腐生真菌、丛枝菌根真菌PLFA绝对含量分别介于 3.47~9.13 nmol·g-1、0.74~3.09 nmol·g-1之间;随海拔的升高,细菌(72%~76%)、丛枝菌根真菌(2%~3%)、假单胞菌(23%~26%)和硫酸盐还原菌(7%~9%)PLFA的相对含量的变幅很小。但是,腐生真菌PLFA的相对含量介于7%~15%之间,以红壤最高(15%),可能与易分解的新鲜有机物质数量在海拔带上的变化较大有关。
真菌与细菌的PLFA比值(F:B)、革兰氏阳性菌与阴性菌的PLFA比值(G+:G-)常用来反映特定微生物种群的相对丰度。大围山海拔带5种土壤F:B介于 0.17~0.25之间,G+:G-介于 0.52~0.79之间,均以红壤最高,反映湘东大围山红壤中真菌、G+菌最为丰富(图1)。
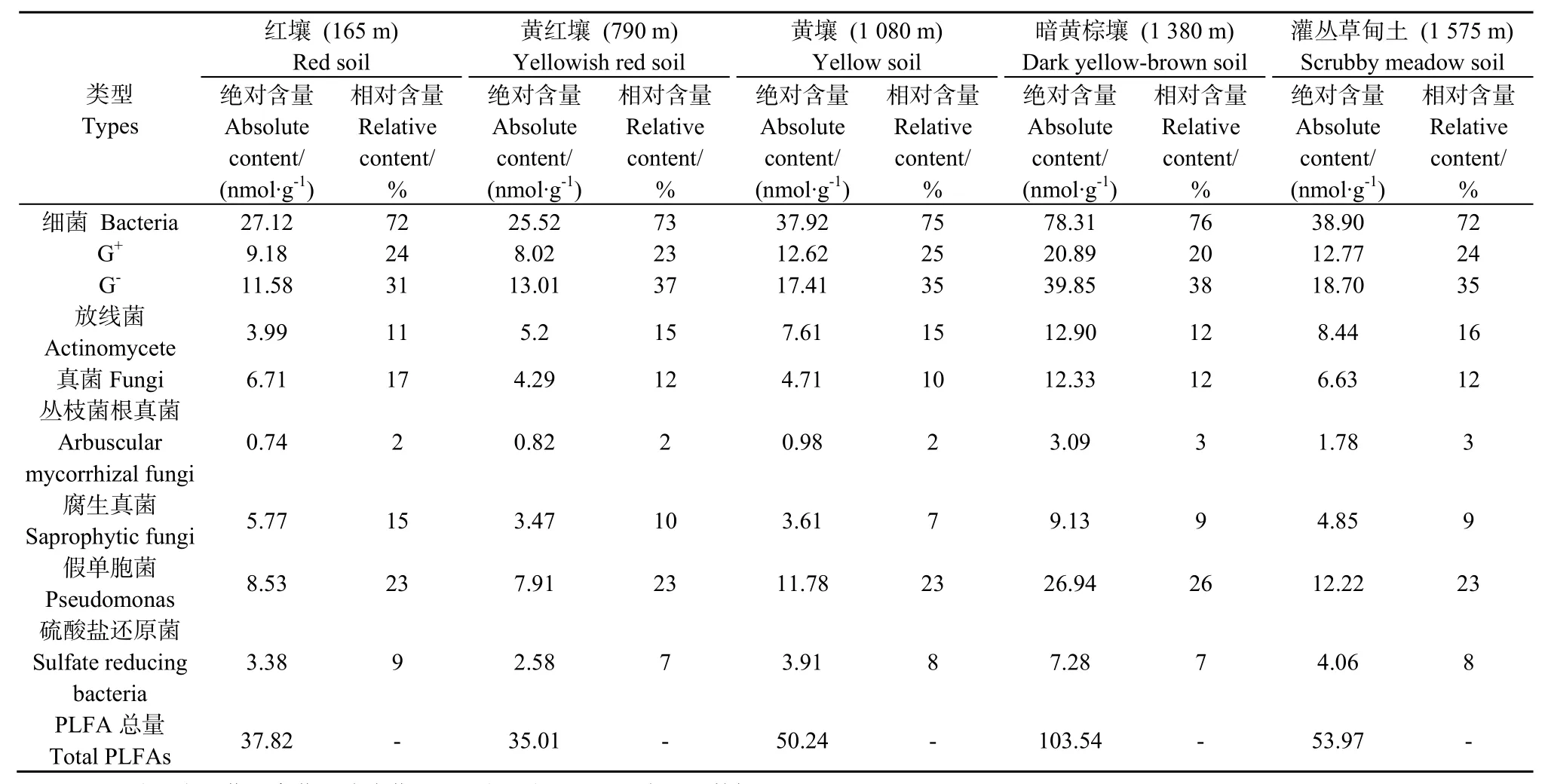
表2 大围山不同海拔带土壤微生物类群分布(PLFA)Table2 Distribution of soil microbial PLFAs along an elevation transect in Daweishan Mount
2.2 不同海拔带土壤微生物群落的多样性指数
土壤微生物群落4种多样性指数总体随海拔升高而升高,在高海拔地带达到最大值(表3)。这反映了随海拔升高,土壤微生物群落多样性增加。Simpson、Shannon-Wiener指数均以灌丛草甸土最高,显示灌丛草甸土微生物群落中最常见种的多样性最大,微生物种变化度和差异度也最大。丰富度指数以暗黄棕壤最高(达到 36),表明其微生物可利用的碳源最为丰富,这与暗黄棕壤有机质含量相对较高、环境条件较适宜有关。均匀度指数以黄红壤最高,表征黄红壤的微生物种分布相对均匀。
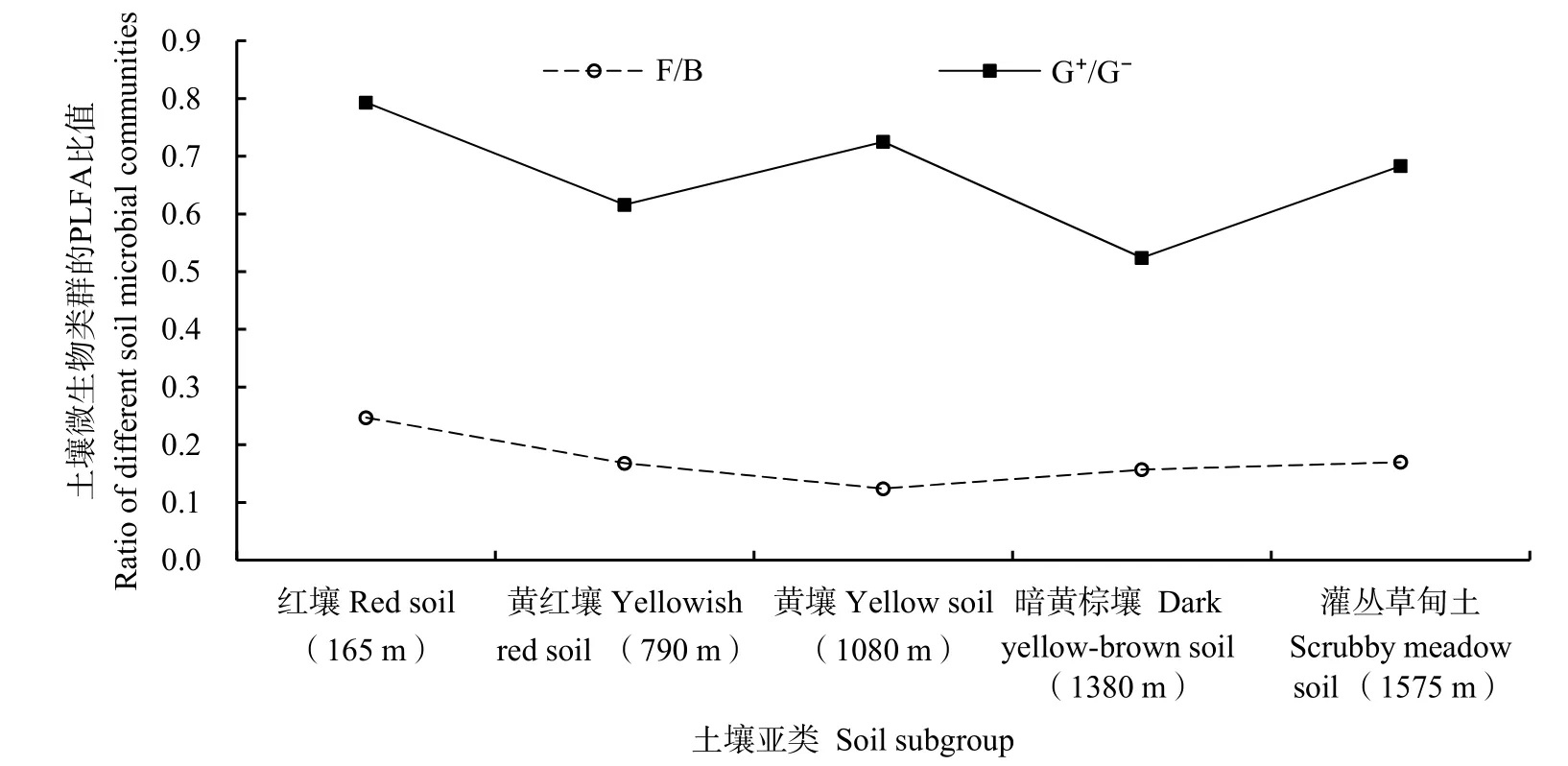
图1 大围山不同海拔带土壤F:B、G+:G-比值Fig.1 Ratio of F to B, G+ to G- along an elevation transect in Daweishan Mount
2.3 不同海拔带土壤微生物的PLFA组成
湘东大围山海拔带 5种土壤共检测出 38种PLFA,以黄红壤最少(28种),暗黄棕壤最多(36种)(图 2)。PLFA 以 16:0、i15:0、16:1w7c/16:1w6c、10Me 16:0、18:1w7c、18:0、cy19:0 w8c、18:1w9c和i16:0为主,这9种PLFA含量占脂肪酸总量的64%~71%;17:1w8c、14:0、17:0和i18:0这4种PLFA含量很低,仅占脂肪酸总量的 0.86%~2%。此外,20:1w7c、a15:1 A、i15:1 F PLFA分别仅在暗黄棕壤、黄壤和灌丛草甸土中检测到特有的生物标记物,含量很低(介于 0.17~0.26 nmol·g-1)。
经归类后,土壤微生物脂肪酸包括单链不饱和脂肪酸、环丙烷饱和脂肪酸、直链饱和脂肪酸、支链脂肪酸和多链不饱和脂肪酸,分别占脂肪酸总量的23%~34%、11%~14%、17%~22%、33%~48%和0.22%~0.34%,且随海拔升高,各类脂肪酸的含量呈升高趋势(表4)。
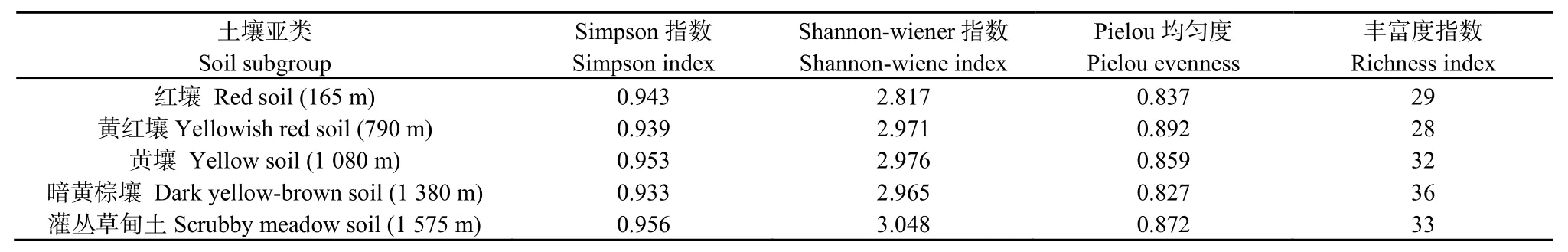
表3 大围山不同海拔带土壤微生物种的多样性指数Table3 Soil microbial diversity index along an elevation transect in Daweishan Mout
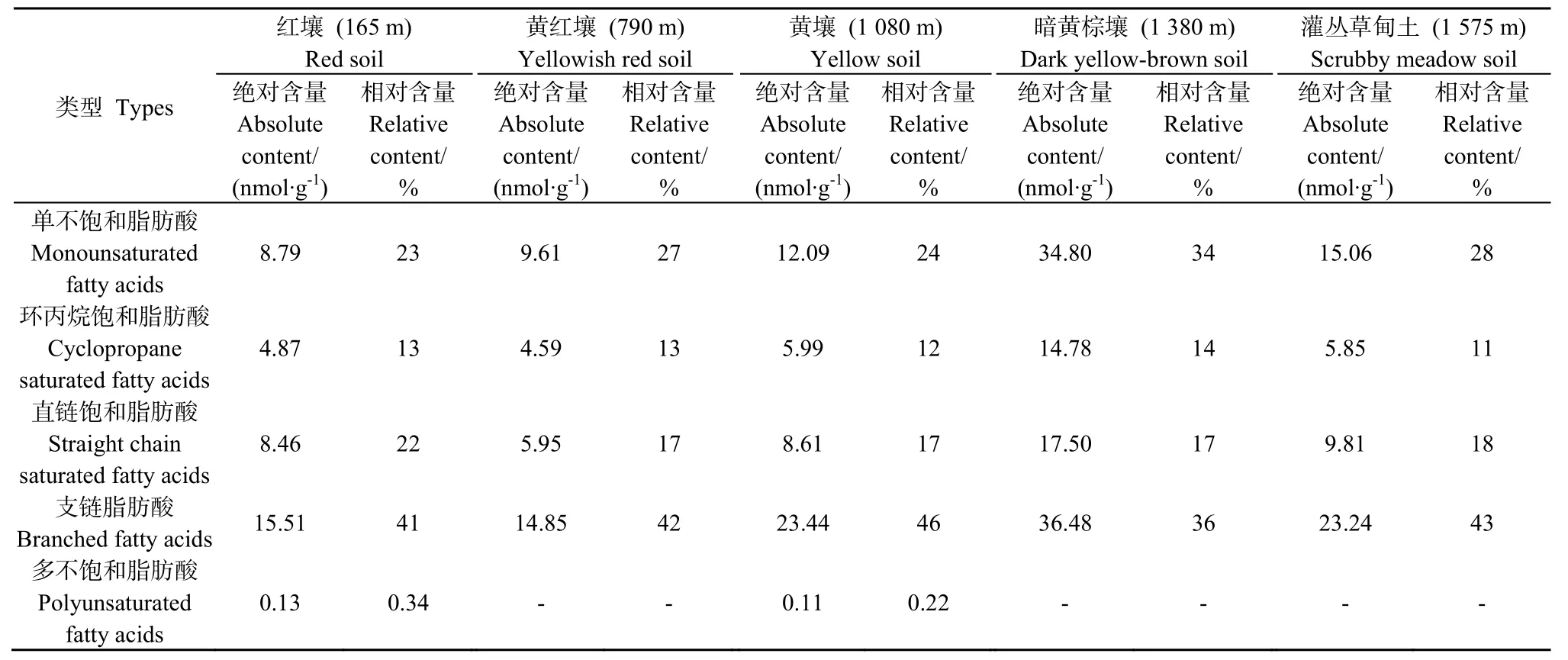
表4 大围山不同海拔带土壤PLFA的类型及含量Table4 Types and contents of soil PLFA along an elevation transect in Daweishan Mout
3 讨论
随着山地海拔的升高,气候、植被、土壤和人类活动发生有规律地更替,强烈影响着土壤微生物群落。据报道,武夷山主峰(500~2100 m)土壤微生物PLFA含量随海拔的升高而降低,主要与海拔升高凋落物输入量减少有关(吴则焰等,2014)。温带的长白山(540~2360 m)、罕山(1250~1890 m)土壤微生物PLFA含量随海拔升高呈先增加再减少趋势,峰值出现在中、高海拔带,可能与低海拔带或高海拔带凋落物和土壤有机质的质量较低有一定的关系(Xu et al.,2015;王淼等,2013)。奥地利阿尔卑斯山地区(900~1900 m)土壤微生物PLFA含量随海拔升高呈先减少再增加趋势,谷值出现在中海拔的针叶林,峰值出现在高海拔的草地;土壤微生物PLFA含量与pH呈正相关,但与C/N呈负相关(Djukic et al.,2010)。意大利阿尔卑斯山地区(545~2000 m)土壤微生物PLFA含量随海拔升高而增加,与土壤有机质含量呈正相关(Siles et al.,2016)。温带东灵山(1020~1770 m)辽东栎林土壤微生物PLFA含量随海拔升高无明显的变化规律,推测是海拔带内土壤微生物群落未受到底物限制,均能进行良好代谢的缘故(张地等,2012)。本研究所在的湘东大围山,土壤微生物PLFA含量随海拔升高呈升高趋势,与土壤有机质、全氮含量的变化基本一致(表 1)。在本区神农架(1700~2800 m)海拔带上,也报道了土壤微生物PLFA含量随海拔升高而升高的现象,可能与海拔升高pH降低有一定关系(张于光等,2014)。本研究中,灌丛草甸土虽然有机质含量最高,但土壤微生物PLFA含量却低于暗黄棕壤,可能与土壤微生物群落难以适应山顶灌丛草甸生态系统特殊的自然环境(低温、高湿)有关。土壤微生物群落在山地垂直带上尚无一致的生物地理分布模式,有机物数量和质量(C/N、养分)、土壤环境(如pH)均是潜在的关键影响因子。
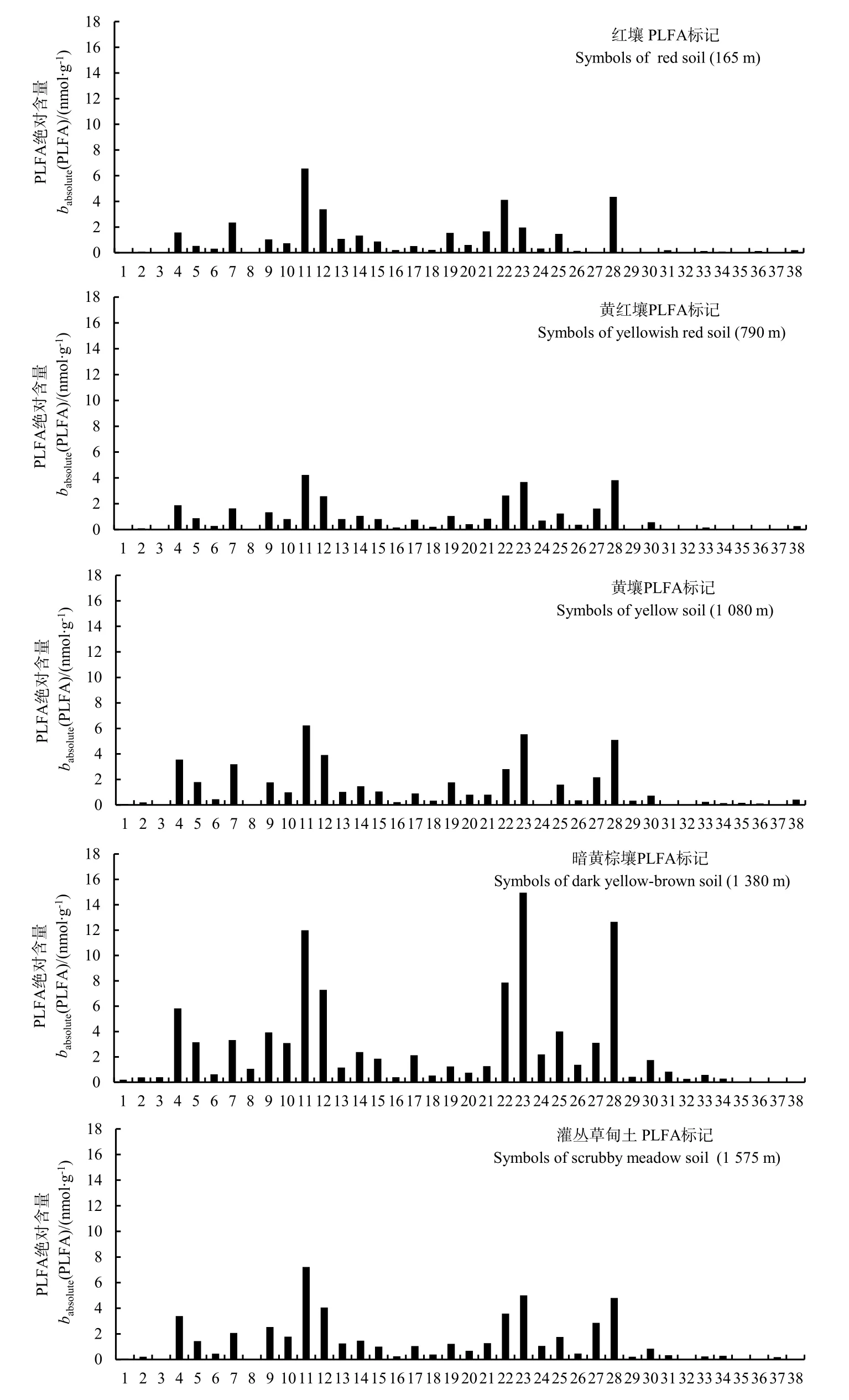
图2 大围山不同海拔带土壤微生物的PLFA图谱Fig.2 PLFA patterns of soil microorganisms along an elevation transect in Daweishan Mout
不同微生物类群的生物量及其比例也具有明显的垂直地带分异规律。真菌和细菌的PLFA比值(F:B)表征真菌和细菌的相对丰度。在热带基纳巴卢山、温带长白山,F:B值随海拔升高而升高,可能与海拔升高温度降低,而真菌具有更强的适应能力有一定关系(Wagai et al.,2011;Xu et al.,2015)。温带罕山的F:B峰值出现在海拔最高的落叶松林,推测真菌在针叶林土壤养分贫乏、酚类等难分解有机质积累环境中具有更强适应性(王淼等,2013)。台湾毛竹林土壤F:B随海拔升高无明显的变化,表明真菌和细菌 PLFA含量随海拔升高的增幅类似(Chang et al.,2015)。本研究中,F:B随海拔升高而降低,可能与海拔升高土壤pH升高、细菌的适应能力增强有一定关系。此外,随着海拔升高、温度降低,真菌的相对比例也呈下降趋势(Zhang et al.,2004)。在青藏高原的高寒土壤中,F:B随海拔升高而降低,可能与海拔升高,土壤有机质和养分有效性升高有关(Xu et al.,2014)。
G+:G-的PLFA比值表征革兰氏阳性菌和革兰氏阴性菌的相对丰度。在温带长白山北坡,G+:G-随海拔升高而升高,可能与海拔升高土壤pH降低有关(Xu et al.,2015)。在热带基纳巴卢山,高海拔带针叶林土壤 G+:G-显著高于低海拔带阔叶林土壤G+:G-,可能与树种有一定的关系(Ushio et al.,2008)。本研究所在亚热带大围山,G+:G-以低海拔带的红壤最高,随海拔升高呈下降趋势。通常,G-在高海拔低温环境更具竞争优势,也对水分变化敏感(Grayston et al.,2005;Margesin et al.,2009)。温带东灵山辽东栎林地,G+:G-随海拔升高而降低,印证了上述观点(张地等,2012)。除了土壤温度和水分,有机质来源和质量也是影响 G+:G-的关键因素。台湾毛竹种植园中,G+:G-随海拔升高而降低,一定程度上与低海拔带土壤中活性有机质的有效性较低有关(Chang et al.,2015)。
山地垂直带上,土壤微生物群落多样性的变化复杂。在北美落基山,土壤细菌中酸杆菌多样性随海拔升高而降低(Bryant et al.,2008),而日本富士山沿海拔梯度,土壤细菌和古菌的多样性分别呈单峰、双峰模式(Singh et al.,2012)。本研究中,土壤微生物群落多样性总体随海拔升高而升高。福建安溪山地茶园、神农架山地垂直带也有类似报道(郑雪芳等,2010;张于光等,2014)。但在东南武夷山,土壤微生物多样性随海拔升高逐渐降低(吴则焰等,2013)。山地垂直带土壤微生物群落多样性的关键驱动因子仍不清楚,植物根际特殊微生物类群的适应性、底物有效性(有机碳、养分)和土壤环境因素的相对贡献研究仍有待加强。
湘东大围山垂直带土壤 PLFA种类较为丰富(38种),高于热带安第斯山(26种)(Krashevska et al.,2008)以及亚热带的神农架(24种)(张于光等,2014)、福建安溪山地茶园(21种)(郑雪芳等,2010)、武夷山(25种)(吴则焰等,2014),但低于亚热带的拉古纳山(89种)(Collins et al.,2003)和缙云山柑橘园(45种)(曾清苹等,2015)。这种PLFA的地域差异可能与所选海拔梯度带幅、植被类型和山体母岩不同有关。
4 结论
湘东大围山为中亚热带典型花岗岩山地垂直带,其土壤垂直带谱具有一定的区域代表性。土壤微生物以细菌为主,其次为放线菌和真菌群落。在细菌群落中,G-细菌的数量大于G+细菌。真菌群落以腐生真菌为主。随着海拔升高,土壤微生物群落的PLFA总量升高,表现为不同类群的微生物PLFA含量也升高。大围山土壤垂直带PLFA种类较为丰富,土壤微生物群落多样性随海拔升高而升高,但真菌、G+菌在土壤微生物中所占比重有所降低。
BLIGH E G, DYER W J. 1959. A rapid method of total lipid extraction and purification [J]. Canadian Journal of Biochemistry and Physiology,37(8): 911-917.
BRYANT J A, LAMANNA C, MORLON H, et al. 2008. Microbes on mountainsides: contrasting elevational patterns of bacterial and plant diversity [J]. Proceedings of the National Academy of Sciences of the United States of America, 105 (S1): 11505-11511.
CHANG E H, CHEN T H, TIAN G, et al. 2015. The effect of altitudinal gradient on soil microbial community activity and structure in moso bamboo Plantations [J]. Applied Soil Ecology, 98: 213-220.
COLLINS H P, CAVIGELLI M A. 2003. Soil microbial community characteristics along an elevation gradient in the Laguna Mountains of Southern California [J]. Soil Biology and Biochemistry, 35(8):1027-1037.
DJUKIC I, ZEHETNER F, MENTLER A, et al. 2010. Microbial community composition and activity in different Alpine vegetation zones [J]. Soil Biology and Biochemistry, 42(2): 155-161.
GRAYSTON S J, PRESCOTT C E. 2005. Microbial communities in forest floors under four tree species in coastal British Columbia [J]. Soil Biology and Biochemistry, 37(6): 1157-1167.
KRASHEVSKA V, BONKOWSKI M, MARAUN M, et al. 2008.Microorganisms as driving factors for the community structure of testate amoebae along an altitudinal transect in tropical mountain rain forests [J]. Soil Biology and Biochemistry, 40(9): 2427-2433.
LANZÉN A, EPELDE L, BLANCO F, et al. 2016. Multi-targeted metagenetic analysis of the influence of climate and environmental parameters on soil microbial communities along an elevational gradient[J]. Scientic reports, 6: 28257.
MARGESIN R, JUD M, TSCHERKO D, et al. 2009. Microbial communities and activities in alpine and subalpine soils [J]. FEMS Microbiology Ecology, 67(2): 208-218.
MORRIEN E, HANNULA S E, SNOEK L B, et al. 2017. Soil networks become more connected and take up more carbon as nature restoration progresses [J]. Nature Communications, doi: 10.1038/ncomms14349.
PEAY K G, SPERBER C, CARDARELLI E, et al. 2017. Convergence and contrast in the community structure of bacteria, fungi and archaea along a tropical elevation-climate gradient [J]. FEMS Microbiology Ecology, doi: org/10.1093/femsec/fix045.
SILES J A, CAJTHAML T, MINERBI S, et al. 2016. Effect of altitude and season on microbial activity, abundance and community structure in Alpine forest soils [J]. FEMS Microbiology Ecolgy, 92(3): fiw008.
SINGH D, TAKAHASHI K, KIM M, et al. 2012. A Hump-Backed trend in bacterial diversity with elevation on Mount Fuji, Japan [J]. Microbial Ecology, 63(2): 429-437.
USHIO M, WAGAI R, BASER T C, et al. 2008. Variations in the soil microbial community composition of a tropical montane,forest ecosystem: does tree species matter? [J]. Soil Biology and Biochemistry, 40(10): 2699-2702.
WAGAI R, KITAYAMA K, SATOMURA T, et al. 2011. Interactive influences of climate and parent material on soil microbial community structure in Bornean tropical forest ecosystems [J]. Ecological Research, 26(3): 627-636.
WANG J J, SOININEN J, ZHANG Y, et al. 2010. Contrasting patterns in elevational diversity between microorganisms and macroorganisms [J].Journal of Biogeography, 38(3): 595-603.
WILLERS C, JANSEN VAN RENSBURG P J, CLAASSENS S. 2015.Phospholipid fatty acid profiling of microbial communities-a review of interpretations and recent applications [J]. Journal of Applied Microbiology, 119(5): 1207-1218.
XU M, LI X L, CAI X B, et al. 2014. Soil microbial community structure and activity along a montane elevational gradient on the Tibetan Plateau [J]. European Journal of Soil Biology, 64: 6-14.
XU Z W, YU G R, ZHANG X Y, et al. 2015. The variations in soil microbial communities, enzyme activities and their relationships with soil organic matter decomposition along the northern slope of Changbai Mountain [J]. Applied Soil Ecology, 86: 19-29.
ZELLES L, BAI Q Y, BECK T, et al. 1992. Signature fatty acids in phospholipids and lipopolysaccharides as indicators of microbial biomass and community structure in agricultural soils [J]. Soil Biology and Biochemistry, 24(4): 317-323.
ZHANG B, LIANG C, HE H, et al. 2013. Variations in soil microbial communities and residues along an altitude gradient on the northern slope of Changbai Mountain, China [J]. Plos One, 8(6): e66184.
ZHANG W J, XU Q, WANG X K, et al. 2004. Impacts of experimental atmospheric warming on soil microbial community structure in a tall grass prairie [J]. Acta Ecologica Sinica, 24(8): 1746-1751.
曾清苹, 何丙辉, 毛巧芝, 等. 2015. 缙云山马尾松林和柑橘林土壤微生物PLFA沿海拔梯度的变化[J]. 环境科学, 36(12): 4667-4675.
褚海燕, 王艳芬, 时玉, 等. 2017. 土壤微生物生物地理学研究现状与发展态势[J]. 中国科学院院刊, 32(6): 585-592.
鲁如坤. 2000. 土壤农业化学分析方法[M]. 北京: 中国农业科技出版社.
马欣, 盛浩, 魏亮, 等. 2016. 湘东大围山不同海拔带土壤溶解性有机碳含量[J]. 生态学杂志, 35(3): 641-646.
王淼, 曲来叶, 马克明, 等. 2013. 罕山不同林型下土壤微生物群落特性[J]. 中国科学: 生命科学, 43(6): 499-508.
吴则焰, 林文雄, 陈志芳, 等. 2013. 中亚热带森林土壤微生物群落多样性随海拔梯度的变化[J]. 植物生态学报, 37(5): 397-406.
吴则焰, 林文雄, 陈志芳, 等. 2014. 武夷山不同海拔植被带土壤微生物PLFA分析[J]. 林业科学, 50(7): 105-112.
颜慧, 蔡祖聪, 钟文辉. 2006. 磷脂脂肪酸分析方法及其在土壤微生物多样性研究中的应用[J]. 土壤学报, 43(5): 851-859.
姚晓东, 王娓, 曾辉. 2016. 磷脂脂肪酸法在土壤微生物群落分析中的应用[J]. 微生物学通报, 43(9): 2086-2095.
于青漪, 王翠红, 甘丽仙, 等. 2014. 浏阳大围山土壤铜锌含量的剖面分布规律[J]. 农业现代化研究, 35(4): 477-480.
张地, 张育新, 曲来叶, 等. 2012. 海拔对辽东栎林地土壤微生物群落的影响[J]. 应用生态学报, 23(8): 2041-2048.
张于光, 宿秀江, 丛静, 等. 2014. 神农架土壤微生物群落的海拔梯度变化[J]. 林业科学, 50(9): 161-166.
郑雪芳, 苏远科, 刘波, 等. 2010. 不同海拔茶树根系土壤微生物群落多样性分析[J]. 中国生态农业学报, 18(4): 866-871.
Characteristics of Soil Microbial Community Along An Elevation Transect in Daweishan Mount of East Hunan Province
MA Haoliu, SONG Jialing, PAN Bo, ZHANG Liang, SHENG Hao*
Institue of Soil Science, Hunan Agricultural University, Changsha 410128, China
Soil microorganism is one of the key components for evaluating ecosystem health. In order to understand the distribution characteristics of soil microbial community along mountain attitude belts, soils derived from granite along an elevation transect(165~1 575 m) in Daweishan Mount of East Hunan Province were selected. Soil (0~20 cm) microbial phospholipid fatty acid (PLFA)contents, composition, and diversity were analyzed. Results showed that soil PLFA species (38 types) were relatively abundant, and the total PLFA ranged from 35.01 to 103.54 nmol·g-1, with the highest for bacteria (25.52~78.31 nmol·g-1), followed by the actinomycete (3.99~12.90 nmol·g-1) and fungi (4.29~12.33 nmol·g-1). The bacteria was dominated by G-community, while the fungi dominated by saprophytic species. The total amount of PLFA, individual PLFA of microbial populations, and diversity index of soil microorganisms increased with increasing altitude, indicating that much higher soil microbial biomass and diversity at high altitude belt. Besides, the highest ratio of F to B (0.17~0.25) and G+to G-(0.52~0.79) was found at low altitude belt occupied by red soil. It decreased with increasing altitude, showing soil microbial community at high altitude was dominated by bacteria and G-community.This study implies that soil microbial community and diversity increase with altitude, and may comprehensively interact with microclimate of mountain, pH, and quantity and quality of soil organic subtracts in Daweishan Mount.
bacteria; fungi; actinomycetes; phospholipid fatty acid method (PLFA); granite; elevation transect
10.16258/j.cnki.1674-5906.2017.12.007
X144; S151.1
A
1674-5906(2017)12-2045-07
马颢榴, 宋佳龄, 潘博, 张亮, 盛浩. 2017. 湘东大围山土壤垂直带谱微生物群落特征[J]. 生态环境学报, 26(12):2045-2051.
MA Haoliu, SONG Jialing, PAN Bo, ZHANG Liang, SHENG Hao. 2017. Characteristics of soil microbial community along an elevation transect in Daweishan Mount of East Hunan Province [J]. Ecology and Environmental Sciences, 26(12): 2045-2051.
国家自然科学基金项目(41571234);湖南省教育厅优秀青年科学研究项目(15B110)
马颢榴(1995年生),女,硕士研究生,研究方向为土壤微生物的生物地理分布。
*通信作者:盛浩,E-mail: shenghao82@163.com; shenghao82@hunau.edu.cn
2017-08-31

