普萘洛尔对体外培养血管瘤内皮细胞的影响及其分子机制
罗勇奇 曾迎红 胡梦叶 汤建萍
410007长沙,湖南省儿童医院皮肤科(罗勇奇、曾迎红、汤建萍);湖南省人民医院心电图室(胡梦叶)
·论著·
普萘洛尔对体外培养血管瘤内皮细胞的影响及其分子机制
罗勇奇 曾迎红 胡梦叶 汤建萍
410007长沙,湖南省儿童医院皮肤科(罗勇奇、曾迎红、汤建萍);湖南省人民医院心电图室(胡梦叶)
目的研究普萘洛尔对体外培养的血管瘤内皮细胞(HemEC)增殖及凋亡的影响,探讨其分子机制。方法收集7例增生期血管瘤患儿的手术切除血管瘤组织用于体外培养HemEC,同时培养人脐静脉内皮细胞(HUVEC)作为对照。采用0、25、50、75、100、125、150 μmol/L普萘洛尔分别处理两种细胞24、48、72 h。MTT法检测各组细胞的存活率,流式细胞仪检测凋亡率。采用含或不含100 μmol/L普萘洛尔的培养基分别培养HemEC(分别为普萘洛尔干预组及空白对照组)18 h,提取两组细胞总RNA,采用表达谱基因芯片技术检测两组HemEC中差异表达的基因,并通过实时定量PCR验证。结果25 μmol/L普萘洛尔作用24、48 h可引起HemEC轻微增殖(P<0.05),而≥100 μmol/L普萘洛尔作用≥24 h可引起HemEC存活率下降,作用≥48 h可引起HUVEC存活率下降。100~150 μmol/L普萘洛尔作用24~72 h,HemEC细胞存活率比HUVEC低(P<0.05)。100~150 μmol/L普萘洛尔作用下,HemEC凋亡率随普萘洛尔作用时间及浓度逐渐升高(均P<0.05)。普萘洛尔干预HemEC后,表达谱基因芯片技术筛选出186个表达差异倍数≥1.5的基因,其中表达明显上调的基因128个,明显下调的58个。实时定量PCR显示,普萘洛尔干预组前蛋白转化酶枯草溶菌素9 mRNA表达水平为空白对照组的(9.88±2.19)倍,脂肪酸结合蛋白3 mRNA为(21.90±8.18)倍,差异均有统计学意义(t=7.028、4.427,P<0.05)。结论高浓度普萘洛尔对HemEC及HUVEC的增殖均有抑制作用,且对HemEC的抑制作用更强。普萘洛尔抑制HemEC的增长可能与抑制HemEC增殖及促进其凋亡有关。
血管瘤;普萘洛尔;细胞增殖;细胞凋亡;基因表达谱;寡核苷酸序列分析
自2008年Léauté⁃Labrèze等[1]发现普萘洛尔能有效治疗血管瘤后,其已成为血管瘤的一线治疗药物,但治疗机制仍不清楚。我们研究普萘洛尔对体外培养的血管瘤内皮细胞(hemangioma endothelial cells,HemEC)增殖及凋亡的影响,同时采用人表达谱芯片筛选普萘洛尔干预体外HemEC前后差异表达基因,寻找普萘洛尔的作用靶点,探讨其治疗血管瘤的分子机制。
材料与方法
一、主要试剂和仪器
微血管内皮细胞(EGM⁃2 MV)培养基(瑞士Lonza公司),DMEM高糖细胞培养基、0.25%胰蛋白酶、胎牛血清、青链霉素(美国Gibco公司);抗血管性血友病因子(von Willebrand factor,vWF)抗体、荧光二抗(美国Abcam公司),MTT试剂(北京索莱宝科技有限公司),盐酸普萘洛尔(分析纯,美国Sigma公司);CD31免疫磁珠、MACS磁珠分选器、细胞凋亡试剂盒(德国美天旎生物技术有限公司),FACsort流式细胞仪(美国BD公司);人脐静脉内皮细胞(human umbilical vein endothelial cells,HUVEC)和人皮肤成纤维细胞由湘雅医院细胞中心惠赠。
二、HemEC的原代培养及鉴定
血管瘤标本来源于湖南省儿童医院外科7例手术切除的增生期血管瘤组织,患儿年龄≤6个月,并已征得患儿家长知情同意。收集的血管瘤组织一部分留作病理检查,一部分用于HemEC原代培养:①消毒血管瘤组织,用含青链霉素的无菌磷酸盐缓冲液(PBS)冲洗,加入分散酶Ⅱ(2.4 U/ml)溶液5 ml,4℃冰箱消化过夜(12~18 h);②第2天去除分散酶Ⅱ溶液,PBS洗2遍,移至10 cm培养皿中,去除瘤体周围表皮及真皮,剪成1 mm3后置入15 ml离心管中,加0.2%Ⅰ型胶原酶10 ml,放至37℃水浴锅,每隔15 min剧烈振荡1次,消化2~3 h,直至呈乳糜状;③用70 μm无菌滤网过滤去除残余血管瘤组织,170×g离心5 min,弃上清液,用5 ml 0.1%牛血清白蛋白(BSA)反复重悬细胞,吹打混匀,离心,用血球计数板计数;④每1×107个细胞加入60 μl 0.1%BSA溶液重悬,加30 μl Fc受体(FcR)抑制剂混匀,加30 μl CD31磁珠,放入4 ℃冰箱,孵育15 min;然后每1×107个细胞加入0.1%BSA溶液1 ml,按试剂说明进行磁珠分选,收集到离心管内的细胞悬液为CD31阳性细胞,即HemEC,然后13 523×g离心5 min,弃上清液;⑤用4 ml含20%胎牛血清的EGM⁃2培养基(EGM⁃2/20%FBS)重悬,计数;先用1 mg/L纤维黏连蛋白溶液包被25 cm2细胞培养瓶,以5×103个/cm2密度将细胞置于培养瓶中,在CO2培养箱内静置培养24 h,48 h后更换培养液,以后每3天更换1次培养液,倒置显微镜下观察并拍照;⑥细胞培养20~25 d达90%融合,按1∶3传代。以原代培养的HemEC为实验组,以DMEM培养基培养的人皮肤成纤维细胞作为阴性对照组,制作细胞爬片,采用vWF抗体和hoechst33342核酸染料和免疫荧光染色鉴定。
三、普萘洛尔干预细胞实验分组及药物配制
取6个无菌离心管,用EGM⁃2/0.5%FBS培养基分别配制25、50、75、100、125、150 μmol/L普萘洛尔溶液,现配现用。实验分为HemEC组和HUVEC组,每组又分为药物干预组和空白对照组。药物干预组又分为25、50、75、100、125、150 μmol/L普萘洛尔6组,空白对照组只加入相同量EGM⁃2/0.5%FBS培养基(不添加生长因子)。
四、MTT法检测细胞增殖活性
消化处于对数生长期的HemEC、HUVEC,分别以每孔1×105个/ml的细胞悬液接种于96孔板,培养24 h后去上清液,各孔分别加入不同浓度普萘洛尔200 μl,空白对照组加不含药物的EGM⁃2/0.5%FBS培养基200 μl,再次培养24 ~ 72 h,每组设3个复孔。加药物2 h后于显微镜下观察细胞状态并拍照。分别在培养24、48、72 h后,加入5 g/L MTT溶液(50 μl/孔)继续培养4 h。用酶标仪测定波长490 nm处吸光度(A)值。细胞存活率={1-[(实验孔A值-调零孔A值)-(对照孔A值-调零孔A值)]/(对照孔A值-调零孔A值)}×100%。
五、流式细胞仪检测细胞凋亡
消化处于对数生长期HemEC和HUVEC,调整细胞密度为1×105个/ml,按2 ml/孔加入6孔板。培养12 h后待细胞贴壁,吸去培养基,各孔分别加入含不同浓度普萘洛尔的EGM⁃2/0.5%FBS培养基2 ml,空白对照组加不含药物的相同培养基2 ml,再次培养24~72 h。分别在24、48、72 h后,吸去培养基,PBS溶液洗1次,加入0.5 ml不含乙二胺四乙酸胰酶消化细胞。当镜下细胞变圆、部分漂浮时,加1 ml完全培养基终止消化,收集细胞悬液至流式管中,170×g离心5 min,弃上清液。加入3 ml PBS重悬洗涤细胞1次,170×g离心5 min,弃上清液。加入200 μl结合缓冲液悬浮细胞。加入膜联蛋白V-异硫氰酸荧光素(AnnexinV⁃FITC)5 μl,避光室温孵育15 min。加5 μl碘化丙锭(PI)染色,流式细胞仪检测细胞凋亡率。
六、表达谱基因芯片技术检测普萘洛尔干预HemEC前后的基因表达差异
选取3例患者生长良好的第2代HemEC,标记为HemEC⁃1、HemEC⁃2、HemEC⁃3,每例患者细胞分为实验组与对照组,共6组细胞。调整细胞密度约为1.0×106/孔,接种于6孔板,培养24 h。当培养板可见细胞铺满80%后,实验组加入含100 μmol/L普萘洛尔的EGM⁃2/0.5%FBS培养基2 ml,不加细胞因子,对照组加入不含药物的相同培养基2 ml,培养18 h。弃去培养基,PBS洗3次,每孔加入1 ml Trizol裂解液,用无菌注射器反复吹打细胞,直至细胞全部溶解。13 523×g离心1 min,吸取上清液转移到无酶离心管中,-80℃冰箱保存、备用。按试剂说明分别提取总RNA并纯化,采用Nano Drop仪器检测RNA浓度及A260/A280比值。将纯化的RNA送上海伯豪生物技术有限公司采用Agilent G3 Human 8*60K芯片进行表达谱基因芯片检测,对结果进行GO分析和Pathway分析,选择差异大且与增殖或凋亡相关的基因,实时定量PCR验证。
七、统计学处理
除原代细胞培养和表达谱基因芯片检测实验外,其他实验均重复3次,结果用±s表示。采用SPSS19.0软件,两个独立样本均数比较采用两样本t检验,对重复测量设计资料数据采用多因素重复测量方差分析,P<0.05为差异有统计学意义。
结 果
一、人HemEC培养
7例的血管瘤组织中有3例成功培养出HemEC。原代内皮细胞培养5 h后开始贴壁,倒置相差显微镜下HemEC呈梭形、多角形,而HUVEC相对偏圆,细胞体积偏大。培养24 h后,HemEC开始分裂增殖,培养基表面浮有一部分未贴壁细胞。原代细胞前期增殖较缓慢,第14天时镜下可见培养瓶底部贴壁生长的细胞密度仍然比较稀疏,之后增殖速度增快,第20天时镜下见HemEC漩涡状增殖,排列较整齐、密集,此时生长达90%融合,见图1。传代后的HemEC增殖活跃。
荧光显微镜下,实验组细胞和阴性对照组成纤维细胞胞核均出现蓝色荧光;实验组细胞胞质内出现vWF的绿色荧光,以核周为主,而阴性对照组人成纤维细胞vWF染色呈阴性,证明此实验组细胞确为HemEC。见图2。
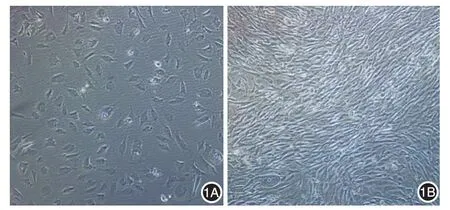
图1 倒置相差显微镜下观察从血管瘤组织分离培养的血管瘤内皮细胞(HemEC)形态(×200) 1A:培养第14天,可见稀疏的梭形或多角形HemEC,约占培养瓶底的30%;1B:培养第20天,可见旋涡状密集排列的梭形细胞,细胞生长超过培养瓶底的90%
二、普萘洛尔干预后细胞形态和细胞增殖活性变化
用0~150 μmol/L普萘洛尔处理HemEC和HUVEC 2 h后,HemEC形态随药物浓度的递增而变化,可见细胞皱缩、变圆,脱壁漂浮,高浓度时甚至细胞轮廓消失;而HUVEC形态在低浓度时变化不明显,普萘洛尔浓度递增到100 μmol/L后,细胞开始出现皱缩、变圆,少许脱壁漂浮。
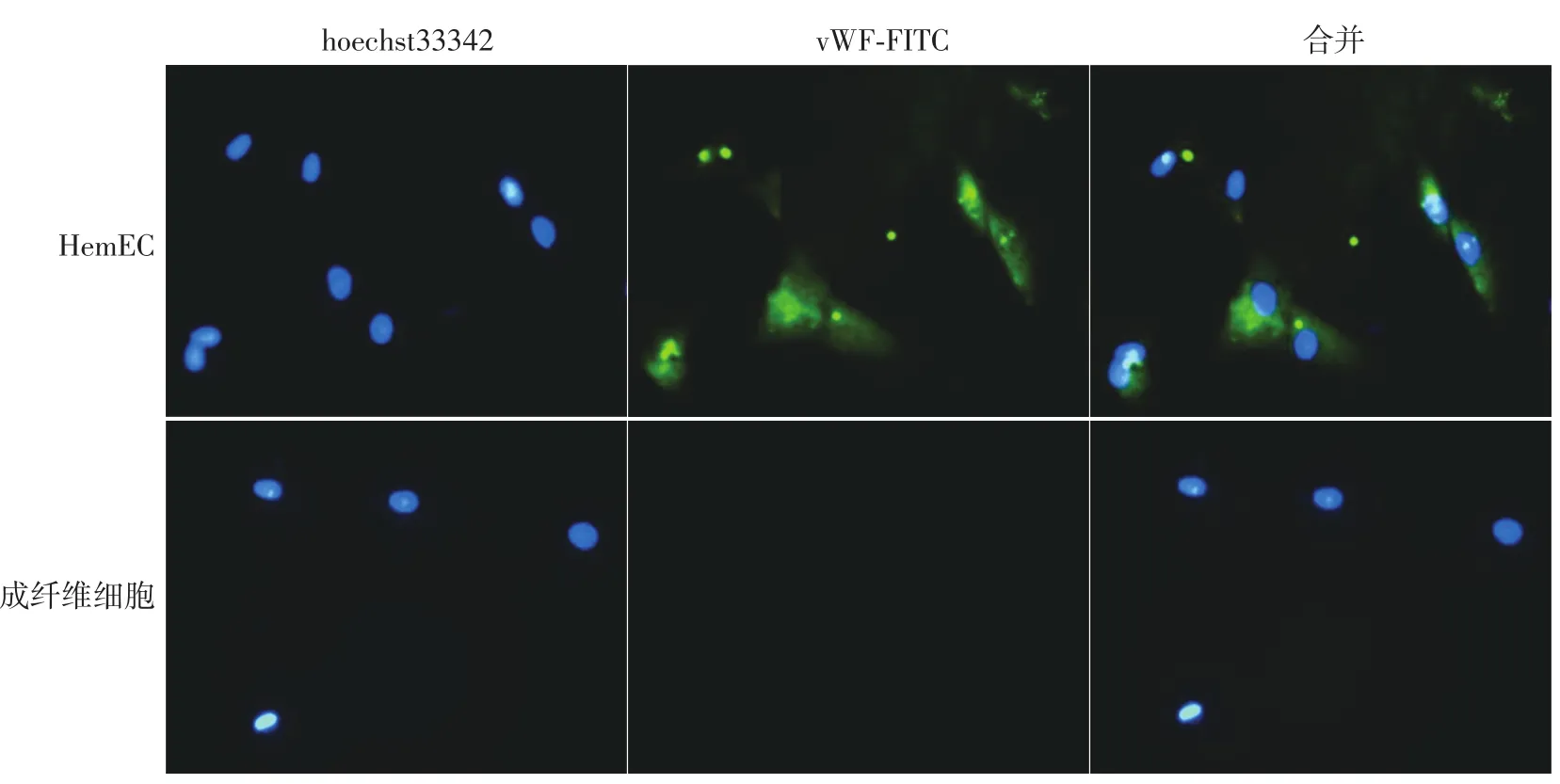
图2 vWF抗体免疫荧光染色法鉴定血管瘤内皮细胞(HemEC)(×400) HemEC胞核hoechst33342染色阳性(蓝色荧光),胞质vWF染色阳性(绿色荧光);人成纤维细胞胞核hoechst33342染色阳性(蓝色荧光),vWF染色阴性(绿色荧光)
对不同浓度普萘洛尔作用后HemEC及HUVEC的存活率数据进行Mauchly球性检验,显示P=0.134,满足协方差矩阵球性检验,不需要对结果进行校正。25 μmol/L普萘洛尔作用24、48 h,可引起HemEC轻度增殖(F=6.06,P< 0.05);≥ 100 μmol/L普萘洛尔作用≥24 h可引起HemEC存活率下降;而普萘洛尔浓度≥100 μmol/L、作用时间≥48 h才可引起HUVEC存活率下降。100~150 μmol/L普萘洛尔作用24~72 h对HemEC的抑制作用大于HUVEC,HemEC细胞存活率更低(100 μmol/L时,F=7.68;125 μmol/L 时,F=17.13;150 μmol/L 时,F=18.23;均P< 0.05),见图3、4。

图3 不同浓度普萘洛尔干预血管瘤内皮细胞(HemEC)后细胞存活率曲线 25 μmol/L普萘洛尔可引起HemEC轻微增殖,中高浓度萘洛尔则会引起HemEC存活率下降
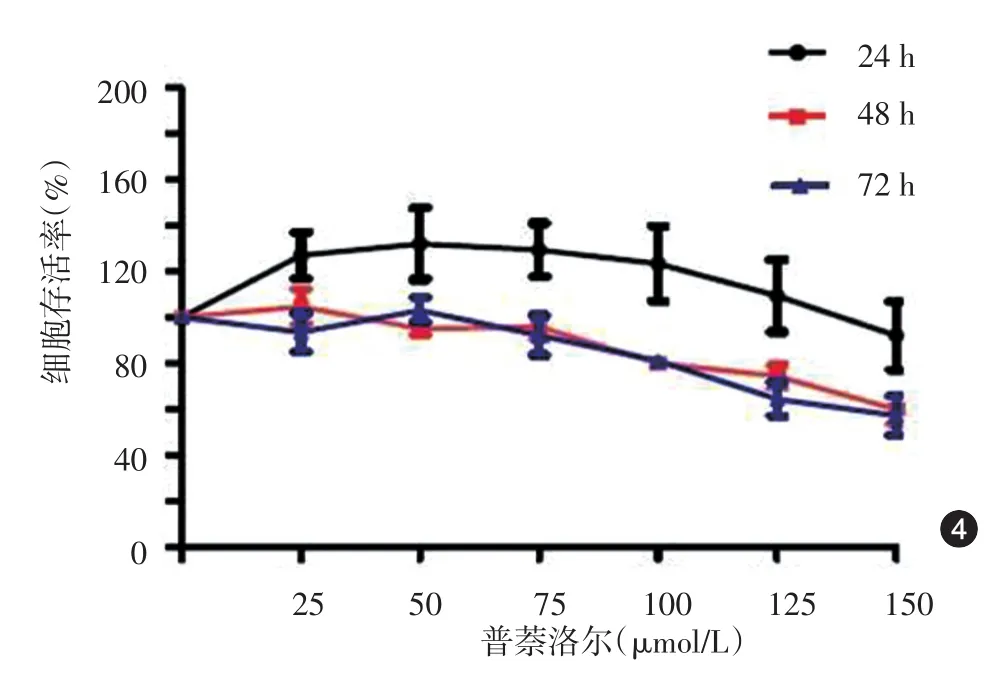
图4 不同浓度普萘洛尔干预人脐静脉内皮细胞后细胞存活率曲线
三、普萘洛尔干预后HemEC凋亡率变化
对不同浓度普萘洛尔干预不同时间后HemEC凋亡率数据进行Mauchly球性检验,显示P=0.059,满足协方差矩阵球性检验。不同普萘洛尔浓度诱导的HemEC凋亡率差异有统计学意义(F=664.96,P<0.05),不同干预时间凋亡率差异亦有统计学意义(F=572.15,P<0.05)。不同浓度普萘洛尔与不同干预时间存在交互作用,即不同浓度普萘洛尔作用下HemEC凋亡率随时间的变化趋势不同(F=85.25,P<0.05)。两两多重比较显示,100~150 μmol/L普萘洛尔作用下,HemEC凋亡率随时间及浓度均逐渐升高(均P<0.05)。见表1。
四、普萘洛尔干预前后HemEC基因表达谱变化
普萘洛尔干预HemEC后进行芯片筛选,差异倍数≥1.5的基因有186条,其中明显上调的有128条,明显下调的58条。差异倍数>2的基因有21条,见表2。对基因芯片结果进行GO分析和Pathway分析,并查阅这些基因的相关功能和研究进展,发现差异倍数>2的基因涉及下列功能:①细胞的增殖、凋亡;②细胞的活化、分化周期;③信号转导;④类固醇生物合成;⑤脂类生物合成;⑥DNA复制、损伤修复。其中,前蛋白转化酶枯草溶菌素9(proprotein convertase subtilisin/kexin 9,PCSK9)、脂肪酸结合蛋白3(fatty acid binding protein 3,FABP3)基因表达显著上调,并分别为对照组的3.22倍与10.14倍,PCSK9、FABP3均与凋亡相关。以GAPDH为内参,实时定量PCR结果显示,普萘洛尔干预后HemEC的PCSK9、FABP3 mRNA表达显著高于对照组,差异倍数分别为9.88±2.19和21.90±8.18,差异均有统计学意义(t值分别为7.028、4.427,P< 0.05),与芯片检测结果相符。
表1 不同浓度普萘洛尔干预不同时间后血管瘤内皮细胞(HemEC)凋亡率 %,±s

表1 不同浓度普萘洛尔干预不同时间后血管瘤内皮细胞(HemEC)凋亡率 %,±s
注:n=5
普萘洛尔0 μmol/L 25 μmol/L 50 μmol/L 75 μmol/L 100 μmol/L 125 μmol/L 150 μmol/L 24 h 2.63±0.08 4.68±0.16 9.40±0.29 13.27±1.03 18.93±1.60 22.12±1.88 31.98±2.57 48 h 3.19±0.19 6.75±0.27 10.82±0.28 17.97±3.28 46.77±7.66 54.30±2.21 61.68±2.22 72 h 5.64±0.13 9.34±0.41 11.61±0.49 18.21±1.23 56.87±4.14 63.95±1.50 70.89±3.57
讨 论
临床研究表明,普萘洛尔治疗婴儿血管瘤疗效显著[2⁃5],但其作用机制仍不明确。Chim等[6]体外培养HemEC,用普萘洛尔干预后其细胞活力、迁移能力下降,且浓度越高作用越强。Annabi等[7]在体外培养人大脑微血管内皮细胞,普萘洛尔干预后血管生成明显减少,可能与抑制基质金属蛋白酶9(MMP⁃9)分泌及内皮细胞生成有关。HemEC过度增殖是血管瘤最特征性的病理改变,是血管瘤发病的中心环节。目前认为普萘洛尔治疗婴儿血管瘤可能与抑制HemEC增生,促进其凋亡有关。
本研究显示,普萘洛尔干预后HemEC和HUVEC细胞形态均出现变化,可见细胞皱缩、变圆,脱壁漂浮。在普萘洛尔低浓度时,HemEC即出现明显的形态变化,而HUVEC形态变化不明显;当普萘洛尔浓度达到100 μmol/L后,HUVEC开始出现明显形态改变,说明HemEC对普萘洛尔的作用比HUVEC敏感。细胞增殖实验显示,≥100 μmol/L普萘洛尔作用≥24 h可引起HemEC存活率下降,这与既往研究相似[8]。Chim等[6]推测普萘洛尔通过抑制缺氧诱导因子1α(HIF⁃1α)途径降低血管内皮生长因子(VEGF)活性,导致PI3/Akt和p38/MAPK下调,抑制HemEC的增生。Ji等[9]发现,β受体激动剂异丙肾上腺素可通过增加HemEC中血管内皮生长因子(VEGF)的表达和VEGF受体2的活性,促进HemEC增生,从反面印证β受体阻滞剂普萘洛尔有抑制HemEC增生的作用。魏珩等[10]发现,普萘洛尔抑制内皮细胞的增殖可能与抑制MMP⁃2、MMP⁃9的表达有关。

表2 普萘洛尔干预血管瘤内皮细胞(HemEC)前后部分差异表达基因(差异倍数≥2)
本研究结果显示,当100~150 μmol/L普萘洛尔作用48 h以上时,HUVEC存活率也出现下降,表明普萘洛尔也可抑制HUVEC增生,只是需要更高的浓度和作用时间,这为临床上采用普萘洛尔治疗静脉畸形提供了理论基础。此外,25 μmol/L普萘洛尔作用24、48 h只能引起HemEC轻微增殖,提示临床上采用普萘洛尔治疗血管瘤的剂量不能太小。
目前,对普萘洛尔作用机制的研究还局限于对血管形成相关因子及细胞凋亡的影响,未能从整体上找出作用的靶点、途径及分子机制。人表达谱基因芯片能一次性大规模、全自动检测数万基因,已广泛应用于基因检测、基因功能等的研究。张莉等[11]采用基因表达谱芯片技术检测血管瘤增生期与消退期之间差异表达的基因,结果显示,在血管瘤增生期一些原癌基因和生长因子表达上调,而消退期促凋亡基因和信号通路上调,表明血管瘤的消退与凋亡相关。本研究显示,普萘洛尔干预前后HemEC有明显表达差异的基因有186个,PCSK9、FABP3、BBC3、E2F2、TSC22D3、AATK、PLEKHF1、PRUNE2、TRIB3等基因涉及细胞增殖、凋亡及调控,DDIT3、ERCC5等基因涉及DNA复制、损伤修复,SQSTM1、YWHAE、ErbB3等涉及信号转导,DHCR24、DHCR7、HSD17B7、LSS等涉及类固醇生物合成,ELOVL6、FADS1等基因涉及脂类生物合成。提示普萘洛尔抑制HemEC增殖、促进其凋亡是细胞代谢、生长调控、信号传导、细胞周期、类固醇生物合成、脂类生物合成等多个基因靶位综合作用的结果,但其中每个基因发挥的具体作用及作用途径仍不清楚,需要进一步研究。人表达谱芯片检测结果为进一步研究普萘洛尔治疗血管瘤的分子机制提供了重要依据。我们将进一步探讨普萘洛尔治疗血管瘤的作用靶点,揭示其作用的分子机制,为普萘洛尔治疗血管瘤提供更有力的理论依据。
[1]Léauté⁃Labrèze C,de la Roque ED,Hubiche T,et al.Propranolol for severe hemangiomas of infancy[J].N Engl J Med,2008,358(24):2649⁃2651.DOI:10.1056/NEJMc0708819.
[2]Léauté⁃Labrèze C,Hoeger P,Mazereeuw ⁃Hautier J,et al.A randomized,controlled trial of oral propranolol in infantile hemangioma[J].N Engl J Med,2015,372(8):735⁃746.DOI:10.1056/NEJMoa1404710.
[3]Hogeling M,Adams S,Wargon O.A randomized controlled trial of propranolol for infantile hemangiomas[J].Pediatrics,2011,128(2):e259⁃266.DOI:10.1542/peds.2010⁃0029.
[4]Léauté⁃Labrèze C,Harper JI,Hoeger PH.Infantile haemangioma[J].Lancet,2017,390(10089):85⁃94.DOI:10.1016/S0140⁃6736(16)00645⁃0.
[5]Léaute⁃Labrèze C,Boccara O,Degrugillier⁃Chopinet C,et al.Safety of oral propranolol for the treatment of infantile heman⁃gioma:a systematic review[J].Pediatrics,2016,138(4).pii:e20160353.DOI:10.1542/peds.2016⁃0353.
[6]Chim H,Armijo BS,Miller E,et al.Propranolol induces regression of hemangioma cells through HIF⁃1α⁃mediated inhibition of VEGF⁃A[J].Ann Surg,2012,256(1):146 ⁃156.DOI:10.1097/SLA.0b013e318254ce7a.
[7]Annabi B,Lachambre MP,Plouffe K,et al.Propranolol adrenergic blockade inhibits human brain endothelial cells tubulogenesis and matrix metalloproteinase ⁃9 secretion[J].Pharmacol Res,2009,60(5):438⁃445.DOI:10.1016/j.phrs.2009.05.005.
[8]吉毅,肖现民,李凯,等.普萘洛尔对婴幼儿血管瘤内皮细胞增殖与凋亡的作用[J].中华小儿外科杂志,2013,34(1):1⁃6.DOI:10.3760/cma.j.issn.0253⁃3006.2013.01.001.
[9]Ji Y,Chen S,Li K,et al.The role of β ⁃adrenergic receptor signaling in the proliferation of hemangioma⁃derived endothelial cells[J].Cell Div,2013,8(1):1.DOI:10.1186/1747⁃1028⁃8⁃1.
[10]魏珩,俞松,姜富贵,等.普萘洛尔对体外培养血管瘤内皮细胞血管内皮生长因子和基质金属蛋白酶⁃2表达的影响[J].中华小儿外科杂志,2012,33(3):193⁃196.DOI:10.3760/cma.j.issn.0253⁃3006.2012.03.009.
[11]张莉,王炜,祁佐良,等.用基因芯片研究同一血管瘤增生和消退期差异表达基因[J].中华整形外科杂志,2003,19(6):452⁃455.DOI:10.3760/j.issn:1009⁃4598.2003.06.017.
Effects of propranolol onin vitrocultured hemangioma endothelial cells and their mechanisms
Luo Yongqi,Zeng Yinghong,Hu Mengye,Tang Jianping
Department of Dermatology,Hunan Children′s Hospital,Changsha 410007,China(Luo YQ,Zeng YH,Tang JP);Department of Electrocardiography,Hunan Provincial People′s Hospital,Changsha 410002,China(Hu MY)
Tang Jianping,Email:jpingtang@126.com
ObjectiveTo evaluate effects of propranolol on the proliferation and apoptosis ofin vitrocultured hemangioma endothelial cells(HemEC),and to explore their molecular mechanisms.MethodsHemangioma tissues were resected from 7 children with proliferative hemangioma,and used forin vitroculture of HemEC.Meanwhile,cultured human umbilical vein endothelial cells(HUVEC)served as controls.The 2 kinds of cells were treated with propranolol at different concentrations of 0,25,50,75,100,125 and 150 μmol/L for 24,48 and 72 hours separately.Methyl thiazolyl tetrazolium(MTT)assay was performed to evaluate cellular proliferative activity,and flow cytometry to determine the apoptosis rate.Some cultured HemEC were divided into 2 groups to be treated with 100 μmol/L propranolol⁃containing culture medium(propranolol group)and culture medium alone(blank control group),respectively,for 18 hours.Total RNA in the 2 groups was extracted separately.Differentially expressed genes in HemEC between the above 2 groups were identified by DNA microarray technology,and verified by real⁃time quantitative PCR.ResultsThe treatment with 25 μmol/L propranolol for 24 and 48 hours caused a slight proliferation of HemEC(P< 0.05).The survival rate of HemEC was decreased after the treatment with propranolol at the concentration of≥ 100 μmol/L for more than 24 hours,while the proliferation of HUVEC was inhibited by the treatment with propranolol at the concentration of ≥ 100 μmol/L for more than 48 hours.During 24-72 hours of treatment with 100-150 μmol/L propranolol,the survival rates of HemEC were significantly lower than those of HUVEC(P< 0.05).After the treatment with 100-150 μmol/L propranolol,the apoptosis rate of HemEC gradually increased with the increase in treatment duration and concentrations of propranolol(allP< 0.05).Compared with the blank control group,186 differentially expressed genes(> 1.5⁃fold changes)were screened out by DNA microarray technology,including 128 up⁃regulated genes and 58 down⁃regulated genes.Real⁃time quantitative PCR showed that the mRNA expression of proprotein convertase subtilisin/kexin type 9(PCSK9)and fatty acid binding protein 3(FABP3)in the propranolol group were(9.88 ± 2.19)and(21.90 ± 8.18)times that in the blank control group respectively(t=7.028,4.427 respectively,P< 0.05).ConclusionsPropranolol at high concentrations can inhibit the proliferation of HemEC and HUVEC,and its inhibitory effect on HemEC is stronger than that on HUVEC.The inhibitory effect of propranolol on HemEC may be related to the inhibition of HemEC proliferation and promotion of HemEC apoptosis.
Hemangioma;Propranolol;Cell proliferation;Apoptosis;Gene expression profiling;Oligonucleotide array sequence analysis
Fund programs:Science and Technology Planning Program for Applied Basic Research of Hunan Province of China(2010FJ6001);Natural Science Foundation of Hunan Province of China(11JJ5054)
汤建萍,Email:jpingtang@126.com
10.3760/cma.j.issn.0412⁃4030.2017.11.006
湖南省应用基础研究科技专项计划项目(2010FJ6001);湖南省自然科学基金(11JJ5054)
2017⁃05⁃03)
周良佳 颜艳)

