日粮中添加谷胱甘肽对虹鳟生长性能和抗氧化性能的影响
王艺, 孙国祥, 刘鹰, 杨修亮, 张旭, 王顺奎
日粮中添加谷胱甘肽对虹鳟生长性能和抗氧化性能的影响
王艺1, 孙国祥2、3, 刘鹰1, 杨修亮3, 张旭3, 王顺奎4
(1.大连海洋大学水产设施养殖与装备工程技术研究中心,辽宁 大连116023;2.中国科学院海洋研究所,山东 青岛266000;3.山东金城生物药业有限公司,山东淄博255000;4.山东东方海洋科技股份有限公司,山东烟台264003)
为研究日粮中添加谷胱甘肽对虹鳟Oncorhynchus mykiss生长性能和抗氧化性能的影响,选择初始体质量为 (718.3±36.3)g的虹鳟,分别投喂添加5种不同水平的谷胱甘肽饲料 (谷胱甘肽含量分别为0、100、200、400、600 mg/kg),8周后观测各组虹鳟的生长情况及机体抗氧化状态。结果表明:虹鳟的增重率 (WGR)、特定生长率 (SGR)、日均摄食量 (AFI)随着饲料中谷胱甘肽添加量的增加均呈现先升高后降低的趋势,且在添加量为200 mg/kg时达到最大值,并显著高于其他各组 (P<0.05),而200 mg/kg组虹鳟的饲料系数 (FCR)则显著低于对照组 (P<0.05),且死亡率最低 (4.04%);谷胱甘肽添加组虹鳟血清、肝脏中超氧化物歧化酶 (SOD)活性均升高,其中200 mg/kg组血清和肝脏中SOD显著升高 (P<0.05);谷胱甘肽添加组虹鳟血清、肝脏和鳃丝中过氧化氢酶 (CAT)活性均高于对照组,且随着谷胱甘肽添加量的增加呈现先升高后降低的趋势,其中200 mg/kg组血清和肝脏中CAT活性显著高于对照组 (P<0.05);谷胱甘肽添加组虹鳟血清、肝脏和鳃丝中谷胱甘肽过氧化物酶 (GSH)和谷胱甘肽还原酶 (GR)活性均高于对照组,且随着谷胱甘肽添加量的增加呈现先升高后降低的趋势,其中200 mg/kg组血清、肝脏和鳃丝中GSH和GR活性均显著高于对照组 (P<0.05);谷胱甘肽添加组虹鳟血清、肝脏和鳃丝中丙二醛 (MDA)含量均低于对照组,但均无显著性差异 (P>0.05),其中200 mg/kg组最低。研究表明,在循环水养殖模式下,饲料中添加适量谷胱甘肽能够提高虹鳟的生长性能,降低饲料系数和死亡率,有助于缓解虹鳟养殖过程中的氧化应激,提高抗氧化能力。
虹鳟;谷胱甘肽;生长;抗氧化性能
虹鳟Oncorhynchus mykiss隶属于硬骨鱼纲、鲑形目 Salmoniformes、鲑亚目 Salmonidei、鲑科 Salmonidae,属冷水性鱼类。虹鳟具有肉味鲜美、营养丰富、人工繁殖简便等特点,目前已成为联合国粮农组织面向世界推广的优良水产养殖品种之一。随着现代水产养殖业的迅速发展,虹鳟养殖模式逐步由粗放型转为集约化。这种养殖模式在提高水产品产量的同时,也存在负面效应。由于养殖密度的增加,虹鳟等水产动物极易受到环境条件、饲料、投喂管理等方面的影响,进而导致应激的产生,如密度胁迫应激、水质胁迫应激、温度应激和运输应激等,严重影响了水产动物的生长[1]。其中,氧化应激是所有应激中最为重要的一种应激方式,任何应激均会形成氧化应激,并对鱼体造成一定程度的氧化损伤,从而降低鱼体的生长速度[2]。目前,国内关于利用免疫增强剂来提高鱼体抗病机制等方面的研究还不够深入。一般认为,通过营养调控来促进鱼体生长,提高鱼体抗氧化能力,是一种可行的方法[3-4]。
谷胱甘肽是由γ-谷氨酸、半胱氨酸、甘氨酸组成的天然生物活性肽,是生物机体内重要的生物活性物质。谷胱甘肽分为还原型和氧化型两种,通常所指的谷胱甘肽为还原型谷胱甘肽[5]。谷胱甘肽不仅能及时清除细胞内过量的氧自由基[6],还具有提高酶活性[7]、保护肝脏细胞[8]、缓解神经元兴奋中毒[9]等许多生理功能。研究证明,谷胱甘肽可以影响牙鲆Paralichthys olivaceus[10]、草鱼Ctenopharyngodon idellus[11]、凡纳滨对虾Litopenaeus vannamei[12-14]和罗非鱼[15]的生长及抗氧化能力。近年来,谷胱甘肽在水产领域的应用逐渐增多,已成为研究热点。研究表明,谷胱甘肽可提高欧洲鲈Dicentrarchus labrax的生长性能,这是由于谷胱甘肽在一定程度上提高了鲈的蛋白酶活性和生长速度[16];饲料中添加谷胱甘肽不仅能促进吉富罗非鱼Oreochromis niloticus的生长,还能提高其肝脏抗氧化酶基因的表达量[17];饲料中添加低剂量的谷胱甘肽可提高凡纳滨对虾生长性能,而添加高剂量的谷胱甘肽,对虾的增重率反而有所下降[17]。
本研究中,拟选用谷胱甘肽作为抗氧化剂,以虹鳟Oncorhynchus mykiss为研究对象,通过在饲料中添加不同比例的谷胱甘肽,研究其对虹鳟生长和抗氧化性能的影响,旨在为深入阐述谷胱甘肽对鱼类抗氧化功能的影响机制提供有益参考,也为虹鳟集约化养殖的氧化应激预防提供数据资料。
1 材料与方法
1.1 材料
试验用虹鳟购自山东东方海洋科技股份有限公司。随机挑选健康活泼、规格一致、体质量为(718.3±36.3)g的虹鳟525尾。试验期间,循环水系统水温保持在 (15.0±1.0)℃,pH为 7.2~7.5,光照条件为12L∶12D,试验过程中使用液氧增氧,溶解氧控制在 (8.5±1.0)mg/L。
1.2 方法
1.2.1 试验饲料的配制 试验用基础饲料组成和营养水平见表1,粗蛋白质和粗脂肪含量分别为43.09%和19.51%。本试验中所用谷胱甘肽由山东金城生物药业有限公司提供,分别在基础饲料中添加100、200、400、600 mg/kg谷胱甘肽制作成试验饲料备用。
1.2.2 试验设计 正式试验前,在循环水养殖系统中将试验鱼暂养14 d,每个水槽为1个养殖单位,容积为300 L,水流速度为1 L/min,投喂基础饲料。正式试验前,所有试验鱼停饲24 h并麻醉 (MS-222,40 mg/L)后称重。将525尾虹鳟平均分配到15个试验用循环水养殖系统中,试验分为5组,每组设3个重复,每个重复放35尾鱼,分别于每天8:00、16:00饱食投喂。对照组饲喂基础饲料,4个处理组分别投喂谷胱甘肽含量为100、200、400、600 mg/kg的试验饲料,连续投喂56 d。

表1 基础饲料组成及营养成分 (风干基础)Tab.1 Ingredients and approximate compositions of the basal diet(air-dry basis)
1.2.3 样品的采集与测定 养殖试验结束后禁食24 h,从每个重复随机选取3尾虹鳟,用5 mL润洗过的无菌注射器尾静脉取血,合并置于无菌Eppendorf管中,于冰箱 (4℃)中过夜后,以4000 r/min离心15 min,取上清液并分装,与取得的肝脏和鳃丝样品一起置于冰箱(-80℃)中保存备用。
以超氧化物歧化酶 (SOD)、过氧化氢酶(CAT)、谷胱甘肽还原酶 (GR)、谷胱甘肽过氧化物酶 (GSH)活性和丙二醛 (MAD)含量作为虹鳟血清、肝脏和鳃丝的抗氧化指标,参照南京建成生物工程研究所的试剂盒说明书测定。分别取肝脏和鳃丝称重后,按质量(mg)∶体积(mL)=1∶9的比例匀浆介质生理盐水,在玻璃匀浆器皿中低温匀浆,按照试剂盒上指标测定的要求调整离心转速和时间,在4℃下离心后取上清液测定。
生长性能指标的计算公式为
增重率(WGR)=(终末体质量-初始体质量)/初始体质量×100%,
特定生长率(SGR)=(ln终末体质量-ln初始体质量)/养殖时间×100%,
饵料系数(FCR)=摄食量/(终末体质量-初始体质量),
日均摄食量(AFI)=日总摄食量/(处理鱼尾数×试验时间),
死亡率(DR)=死亡鱼数/初始鱼数×100%。
1.3 数据处理
试验数据采用SPSS 19.0软件中的单因素方差分析 (One-way,ANOVA)进行处理,用 Tukey检验法进行组间多重比较。数据以平均值±标准差(mean±S.D.)表示,n=3,显著性水平设为0.05。
2 结果与分析
2.1 虹鳟的生长性能
从表2可见:随着谷胱甘肽添加量的增加,虹鳟的增重率、特定生长率、日均摄食量均呈先升高后降低的趋势。其中,谷胱甘肽添加量为200 mg/kg时,测量的5个指标均与对照组有显著性差异 (P<0.05),且虹鳟死亡率最低 (4.04%)。

表2 饲料中谷胱甘肽不同添加水平对虹鳟生长及饲料利用的影响Tab.2 Effects of dietary glutathione on the growth and feed conversion of rainbow trout Oncorhynchus mykiss
2.2 饲料中不同谷胱甘肽添加量下虹鳟血清抗氧化性能的变化
从表3可见:随着谷胱甘肽添加量的增加,虹鳟血清中SOD、GSH、CAT、GR活性的变化趋势一致,均呈先升高后降低的趋势,对照组酶活性最低,200 mg/kg谷胱甘肽添加组酶活性最高;其中仅200 mg/kg谷胱甘肽添加组SOD活性以及200~600 mg/kg谷胱甘肽添加组CAT活性显著高于对照组 (P<0.05),而不同添加量的谷胱甘肽对GSH、GR活性无显著性影响 (P>0.05);不同添加量的谷胱甘肽对MDA含量也无显著性影响 (P>0.05),其中对照组MDA含量最高,200 mg/kg谷胱甘肽添加组MDA含量最低。
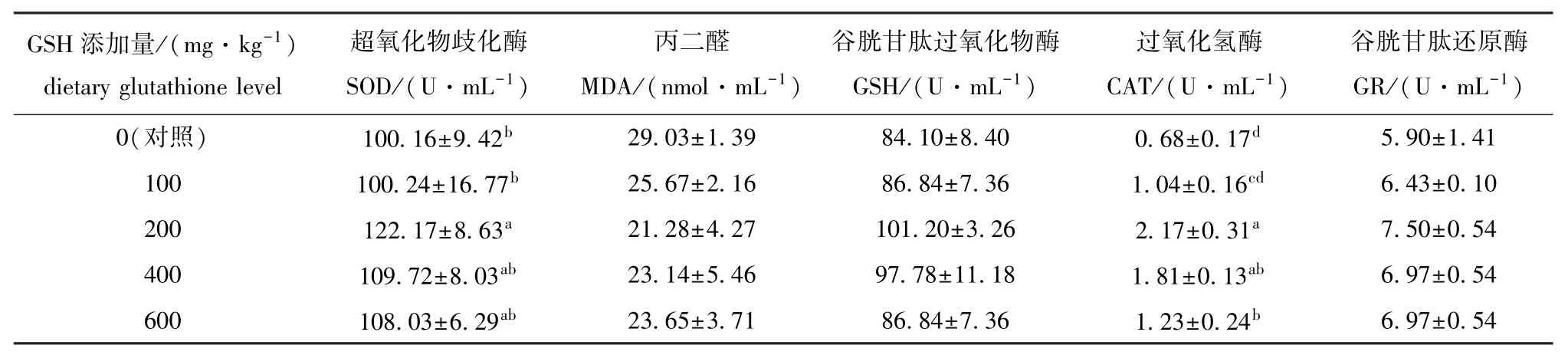
表3 饲料中谷胱甘肽不同添加水平对虹鳟血清抗氧化酶活性和丙二醛含量的影响Tab.3 Effects of dietary glutathione on the activities of serum antioxidant enzymes and malondiadehyde contents of rainbow trout Oncorhynchus mykiss
2.3 饲料中不同谷胱甘肽添加量下虹鳟肝脏抗氧化性能的变化
从表4可见:随着谷胱甘肽添加量的增加,虹鳟肝脏SOD、GSH、CAT、GR活性的变化趋势一致,均呈先升高后降低的趋势,对照组酶活性最低,200 mg/kg谷胱甘肽添加组酶活性最高;其中仅200 mg/kg谷胱甘肽添加组 SOD、CAT、GR活性以及400 mg/kg谷胱甘肽添加组SOD活性显著高于对照组 (P<0.05),而不同添加量的谷胱甘肽对GSH活性无显著性影响 (P>0.05);不同添加量的谷胱甘肽对MDA含量也无显著性影响 (P>0.05),其中对照组MDA含量最高,200 mg/kg谷胱甘肽添加组MDA含量最低。
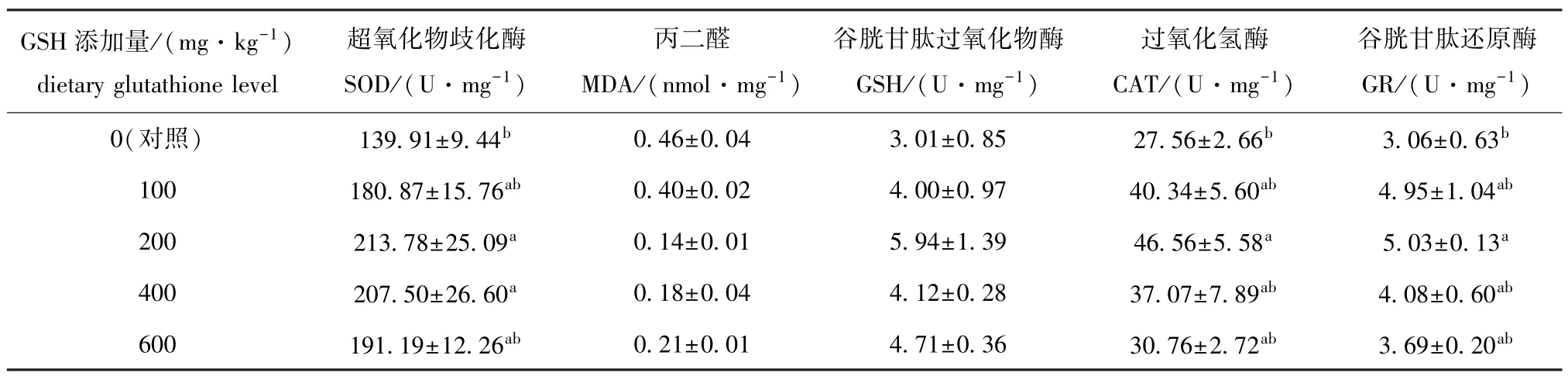
表4 饲料中不同谷胱甘肽添加水平对虹鳟肝脏抗氧化酶活性和丙二醛含量的影响Tab.4 Effect of dietary glutathione level on the activities of hepatic antioxidant enzymes and malondiadehyde contents of rainbow trout Oncorhynchus mykiss
2.4 饲料中不同谷胱甘肽添加量下虹鳟鳃丝抗氧化性能的变化
从表5可见:随着谷胱甘肽添加量的增加,虹鳟鳃丝SOD活性呈先降低后升高再降低的趋势,100 mg/kg谷胱甘肽添加组的SOD活性最低,200 mg/kg谷胱甘肽添加组的SOD活性最高;而GSH、CAT、GR活性的变化趋势一致,均呈先升高后降低的趋势,对照组 GSH、CAT活性最低,200 mg/kg谷胱甘肽添加组GSH、CAT活性最高;其中仅200 mg/kg谷胱甘肽添加组 GSH、GR活性显著高于对照组 (P<0.05),而不同添加量的谷胱甘肽对SOD、CAT活性无显著性影响 (P>0.05);不同添加量的谷胱甘肽对MDA含量也无显著性影响(P>0.05),其中对照组 MDA含量最高,200 mg/kg谷胱甘肽添加组MDA含量最低。
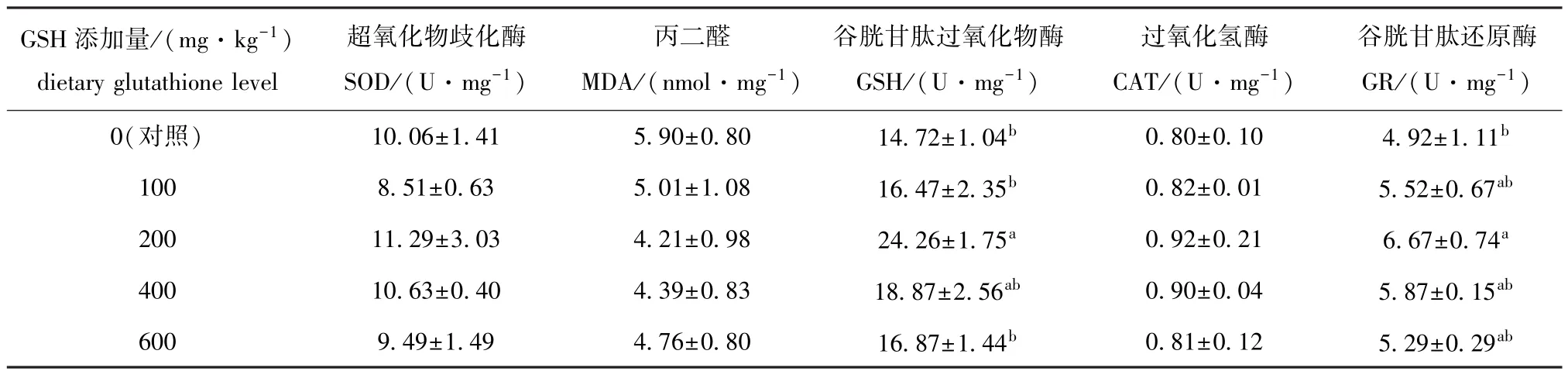
表5 饲料中不同谷胱甘肽添加水平对虹鳟鳃丝抗氧化酶活性和丙二醛含量的影响Tab.5 Effect of dietary reduced glutathione on the activities of gill filament antioxidant enzymes and malondiadehyde contents of rainbow trout Oncorhynchus mykiss
3 讨论
3.1 谷胱甘肽对虹鳟生长性能的影响
本研究中添加适量的谷胱甘肽能显著提高虹鳟的增重率、特定生长率和日均摄食量,同时能降低饲料系数和死亡率,表明谷胱甘肽可提高虹鳟的生长性能。这一结果与刘晓华等[13]对凡纳滨对虾以及周婷婷等[17]对吉富罗非鱼中的研究结果类似。目前,关于谷胱甘肽促进水产动物生长的内在机制研究较为缺乏。有研究指出,谷胱甘肽能够促进水产鱼类细胞RNA的表达,进而有助于蛋白质的合成,从而促进水产动物的生长[18]。也有报道指出,谷胱甘肽可提高血清中与生长有关的胰岛素样生长因子-Ⅰ (IGF-Ⅰ)水平,而IGF-Ⅰ是介导生长激素促生长效应的主要因子,其可以促进细胞有丝分裂以及细胞和组织的生长代谢,因而外援性增加谷胱甘肽可以促进罗非鱼的生长[19]。王芳倩等[10]研究认为,谷胱甘肽组成中含有半胱氨酸,其脱羧产物半胱胺可以破坏生长抑制素分子的二硫键,使其丧失生物学功能,促进生长激素的分泌,从而促进了鱼体的生长。这一结论在对草鱼的研究中亦得到证实[11],且与对凡纳滨对虾[13]和吉富罗非鱼[20]的研究结果一致。由此推测,谷胱甘肽可能是通过影响与生长有关的激素水平来促进虹鳟的生长,其具体作用机制有待于进一步探索。
本试验结果同样表明,日粮中添加谷胱甘肽能在一定程度上降低虹鳟的死亡率,这可能与鱼体的抗氧化能力有关。氧自由基会引发脂质过氧化反应,生成脂质过氧化物,脂质过氧化物会导致细胞代谢功能障碍,严重则导致死亡[21-22]。本试验中谷胱甘肽能够对虹鳟的抗氧化能力产生积极影响,分析其原因,说明谷胱甘肽对虹鳟鱼体具有生长和抗氧化等方面的积极调节作用,因而可以降低死亡率。
3.2 谷胱甘肽对虹鳟抗氧化性能的影响
氧自由基的产生与水产动物的健康状况具有十分密切的联系[23]。SOD、CAT、GR等有清除氧自由基的作用[24],是机体内与谷胱甘肽相关的抗氧化酶,因此,这几种酶的活性通常用来反映机体自由基的动态变化[22,25-26]。 SOD 可以催化超氧阴离子发生歧化反应,生成过氧化氢和氧气,从而降低组织中超氧阴离子含量,是一种重要的抗氧化酶,其活性能够反映氧自由基的代谢情况[27-29]。动物体内过氧化氢浓度较高时,需要CAT来消除其毒性[30],将过氧化氢分解为水和氧气,从而使细胞免受过氧化氢的毒害[31-32]。GR能够催化氧化型谷胱甘肽 (GSSG)还原为GSH,而GSH可以使含有巯基的酶保持活性,从而维持细胞膜的完整性[33]。氧自由基能够导致脂质过氧化,MDA是自由基脂质过氧化损伤的最终分解产物之一,能够引起蛋白质等生物大分子的交联聚合,且具有细胞毒性,其含量的多少能够直接反映脂质过氧化的程度,也能够反映自由基对机体的损伤程度[34-35]。
本试验结果显示,谷胱甘肽添加组虹鳟血清SOD、CAT、GSH和GR活性较对照组升高,且随添加量的增加呈现先升高后降低的趋势。在周婷婷等[17]的研究中,血清与肝脏SOD的活性同样随添加量的增加呈现先升高后降低的趋势。推测可能是因为外源性的谷胱甘肽降低了氧自由基对机体的损伤,减轻了虹鳟的抗氧化应激[36]。而在王芳倩[10]对牙鲆的研究中,SOD的活性未受到饲料中谷胱甘肽添加量的影响,推测谷胱甘肽对SOD活性的影响与饲养对象的不同也有关,具体作用机制有待进一步研究。周婷婷等[17]对吉富罗非鱼的试验显示,随着谷胱甘肽添加量的增加,罗非鱼血清和肝脏中CAT的活性均呈先升高后降低的趋势,作者推测,CAT可以清除机体内的过氧化氢,使细胞免受其毒害,CAT活性发生变化是因为体内的抗氧化物酶系统被激活了。本研究中,虹鳟血清CAT总体活性高于对照组,推测是由于添加适量的谷胱甘肽可以调节机体的抗氧化状态,降低细胞中过氧化氢的浓度,减轻细胞的损伤程度。本试验中,虹鳟血清中的GSH和GR活性均高于对照组,推测是外源性谷胱甘肽对虹鳟体内与谷胱甘肽有关的反应和代谢有一定的促进作用,使得谷胱甘肽的需要量增多,因而能够将GSSG转化为GSH的GR活性也相应的增强[17,33]。本试验结果显示,谷胱甘肽添加组MDA含量均低于对照组,且随着谷胱甘肽添加量的增加,MDA含量呈现先降低后升高的趋势,且外源性谷胱甘肽对MDA含量无显著影响,与梁春梅[37]的研究结果一致。推测得到本试验结果的原因是适量的谷胱甘肽可以降低脂质过氧化反应对细胞的毒害作用,以减轻细胞损伤程度,其具体作用机制还有待深入研究。
本试验中肝脏抗氧化酶活性结果显示,谷胱甘肽添加组虹鳟肝脏SOD活性均升高,且随添加量的增加呈先升高后降低的趋势。说明外源性的谷胱甘肽降低了细胞内氧自由基的含量,这与在血清中的试验结果一致。同时,肝脏CAT活性均高于对照组,且随着谷胱甘肽添加量的增加呈现先升高后降低的趋势,这与血清中CAT的试验结果相一致,并与Mourente等[38]的研究结果一致。焦彩虹[39]研究发现,饲料中添加一定量的谷胱甘肽可以提高奥尼罗非鱼血清和肝脏中GR活性。朱选等[24]也发现,当饲料中添加400 mg/kg的谷胱甘肽时,草鱼肝胰脏中GR活性显著高于对照组。本试验中,200 mg/kg谷胱甘肽添加组虹鳟肝脏中的GSH和GR活性显著高于对照组,推测与血清中GSH和GR活性升高的原因相似,外源性谷胱甘肽能够促进对虹鳟体内与谷胱甘肽有关的代谢反应,从而使GSSG转化为GSH的GR活性增强,以满足谷胱甘肽的需要量的增多[17,33]。各添加组肝脏MDA含量与血清MDA含量变化保持一致,均随谷胱甘肽添加量的增加先降低后升高,进一步说明适量的谷胱甘肽能够减轻细胞损伤程度。
本试验中鳃丝抗氧化酶活性结果显示,虹鳟鳃丝中谷胱甘肽添加组SOD、CAT、GSH和GR活性较对照组有所升高,但仅200 mg/kg组的GSH和GR活性显著高于对照组。GR在机体内的主要作用是催化GSSG还原为GSH,从而维持GSH/GSSG的平衡。王芳倩等[10]的试验结果表明,外源性谷胱甘肽能够辅助维持鱼体内GSH/GSSG的平衡,GSH由内源性GSSG转化。这也与本试验中GSH和GR活性在血清和肝脏中的试验结果一致。
综上所述,添加适量的谷胱甘肽不仅能够提高虹鳟的增重率、特定生长率,降低饵料系数和死亡率,且有助于缓解虹鳟养殖过程中的氧化应激。在循环水养殖模式下,体质量约718.3 g的虹鳟饲料中谷胱甘肽的适宜添加量为200 mg/kg。
[1] 方允中,杨胜,伍国耀.自由基、抗氧化剂、营养素与健康的关系[J].营养学报,2003,25(4):337-343.
[2] 刘波.高温应激与大黄蒽醌提取物对团头鲂生理反应及相关应激蛋白表达的影响[D].南京:南京农业大学,2012.
[3] 麦康森,艾庆辉.水产养殖中的环境胁迫及其预防——营养学途径[C]//中国水产学会2003年学术年会.北京:中国水产学会,2003:767-774.
[4] 王荻,刘红柏,罗添允.中草药与益生菌在水产养殖中协同作用的研究进展[J].大连海洋大学学报,2016,31(5):583-588.
[5] 江洁,单立峰.谷胱甘肽的制备及其应用[J].饲料工业,2007,28(15):15-17.
[6] Ceriello A.Hyperglycaemia:the bridge between non-enzymatic glycation and oxidative stress in the pathogenesis of diabetic complications[J].Diabetes,Nutrition & Metabolism,1999,12(1):42-46.
[7] 贾贞,王丹,游松.谷胱甘肽的研究进展[J].沈阳药科大学学报,2009,26(3):238-242.
[8] Ponsoda X,Bort R,Jover R,et al.Increased toxicity of cocaine on human hepatocytes induced by ethanol:role of GSH[J].Biochemical Pharmacology,1999,58(10):1579-1585.
[9] Raghunathan V K,Ellis E M,Tettey J N A,et al.Involvement of reduced glutathione and glutathione reductase in the chronic toxicity of hexavalent chromium to monocytes in vitro[J].Toxicology,2007,231(2-3):105-106.
[10] 王芳倩,张文兵,麦康森,等.饲料中添加还原型谷胱甘肽对牙鲆生长和抗氧化能力的影响[J].中国海洋大学学报,2011,41(4):51-56.
[11] 赵红霞,谭永刚,周萌,等.饲料中添加谷胱甘肽对草鱼生长、生理指标和抗病力的影响[J].中国水产科学,2007,14(4):678-683.
[12] 曹俊明,刘晓华,周萌,等.饲料中添加谷胱甘肽对凡纳滨对虾非特异性免疫因子和相关酶活性的影响[J].华中农业大学学报,2007,26(4):528-532.
[13] 刘晓华,曹俊明,吴建开,等.饲料中添加谷胱甘肽对凡纳滨对虾肝胰腺抗氧化指标和脂质过氧化物含量的影响[J].水产学报,2007,31(2):235-240.
[14] Vincenzini M T,Favilli F,Iantomasi T.Intestinal uptake and transmembrane transport systems of intact GSH:characteristics and possible biological role[J].Biochimica et Biophysica Acta(BBA)-Reviews on Biomembranes,1992,1113(1):13-23.
[15] 张国良,赵会宏,周志伟,等.还原型谷胱甘肽对罗非鱼生长和抗氧化性能的影响[J].华南农业大学学报,2007,28(3):90-93.
[16] Infante J L Z,Cahu C L,Peres A.Partial substitution of di- and tripeptides for native proteins in sea bass diet improves Dicentrarchus labrax larval development[J].The Journal of Nutrition,1997,127(4):608-614.
[17] 周婷婷,曹俊明,黄燕华,等.饲料中添加谷胱甘肽对吉富罗非鱼肝脏生长及抗氧化相关基因mRNA表达量的影响[J].广东农业科学,2012,39(14):146-149.
[18] 梁萌青,王成刚,陈超,等.几种添加剂对红鳍东方鲀的促生长效果与RNA/DNA关系[J].海洋水产研究,2001,22(2):38-41.
[19] Chen J Y,Chen J C,Chang Chiyao,et al.Expression of recombinant tilapia insulin-like growth factor-I and stimulation of juvenile tilapia growth by injection of recombinant IGFs polypeptides[J].Aquaculture,2000,181(3-4):347-360.
[20] Xiao Dong,Lin Haoran.Effects of cysteamine—a somatostatin-inhibiting agent—on serum growth hormone levels and growth in juvenile grass carp(Ctenopharyngodon idellus)[J].Comparative Biochemistry and Physiology Part A:Molecular&Integrative Physiology,2003,134(1):93-99
[21] Di Giulio R T D,Washburn P C,Wenning R J,et al.Biochemical responses in aquatic animals:a review of determinants of oxidative stress[J].Environmental Toxicology and Chemistry, 1989, 8(12):1103-1123.
[22] Rudneva I I.Blood antioxidant system of Black Sea elasmobranch and teleost[J].Comparative Biochemistry and Physiology Part C:Pharmacology, Toxicology and Endocrinology, 1997, 118(2):255-260.
[23] Winston G W.Oxidants and antioxidants in aquatic animals[J].Comparative Biochemistry and Physiology Part C:Comparative Pharmacology,1991,100(1-2):173-176.
[24] 朱选,曹俊明,赵红霞,等.饲料中添加谷胱甘肽对草鱼组织中谷胱甘肽沉积和抗氧化能力的影响[J].中国水产科学,2008,15(1):160-166.
[25] Mourente G,Tocher D R,Diaz E,et al.Relationships between antioxidants,antioxidant enzyme activities and lipid peroxidation products during early development in Dentex dentex eggs and larvae[J].Aquaculture,1999,179(1-4):309-324.
[26] Trenzado C,Hidalgo M C,García-Gallego M,et al.Antioxidant enzymes and lipid peroxidation in sturgeon Acipenser naccarii and trout Oncorhynchus mykiss.A comparative study[J].Aquaculture,2006,254(1-4):758-767.
[27] Campa-Córdova A I,Hernández-Saavedra N Y,De Philippis R,et al.Generation of superoxide anion and SOD activity in haemocytes and muscle of American white shrimp(Litopenaeus vannamei)as a response to β-glucan and sulphated polysaccharide[J].Fish & Shellfish Immunology,2002,12(4):353-366.
[28] 张欣.超氧化物歧化酶(SOD)及其研究进展[J].内蒙古石油化工,2010,36(16):14-15.
[29] Li Zhihua,Xie Song,Wang Junxia,et al.Effect of intermittent starvation on growth and some antioxidant indexes of Macrobrachium nipponense(De Haan)[J].Aquaculture Research,2009,40(5):526-532.
[30] Hunt C R,Sim J E,Sullivan S J,et al.Genomic instability and catalase gene amplification induced by chronic exposure to oxidative stress[J].Cancer Research,1998,58(17):3986-3992.
[31] David M,Munaswamy V,Halappa R,et al.Impact of sodium cyanide on catalase activity in the freshwater exotic carp,Cyprinus carpio(Linnaeus)[J].Pesticide Biochemistry and Physiology,2008,92(1):15-18.
[32] 孟令丽,梁成云,杨彦飞,等.维生素E对不同饲喂时期延边黄牛血清维生素E含量及抗氧化酶的影响[J].黑龙江畜牧兽医,2009(6):40-41.
[33] 储霞玲.硒和谷胱甘肽联合作用对凡纳滨对虾生长及抗氧化功能的影响[D].广州:中山大学,2009.
[34] 陈汉,王慧君,李学锋,等.甲基苯丙胺对大鼠脑组织中NO,SOD和MDA的影响[J].中国药物依赖性杂志,2007,16(2):102-104.
[35] Pellerin-Massicotte J.Oxidative processes as indicators of chemical stress in marine bivalves[J].Journal of Aquatic Ecosystem Health,1994,3(2):101-111.
[36] Peña-Llopis S,Peña J B,Sancho E,et al.Glutathione-dependent resistance of the European eel Anguilla anguilla to the herbicide molinate[J].Chemosphere,2001,45(4-5):671-681.
[37] 梁春梅.还原型谷胱甘肽对奥尼罗非鱼(Oreochromis niloticus×O.aureus)幼鱼生长、免疫功能的影响及其机理研究[D].广州:华南农业大学,2006.
[38] Mourente G,DíAz-Salvago E,Bell J G,et al.Increased activities of hepatic antioxidant defence enzymes in juvenile gilthead sea bream(Sparus aurata L.)fed dietary oxidised oil:attenuation by dietary vitamin E[J].Aquaculture,2002,214(1-4):343-361.
[39] 焦彩虹.谷胱甘肽对罗非鱼生长的影响及其机理研究[D].广州:华南农业大学,2004.
Effects of dietary glutathione on growth and anti-oxidative capability of rainbow trout Oncorhynchus mykiss
WANG Yi1, SUN Guo-xiang2、3, LIU Ying1, YANG Xiu-liang3, ZHANG Xu3, WANG Shun-kui4
(1.Aquacultural Engineering Research & Development Center, Dalian Ocean University, Dalian 116023, China; 2.Institute of Oceanology, Chinese A-cademy of Sciences, Qingdao 266000, China; 3.Shandong Jincheng Biological Pharmaceutical Company Limited, Zibo 255000, China; 4.Shandong Oriental Ocean Company Limited, Yantai 264003, China)
The rainbow trout Oncorhynchus mykiss with initial body weight of(718.3±36.3)g were reared in a recycling water system and fed diets containing glutathione(GSH)at a rate of 0,100,200,400 and 600 mg/kg at water temperature of(15.0±1.0)℃ for 8 weeks to investigate the effects of dietary glutathione on the growth performance and antioxidant ability and resistance to nitrite exposure in rainbow trout.The results showed that average weight gain rate(WGR),specific growth rate(SGR)and food intake(FI)were found to be elevated first and then declined with increase in dietary SGR level,the maximum in the fish fed the diet containing 200 mg/kg of GSH and significantly higher than those in other groups(p<0.05).There was significantly lower food conversion ratio in 200 mg/kg group than in other groups(p<0.05), with the minimal mortality rate(4.04%).The gill filament and serum superoxide dismutase(SOD)activities in GSH-fed fish were higher than those in the control group,significantly higher serum and hepatic SOD activities in 200 mg/kg GSH groups.The gill filament,serum and hepatic catalase(CAT)activities were higher in GSH-fed fish than those in the control group, increase first and then decrease with elevated dietary GSH level, significantly higher serum and hepatic CAT activities in 200 mg/kg GSH groups(p<0.05).There were significantly lower malondialdehyde(MDA)levels in serum,liver and gill filament in GSH-fed fish than those in the control group, without significant difference(P>0.05), and the minimum in the fish fed the diet containing GSH at a rate of 200 mg/kg.The findings indicate that supplementation of suitable amount of glutathione leads to improve the growth and antioxidant capacity of rainbow trout.
Oncorhynchus mykiss; glutathione; growth; anti-oxidative capability
S963
A
10.16535/j.cnki.dlhyxb.2017.06.003
2095-1388(2017)06-0651-07
2017-04-14
国家自然科学基金资助项目 (31472312,31672673);江苏省重点研发计划项目 (BE2015325);青岛市博士后启动基金资助项目(Y6KY06106N)
王艺 (1993—),女,硕士研究生。E-mail:wxxfbxvip@163.com
刘鹰 (1970—),男,博士,研究员。E-mail:yingliu@dlou.edu.cn

