产细菌素菌株的筛选鉴定及活性研究
郝 莹, 郭礼强, 刘东霞, 孙 军, 赵 晗
产细菌素菌株的筛选鉴定及活性研究
郝 莹, 郭礼强, 刘东霞, 孙 军*, 赵 晗
(潍坊出入境检验检疫局,山东潍坊 261041)
为筛选产细菌素的乳酸菌株,本试验采用高效液相色谱法与微生物学方法相结合的方式进行初步筛选。从土壤中分离获得一株乳酸菌菌株P9-5,将菌株P9-5发酵液作用于单核细胞增生李斯特氏菌发现,其产生的细菌素对该致病菌有抑制活性。结合菌落及菌体形态,通过Biolog自动微生物鉴定系统鉴定和16S rDNA基因序列相似性分析,鉴定菌株P9-5为戊糖片球菌(Pediococcus pentosaceus),为菌株P9-5的进一步开发利用提供了技术支持。
细菌素;抑菌特性;高效液相色谱;自动微生物鉴定系统;鉴定
To study and screen the bacteriocin-producing lactic acid bacteria,a lactic acid bacteria strain P9-5 was isolated from soil.The high performance liquid chromatographic method and microbiology technique were used to screen strains P9-5.The results showed that the culture filtrate of P9-5 exhibited high inhibitory activity against Listeria monocylogenes.According to the colonies,cells morphology,the results of the Biolog automated microbial analysis system and 16S rDNA sequence alignment,the isolated strain was identified as Pediococcus pentosaceus.It provided technical support for further development and utilization of strain P9-5.
bacteriocin;antimicrobial characteristics;high performance liquid chromatography;automatic microbiology analysis system;identification
近年来,世界各地由单核细胞增生李斯特氏菌引起的中毒事件层出不穷,预防和控制单核细胞增生李斯特氏菌污染成为了社会关注的热点(Vijayakumar等,2015;吕燕妮等,2007)。 乳酸菌是一类可发酵碳水化合物产生大量乳酸的革兰氏阳性菌的统称,具有多种有益的生理功能,能够产生有机酸、细菌素等抑菌物质(李悦等,2008)。细菌素是某些细菌在代谢过程中通过核糖体合成机制产生的具有抑菌活性的多肽或前体多肽,产生菌对其自身分泌的细菌素具有免疫作用(Malheiros等,2015;Cui等,2012;刘丽等,2011)。 在研究中发现,某些乳酸菌产生的细菌素对单核细胞增生李斯特氏菌具有强烈的抑制作用,这些细菌素通常都属于Ⅱa型细菌素。该类细菌素经济、有效,并且不会对环境造成二次污染,有望从源头上对单核细胞增生李斯特氏菌污染加以控制(Furtado 等,2014;Banerjee 等,2013;吕燕妮,2007;韩雪等,2006)。
目前,国内成型的Ⅱa型细菌素类产品较少。Ⅱa型细菌素类制剂作为控制单核细胞增生李斯特氏菌的一种手段急需研究和开发。本研究通过抗单核细胞增生李斯特氏菌菌株的筛选,旨在建立合理、有效的单核细胞增生李斯特氏菌拮抗乳酸菌株的筛选方法,为单核细胞增生李斯特氏菌的控制提供更多选择。
1 材料与方法
1.1 样品来源 从山东潍坊、烟台等地区采集不同地点的土样、牛奶、泡菜、发酵产品等样品。
1.2 指示菌 单核细胞增生李斯特氏菌(Listeria monocytogenes)NICPBP 54002。
1.3 培养基 MRS肉汤培养基:购于北京路桥技术有限责任公司。称取52.3 g粉末加入1 L水,加热煮沸至完全溶解,分装。115℃高压灭菌15 min。
MRS琼脂:购于北京路桥技术有限责任公司。称取64.25 g粉末加入1 L水,加热煮沸至完全溶解。121℃高压灭菌15 min。冷却至46℃左右倒平板或斜面。
TSB培养基:购于北京路桥技术有限责任公司。称取36 g粉末加入1 L水,加热煮沸至完全溶解。121℃高压灭菌15 min。
TSA培养基:购于北京路桥技术有限责任公司。称取51 g粉末加入1 L水,加热煮沸至完全溶解。121℃高压灭菌15 min。冷却至46℃左右倒平板或斜面。
BUG+B培养基:购于美国Biolog公司。称取57 g粉末于950 mL蒸馏水中,加热煮沸至完全溶解,冷却至25℃,调整pH至7.3±0.1,121℃高压灭菌15 min,冷却至45~50℃,加入50 mL脱纤维羊血混匀。
1.4 仪器与设备 HVE-50立式压力蒸汽灭菌器,日本Hirayama公司;BSC-1300ⅡA/B3生物安全柜,上海博迅医疗生物仪器股份有限公司;CX21显微镜,日本OLYMPUS公司;Aglient 1260高效液相色谱仪,美国安捷伦公司;PL 602-S分析天平,梅特勒-托利多仪器(上海)有限公司;Incucell 111恒温培养箱,德国MMM公司;移液枪,德国Eppendorf公司;5417R台式高速离心机,德国Eppendorf公司;UV2100分光光度计,尤尼柯(上海)仪器有限公司;全自动微生物鉴定系统,美国Biolog公司。
1.5 试验方法
1.5.1 乳酸菌的分离筛选 称取混合均匀的试验样品于MRS肉汤培养基中,置于培养箱中培养48 h,均匀混合后在无菌条件下用移液器吸取培养液进行一系列梯度稀释。取10-4、10-5、10-6三个稀释度涂布MRS琼脂平板,37℃培养24~48 h,挑取单菌落纯化(董瑞丽等,2013;Yang 等,2012)。
在无菌条件下,挑取分离纯化后的菌落于新鲜的MRS肉汤中,置于培养箱中37℃培养48 h后,菌落培养液离心除去菌体,加入相同体积的0.01 mol/L的硫酸溶液混合均匀,进行酸解,12000 r/min离心5 min,过滤稀释后上机检测菌落培养液中的乳酸含量(马瑞等,2012;Svetoch,2011)。色谱条件为色谱柱:Aglient ZORBAX SBC18,5 μm,4.6 mm×250 mm;流动相:0.1%磷酸水溶液(pH 2.0),乙腈;磷酸水∶乙腈 5∶95;流速:0.3 mL/min;柱温:室温;波长:210 nm;进样量:10 μL。
将检测到产生乳酸的纯化后的菌落进行革兰氏染色镜检和过氧化氢试验,选取革兰氏染色阳性和过氧化氢酶阴性菌初步确认为乳酸菌 (崔一喆等,2016)。
1.5.2 产Ⅱa型细菌素的乳酸菌筛选及对单增李斯特氏菌的拮抗作用 将筛选出的乳酸菌株,接入MRS肉汤培养基培养3 d后,8000 r/min离心10 min,取上清,用1 mol/L NaOH溶液调整发酵液的 pH 到 6.5 ~ 7.0(Huang等,2009;周伟等,2006);单增李斯特氏菌在TSB肉汤培养基中35℃培养18 h,按1%接种量接种于10 mL新鲜的TSB肉汤培养基中,加入调节pH后的乳酸菌发酵液,置于35℃,连续培养8 h,每隔一定时间测定培养液在600 nm波长处的OD值,以不加乳酸菌发酵液的单增李斯特氏菌培养液为对照 (Goh等,2015;余倩等,2013)。
1.5.3 菌株鉴定 将获得的菌株进行分子生物学鉴定,从GenBank数据库中获得与菌株16SrDNA同源的序列数据,使用MEGA 5.10软件计算序列相似性并作系统发育分析,并构建系统发育树(齐育平等,2013;Abbasiliasi等,2012)。 同时,挑取菌株纯培养物单菌落,接种于BUG培养基平板,37℃培养24~48 h,CO2浓度为6.5%,转接1~2代。使用Inoculatorz棉签从BUG平板上沾取菌落接种于IF-C接种液中,将浊度调整为90%~98%。菌悬液倒入V型加样水槽中,使用8道移液器将菌悬液按顺序加入微孔板的所有孔中,每孔100 μL。将微孔板置于37℃培养16~48 h,使用Biolog自动微生物鉴定系统进行鉴定 (董瑞丽等,2013;刘江等,2012)。
2 结果与分析
2.1 乳酸菌的分离筛选 乳酸菌是一类可发酵碳水化合物产生大量乳酸的革兰氏阳性菌的统称(李悦等,2008)。刘丽等(2011)将稀释后的样品涂布到乳酸菌分离培养基上,通过挑选有溶钙圈的菌落,多次划线纯化进行乳酸菌的分离。崔一喆等(2016)通过革兰氏染色和过氧化氢酶试验,根据革兰氏染色阳性和过氧化氢酶接触阴性初步确定为乳酸菌。董雨馨等(2016)使用倾注法将样品接种在碳酸钙-MRS琼脂平板上,培养后,选取有溶钙圈的菌落,初步判断为乳酸菌,进行下一步试验。本文应用高效液相色谱法对稀释一定倍数的纯化后的细菌培养液进行检测与定性分析,将乳酸标准溶液与样品色谱图进行对照,根据出峰时间进行判断,乳酸出峰时间为12.5 min左右,通过对检测结果(图1和图2)的分析,将培养液中乳酸检测阳性的菌株进行下一步试验。对上机筛选所得菌株进行革兰氏染色和过氧化氢试验,乳酸菌为革兰氏染色阳性,过氧化氢酶试验阴性。
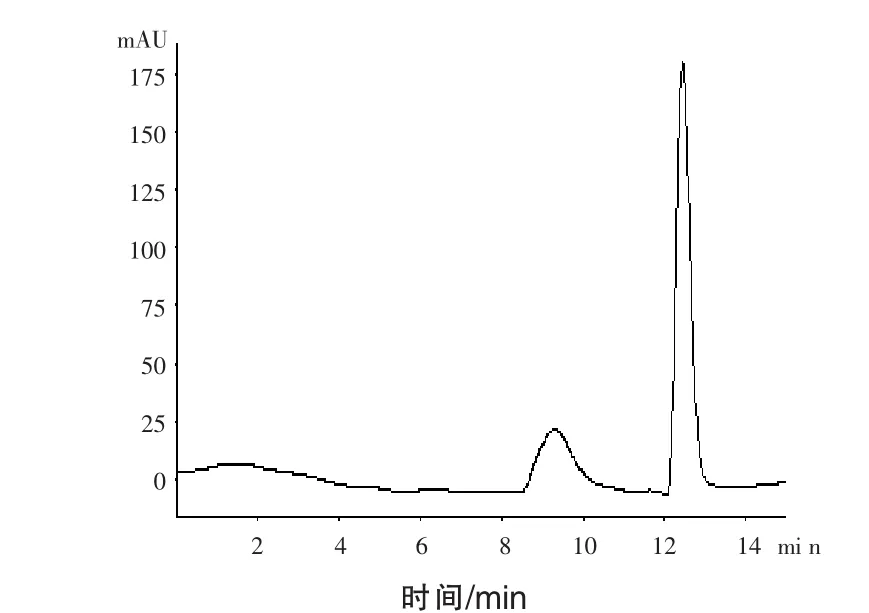
图1 乳酸标准溶液的色谱图
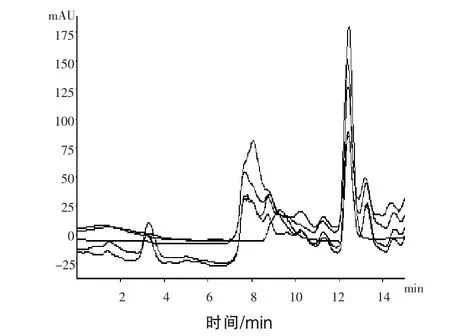
图2 乳酸标准溶液与样品的色谱图
2.2 产Ⅱa型细菌素乳酸菌的筛选及对单增李斯特氏菌的拮抗作用 由图3可知,菌株P9-5发酵液对单核细胞增生李斯特氏菌的生长具有明显的抑制作用。含单增李斯特氏菌的培养基与菌株P9-5发酵液混合后,随着培养时间的延长,对照组与发酵液处理组中单增李斯特氏菌均持续增长,但发酵液处理组的菌体增长速度与菌体量一直低于对照组。培养2 h后,对照组与处理组中单增李斯特氏菌的增长差距逐渐增大,培养到6 h时,对照组与发酵液处理组中单增李斯特氏菌的增长均趋于平稳,菌体量差距达到最大。在培养过程中,经过乳酸菌发酵液处理后,与对照相比,单核细胞增生李斯特氏菌的生长量降低30%,其生长受到明显抑制。
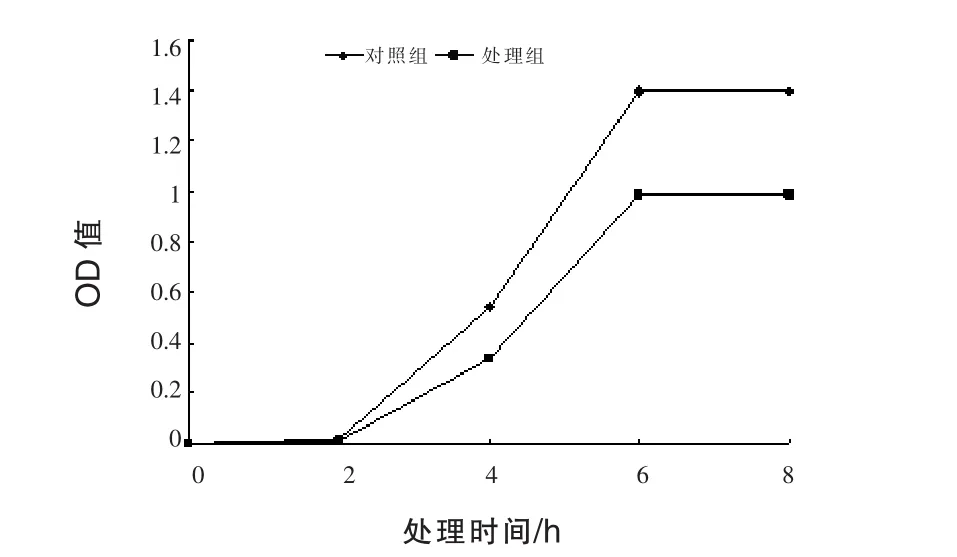
图3 P9-5对单增李斯特氏菌的拮抗作用
2.3 菌株鉴定 纯化后的菌株P9-5在MRS培养基上的菌落形态为乳白色菌落,边缘整齐,正面略凸起,表面光滑湿润,不透明,革兰氏染色呈阳性,无芽胞。提取菌株P9-5基因组DNA,扩增其16S rDNA基因序列,进行核苷酸序列分析。
将测序获得的菌株核苷酸序列信息提交至美国国家生物技术信息中心,利用Blast检索系统在GenBank数据库中与已知核苷酸序列进行同源性比对,获得与菌株P9-5 16S rDNA同源性较高的序列数据,使用MEGA 5.10软件计算序列相似性并作系统发育分析,构建菌株P9-5的系统发育树(李强坤等,2016)。由图4可以看出,菌株P9-5与戊糖片球菌(Pediococcus pentosaceus)的核苷酸序列具有最高的同源性,初步确定为戊糖片球菌。

图4 基于16S rDNA建立的P9-5菌株的系统发育树
Biolog自动微生物鉴定系统,是利用微生物对不同碳源呼吸代谢的差异,针对每一类微生物筛选95种不同碳源或其他化学物质,配合四唑类显色物质(如TTC、TV),通过检测微生物细胞利用不同碳源进行呼吸代谢产生的氧化还原物质与显色物质发生反应而导致的颜色变化以及微生物生长造成的浊度差异,生成特征指纹图谱,与标准菌株图谱数据库进行比对,即可得出鉴定结果(董瑞丽等,2013)。
使用Biolog自动微生物鉴定系统对菌株P9-5进行鉴定,得出四个最可能的鉴定结果(表1)。相似度指数值表示了测试结果与数据库相应数据条的匹配程度,培养后,只有当相似度指数大于0.50时,鉴定结果才能被接受(刘江等,2012)。菌株P9-5鉴定结果显示与戊糖片球菌相似度指数为0.726,综合16S rDNA试验分析结果,确定菌株P9-5 为戊糖片球菌(Pediococcus pentosaceus)。
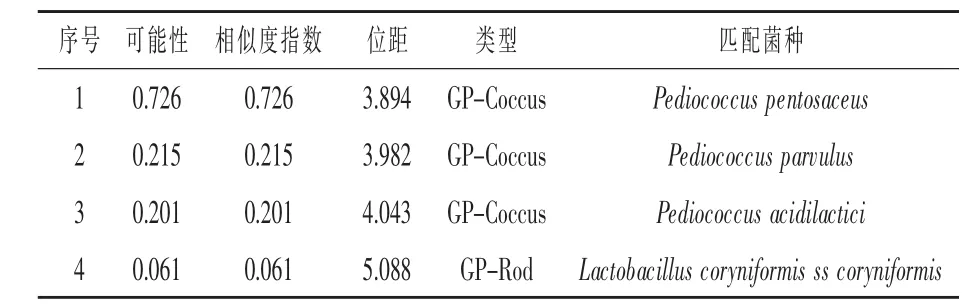
表1 P9-5的Biolog鉴定结果
3 讨论
单核细胞增生李斯特菌是常见的致病微生物,可引起李斯特菌病,致死率相对较高。并且单增李斯特菌在4℃条件下仍可繁殖,预防和控制该菌的污染具有一定的困难 (董雨馨等,2016;许红岩,2013)。化学类防腐剂以及抗生素的添加可以有效抑制致病菌的生长,但是可能存在致癌、致畸、抗药性和食物中毒等安全问题,而细菌素可作为抗竞争分子生物膜的信号分子阻碍致病菌入侵微生物群落,可被动物消化道的部分蛋白酶降解,具有无毒、无抗药性、无副作用、无残留等优点(董雨馨等,2016;胡美忠等,2016;尹乐斌等,2016;许红岩,2013)。许红岩等(2013)从土壤中分离出一株单增李斯特氏菌的拮抗微生物,鉴定为枯草芽孢杆菌,在食品保鲜中显示出了良好的应用前景。姜晶等(2016)从酸马奶中提纯的植物乳杆菌细菌素可有效抑制大肠杆菌O78的生长。李强坤等(2016)通过牛津杯法筛选得到几株高抑菌活性的植物乳杆菌,对大肠杆菌O157∶H7和金黄色葡萄球菌有较好的抑菌效果。
本研究通过微生物与高效液相色谱方法相结合的方式,建立了筛选乳酸菌的新方法,采用液体培养法筛选得到有效的产细菌素的乳酸菌P9-5,对单增李斯特氏菌的生长具有很好的抑制作用。通过分子生物学方法以及Biolog自动微生物鉴定系统对菌株P9-5进行鉴定,确定其为戊糖片球菌(Pediococcus pentosaceus)。应用于工业生产及环境中易被单增李斯特氏菌污染的阶段,有利于提高单增李斯特氏菌防控水平,促进畜牧业以及食品行业的安全发展。
[1]崔一喆,蒋再慧,周亚强,等.鸡源抑菌性乳酸菌的特性研究与鉴定及饲喂肉仔鸡的效果研究[J].中国微生态学杂志,2016,28(5):506 ~ 511.
[2]董瑞丽,乔晓艳,李杨,等.酱香型大曲中一株细菌的分离及其Biolog鉴定[J].酿酒,2013,40(1):45 ~ 47.
[3]董雨馨,张君超,张红星,等.1株产细菌素植物乳杆菌的筛选及其细菌素抑菌性质研究[J].食品与发酵工业,2016,42(7):74 ~ 79.
[4]韩雪,周志江.乳酸片球菌细菌素的活性及特性的研究[J].食品研究与开发,2006,27(4):19 ~ 21.
[5]胡美忠,党丽娟,陆兆新.Lactobacillus plantarum 163产细菌素食品级培养基筛选及发酵条件优化[J].食品科学,2016,37(15):165 ~ 170.
[6]姜 晶,敖日格乐,王纯洁,等.酸马奶提取植物乳杆菌DSM20174细菌素的理化特性研究[J].中国畜牧兽医,2016,43(2):444 ~ 449.
[7]吕燕妮,李平兰,周伟,等.Ⅱa类细菌素的结构、生物合成与活性[J].微生物学通报,2007,34(5):955 ~ 959.
[8]李强坤,柳陈坚,张园莲,等.植物乳杆菌对食源性病原菌作用的研究[J].食品科学,2016,37(11):18 ~ 23.
[9]李悦,孙玉梅,杨红,等.产细菌素乳酸菌的筛选及其发酵特性[J].大连工业学学报,2008,27(1):19 ~ 21.
[10]刘江,谷洁,高华,等.秦岭山区无机磷细菌筛选及其Biolog和分子生物学鉴定[J].干旱地区农业研究,2012,30(1): 184 ~ 189.
[11]刘丽,郝彦玲,张红星,等.1株产细菌素植物乳杆菌的筛选及所产细菌素的理化性质分析[J].中国食品学报,2011,11(6):47 ~ 52.
[12]马瑞,欧阳嘉,李鑫,等.高效液相色谱法同时测定生物质乳酸发酵液中有机酸及糖类化合物[J].色谱,2012,30(1):62 ~ 66.
[13]齐育平,陈丹凤,黄樟阳,等.1株拮抗水稻纹枯病菌鼠乳杆菌的筛选与鉴定[J].微生物学杂志,2013,33(6):43 ~ 48.
[14]许红岩,段效辉,李小清.单核细胞增生李斯特氏菌拮抗菌的分离鉴定及其抑菌活性[J].食品科学,2013,34(15):181 ~ 185.
[15]尹乐斌,张臣飞,孙菁,等.一株产细菌素乳酸菌的分离鉴定及生物学特性研究[J].食品与机械,2016,32(3):12 ~ 15.
[16]余倩,杨倩妹.一株植物乳杆菌所产细菌素的特性研究[J].食品工业,2013,34(4):156 ~ 159.
[17]周伟,李平兰,周康,等.温度、pH及盐对植物乳杆菌素L-1作用单核细胞增生李斯特氏菌的影响[J].食品科学,2006,27(2):121 ~ 125.
[18]Abbasiliasi S,Tan J,Ibrahim T A T,et al.Isolation of Pediococcus acidilactici Kp10 with ability to secrete bacteriocin-like inhibitory substance from milk products for applications in food industry[J].BMC Microbiology,2012,12:260.
[19]Banerjee S P,Dora K C,Chowdhury S.Detection,partial purification and characterization of bacteriocin produced by Lactobacillus brevis FPTLB3 isolated from freshwater fish[J].Food Sci Technol,2013,50(1):17 ~ 25.
[20]Cui Y H,Zhang C,Wang Y F,et al.Class IIa Bacteriocins:Diversity and New Developments[J].International Journal of Molecular Sciences,2012(13):16668~16707.
[21]Furtado D N,Todorov S D,Landgraf M,et al.Bacteriocinogenic Lactococcus lactis subsp.lactis DF04Mi isolated from goat milk:Characterization of the bacteriocin[J].Brazilian Journal of Microbiology,2014,45(4):1541 ~ 1550.
[22]Goh H F,Philip K.Purification and Characterization of Bacteriocin Produced by Weissella confusa A3 of Dairy Origin [J].Plos One,2015,10:e0140434.
[23]Huang Y,Luo Y,Zhai Z,et al.Characterization and application of an anti-Listeria bacteriocin produced by Pediococcus pentosaceus 05-10 isolated from Sichuan Pickle,a traditionally fermented vegetable product from China[J].Food Control,2009,20:1030 ~ 1035.
[24]Malheiros P S,Anna V S,Todorov S D,et al.Optimization of growth and bacteriocin production by Lactobacillus sakei subsp.sakei 2a[J].Brazilian Journal of Microbiology,2015,46(1):825 ~ 834.
[25]Svetoch E A,Eruslanov B V,Levchuk V P,et al.Isolation of Lactobacillus salivarius 1077 (NRRL B-50053) and Characterization of Its Bacteriocin,Including the Antimicrobial Activity Spectrum [J].Applied and Environmental Microbiology,2011,77(8):2749 ~ 2754.
[26]Vijayakumar P P,Muriana P M.A Microplate Growth Inhibition Assay for Screening Bacteriocins against Listeria monocytogenes to Differentiate Their Mode-of-Action[J].Biomolecules,2015,5:1178 ~ 1194.
[27]Yang E,Fan L H,Jiang Y M,et al.Antimicrobial activity of bacteriocinproducing lactic acid bacteria isolated from cheeses and yogurts[J].AMB Express,2012,48(2):1 ~ 12.■
S816.3
A
1004-3314(2017)22-0019-04
10.15906/j.cnki.cn11-2975/s.20172205
山东检验检疫局科研项目计划(SK201217);潍坊市科学技术发展计划(2014RKX094)
*通讯作者

