影响产土味素链霉菌生长及代谢的白酒酿造相关环境因素
杜海,杜小威,赵景龙,张鑫,徐岩*
1(工业生物技术教育部重点实验室,江南大学酿酒科学与酶技术中心,江苏 无锡,214122)2(山西杏花村汾酒厂股份有限公司,技术中心,山西 汾阳,032205)
影响产土味素链霉菌生长及代谢的白酒酿造相关环境因素
杜海1,杜小威2,赵景龙2,张鑫2,徐岩1*
1(工业生物技术教育部重点实验室,江南大学酿酒科学与酶技术中心,江苏 无锡,214122)2(山西杏花村汾酒厂股份有限公司,技术中心,山西 汾阳,032205)
产土味素(geosmin)的链霉菌对白酒酿造菌群及风味造成严重影响。该研究目的是发现白酒酿造中限制土味素生物合成的特征环境因子。针对白酒群体微生物固态酿造体系的特征,系统地研究了酿造环境因素(温度、水分、乙醇含量、pH等)对产土味素链霉菌生长及代谢的影响规律。研究发现土味素的产量与菌体的生物量和生长速率是呈正相关的关系。发现产土味素链霉菌最适生长温度为30 ℃,最适生长的基质含水量为50%。乙醇体积分数高于10%的酿造环境中,产土味素链霉菌菌体生长会受到完全抑制。菌体在中性偏碱性(pH7~8)的环境中可以大量繁殖。在酸性(pH3~5)环境中,产土味素链霉菌菌体生长受到抑制,并进而减少土味素的产生。研究结果对有效控制白酒中土霉异味提供了可靠的理论依据。
土味素;链霉菌;环境因子;白酒
中国白酒以酿造过程复杂,香气成分丰富而闻名于中外[1]。目前,从白酒中检测到的香气成分种类均达到百种以上[1]。然而,白酒中除了香气成分以外,还存在着许多令人不悦的异味物质,而土霉味、涩味、酸味等是中国白酒中常见的异味[2-3]。尤其是土霉味,更是给白酒界带来了很大的困扰。
目前,在国内外得到广泛关注的土霉味物质有两种:2-甲基异莰醇(2-MIB)和土味素(geosmin)。这类物质出现频率最多的领域是在饮用水和水产养殖方面。产土霉味的微生物主要有放线菌(主要是链霉菌)和浮游藻类等。自GERBER[4]分离到土霉味物质土味素以来,关于土霉味物质的研究进展一直很快,从分离、检测、鉴定、生物合成及降解方面都取得了显著的成效[5-9]。目前土味素的合成途径已基本清楚,在天蓝链霉菌中的sco6073基因的功能得到确认,由其编码两种关键酶,进而催化法尼焦磷酸(FPP)环化合成geosmin[10]。在降解方面目前采用的方法主要有膜过滤、活性炭吸附、生物降解等[11],这些方法都能有效地去除掉水中的土霉味物质。
虽然土霉味是中国白酒中常见的异味,但是中国白酒界对其研究却很少。以前研究并不能明确中国白酒中土霉味的化学本质及其来源。白酒酿造行业内一般认为土霉味来源于糠壳,由于糠壳发霉或蒸煮不彻底以致进入白酒中。然而最近的研究表明,土霉味的化学本质是土味素[2]。该物质并非产自糠壳,而是来源于大曲。是通过大曲中微生物的新陈代谢而产生的,通过发酵进而进入酒醅,通过蒸馏过程进入原酒中。
本研究团队前期从白酒大曲中分离出4株产土霉异味的链霉菌,并发现所产土味素为分离得到的链霉菌的共性代谢物[6]。虽然在长期的微生物学及发酵工程研究中,链霉菌的代谢特征及其相关生理生化特性已经有很多相关报道[12-15],然而,产土味素链霉菌在我国传统白酒酿造环境中的生长特性以及对环境的抗逆性并不清晰。因此,从微生物源头控制角度出发,有必要了解这一类微生物的生长特性。从而,利用工艺参数调节达到有针对性地控制该类微生物的生长及代谢。
本研究将通过考察影响产土味素链霉菌的白酒酿造过程环境因素,从中发现制约土味素生物合成的限制性环境因子。从而对白酒中土味素含量进行有针对性的,有效的控制。这对于丰富我国白酒酿造机理和传统产业的升级改造都将具有重要的理论和实践价值。
1 材料与方法
1.1 材料
链霉菌菌株(StreptomycesfradiaeHX,StreptomycesalbusFXJ,StreptomycesradiopugnansQC-1和StreptomycessampsoniiQC-2)均分离自白酒大曲,利用质谱分析菌种代谢产物,确定其为土味素生产菌株后保存其孢子于甘油管中。大曲样品均取自某清香型白酒厂,其制曲最高温度为40~48 ℃。
1.2 主要试剂及培养基
磷酸氢二钠,磷酸二氢钾,柠檬酸,均购于中国医药(集团)上海化学试剂公司。
马铃薯-葡萄糖培养基(液态培养基):10 g马铃薯煮熟,得500 mL液体。添加10 g葡萄糖。115 ℃灭菌20 min。
麸皮培养基(固态培养基):称取含水量为50%的麸皮,向其中添加20 g/kg的葡萄糖。115 ℃灭菌20 min。
将分离得到的产土味素菌株按照1011CFU/g的接种量分别接种于灭菌后的上述固态/液态培养基中,30 ℃下培养。其中,固态培养为培养箱中静置培养,液态培养基设置摇床转速为250 r/min。
1.3 生物量的测定
采用梯度稀释涂布法测定固态发酵培养基中的生物量。取10 g固态发酵培养物,向其中添加50 mL无菌生理盐水进行稀释,振荡充分后吸取液体并稀释到合适梯度,涂布于含马铃薯葡萄糖琼脂的培养基平板上。30 ℃倒置培养涂布后的平皿,待菌落形成后计数。单一稀释梯度重复3次,取其平均值。
采用烘干法[1]测定液态发酵培养基的生物量。取10 mL发酵液,8 000 r/min离心收集菌体。分别用5 mL无菌生理盐水洗涤2次。置于100~105 ℃烘箱内3 h,冷却30 min。再烘1 h至恒重。称量干燥后的菌体质量,计算单位体积发酵液中菌体干重。
1.4 水分含量的测定
采用烘干法[1]测定。在100~105 ℃烘箱里放入已称重量的待测样品,烘干3 h,于干燥皿冷却30 min,再烘1 h至恒重。称量烘干样品质量。计算样品烘干后失去水分的质量,除以样品烘干前质量得出结果为样品的含水量。
1.5 pH值的测定
固态麸皮培养物与酒醅pH值的测定:称取5 g固态麸皮培养物或酒醅,加入50 mL灭过菌的生理盐水,150 r/min振荡30 min,pH计测定。
液态培养基:取50 mL发酵液10 000 r/min离心10 min后弃沉淀。用pH计直接测上清液的pH值。
1.6 不同pH值缓冲液的配制
pH 3~7的缓冲液参照《工业微生物实验技术手册》中磷酸氢二钠-柠檬酸缓冲液配制方法配制。pH8~9的缓冲液参照该书磷酸氢二钠-磷酸二氢钾缓冲液配制方法配制。
1.7 耐酒精能力测定
向灭菌后的马铃薯葡萄糖琼脂中加入终体积分数为5%、10%、15%、20%的乙醇,在凝固后的平板中点接种产土味素链霉菌FXJ,HX,QC-1和QC-2。30 ℃培养箱倒置培养,每个测试样设3次重复。定时查看菌体生长情况。
1.8 土味素含量的测定
采用顶空固相微萃取技术(HS-SPME)结合气相色谱-质谱(GC-MS)方法对发酵产物中的挥发性物质进行分析[16]。固态麸皮培养物与酒醅土味素含量的测定:称取5 g固态麸皮培养物或酒醅,加入50 mL灭过菌的超纯水,冰浴超声30 min后,吸取8 mL到预先称有3 g NaCl的顶空瓶中,加入10 μL内标后进行HS-SPME-GC-MS的检测分析。液态培养基中土味素含量的测定:取10 mL发酵液于10 000 r/min离心10 min后,弃沉淀。吸取8 mL上清液到预先称有3 g NaCl的顶空瓶中,加入10 μL内标后进行HS-SPME-GC-MS的检测分析。
GC条件:色谱柱为 DB-Wax (30 m × 0.25 mm × 0.25 μm,Agilent)。进样口温度250 ℃,载气 He,流速 2 mL/min,检测器温度 250 ℃。程序升温:初始温度 50 ℃ 保持 2 min,以10 ℃/min 的速度升温至160 ℃,然后以5 ℃/min 的速度升温至230 ℃ 保持35 min,溶剂延迟5 min。
MS条件:EI电离源,电子能量70 eV,离子源温度230 ℃,扫描范围 33.00 ~ 500.00 amu。
2 结果与分析
2.1 产土味素链霉菌生长及土味素代谢规律
在白酒复合微生态系统中,不同微生物的生长有其独特的特征。微生物生长速率的快慢,直接影响该物种在微生态体系中分布权重与构造。如图1所示,在液体培养条件下,所考察的链霉菌从1.0~3.5 d开始有明显的增殖趋势,培养至4.0~4.5 d后达到生长稳定期。QC-2增殖速度最快,且在培养过程中最大菌体量可达19.8 g/L,是所筛链霉菌在相同培养条件下菌体生长量最高的。
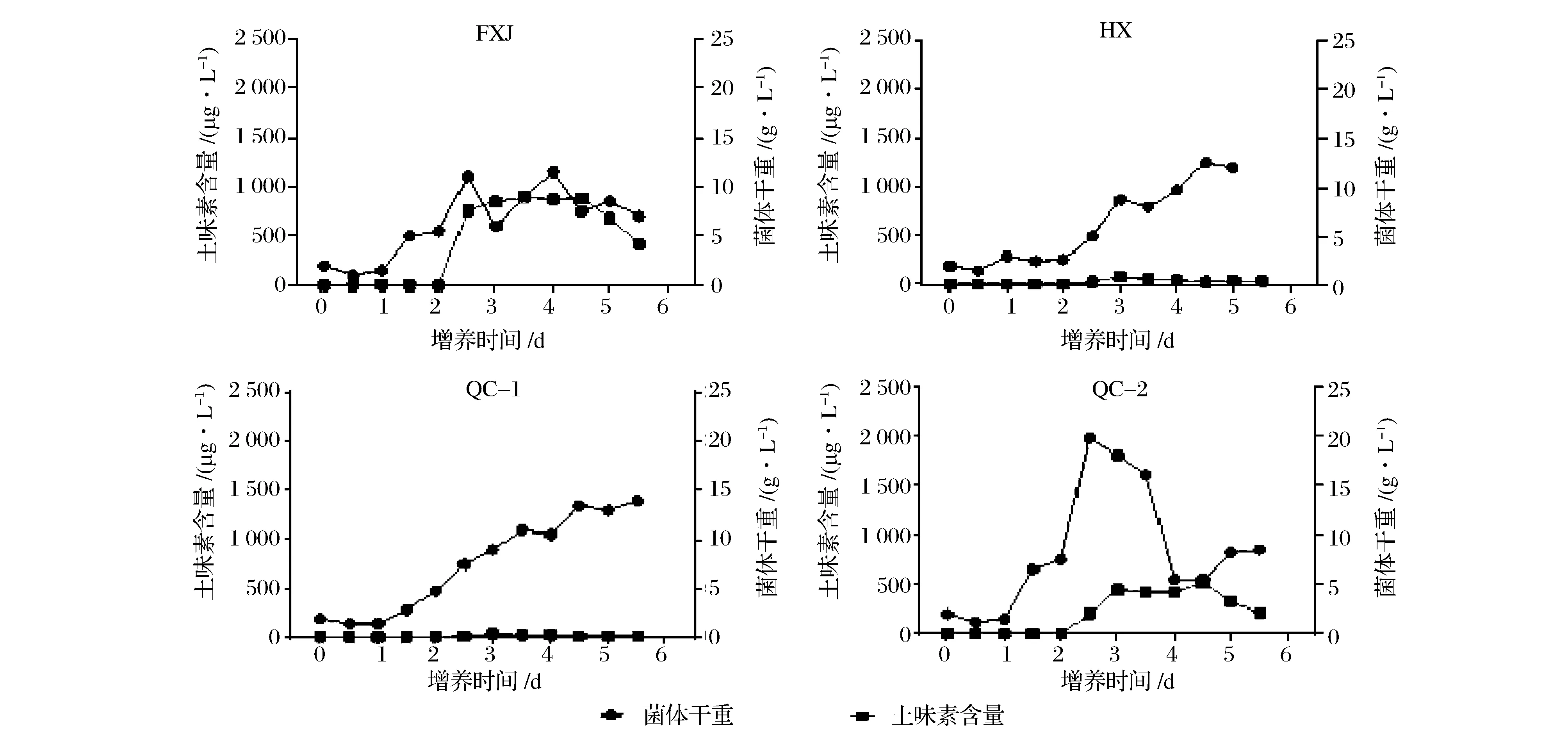
图1 土味素产量与链霉菌菌体生长关系Fig.1 Relationship between geosmin yield and cell growth of Streptomyces
同时,由图1可知,在液态发酵2.5~3.0 d时,各培养基中均开始出现土味素含量快速升高的现象,其中,FXJ与QC-2的变化最为明显。在发酵4.5 d后,该物质含量呈逐渐下降趋势。根据总体的观察现象可知,土味素的产生与菌体生长主要呈现正相关的关系。土味素检出的时间段要滞后于菌体的指数生长期。生长速率快的菌体,具有相对更高的最高土味素浓度数值。
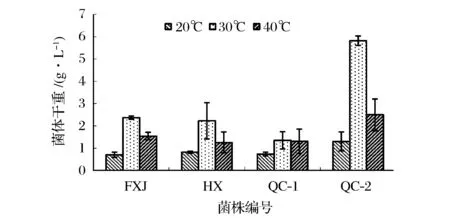
图2 四株产土味素菌株在不同温度下培养120 h菌体量比较Fig.2 Biomass comparisons of the four geosmin-producing strains incubated at different temperatures for 120 h
在20、30、40 ℃的温度条件下,利用这4株产土味素链霉菌于马铃薯-葡萄糖培养基中进行发酵试验。发酵120 h后,取10 mL发酵液,预处理后进行HS-SPME-GC-MS检测分析。将离心得到的细胞,用5mL生理盐水洗涤2遍,所得菌体120 ℃下烘至恒重,称量细胞干重。如图2所示,这4株链霉菌均在30 ℃培养条件下的菌体培养量最高。
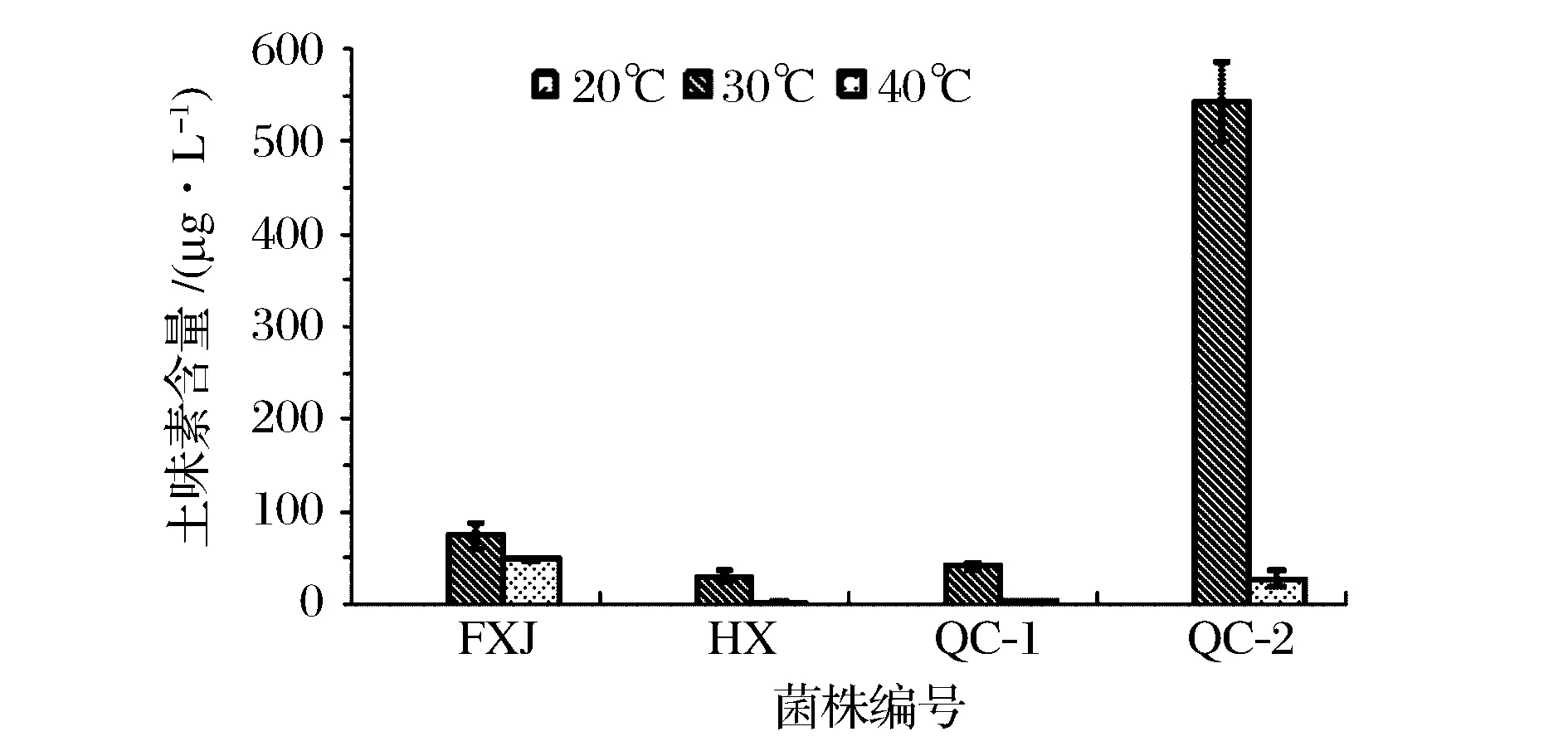
图3 四株菌不同温度培养120 h产土味素量比较Fig.3 Geosmin productions of four geosmin-producing strains incubated at different temperatures for 120 h
进一步考察这4株菌分别在20、30、40 ℃培养时土味素的产量。由图3可知,在30 ℃条件生长的菌体产生的土味素含量最高,约为在20 ℃时培养生长的1 000倍。由此可知,30 ℃为菌体生长并代谢土味素的最适温度,且温度对于菌体生长及代谢产物中土味素的含量有明显的影响。在20和40 ℃条件下培养,由于菌体生长受到抑制,土味素的代谢量也明显减少。值得注意的是,在30 ℃条件下生长的QC-2菌株产土味素能力与繁殖能力远强于其他菌株。
2.2 水分对产土味素链霉菌生长的影响
通过考察产土味素链霉菌生长繁殖对水分的要求,从而分析在制曲过程中容易污染产土味素链霉菌的原因。本研究配制初始含水量为30%、40%、50%、60%的固态培养基,进行实验考察。将4株产土味素链霉菌分别接种于上述不同初始含水量的培养基中,同时通过空气加湿装置保持培养箱中相对湿度为90%,于30 ℃恒温培养120 h,测定菌体生长情况。
结果如图4所示,相比含水量为30%组别的菌体生长情况,菌体在含水量为50%的固态麸皮培养基中增殖更为明显。由此说明,较低含水量的物料不利于链霉菌的生长,菌体生长受到抑制。

图4 产土味素链霉菌在不同含水量固态麸皮培养基中的生长情况Fig.4 Growth of geosmin-producing Streptomyces on solid-state bran cultures with different water contents
2.3 乙醇含量对产土味素链霉菌生长的影响
通过考察在固态基质中,乙醇含量对产土味素链霉菌的影响情况。以不含乙醇的培养基为对照,分别考察含有5%、10%、15%、20%乙醇的固态琼脂培养基中产土味素的4株链霉菌的生长情况。
由图5可知,与对照相组比较,在含5%乙醇的培养基中,4株链霉菌的生长受到了一定的抑制。在含10%以上的乙醇的培养基中,这些微生物的生长被完全抑制(含15%,20%乙醇的情况未列出)。这表明产酒率较高的酿造环境有利于抑制链霉菌的生长。

图5 乙醇体积分数对产土味素链霉菌生长抑制情况Fig.5 Growth inhibitions of geosmin-producing Streptomyces by different ethanol contents
2.4 pH对产土味素链霉菌生长及土味素代谢的影响
环境pH与微生物的生长代谢有着密切的关系。通过考察产土味素链霉菌在固、液态培养状态下对pH变化对其生长和代谢土味素的影响状况,以明确产土味素链霉菌在酿造环境中的适应能力。
为研究不同产土味素菌株生长繁殖最适的pH条件,分别考察了用缓冲溶液确定不同初始pH(pH 3、4、5、6、7、8、9)下菌体的生长情况。由图6可知,在酸性条件下,这些菌株生长较慢或不生长繁殖。在pH为7和8条件下,各菌株生长普遍较好。

图6 四株菌在不同初始pH培养基中生长情况Fig.6 Growth of four strains in media with different initial pH
随后又考察了发酵起始和结束时,各发酵液pH变化。由图7可知,在pH为3、4、5时,发酵前后pH变化不大。分析其原因为酸性条件(pH3~5)不适合4株菌的生长,所以代谢较为缓慢,产生的代谢产物较少,因而对发酵液pH的影响也较小。在中碱性条件下,尤其是pH为8、9时,发酵前后pH变化较大,且都为降低趋势,其中HX降幅最为明显。

图7 不同初始pH培养基中4株产土味素菌株发酵120 h后pH变化Fig.7 pH changes of media incubated with four geosmin-producing strains in 120 hours
利用磷酸氢二钠-柠檬酸缓冲液与利用磷酸氢二钠-磷酸二氢钾缓冲液分别配制pH为3、4、5、6、7、8、9的固态麸皮培养基。接入4株链霉菌后培养120 h,检测其中土味素含量。由图8可知,4株产土味素的菌株在液态培养基(图8A)和固态培养基(图8B)中,不同pH下产生土味素的浓度情况较为一致。除QC-1在pH为6的条件下产明显的土味素外,其他3株菌均在中碱性环境中产生较为明显的土味素。在pH为3、4、5的情况下,实验各批次几乎都没有土味素产生,pH较低的酿造环境有利于降低土味素的产生。

图8 固/液态培养4种菌株土味素含量比较(A,液态;B,固态)Fig.8 Comparison of geosmin contents produced by four strains incubated with different pH in liquid-state culture (A) and solid-state culture (B)
3 讨论
土味素的产出主要集中于各菌指数生长期的中后期到稳定期前期。相比菌体生长情况,土味素的大量检出要比菌体大量增殖平均滞后0.5~1.0 d。由此可知,土味素与所述链霉菌的生长存在一定相关性。土味素可作为这类微生物检测的标记物,并且土味素的含量可以一定程度地反映生物量的多少。
KOMATSU[14]的研究中也发现,大部分菌株发酵产出土味素的含量在5 d后达到最高,随后土味素的浓度会有所下降。但该文献并没有解释浓度降低的原因。GERBER[4]在其发表的文中也提到土味素的最大产量时期。POLLAK[12]等人研究了2.5L实验室生物反应器中StreptomycescitreusCBS 109.60的生长情况及土味素产生过程。与抗生素生产相比,在琼脂平板培养的放线菌土味素的产量往往与菌体的生长呈正相关。在液态培养情况下,Streptomycescitreus与线性生长阶段紧密相关。在最初的20 h内,胞内的土味素含量逐级升高。随后土味素开始通过细胞膜,进而在培养基中可以检测到土味素。胞外的土味素含量总是要高于胞内的含量。目前,还不清楚土味素的跨膜转运机制。但是,与浓度梯度相反的积累现象可以推论该转运机制属于主动运输。
白酒酿造过程中的微生物生物区系以中温菌为主,这类菌的生长温度在20~45 ℃。在此温度范围内,能够保证细胞内一系列生物化学反应,从而维持微生物的生命活动。在所考察温度条件下,所有菌株的最优生长温度均为30 ℃。在该温度条件下,菌体生长最快,产土味素的量也最高。而在20 ℃和40 ℃下培养,菌体的生长均受到抑制。由此可知产土味素链霉菌耐受的温度范围较窄。
水分不仅是组成微生物细胞的重要物质,而且是生命体中维持各种生化反应并完成正常代谢必需的物质。培养物中可以被微生物利用水分的多少直接关系到微生物的生长状态。在粮食贮存过程中通常将粮食的水含量控制在“安全水分”以下,抑制微生物的生长引起的霉变。谷物类粮食的“安全水分”约为14%[17]。在这种低水分含量的环境中,大部分的微生物是很难生长繁殖的。另一方面,在传统酿造过程中,通常通过控制物料中的水分含量来活化菌种,完成自然接种。我国白酒大曲采用自然接种的方式,其中主要的微生物来源之一就是小麦、豌豆和大麦等粮食原料中原有的微生物。这些微生物在粮食贮存时,由于水分含量较低,菌体处于休眠状态。制曲原料经过粉碎和加水,压制形成曲坯。冬季曲坯含水量控制在38%~40%,夏季曲坯含水量控制在39%~41%[1]。在此过程中制曲原料的碳源、氮源等营养物质被释放。从而,营造出适合微生物生长的环境。此时,附着在制曲原料中的微生物被活化,形成大曲微生态的“雏形”。我们前期的研究中发现,白酒中的土味素的形成主要是由于制曲过程中污染产土味素的链霉菌。如前所述曲坯的含水量通常控制在40%左右,此时的含水量比较适宜产土味素链霉菌的生长。而且,这类菌广泛地存在于大曲“自然接种”的环境中,这就可以解释在制曲过程中为何容易污染产土味素的链霉菌。同时,40%的含水量也适合白酒酿造过程中主要功能微生物的生长繁殖。因此,水分的控制不能作为避免白酒酿造过程中污染产土味素链霉菌的控制点。在含水量达到60%时,固态静置培养条件下氧气的传递受到限制,因此菌体生长同样也会受到抑制。
白酒酿造过程中,随着发酵时间的延长酒醅中的氧气逐渐被消耗,形成微氧环境和局部的厌氧环境。此时,主要的功能酿造微生物会不断产生并积累酒精,酵母菌逐渐成为酒醅中的主要微生物。正常的白酒发酵会在酿造后期产生明显带有乙醇香气的“醩香”。酒醅发酵到中后期,其中的乙醇体积分数可以达到10%。由此可知,在酒醅发酵过程中,产乙醇这一酿造环境因素可抑制产土味素的链霉菌生长。所以,在正常的白酒酒醅发酵过程中,产土味素的链霉菌是不能大量繁殖生长的。该结论也与之前的酒醅发酵研究结果相吻合,即酒醅发酵中后期土味素的含量几乎没有变化[6]。然而,由于白酒酿造为生料制曲,且在较为开放的体系中进行,因此在制曲过程中污染该类微生物的可能性较大。
pH不仅会影响微生物细胞膜上电荷的状态,引起细胞内外物质交换改变,而且还会影响到外界有机质的离子化程度,间接影响微生物对这些物质的吸收。虽然经长期进化,大多微生物能在较宽的pH范围内生长,但是不同微生物具有不同的最适生长pH。在最适的pH范围内,微生物的生长代谢最为活跃。本研究发现产土味素菌株合适在偏碱性的环境中生长。
在碱性条件下,产土味素菌株的生长、代谢较为活跃,其代谢产物影响了发酵液pH的变化。从而使自身的生长环境处于较适于自身生存的状态。POLLAK[12]等人研究了2.5 L实验室生物反应器中StreptomycescitreusCBS 109.60的生长情况及土味素产生过程。在培养过程中,废气中土味素的浓度是连续上升的。在最初的48 h内,pH缓缓降低(从7.5降到6),随后培养基的pH增长到最初的7.5。在培养基和尾气中检测到了甲基吡嗪(methylpyrazine),2,5-二甲基吡嗪(2,5-dimethylpyrazine),2,5-二甲基吡嗪(2,6-dimethylpyrazine)的含量分别为3、6、8 μg/L。吡嗪等碱性物质的产生会导致培养基pH值升高[18-19]。已有研究认为,吡嗪是链霉菌典型的挥发性代谢产物。GAINES和COLLINS[15]研究了S.odorifer的代谢产物,其中就有氨类物质。在我们的研究中也发现,在大曲中所筛选的4株链霉菌的挥发性代谢产物中均有不同种类和含量的吡嗪类物质产生,其中有四甲基吡嗪、2,5-二甲吡嗪、2,6-二甲吡嗪等。这些弱碱性物质的存在能够起到pH缓冲液的作用,使微生物所处的营养体系维持在适度偏碱的环境中。
张文学[20]等人研究了白酒酒醅的pH,发现发酵过程中酒醅的pH在3.2~4.2之间。酒醅中偏酸性的pH环境,能够抑制产土味素菌株的大量繁殖,从而避免土味素在白酒酿造过程的大量生成。因此,可以解释在酒醅中即使含有产土味素的链霉菌,也不会有大量土味素产生的现象。有研究表明,微生物细胞在受到外界环境的胁迫或刺激时,可以通过调节自身状态或启动合成并向细胞外释放某种“自卫”物质来抵御和应对外界环境的变化。例如,聂薇等人[21]发现高产谷胱甘肽的产阮假丝酵母(Candidautilis)在低pH环境中受到胁迫时,通过增加谷胱甘肽的合成并释放到外界中来抵御pH的变化。整个白酒的酿造是在偏酸性的环境下进行的,但是适于偏碱性的环境中生长的产土味素链霉菌在不同地域的酒厂中广泛存在。
综上所述,本文通过考察不同环境因子下产土味素链霉菌的生长及代谢情况,明确了该类链霉菌的生长繁殖特征。同时,通过本文研究结果可知,高酒精度与低pH等环境条件可抑制该类链霉菌的生长,从而降低土味素在白酒酿造环境中的出现概率。后续需以风味为导向,对白酒主体香气及其他常见异味的化学本质及其产生机制进行深入研究。综合各种重要风味产生机制,通过酿造环节优化,整体提升白酒品质和生产效率。
[1] 沈怡方, 白酒生产技术全书[M].北京: 中国轻工业出版社,1998: 4-615.
[2] DU H, FAN W, XU Y. Characterization of geosmin as source of earthy odor in different aroma type Chinese liquors[J]. Journal of Agricultural and Food Chemistry, 2011, 59(15):8 331-8 337.
[3] 封明振, 王贤张国杰. 浓香型酒酸味、辣味、涩味浅析[J]. 酿酒科技, 2000(1):30-31.
[4] GERBER N N, LECHEVALIER H A. Geosmin, an earthy-smelling substance isolated from actinomycetes[J]. Applied Microbiology, 1965, 13(6):935-938.
[5] LU G P, FELLMAN J K, EDWARDS C G, et al. Quantitative determination of geosmin in red beets (BetavulgarisL.) using headspace solid-phase microextraction [J]. Journal of Agricultural and Food Chemistry, 2003, 51(4):1 021-1 025.
[6] DU H, XU Y. Determination of the microbial origin of geosmin in chinese liquor[J]. Journal of Agricultural and Food Chemistry, 2012, 60(9):2 288-2 292.
[7] DICKSCHAT J S, BODE H B, MAHMUD T, et al. A novel type of geosmin biosynthesis in Myxobacteria[J]. Journal of Organic Chemistry, 2005, 70(13):5 174-5 182.
[8] 武敬松, 刘恒兆. 白酒不良口味的成因及解决措施 [J]. 酿酒科技, 2006((2):109.
[9] 李家明, 饶家权. 白酒中异杂味的形成及解除途径 [J]. 酿酒科技, 1992(6):12-14.
[10] BLAHA L, SABATER S, BABICA P, et al. Geosmin occurrence in riverine cyanobacterial mats: Is it causing a significant health hazard? [J]. Water Science and Technology, 2004, 49(9):307-312.
[11] TUCKER C S. Off-flavor problems in aquaculture [J]. Reviews in Fisheries Science, 2000, 8(1):45-88.
[12] POLLAK F, BERGER R. Geosmin and related volatiles in bioreactor-culturedStreptomycescitreuscbs 109.60 [J]. Applied and Environmental Microbiology, 1996, 62(4):1 295-1 299.
[13] REZANKA T, PRELL ASIGLER K. Identification of odorous compounds from nine fermentor-cultivatedStreptomycesstrains [J]. Folia Microbiologica, 2008, 53(4): 315-318.
[14] KOMATSU M, TSUDA M, OMURA S, et al. Identification and functional analysis of genes controlling biosynthesis of 2-methylisoborneol [J]. Proceeding of the National Academy of Science,2008, 105:7 422-7 427.
[15] GAINES. Volatile substances produced byStreptomycesodorifer[J]. Lloydia, 1963, 26:247-253.
[16] DU H, XU Y. Determination of the microbial origin of geosmin in chinese liquor [J]. Journal of Agricultural and Food Chemistry, 2012, 60(9):2 288-2 292.
[17] 李兴军, 张元娣, 王双林,等. 谷物安全水分估算[J]. 粮食加工, 2011, 36(3):41-45.
[18] ZHU B F, XU Y. A feeding strategy for tetramethylpyrazine production byBacillussubtilisbased on the stimulating effect of ammonium phosphate [J]. Bioprocess and Biosystems Engineering, 2010, 33(8):953-959.
[19] ZHU B F, XU Y. Production of tetramethylpyrazine by batch culture ofBacillussubtiliswith optimal pH control strategy [J]. Journal of Industrial Microbiology & Biotechnology, 2010, 37(8): 815-821.
[20] 张文学, 岳元媛, 向文良. 浓香型白酒酒醅中化学物质的变化及其规律性 [J]. 四川大学学报, 2005, 37(4): 44-48.
[21] 聂薇, 卫功元, 李寅,等. 利用低pH胁迫作用促进产朊假丝酵母生产谷胱甘肽 [J]. 化工学报, 2005(9): 1 750-1 756.
Theinfluencesoftheenvironmentalfactorsonthegrowthandmetabolismofgeosmin-producingStreptomycesintheliquor-makingprocess
DU Hai1,DU Xiao-wei2,ZHAO Jing-long2,ZHANG Xin2,XU Yan1*
1 (Key Laboratory of Industrial Biotechnology, Ministry of Education, School of Biotechnology, Jiangnan University,Center for Brewing Science and Enzyme Technology, Wuxi 214122, China)2 (Shanxi Xinghuacun Fen Liquor Technology Center, Fenyang 032205, China)
Geosmin-producingStreptomycesmay cause the imbalance ofmicrobial flora seriously deterioratthe liquor aroma.The aim of this study is to identify the key factors restricting geosmin production in the liquor-making process.The influence of the main liquor-makingvariables(temperature, water content, ethanol content, pH)on the growth and metabolism of geosmin-producingStreptomyceswere investigated.The results showedthat the yield of geosmin was positivelyrelated with the biomass and growth rate of theStreptomycescells.The most suitable temperature for thegrowth ofStreptomyceswas 30℃, andthe optimum water content was 50%. The growth of geosmin-producingStreptomycesiscompletely inhibited at the alcohol content of over 10% vol. Moreover,Streptomycescangrow rapidly in the neutral and alkalescent (pH7-8) environment, whileit is severelyinhibited in the acidic environment(pH3-5) reduce geosmin production. The above discoveries provide reliable theory to control the earthy off-flavor in Chinese liquor.
geosmin;Streptomyces; environmental factor; Chinese liquor
10.13995/j.cnki.11-1802/ts.014929
博士,讲师(徐岩教授为通讯作者,E-mail: yxu@jiangnan.edu.cn)。
国家自然科学基金项目(31501469, 31530055);江苏省自然科学基金项目(BK20150143);中央高校基本科研基金(JUSRP11537);中国白酒“3C”计划
2017-06-10,改回日期:2017-07-07

