NADH氧化途径迁移促进丁酸梭状芽孢杆菌的生长
夏会丽,陈思思,陈雄,黄亚男,谢婷,李爱玲,王志*
1(发酵工程教育部重点实验室,湖北省工业发酵协同创新中心,湖北省工业微生物重点实验室,湖北工业大学,湖北 武汉,430068)2(河南省南街村(集团)有限公司,河南 临颍,462600)3(天方药业股份有限公司,河南 驻马店,463000)
NADH氧化途径迁移促进丁酸梭状芽孢杆菌的生长
夏会丽1,陈思思1,陈雄1,黄亚男2,谢婷3,李爱玲3,王志1*
1(发酵工程教育部重点实验室,湖北省工业发酵协同创新中心,湖北省工业微生物重点实验室,湖北工业大学,湖北 武汉,430068)2(河南省南街村(集团)有限公司,河南 临颍,462600)3(天方药业股份有限公司,河南 驻马店,463000)
为提高丁酸梭菌的发酵生物量,首先在厌氧瓶水平确定了0 h添加0.2 mmol/L乙醛可以有效提高细胞数,后在10 L发酵罐规模研究了葡萄糖和乙醛共补料策略对丁酸梭菌发酵性能的影响。结果表明:采用葡萄糖和乙醛共补料能获得较高的生物量(11.37×108CFU/mL),相对于葡萄糖补料发酵(9.93×108CFU/mL)和批发酵(9.39×108CFU/mL)分别提高了14.5%和21.1%。发酵8 h时,丁酸和乙酸的比生成速率相对于葡萄糖补料发酵分别降低18.9%和17.3%,而乙醇的比生成速率却提高了9.7%,实现了高生物量和低产酸的相对统一。乙醛的添加使NADH的氧化由丁酸合成途径部分向乙醇合成支路迁移,增强了乙醇的合成效率,降低丁酸、乙酸的积累,提高了丁酸梭菌的生长效率。
丁酸梭菌;生物量;NADH的氧化;乙醛
丁酸梭状芽孢杆菌(Clostridiumbutyricum)主要存在于干酪、动物的肠道与粪便、土壤等自然环境中[1-2],是直或弯曲的革兰氏阳性厌氧内生芽孢杆菌。菌落白色或奶油色,呈煎蛋样,中间隆起,菌体中常有圆形或卵圆形芽孢,无孢子外壁和附属丝,形成芽孢后中部膨大呈梭状或纺锤状使菌体偏末端部膨大呈梭状,单个或成对,短链,偶见丝状菌体,周生鞭毛,具有运动性[3-4]。
丁酸梭菌经糖酵解途径发酵葡萄糖产生丙酮酸、NADH和ATP。乙酰CoA在系列酶的作用下生成丁酸伴随NADH的氧化和ATP的生成,丁酸、NADH的氧化和ATP的摩尔关系是1∶2∶1。乙酰CoA在乙醛脱氢酶和乙醇脱氢酶的作用下经乙醛生成乙醇,伴随着NADH的氧化,乙醇和NADH的氧化的摩尔关系是1∶2,但是该方向的碳通量往往不是很大[6]。
发酵过程中随细菌快速增长而大量积累的有机酸会对细胞产生酸胁迫效应[7-9],细菌应激响应策略之一是代谢由酸生成向有机分子(如乙醇、丙二醇、1,3-丁二醇等)合成迁移。乙醛是酵母等微生物厌氧发酵过程中常见的特征性分子[10],乙醛还原为乙醇的过程中能通过NAD+的再生促进NADH/NAD+的平衡而刺激酵母生长[11]。但是,由于丁酸梭菌经乙醛生成乙醇的碳通量不是很大[6],能否通过强化该途径以竞争性降低乙酸、丁酸的合成效率来缓解酸胁迫还未见报道。
为提高丁酸梭菌的生物量及生长效率,本研究首先在厌氧瓶水平优化了乙醛的添加浓度,确定了乙醛的促生长功能。在此基础上重点研究了10 L发酵罐水平丁酸梭菌批培养、碳源补料发酵和碳源乙醛共补料发酵的生长、酸醇代谢差异,为该菌株的工业化生产提供理论依据和技术指导。
1 材料与方法
1.1 材料与试剂
丁酸梭状芽孢杆菌HBUT-01(ClostridiumbutyricumHBUT-01),为本实验室从河畔污泥中分离得到的菌株,菌落为奶油色的规则圆形菌落,生长过程中有H2产生,细胞中间膨胀,呈梭形,一端有淀粉粒积累,现保藏于中国典型培养物保藏中心(CCTCC M 2016628)[12]。
种子培养基(g/L):葡萄糖8.0,胰蛋白胨10.0,牛肉膏10.0,酵母粉3.0,琼脂20,pH 7.2,115 ℃灭菌20 min。
发酵培养基(g/L):葡萄糖16.1,蛋白胨25.0,酵母粉7.0,K2HPO40.5,MgSO4·7H2O 0.8,MnSO4·H2O 0.02,p H 7.2,115 ℃灭菌20 min。
酵母粉:安琪酵母股份有限公司;甲酸:天津市光复精细化工研究所;蛋白胨:山东青岛悦康生物技术有限公司;其他试剂均来自国药集团化学试剂有限公司。
1.2 仪器与设备
DELTA 320 pH计,梅特勒托利多仪器有限公司;立式压力蒸汽灭菌器,上海博迅实业有限公司医疗设备厂;CJ-2D型无菌操作台,天津市泰斯特仪器有限公司;SGJ-10 L/C发酵罐,上海联环生物工程设备有限公司;TG18M台式高速离心机,长沙平凡仪器仪表有限公司;HNY-211B全温振荡培养箱,天津欧诺仪器仪表有限公司; UVmini-1240紫外可见分光光度计,岛津制作所;蠕动泵,保定兰格恒流泵有限公司;高效气相色谱,安捷伦公司。
1.3 实验方法
1.3.1培养方法
斜面种子活化方法:将保藏在-20 ℃中的丁酸梭菌的厌氧甘油管在氮气保护下,用接种环接种到厌氧管斜面,恒温培养箱中37 ℃培养12 h。
厌氧瓶种子培养方法:培养好的斜面,在氮气保护下加无菌、无氧的生理盐水3 mL洗菌苔,倒入无菌无氧的空三角瓶中,摇晃均匀,取0.6 mL菌悬液于种子培养基(厌氧瓶120 mL,装液量30 mL),于37 ℃、100 r/min的摇床内培养12 h。
厌氧瓶发酵培养方法:装液体量30 mL,初始pH 7.2,115 ℃高压灭菌20 min,以2%的接种量转接厌氧瓶种子菌液,37 ℃,100 r/min的摇床内培养9~12 h。
10 L罐培养方法:发酵培养基基料5 L,接种量2.5%(v/v),转速100 r/min,接种前、后通氮气(流量0.1 vvm)各1 h,后密闭培养。37 ℃培养约12 h左右。用10 mol/L的NH3·H2O控制pH在6.0左右。
10 L罐葡萄糖补料发酵方法:补料瓶中装8%葡萄糖溶液600 mL,115 ℃高压灭菌20 min,5~10 h流加8%葡萄糖溶液,控制流加速率使葡萄糖维持在3.0 g/L左右。pH控制同上。
10 L罐葡萄糖和乙醛的共补料发酵方法:灭过菌的8%葡萄糖溶液中加40%乙醛溶液(0.22 μm滤膜过滤)0.16 mL,流加方法同上。pH控制同上。
1.3.2 菌体干重测定
取8 mL发酵液于离心管中,6 000 r/min离心5 min后弃上清。将收集到的菌体用5 mL蒸馏水重悬菌体,离心并重复洗涤2次。然后将菌体105 ℃烘干至恒质量,称质量计算细胞干重[13]。
1.3.3 细胞数的测定
使用Hungate滚管计数法进行计数[14]。
1.3.4 丁酸、乙酸的测定
采用气相色谱法测定:安捷伦7890B GC,FID检测器,HP-INNOWax毛细管柱柱长30 m,内径0.53 mm,膜厚1 μm;程序升温条件:40 ℃保留5 min,后以20 ℃/min升到120 ℃,再以10 ℃/min 升到220 ℃,220 ℃ 保留3 min。流速 5 mL/min,进样口温度250 ℃,检测器280 ℃[15]。
1.3.5 葡萄糖测定
葡萄糖含量测定采用3,5-二硝基水杨酸法[16]。
1.3.6 乙醇浓度的测定
使用SBA-40C生物传感器测定乙醇浓度。
2 结果与分析
2.1 不同乙醛添加量对丁酸梭菌生物量的影响
发酵过程代谢由小分子有机酸向醇分子合成迁移是细菌和酵母等微生物缓解酸胁迫效应的应激响应策略之一。由于丁酸梭菌经乙醛生成乙醇的碳通量不是很大[6],能否通过强化该途径降低乙酸、丁酸的合成效率来缓解酸胁迫?因此,考察了不同乙醛添加量对丁酸梭菌生长的影响,如图1所示。

图1 乙醛的添加对生物量的影响Fig.1 Effect of acetaldehyde addition on the biomass
乙醛的添加量对丁酸梭菌细胞数的影响成峰型分布,以0.2 mmol/L的添加量生物量最高,达到9.31×108CFU/mL,比对照组(7.35×108CFU/mL)提高26.7%,比0.1 mmol/L和0.3 mmol/L的添加量分别提高1.3%和20.1%。考虑到丁酸梭菌在厌氧瓶和10 L发酵罐规模的代谢差异以及在10 L发酵罐规模生物量的提高,0.1 mmol/L可能不能满足菌体的需要,因此确定乙醛的最佳添加浓度为0.2 mmol/L。
2.2 厌氧瓶中添加0.2 mmol/L乙醛对丁酸梭菌生长和代谢的影响
厌氧瓶发酵,0 h添加0.2 mmol/L的乙醛(实验组),其对丁酸梭菌生长和主要代谢的影响如图2所示。

图2 添加0.2 mmol/L乙醛对丁酸梭菌生物量、丁酸、乙酸和乙醇的影响(实心标识为对照组、空心标识为实验组)Fig.2 Effect of acetaldehyde addition at 0 h on biomass, butycate, acetic and ethanol of Clostridium butyricum (Filled symbols are the experimental, open symbols are the control)
发酵过程中细胞数比对照组提高10%~15%。另外,发酵过程中丁酸、乙酸质量浓度都持续增加,发酵结束时实验组丁酸、乙酸质量浓度分别为2.55 g/L和0.73 g/L,比对照组的3.25 g/L和0.87 g/L分别降低21.5%和16.4%。但是,发酵结束时实验组乙醇质量浓度为0.24 g/L,比对照组提高20%,说明乙醛的添加确实促进了乙醇的生成,降低丁酸、乙酸的合成,提高了丁酸梭菌的生长效率。
2.3 10 L发酵罐分批培养丁酸梭菌的生长与产酸特性
在10 L发酵罐中发酵培养丁酸梭菌,菌体生长和主要代谢变化如图3所示。

图3 丁酸梭菌在10 L发酵罐中的生长与产酸醇过程Fig.3 Time course of cell growth as well as acids and ethanol production in batch culture by Clostridium butyricum
经过短暂的延迟期,细胞对数生长至8 h(峰值,9.39×108CFU/mL)后开始自溶,10 h为7.85×108CFU/mL,比峰值下降16.4%。有趣的是,丁酸浓度与细胞数的变化几乎一致,菌体的生长和丁酸浓度存在明显的相关性,并有很好的线性相关性(以丁酸浓度为横坐标,对应时间点的细胞数为纵坐标得到一线性方程:y=0.356 8x-0.587,R2=0.971 7)。2~8 h丁酸质量浓度持续增加至2.98 g/L,之后逐渐降低。乙酸的积累相对较少,8 h乙酸质量浓度(峰值)为0.5 g/L。发酵至10 h时,丁酸浓度是乙酸浓度的6.32倍(表1),这也说明,丁酸梭菌以丁酸发酵为碳代谢主流。2~8 h细胞对数生长的同时葡萄糖快速消耗,平均消耗速率为2.56 mg/(g·h),8 h发酵液中葡萄糖质量浓度仅为0.88 g/L。由于葡萄糖等碳源的不足使菌体的抗逆性变差,8 h后细胞开始自溶,这为后期的研究提供了重要的补料窗口信息。
2.4 流加葡萄糖对HBUT-01生长和代谢的影响
在10 L发酵罐中发酵培养丁酸梭菌,5~10 h流加8%葡萄糖溶液(600 mL),控制流加速率使葡萄糖维持在3.0 g/L左右(优化后的残糖浓度,资料未显示),菌体生长和主要代谢变化如图4所示。

图4 流加葡萄糖对丁酸梭菌生长和代谢的影响(虚线表示补料的结束和开始)Fig.4 Effects of the feed with glucose on biomass and metabolism of Clostridium butyricum (The vertical dotted lines indicate the start and the end of fed-batch)
经过2 h的延迟期,细胞对数生长至8 h细胞数最大(9.93×108CFU/mL),比批发酵对照提高6%。由于葡萄糖的流加,整个发酵周期中丁酸和乙酸质量浓度都持续增加。对数末期(8 h,以下同)丁酸质量浓度及其比生成速率分别为3.09 g/L(比对照批发酵提高4%)和74 mg/(g·h)(比对照批发酵仅降低1.33%),乙酸质量浓度和比生成速率分别为0.36 g/L、8.67 mg/(g·h)。
另外,补料结束时,流加葡萄糖批发酵的乙醇质量浓度为0.26 g/L,和对照批发酵相当。丁酸质量浓度是乙酸的8.02倍(表1),比对照批发酵高26.9%,说明流加葡萄糖增强了EMP途径碳通量,增加的NADH优先通过合成丁酸来生成NAD+,保证NADH/ NAD+的平衡,维持代谢过程的正常进行,而且碳流经乙醇合成途径氧化NADH不占优势[17]。流加葡萄糖生成乙醇的浓度并没有增加,再次验证了乙酰辅酶A到乙醇的碳通量不是很大的报道[6]。

表1 菌株HBUT-01在不同发酵条件下的酸醇比生成速率(实验数据为3个样品的平均值±标准偏差)Table 1 Specific production rate of acids, ethanol in different fed-batch culture condition of HBUT-01(Data are means±S.D., n=3)
注:相同的字母表示差异不显著(p<0.05)。
2.5 流加葡萄糖和乙醛对丁酸梭菌生长和代谢的影响
在上述分批补料条件下,8%的葡萄糖补料溶液中添加0.16 mL浓度40%的乙醛(罐内终浓度为0.2 mmol/L),控制相同的流加速率,菌体生长和主要代谢变化如图5所示。
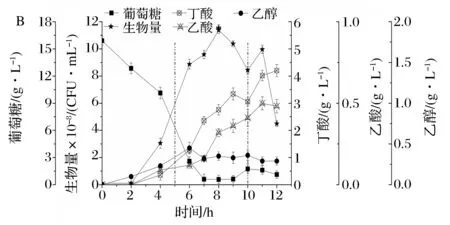
图5 流加葡萄糖和乙醛共补粒对丁酸梭菌生长和代谢的影响(虚线表示补粒的结束和开始)Fig.5 Effects of the co-feed with glucose and acetaldehyde on biomass and metabolish of Clostridium butyricum(The vertical dotted lines indicate the start and the end of fed-batch)
2~8 h细胞快速生长达到峰值(11.37×108CFU/mL),比葡萄糖补料发酵提高14.5%,比批发酵提高21.1%。葡萄糖和乙醛共补料的整个发酵过程中,丁酸和乙酸的合成效率均降低。8 h丁酸质量浓度(2.76 g/L)和其比生成速率比葡萄糖补料发酵分别降低10.7%、18.9%,见表1;乙酸质量浓度(0.33 g/L)和其比生成速率比只补葡萄糖的对照组分别降低11.6%、17.3%。
另外,葡萄糖和乙醛共补料,乙醇的合成增强。对数末期乙醇质量浓度(0.35 g/L)和比生成速率比只葡萄糖补料发酵分别提高20.7%和10%。补料结束时乙醇质量浓度(0.36 g/L)和比生成速率分别比只补葡萄糖的对照组(0.26 g/L、7.47 mg/(g·h))提高38.5%和3.1%。
由于丁酸梭菌以丁酸发酵为主,以补料结束时生成的丁酸和乙醇的摩尔质量和葡萄糖补料发酵相比,进行概算,发现:添加乙醛分子后乙醇的生成量增加2.2 mmol/L,由于1 mol乙酰CoA生成乙醇需要氧化2 mol的NADH,因此,由此途径氧化的NADH增加4.4 mmol/L。另一方面丁酸减少5.34 mmol/L,由于1 mol乙酰CoA生成丁酸需要氧化2 mol的NADH,因此,由此途径氧化的NADH减少10.68 mmol/L。说明:经丁酸合成途径氧化的NADH有41.2%向乙醇支路迁移,增强了乙醇合成、减少了丁酸生成;有2 mmol/L的乙醇的碳架是由乙酰CoA节点流入,乙醛分子作为代谢调控因子起到了调控糖代谢流的作用;丁酸梭菌碳代谢中NADH的氧化还有乳酸和氢气的生成途径等,减少的约有58.8%的经丁酸合成途径氧化的NADH也可能进入了这些途径。
3 结论
本实验在10 L发酵罐水平考察了葡萄糖和乙醛共补料策略对丁酸梭菌发酵生长的影响,获得了一种有效的流加发酵策略,即5~10 h同时流加葡萄糖和乙醛溶液,生物量达到了11.37×108CFU/mL,并且发酵液中丁酸和乙酸浓度降低,使得原来经丁酸合成途径氧化的NADH有41.2%向乙醇支路迁移,强化了乙醇途径,有效缓解了酸胁迫,促进丁酸梭菌的生长,成功实现了高生物量和低有机酸产量的相对统一。并且发现乙醇生成途径不是丁酸梭菌NADH氧化的主要通路,但是该途径可以通过外源乙醛分子的添加得到强化,乙醛还原酶可能是该途径的代谢瓶颈。本研究获得的流加策略对丁酸梭菌工业化生产具有一定的指导意义。
[1] 张善亭,史燕,张淑丽,等.丁酸梭菌的研究应用进展[J].生物技术通报,2013,9:27-33.
[2] BENNO Y,SAWADA K,MITSUOKA T.The intestinal microflora of infants: composition of fecal flora in breast-fed and bottle-fed infants[J]. Microbiology and Immunology,1984,28(9):975-986.
[3] 赵建新,张灏,田丰伟.丁酸菌的分离, 鉴定及筛选[J].无锡轻工大学学报,2002, 21(6):597-601.
[4] 冉雪松,王振华,潘康成.丁酸梭状芽袍杆菌的研究进展[J].安徽农学通报,2007,13(4):37-39.
[5] 黄振兴.厌氧菌群发酵制氢的定向强化及其机制解析[D].无锡:江南大学,2013.
[6] CAI G,JIN B,SAINT C,et al.Genetic manipulation of butyrate formation pathways inClostridiumbutyricum[J].Journal of Biotechnology,2011,155(3):269-274.
[7] SZYMANOWSKA-POWAOWSKA D,KUBIAK P. Effect of 1,3-propanediol, organic acids, and ethanol on growth and metabolism ofClostridiumbutyricumDSP1[J].Applied Microbiology and Biotechnology,2015,99(7):3 179-3 189.
[8] TORRES S,PANDEY A,CASTRO GR.Organic solvent adaptation of Gram positive bacteria: Applications and biotechnological potentials[J].Biotechnol Adv,2011,29:442-452.
[9] 吕春微,李霜,徐晴.工业微生物的酸胁迫响应及其抵御策略[J].中国生物工程杂志,2014,34(3):132-137.
[10] STANLEY G A,HOBLEY T J,PAMMENT N B.Effect of acetaldehyde onSaccharomycescerevisiaeandZymomonasmobilissubjected to environmental shocks[J]. Biotechnology & Bioengineering, 1997,53(1):71-78.
[11] 魏运平节,赵光鳌.葡萄酒酿造中乙醛的形成及其重要作用[J].酿酒科技,2003(2):77-78.
[12] 夏会丽,陈思思,陈雄,等.丁酸梭菌的鉴定与培养基优化[J].食品科学,2017, 38(8):56-62.
[13] 史泽旭,朱莉,高敏杰,等.优化碳源及Na2SeO3补料策略强化发酵生产富硒酵母[J].食品与发酵工业,2016, 42(7):48-52.
[14] 周德庆.微生物学教程[M].北京:高等教育出版社,1993:166-170.
[15] WANG Z,WANG Y,XIE F,et al.Improvement of acetoin reductase activity enhances bacitracin production byBacilluslicheniformis[J].Process Biochemistry,2014,49(12):2 039-2 043.
[16] HAYASHIDA Y,NISHIMURA K,SLAUGHTER J C.The importance of the furanones HDMF and HEMF in the flavour profile of Japanese barley miso and their production during fermentation[J].Journal of the Science of Food & Agriculture,1998,78(1):88-94.
[17] 王少华.丙酮丁醇梭菌发酵酸败机制及氧化还原电位调控研究[D].北京:中国科学院研究生院,2011.
NADHoxidationtransferpromotesthegrowthofClostridiumbutyricum
XIA Hui-li1, CHEN Si-si1, CHEN Xiong1, HUANG Ya-nan2,XIE Ting3, LI Ai-ling3, WANG Zhi1*
1(Key Laboratory of Engineering (Ministry of Education), Hubei Collaborative Innovation Center for Industrial Fermentation, Hubei Key Laboratory of Industrial Microbiology, Hubei University of Technology, Wuhan 430068,China)2(Nanjiecun (Group) Co. Ltd., Linying 462600, China) 3(Topfond Pharmaceutical Co. Ltd., Zhumadian 463000, China)
In order to improve the biomass ofClostridiumbutyricum, acetaldehyde addition with an optimized concentration of 0.2 mmol/L at 0 h was first ensured at the anaerobic bottles level, which can significantly increase the biomass, and then, the effects of glucose co-feeding with acetaldehyde strategies on the fermentation characteristics ofClostridiumbutyricumin a 10 L bioreactor were investigated. The results showed that glucose co-feeding with acetaldehyde enhanced the cell growth (11.37×108CFU/mL), which was 14.5% and 21.1% higher than those of glucose fed-batch culture (9.93×108CFU/mL) and the batch culture (9.39×108CFU/mL). Furthermore, the specific productivity of butyrate and acetic decreased by 18.9% and 17.3%, and the specific productivity of ethanol was increased by 9.7% glucose fed-batch culture, achieving the unity between a higher biomass and a lower acid production simultaneously. The addition of acetaldehyde promoted the NADH oxidation from butyrate biosynthesis pathway to the ethanol biosynthesis branch, which enhanced the ethanol synthesis with the reduced accumulation of butyrate and acetate, and the cell growth efficiency ofClostridiumbutyricumwas improved simultaneously.
Clostridiumbutyricum; biomass; NADH oxidation; acetaldehyde
10.13995/j.cnki.11-1802/ts.014394
硕士研究生(王志副教授为通讯作者,E-mail: 476462848@qq.com)。
湖北省自然科学基金(2014CFB604)
2017-03-27,改回日期:2017-05-08

