miR-221/miR-222家族在神经胶质瘤患者脑脊液中的表达及其诊断价值
张青,仇诚,夏东彦,李英斌
·神经生物学研究·
miR-221/miR-222家族在神经胶质瘤患者脑脊液中的表达及其诊断价值
张青,仇诚,夏东彦,李英斌
目的探讨miR-221/miR-222在胶质瘤患者脑脊液中的表达及其诊断价值。方法采用实时荧光定量PCR检测31例胶质瘤患者和33例非胶质瘤患者的脑脊液miR-221/miR-222表达水平,并采用ROC曲线评价其诊断胶质瘤的价值。结果miR-221和miR-222在胶质瘤患者脑脊液中的表达水平均明显高于对照组(均P<0.001)。高级别胶质瘤患者的脑脊液miR-221、miR-222表达水平高于低级别组,其中miR-222表达水平的差异具有统计学意义(1.49倍,P=0.007)。脑脊液miR-221、miR-222的表达水平都能将胶质瘤患者与对照者区分开;而二者联合诊断胶质瘤的曲线下面积(AUC)为0.849,灵敏度为81.8%,特异度为83.9%。结论脑脊液中高表达的miR-221/miR-222有可能作为胶质瘤诊断的生物标志物。
胶质瘤;脑脊液;miR-221/miR-222;诊断
神经胶质瘤是起源于神经胶质细胞的肿瘤,是中枢神经系统原发恶性肿瘤中最常见的一种类型,约占全部颅内肿瘤的40%~50%[1-2]。胶质瘤细胞在脑组织中呈弥漫、浸润性生长,且随着肿瘤级别的增加而侵袭性增强。由于肿瘤组织与正常脑组织分界不清,常规手术难以彻底切除肿瘤;且胶质瘤对放化疗均不敏感,使得胶质瘤患者的预后很差,中位生存期只有14个月;大部分脑胶质瘤患者在诊断后的两年内死亡[3]。早期诊断,并对胶质瘤患者进行早期干预,能提高患者的生存期和生存质量。目前临床上主要通过影像学检查对胶质瘤进行术前诊断,并通过病理检查进行确诊。但是影像学检查诊断胶质瘤的特异性和敏感性并不十分理想[4]。目前还未发现外周血或者脑脊液中有较为理想的,用于辅助诊断胶质瘤的生物标志物。
MicroRNA(miRNA)是一类长度约为22个核苷酸的小非编码RNA分子,可与靶基因的3’UTR进行特异性结合从而对靶基因进行调控,进而广泛参与机体的正常生理及病理过程[5]。有许多研究表明,miRNA在肿瘤的发生、进展、诊断及预后和治疗中起重要的基因调控作用[6-8]。近年来大量研究发现,miRNA可以稳定存在于血液、尿液和脑脊液等体液中,且可以作为众多肿瘤潜在的无创性诊断标志物[9-11]。多个研究显示,miR-221/miR-222在胶质瘤组织、细胞系及血液中呈高表达,并具有癌基因的作用[12-14]。目前还很少有关于miR-221/miR-222家族在胶质瘤患者的脑脊液中表达水平的报道;只有1篇研究报道miR-221在神经胶质瘤患者的脑脊液中呈高表达,但并未分析其潜在的诊断价值[15]。本研究通过检测31例神经胶质瘤患者和33例对照者的脑脊液miR-221/miR-222表达水平,并进行分析比较;以探讨miR-221/miR-222在胶质瘤患者脑脊液中的表达,以及其作为诊断胶质瘤的生物标志物的价值。
1 资料与方法
1.1 资料 (1)胶质瘤组:系南京医科大学第二附属医院神经外科于2013年1月~2017年2月收治的经病理学检查确诊的31例神经胶质瘤患者,男性18例,女性13例,年龄17~76岁,平均年龄(50.8±13.9)岁;术前均未进行放化疗治疗;根据世界卫生组织(WHO)的分级标准,低级别胶质瘤14例(WHO Ⅰ级5例,Ⅱ级9例),高级别胶质瘤17例(WHO Ⅲ级11例,Ⅳ级6例)。(2)对照组:为同期在我科行腰穿脑脊液常检查结果正常,且无肿瘤、肝肾功能异常、中枢神经系统感染或全身感染的33例患者,男性17例,女性16例,年龄25~75岁,平均年龄(48.5±14.6)岁。两组患者的性别及年龄比较,差异无统计学意义。所有研究对象均签署了知情同意书。
1.2 方法
1.2.1 脑脊液标本采集 两组患者在治疗前行腰穿脑脊液检查时,留取脑脊液标本1 ml,采用4℃离心机两部离心法(1 500 r/min,10 min;12 000 r/min,2 min)去除细胞等成分后,存于-80℃冰箱待成批进行检测。
1.2.2 脑脊液RNA的提取 采用mirVana microRNA isolation kit试剂盒(美国Life公司)对脑脊液中的RNA进行提取。每例脑脊液标本取200 μl,加入试剂盒中提供的裂解液200 μl并充分混匀,随后加入5 μmol/L cel-miR-39标准品(广州锐博生物技术有限公司)5 μl,按照说明书进行RNA提取,并溶于60 μl的DEPC水中放置于-80℃冰箱备用。利用紫外分光光度计对所提取的RNA的浓度及纯度进行分析。
1.2.3 miR-221/miR-222表达的检测 采用实时荧光定量PCR(qRT-PCR)方法。miR-221/miR-222及cel-miR-39(用作参照基因)的特异性RT-PCR引物均购于广州RiboBio公司。逆转录采用25 μl体系:RNA模板15 μl和500 nM RT primer 2 μl, 经70℃ 10 min,4℃ 4 min后,再加入RT buffer 5 μl, reverse transcriptase 0.5 μl,dNTPs Mixture 2 μl,RNA inhibitor 0.5 μl和DEPC水7.5 μl,经42℃ 60 min,70℃ 10 min生成cDNA。使用SYBR Premix体系(大连宝生物工程有限公司)在ABI 7900实时定量PCR仪(美国Applied Biosystems公司)上进行PCR反应。采用5 μl反应体系:cDNA 0.5 μl,PCR引物工作液 1 μl,SYBR Premix Ex Taq Ⅱ荧光染料 2.5 μl和DEPC水1 μl。反应条件为95℃ 20 s,95℃ 10 s ,60℃ 20 s及70℃ 10 s;共40个循环。每例脑脊液标本均进行3次检测。反应结束后分析PCR扩增曲线,根据得到的Ct值,并与参照基因cel-miR-39进行标准化后,计算脑脊液miR-221/miR-222的表达水平。脑脊液miR-221/miR-222的表达水平以2-△△Ct表示,其中△Ct=Ct样本-Ctcel-miR-39,△△Ct=△Ct病例-△Ct对照。
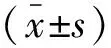
2 结 果
2.1 胶质瘤组与对照组脑脊液miR-221/miR-222表达水平的比较 见图1、2。图1A和图1B为部分样本qRT-PCR的扩增曲线(A)和溶解曲线(B)。从图中可以看出,能较好地检测出脑脊液的miR-221/miR-222表达水平,且引物具有较高的特异性,表明实验的可靠性。两组脑脊液miR-221和miR-222表达水平的比较,胶质瘤组的脑脊液miR-221(△Ct值7.47±1.16)和miR-222(△Ct值6.32±0.93)表达水平分别是对照组的2.89倍(△Ct值8.87±0.87)和2.38倍(△Ct值7.36±1.25),差异均有统计学意义(均P<0.001)。
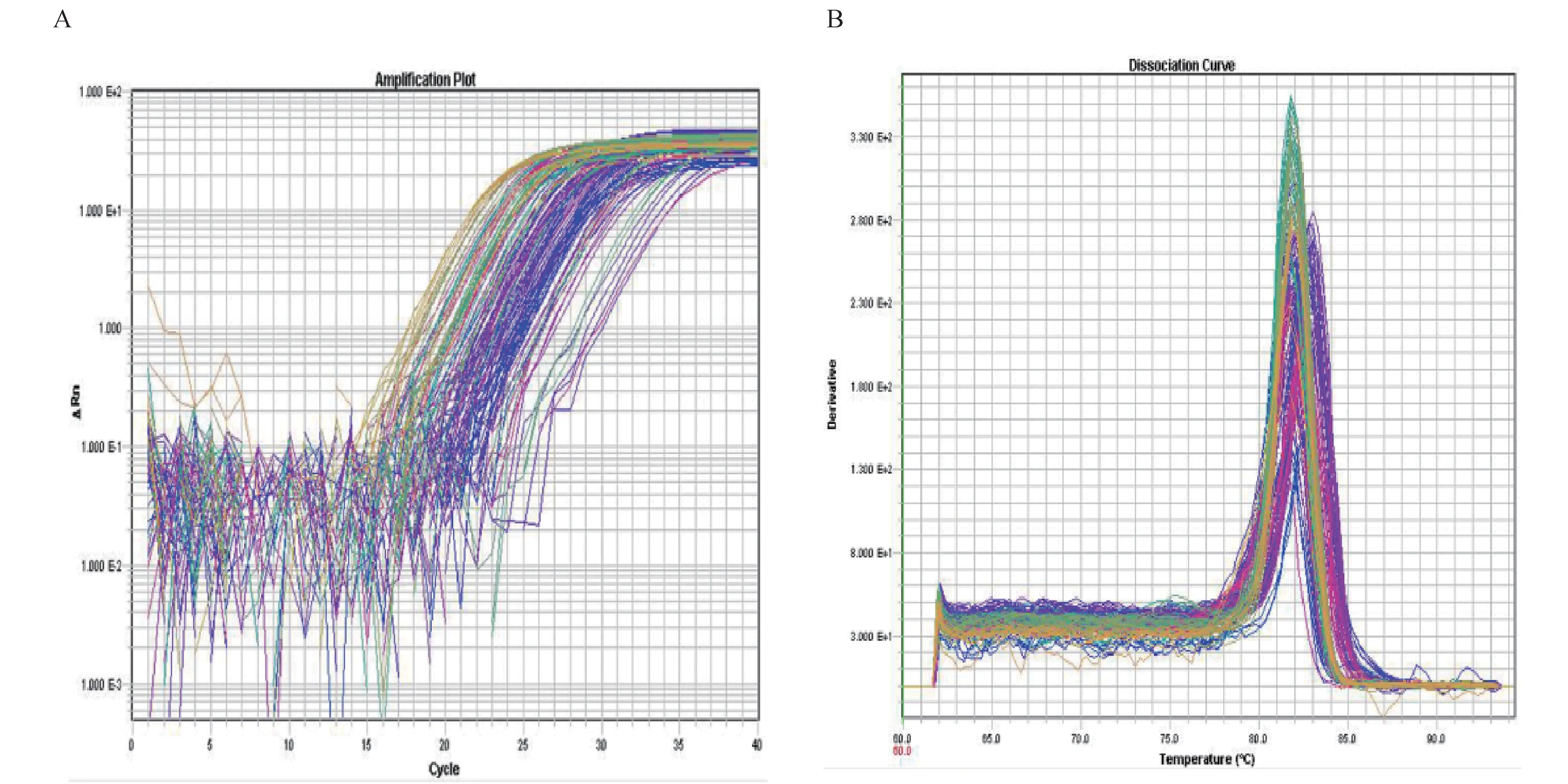
图1 qRT-PCR的扩增曲线(A)和溶解曲线(B)
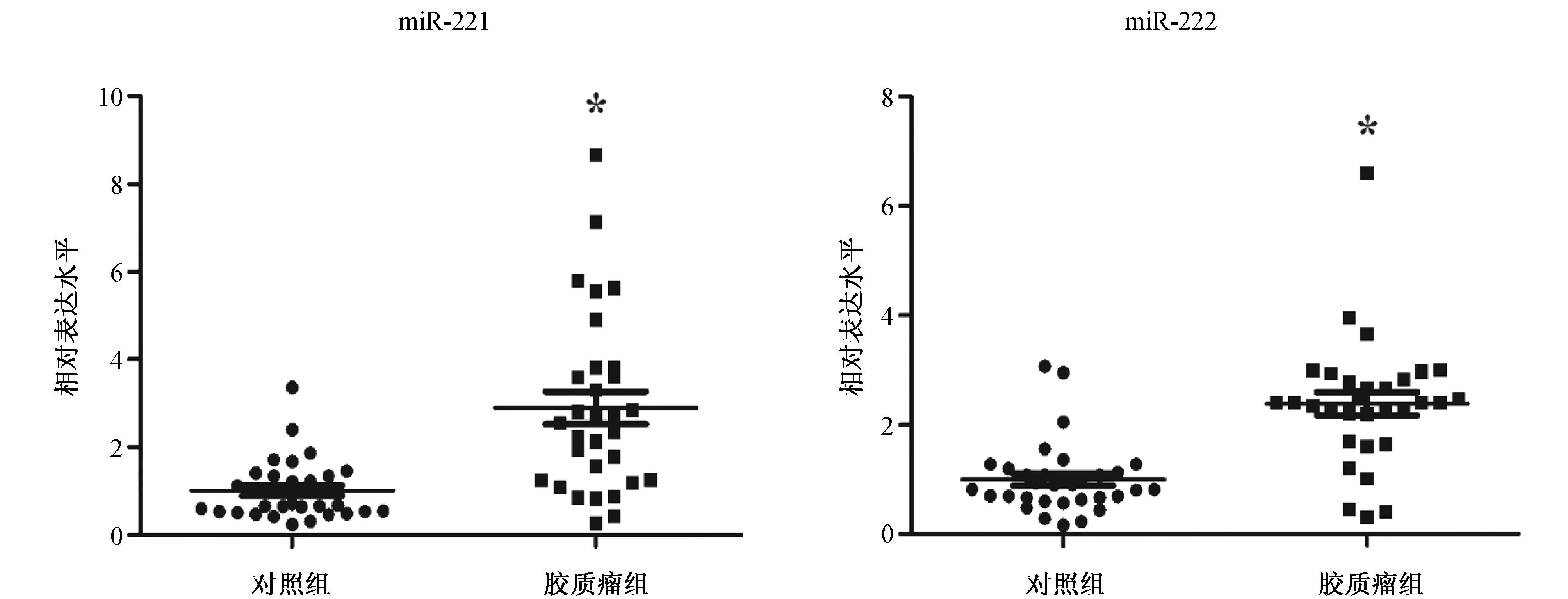
图2 胶质瘤组与对照组脑脊液miR-221和miR-222表达水平的比较(注:与对照组比较*P<0.05)
2.2 低级别与高级别胶质瘤患者的脑脊液miR-221/miR-222表达水平比较 见图3。高级别胶质瘤患者的脑脊液miR-221及miR-222表达水平均比低级别胶质瘤患者高,但只有miR-222表达水平的差异有统计学意义(1.49倍,P=0.007)。但是无论是低级别还是高级别胶质瘤患者的脑脊液miR-221(低级别:2.43倍,P=0.001;高级别:3.28倍,P<0.001)和miR-222表达水平(低级别:1.88倍,P=0.001;高级别:2.79倍,P<0.001)均显著高于对照组。
2.3 脑脊液miR-221、miR-222表达及二者联合诊断胶质瘤的价值 通过受试者工作特征(ROC)曲线分析评价脑脊液miR-221/miR-222表达水平作为诊断胶质瘤标志物的可能性。结果显示,脑脊液miR-221和miR-222能够分别以0.831(95%可信区间:0.727~0.935)和0.773(95%可信区间:0.643~0.903)的曲线下面积(AUC),将胶质瘤组患者与对照组区分开(图4A、4B)。最佳临界点的灵敏度分别为90.9%和81.8%,特异度为67.7%和 83.9%。同时,进一步分析miR-221与miR-222联合诊断胶质瘤的价值。miR-221与miR-222联合所得到的AUC为0.849(95%可信区间:0.749~0.95),比单独任一miRNA的AUC都要大;最佳临界点的灵敏度为81.8%,特异度为83.9%(图4C)。
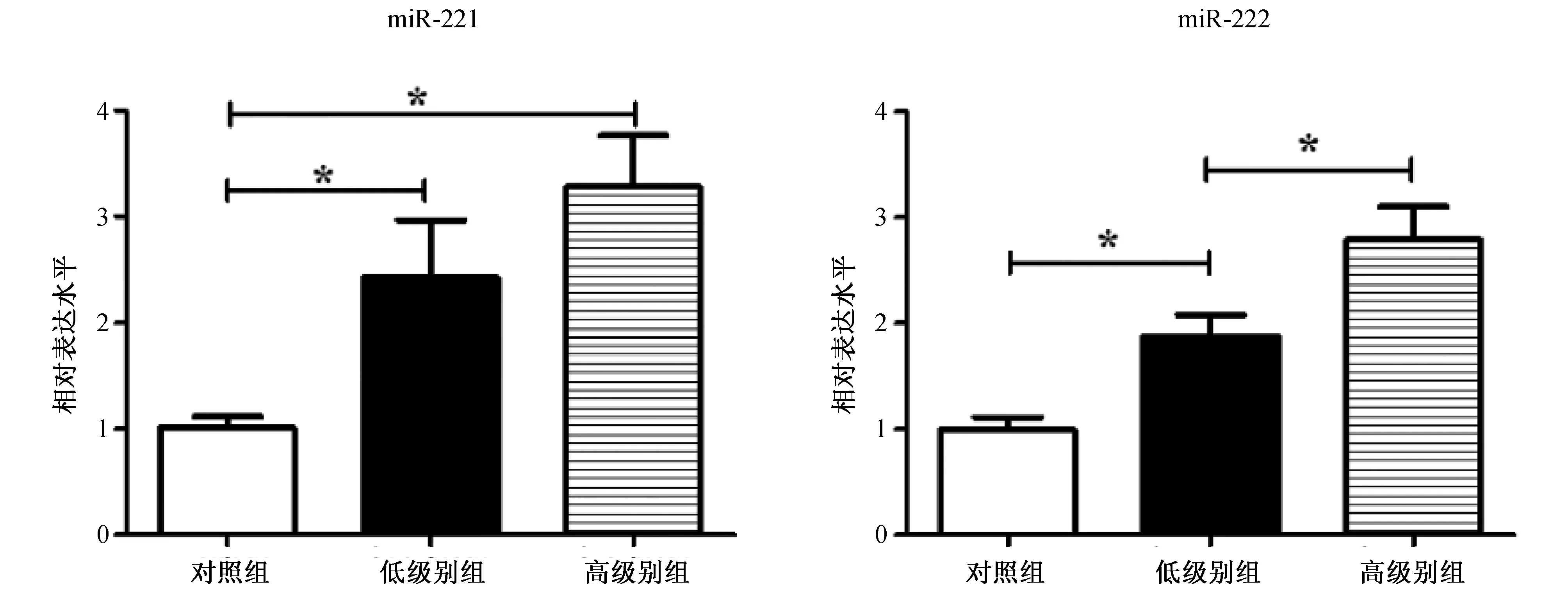
图3 低级别和高级别脑胶质瘤患者及对照组脑脊液miR-221、miR-222表达水平的比较(注:与对照组或低级别组比较*P<0.05)
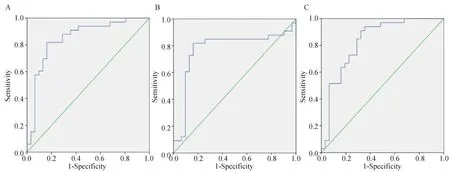
图4 脑脊液miR-221(A)、miR-222(B)及二者联合(C)诊断胶质瘤的ROC分析
3 讨 论
越来越多的研究显示,miRNA广泛参与肿瘤发生、发展的过程。2008年,Mitchell等首先发现miRNA能够稳定存在于外周血中,并能作为诊断前列腺癌的潜在标志物[16]。这一发现启动了众多研究者探索体液miRNA作为肿瘤生物标志物的研究工作。
胶质瘤是临床上最常见的颅脑恶性肿瘤。根据WHO的分类方法,胶质瘤被分为WHO Ⅰ~Ⅳ级,其中Ⅰ、Ⅱ级为低级别胶质瘤,Ⅲ、Ⅳ级为高级别胶质瘤[17]。由于肿瘤浸润性生长的特性,且级别越高的胶质瘤侵袭性越强,导致手术难以对肿瘤组织进行完全切除。手术、放化疗是目前针对胶质瘤的主要治疗方法,虽取得了一定的进展,但胶质瘤患者的预后仍不容乐观[18]。而早期诊断、早期干预能够提高患者的生存以及生活质量。
现阶段,已有多项研究通过分析胶质瘤患者与对照者之间的miRNA表达谱的差异,来寻找潜在的可用于辅助诊断胶质瘤的miRNA。其中,miR-221/miR-222被证实在胶质瘤组织、细胞系以及血浆中呈高表达。miR-221和miR-222基因是较为明确的原癌基因簇,二者呈前后排列,位于Xp11.3区约1 kb的区域内,是成簇分布的miRNA,在胃癌、肝癌、结肠癌、恶性黑色素瘤、前列腺癌、肺癌等恶性肿瘤中表达异常[15]。miR-221和miR-222的种子序列完全同源,具有许多相同的作用靶点,在胶质瘤中发挥着癌基因的作用。高表达的miR-221/miR-222可促进胶质瘤细胞生长、侵袭以及血管生成,是胶质瘤患者预后不良的因素[19-22]。最近的研究发现,miR-221/miR-222通过靶向TIMP2 促进人体神经胶质瘤细胞侵袭和血管生成[22]。同时,血浆中高表达的miR-221/miR-222也可以作为胶质瘤患者非侵入性的诊断以及预后评判的标志物[23]。但是,目前还没有关于miR-221/miR-222家族在胶质瘤患者脑脊液中的表达水平,及其诊断意义的相关研究。
本研究通过qRT-PCR的方法对31例胶质瘤患者和33例对照者的脑脊液miR-221/miR-222表达水平进行定量检测,并进一步分析脑脊液miR-221/miR-222作为诊断胶质瘤生物标志物的价值。结果显示,miR-221和miR-222在胶质瘤患者脑脊液中的表达水平均显著高于对照组(均P<0.001)。且与低级别胶质瘤患者比较,高级别胶质瘤患者脑脊液miR-221和miR-222的表达水平更高,但只有miR-222表达水平的差异具有统计学意义(1.49倍,P=0.007)。这表明miR-221与胶质瘤的恶性程度及侵袭性可能有密切关系。而miR-221在低级别与高级别胶质瘤患者的脑脊液表达水平之间的差异无统计学意义;这可能与本组的样本数较少有关,有待收集更多的病例进一步研究。通过ROC曲线分析发现,脑脊液miR-221与miR-222都能够很好地将胶质瘤与对照组患者区分开。进一步的合并分析结果显示,miR-221与miR-222联合诊断胶质瘤的价值要高于单一的miRNA,且灵敏度和特异度也都要好于单一的miRNA。这一结果也表明,脑脊液miR-221、miR-222表达的联合检测对于诊断胶质瘤具有十分重要的价值。
相较于外周血浆、血清,脑脊液样本受细胞、蛋白等影响较小;因此其可能是检测miRNA的更好的样本来源。但由于脑脊液标本不易获得,导致本研究的样本数偏少。将来的研究应纳入更多的样本数,将更有利于验证检测脑脊液miR-221/miR-222表达水平对胶质瘤的诊断价值。
综上所述,本研究通过分析比较胶质瘤患者与对照者的脑脊液miR-221/miR-222表达水平的差异,发现其有作为诊断胶质瘤的生物标志物的潜力。
[1] Ostrom QT,Gittleman H,Farah P,etal.CBTRUS statistical report:Primary brain and central nervous system tumors diagnosed in the United States in 2006-2010[J].Neuro-oncology,2013,15:ii1.
[2] Bartek J Jr,Ng K,Bartek J,etal.Key concepts in glioblastoma therapy[J].J Neurol Neurosurg Psychiat, 2012,83:753.
[3] Stupp R,Hegi ME,Mason WP,etal.Effects of radiotherapy with concomitant and adjuvant temozolomide versus radiotherapy alone on survival in glioblastoma in a randomised phase Ⅲ study:5-year analysis of the EORTC-NCIC trial[J].Lancet Oncol,2009,10:459.
[4] Sorensen AG,Batchelor TT,Wen PY,etal.Response criteria for glioma[J].Nature Clin Prac Oncol, 2008,5:634.
[5] Ha M,Kim VN.Regulation of microRNA biogenesis[J].Nature Rev Molec Cell Bio, 2014,15:509.
[6] 钱进,徐英纳,栾文康,等.miR-1224-5p在胶质瘤中的表达及其对胶质瘤细胞增殖的影响[J].临床神经外科杂志,2016,13:325.
[7] Inui M,Martello G,Piccolo S.MicroRNA control of signal transduction[J].Nature Rev Molec Cell Bio, 2010,11:252.
[8] Zimmerman AL,Wu S.MicroRNAs,cancer and cancer stem cells[J].Cancer Let,2011,300:10.
[9] Verma AM,Patel M,Aslam MI,etal.Circulating plasma microRNAs as a screening method for detection of colorectal adenomas[J].Lancet,2015,385(Suppl 1):S100.
[10] Min X,Zhuang Y,Zhang Z,etal.Lab in a Tube:Sensitive detection of microRNAs in urine samples from bladder cancer patients using a single-label DNA probe with AIEgens[J].ACS Applied Materials Interfaces,2015,7:16813.
[11] Murray MJ,Bell E,Raby KL,etal.A pipeline to quantify serum and cerebrospinal fluid microRNAs for diagnosis and detection of relapse in paediatric malignant germ-cell tumours[J].British J Cance,2016,114:151.
[12] Quintavalle C,Mangani D,Roscigno G,etal.MiR-221/222 target the DNA methyltransferase MGMT in glioma cells[J].PloS One,2013,8:e74466.
[13] Karsy M,Arslan E,Moy F.Current progress on understanding microRNAs in glioblastoma multiforme[J].Genes Cancer,2012,3:3.
[14] 康春生,浦佩玉,贾志凡,等.人脑胶质瘤细胞系miRNA表达谱初步研究[J].中华神经外科杂志,2008,24:468.
[15] 陈欣,赵斌杰,潘泰峰,等.神经胶质瘤患者脑脊液microRNA-221水平的测定及意义[J].山西医科大学学报,2013,44:142.
[16] Mitchell PS,Parkin RK,Kroh EM,etal.Circulating microRNAs as stable blood-based markers for cancer detection[J].Proc National Acad Sci Am,2008,105:10513.
[17] 《中国中枢神经系统胶质瘤诊断与治疗指南》编写组.中国中枢神经系统胶质瘤诊断与治疗指南[J].中华医学杂志,2016,96:485.
[18] 潘俊辰,徐拓野,余震南,等.胶质瘤中过表达长链非编码RNA loc285194 促进胶质瘤细胞凋亡[J].临床神经外科杂志,2015,12:118.
[19] Zhang C,Kang C,You Y,etal.Co-suppression of miR-221/222 cluster suppresses human glioma cell growth by targeting p27kip1 in vitro and in vivo[J].Int J Oncol,2009,34:1653.
[20] Zhang J,Han L,Ge Y,etal.miR-221/222 promote malignant progression of glioma through activation of the Akt pathway[J].Int J Oncol,2010,36:913.
[21] Zhang C,Zhang J,Hao J,etal.High level of miR-221/222 confers increased cell invasion and poor prognosis in glioma[J].J Translat Med,2012,10:119.
[22] Yang F,Wang W,Zhou C,etal.MiR-221/222 promote human glioma cell invasion and angiogenesis by targeting TIMP2[J].Tumour Bio,2015,36:3763.
[23] Zhang R,Pang B,Xin T,etal.Plasma miR-221/222 family as novel descriptive and prognostic biomarkers for glioma[J].Molec Neurobio,2016,53:1452.
IdentificationofmiR-221/miR-222incerebrospinalfluidasbiomarkerfordiagnosisofglioma
ZHANGQing,QIUCheng,XIADong-yan,etal.
DepartmentofNeurosurgery,theSecondClinicalMedicalCollegeofNanjingMedicalUniversity,Nanjing210011,China
LIYing-bin
ObjectiveTo explore different expression of miR-221/miR-222 in cerebrospinal fluid (CSF) between glioma patients and controls,and investigate the potential role of CSF miR-221/miR-222 in detecting glioma.MethodsA total of 31 glioma patients and 33 non-glioma patients (controls) were enrolled in our study.Expression levels of CSF miR-221/miR-222 were analyzed by quantitative reverse transcription polymerase chain reaction (qRT-PCR).Diagnostic value of CSF miR-221/miR-222 was assessed by receiver operating characteristic (ROC) method.ResultsCSF miR-221 and miR-222 were significantly higher in glioma patients compared with controls (allP<0.001).The expression of miR-221/miR-222 in the CSF of patients with high grade glioma was higher than that in low grade glioma,and the difference of miR-222 expression was statistically significant (1.49 fold,P=0.007).The area under the ROC curve (AUC) of the combination of the two miRNAs was 0.849,with sensitivity of 81.8% and specificity of 83.9%.ConclusionmiR-221/miR-222 in CSF can serve as a biomarker in diagnosing glioma.
glioma;cerebrospinal fluid;miR-221/miR-222;diagnosis
南京市科技计划项目基金(201303042)
210011 南京,南京医科大学第二临床医学院(南京医科大学第二附属医院)神经外科
李英斌
10.3969/j.issn.1672-7770.2017.06.001
R739.41
A
1672-7770(2017)06-0401-05
(收稿2017-07-26 修回2017-10-08)

