黄色短杆菌ilvBN和ilvC基因定点突变对L-缬氨酸发酵的影响
,,,
(廊坊梅花生物技术开发有限公司,河北 廊坊 065001)
黄色短杆菌ilvBN和ilvC基因定点突变对L-缬氨酸发酵的影响
宫卫波,王海雷,程国平,赵津津
(廊坊梅花生物技术开发有限公司,河北 廊坊 065001)
以黄色短杆菌MH-1000为出发菌株,使用PCR技术克隆ilvBN与ilvC基因,对ilvBN进行定点突变,获得解除L-缬氨酸对乙酰羟酸合酶反馈抑制突变型基因ilvBN′.对基因ilvC进行点突变,获得乙酰羟酸变位酶突变基因ilvC′.通过重叠延伸PCR方法,将基因片段ilvBN′和ilvC′拼接为ilvBN′C′,进而连接至穿梭载体pXMJ19获得重组质粒pXMJ19-ilvBN′C′.该重组质粒转化至出发菌株获得工程菌株MH-1032.50 L分批补料发酵结果显示:MH-1000发酵72 h L-缬氨酸质量浓度为35.2 g/L,MH-1032发酵72 h L-缬氨酸质量浓度为38.4 g/L,增长9.1%,糖酸转化率从21.7%提高到25.8%.
L-缬氨酸;乙酰羟酸合酶;乙酰羟酸变位酶;黄色短杆菌
L-缬氨酸作为增味剂、添加剂,应用于食品、饲料、医药和化妆品等领域.L-缬氨酸是人体必需八种氨基酸之一.工业上主要使用发酵法生产L-缬氨酸,所用菌种以棒杆菌为主.一般通过增强L-缬氨酸代谢通路关键酶、限速酶的表达[1-2],阻断或者减弱支路代谢[3-4],改变细胞膜对底物和产物透性,增强细菌对糖等底物的耐受,抑制终产物分解[5-7]等方法提高L-缬氨酸产量.另外优化发酵培养基配方、改善发酵工艺也可提高L-缬氨酸产量[8-9].徐庆阳等[10]以黄色短杆菌(B.flavum)XV0505(Leu-+Ile-+2-TAr+α-ABr+SGr)在10 L小罐中发酵72 h,最高产L-缬氨酸53.4 g/L,糖酸转化率为26.7%.张伟国等[11]通过诱变筛选出了XQ-8(Leulα+ABhr+2-TAhr+AHVhr),摇瓶产酸达66 g/L.但是以诱变为基础的菌株筛选效率比较低,现基本被基因工程手段替代.
笔者采用对ilvBNC进行定点突变的方法,解除了L-缬氨酸对乙酰羟酸合酶(AHAS)的反馈抑制,同时经过定点突变,将乙酰羟酸变位酶(AHAIR)的辅酶NADPH改为NADH,摇瓶发酵产L-缬氨酸19.5 g/L,比突变前提高16.8%;50 L发酵罐产L-缬氨酸38.4 g/L,比突变前提高9.1%.
1 材料与方法
1.1 材 料
大肠杆菌transT1(北京全式金生物技术有限公司),黄色短杆菌MH-1000(α-ABhr+2-TAhr+AHVhr),廊坊梅花生物技术开发有限公司保藏菌种.
大肠杆菌-棒杆菌穿梭质粒pXMJ19,本实验所使用的菌株及载体详见表1.

表1 本实验中细菌和质粒Table 1 Strains and plasmids in this experiment
1.2 试剂及设备
限制性内切酶、DNA连接酶,MBI Fermentas公司;Fast pfu DNA polymerase,TransStart FastTaq DNA polymerase,TransStart FastPfu DNA polymerase,DNA Marker,dNTPs等,北京全氏金生物技术有限公司;质粒小量提取试剂盒、琼脂糖凝胶DNA回收试剂盒、基因组提取试剂盒,北京天根生化科技有限公司;引物合成及测序送交英潍捷基(上海)贸易有限公司完成;往复式摇床、恒温培养箱、PCR仪、电泳-凝胶成像系统等;SBA生物传感仪,山东省科学院微生物研究所;50 L发酵罐,上海百仑生物科技有限公司.
1.3 培养基
LB培养基:氯化钠10 g/L,蛋白胨10 g/L,酵母粉5 g/L,121 ℃灭菌20 min.
黄色短杆菌摇瓶及50 L小罐发酵培养基配制参考文献[11].LBHIS(LB with brain heart infusion and sorbitol)用于电转化后恢复培养,BHI(Brain heart lnfusion medium)感受态细胞培养等培养基配制参考文献[12-13].
黄色短杆菌斜面培养基LBG:LB培养基+0.5%葡萄糖,NaOH调节pH至7.0,121 ℃灭菌20 min.
黄色短杆菌种子培养基:葡萄糖25 g/L,尿素2.5 g/L,玉米浆40 g/L(氨基氮1.0%~1.3%,波美度19.5~22),KH2PO41 g/L,MgSO40.5 g/L,NaOH调节pH至7.0,121 ℃灭菌20 min.
黄色短杆菌50 L发酵培养基:葡萄糖50 g/L,玉米浆15 g/L,KH2PO41 g/L,MgSO40.5 g/L,NaOH调节pH至 7.0,121 ℃灭菌20 min.
1.4 发酵以及数据测定
摇瓶发酵条件:摇床转速170 r/min,发酵温度33 ℃,时间72 h.发酵结束后加水定容至20 mL;吸取菌液0.1 mL,使用0.5 mol/L盐酸稀释至5 mL,分光光度计测量OD562;取1 mL菌液至1.5 mL的EP管中,12 000 r/min离心2 min,安捷伦液相色谱测定L-缬氨酸产量;吸取1.5 mL EP管中10 μL上清液至990 μL去离子水中,SBA生物传感仪测定发酵液剩余葡萄糖;50 L发酵罐发酵条件,样品测定参考文献[11].
1.5 感受态细胞制备及其他分子操作
大肠杆菌感受态细胞制备参考文献[14],MH-1000感受态细胞制备参考文献[15-16].基因组提取、质粒提取、酶切和连接等按照试剂盒或说明书进行操作.引物设计参照黄色短杆菌ATCC14067相关基因(表2),并添加相应的酶切位点和保护碱基.
1.6 ilvBN定点突变
提取黄色短杆菌基因组,使用引物ilvBN-F和ilvBN-R经PCR获得ilvBN.以ilvBN为模板,分别使用ilvBN-F,ilvBN-IR和ilvBN-IF,ilvBN-R扩增两个基因片段ilvB和ilvN.
利用重叠延伸PCR的方法,以ilvBN-F,ilvBN-R为引物,等摩尔浓度的ilvB,ilvN为模板PCR,TransStart FastTaq DNA polymerase,TransStart FastPfu DNA polymerase混合酶,体积比1∶10,体系50 μL包括:10 μL 5×Primer star buffer (Mg2+plus),4 μL的dNTP混合物(各2.5 mmol/L),引物各1 μL,混合酶1 μL,模板ilvB和ilvN适量,补水至50 μL.PCR条件:94 ℃预变性2 min;94 ℃变性20 s,55 ℃退火20 s,72 ℃延伸1 min,以上30 个循环;72 ℃延伸10 min.PCR结束后获得定点突变的ilvBN′.

表2 本实验中所用引物1)Table 2 Primers in this experiment
注:1) 表中带有下划线的碱基表示突变位点.
回收上步中PCR产物后,连接T载体pEASYTM-T5,获得pEASYTM-T5-ilvBN′,转化至大肠杆菌;使用M13为鉴定引物测序鉴定,提取质粒pEASYTM-T5-ilvBN′经Hind III与EcoR I酶切,回收ilvBN′片段,与相同酶切回收的pXMJ19连接,构建pXMJ19-ilvBN′.
转化pXMJ19-ilvBN′至大肠杆菌,平板培养,挑单菌落进行摇瓶过夜培养,提取质粒作为模板,以pX-F和pX-R为引物进行PCR测序鉴定;鉴定完毕获得阳性克隆后,提取质粒pXMJ19-ilvBN′转化MH-1000,转化条件、培养基配方参考文献[12-13],以pX-F和pX-R为引物进行PCR测序鉴定筛选阳性克隆.
1.7 ilvC定点突变
提取黄色短杆菌基因组为模板,以ilvNC-F和ilvNC-R为引物PCR获得ilvNC;以ilvNC为模板,分别使用ilvNC-F,ilvC-IR和ilvC-IF,ilvNC-R为引物扩增两个基因片段ilvNCF和ilvCR.
利用重叠延伸PCR的方法,以ilvNC-F,ilvNC-R为引物,等摩尔浓度的ilvNCF和ilvCR为模板进行PCR,获得定点突变ilvC′,连接T载体pEASYTM-T5,构建pEASYTM-T5-ilvC′,转化至大肠杆菌,24 h长出菌落后,挑单菌落或摇瓶过夜培养后提质粒作为模板,T载体自带引物M13进行PCR鉴定,测序,序列正确可用于ilvBN′C′的重叠延伸PCR.
1.8 ilvBN′与ilvC′连接、转化
以ilvBN-F和ilvN-R为引物,ilvBN′为模板,扩增出ilvBN′F;以ilvNC-F和ilvC-R为引物,ilvC′为模板,扩增出ilvC′R.
回收上步骤中ilvBN′和ilvC′R基因片段,以ilvBN′F与ilvC′R为模板,以ilvBN-F和ilvC-R为引物,PCR扩增形成ilvBN′C′,条件基本同1.6.体系50 μL:包括10 μL 5×Primer star buffer(Mg2+plus),4 μL的dNTP混合物(各2.5 mmol/L),引物各1 μL,混合酶1 μL,模板ilvBN′和ilvC′R适量,补水至50 μL.PCR条件为:94 ℃预变性2 min;94 ℃变性20 s,55 ℃退火20 s,72 ℃延伸1.5 min,以上30 个循环;最后72 ℃延伸10 min,连接T载体pEASYTM-T5,形成pEASYTM-T5-ilvBN′C′,使用M13引物、Hind III与EcoR I双酶切进行鉴定,鉴定阳性克隆测序.
摇瓶过夜培养测序正确的大肠杆菌,提取质粒pEASYTM-T5-ilvBN′C′,使用Hind III与EcoR I酶切,回收ilvBN′C′片段后,连接同样酶切回收的pXMJ19,构建质粒pXMJ19-ilvBN′C′,转化至大肠杆菌,长出菌落后挑单菌落为PCR模板,以pX-F和pX-R为引物进行PCR进行扩增,测序验证为阳性克隆后,提取质粒pXMJ19-ilvBN′C′转化MH-1000,再次以pX-F和pX-R为引物,以转化后菌株为模板进行PCR,测序筛选阳性克隆.
1.9 分批补料
50 L发酵罐发酵条件:接种量10%,通风比1 vvm,搅拌转速200~500 r/min,温度31 ℃,25%氨水流加调节pH至7.0,流加650 g/L高浓度葡萄糖补充碳源,控制溶氧30%~50%,发酵液葡萄糖质量浓度1~2 g/L.
2 结 果
2.1 ilvBN的定点突变及转化
将ilvBN从MH-1000菌株基因组上扩增,使用重叠延伸PCR方法进行定点突变,将AHAS小亚基别构中心的3个氨基酸做如下替换Gly20Asp,Ile21 Asp和Ile22 Phe,相应的的核苷酸GGAATCATT定点突变成GATGACTTT,解除了L-缬氨酸对AHAS的反馈抑制(图1),获得定点突变基因.质粒pXMJ19-ilvBN′模板,以pX-F,pX-R为引物PCR验证如图2所示,ilvBN′大小约为2.5 kb(基因大小2 413 bp)左右(泳道2).构建的pXMJ19-ilvBN′C′经Hind III和EcoR I双酶切,有两条片段(泳道4),质粒片段pXMJ19约为6.6 kb(质粒6 601 bp),验证结果为阳性,获得MH-1031.

图1 ilvBN基因定点突变位点及其上下游序列测序图谱Fig.1 Site-directed mutation of ilvBN and related sequences
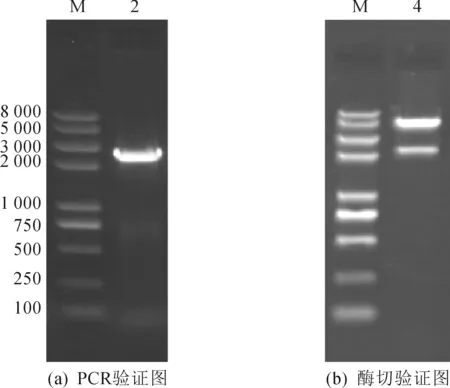
图2 质粒pXMJ19-ilvBN′C′的PCR及酶切验证Fig.2 Validation of pXMJ19-ilvBN′C′ through PCR and endonuclease digestion
2.2 ilvC的定点突变
将ilvC从MH-1000菌株基因组中PCR扩增,对照本基因序列中氨基酸表达偏好性设计定点突变碱基(核苷酸5′-TCCCAGAACCTCCGCGATTCTGGCGTTGAGGTTGTCATT GGTCTGCG-3′),用重叠延伸PCR方法定点突变成5′-GGCCAGAACCTCCGCGATTCT GGCGTTGAGGTTGTCA TTGGTGAGTT-3′,即氨基酸替换为Ser34Gly,Leu48Glu和Arg49Phe.这样ilvC编码酶的辅酶从NADPH变为NADH,获得ilvC′,如图3所示.
2.3 ilvBN′C′基因片段的拼接验证
以质粒pXMJ19-ilvBN′C′为模板,pX-F,pX-R为引物进行PCR验证,如图4所示,获得的条带3.5 kb(泳道2:基因大小3 610 bp)左右.质粒pXMJ19-ilvBN′C′经Hind III和EcoR I双酶切,理论获得3 610 bp和6 551 bp的条带,分别为ilvBN′C′和pXMJ19质粒片段(图4),获得条带分别与所述相符.使用纯化的ilvBN′C′的PCR产物测序,获得序列除了碱基突变之外,与ATCC14067序列一致,用Vector NTI 11软件绘制质粒pXMJ19-ilvBN′C′图谱,如图5所示.

图3 ilvC基因定点突变位点及其上下游序列测序图谱Fig.3 Site-directed mutation of ilvC and related sequences
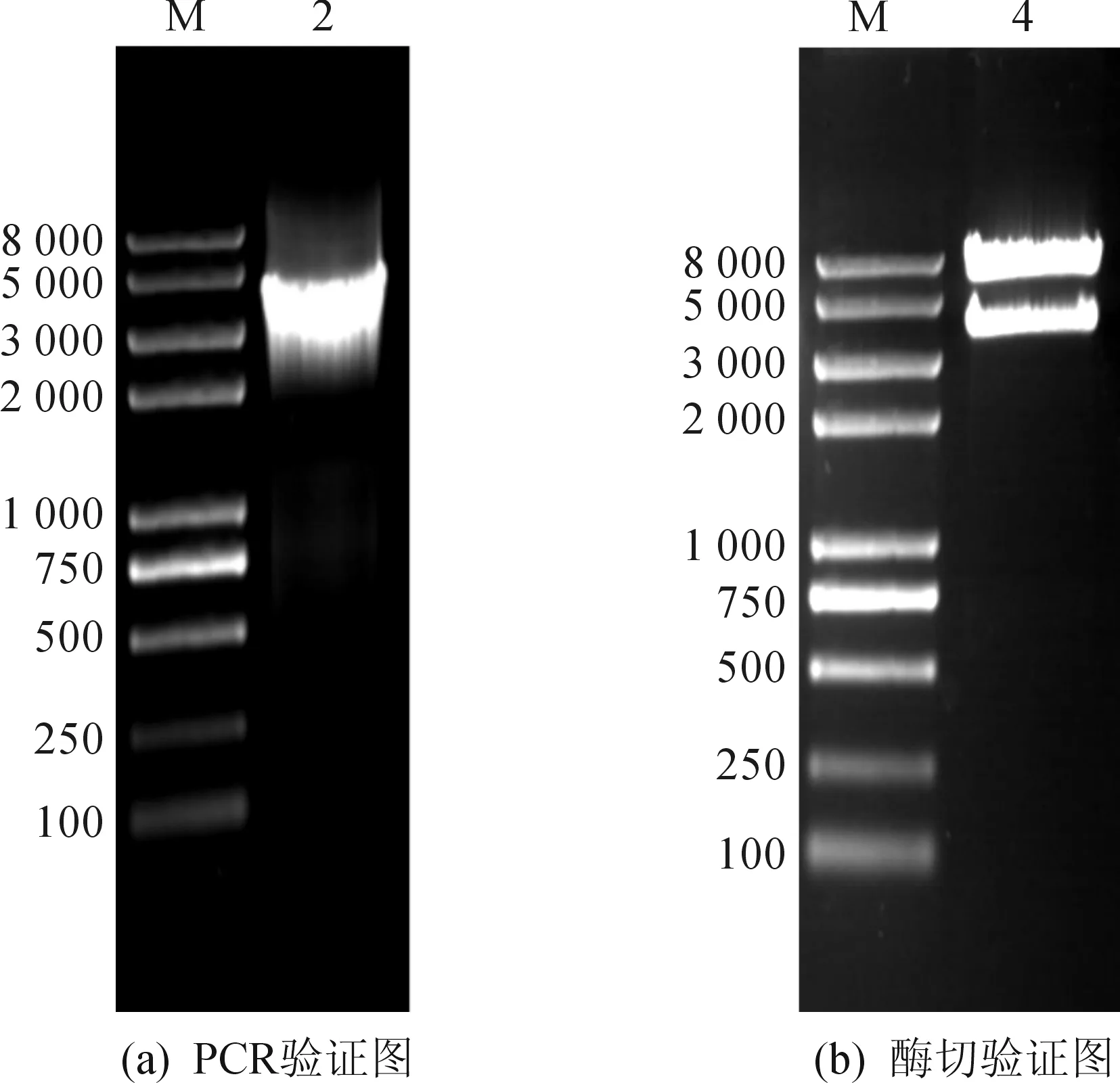
图4 质粒pXMJ19-ilvBN′C′的PCR及酶切验证Fig.4 Validation of pXMJ19-ilvBN′C′ through PCR and endonuclease digestion
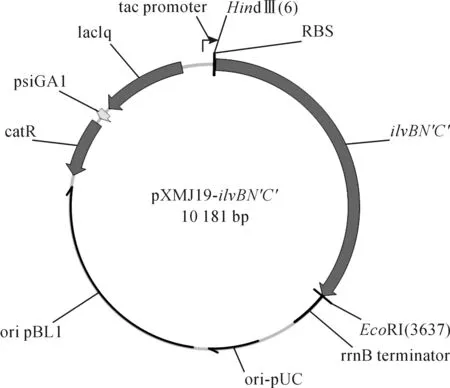
图5 构建的pXMJ19-ilvBN′C′质粒图谱Fig.5 Plasmid profile of pXMJ19-ilvBN′C′
2.4 基因工程菌的产L-缬氨酸情况
将已构建的pXMJ19-ilvBN′和pXMJ19-ilvBN′C′分别转化至MH-1000后,获得MH-1031和MH-1032,通过20 mL/500 mL三角烧瓶和50 L发酵罐验证3 批次,发酵时间72 h,往复式摇床振幅5 cm,170 r/min,50 L发酵OD和L-缬氨酸见图6.
摇瓶发酵初始产酸16.7 g/L,MH-1031产L-缬氨酸18.2 g/L,比出发菌增长9.0%,MH-1032产L-缬氨酸19.5 g/L,比出发菌增长16.8%,比MH-1031增长7.1%;
50 L发酵罐发酵测试显示(图6):MH-1031/pXMJ19-ilvBN′,MH-1032/pXMJ19-ilvBN′C′生长比MH-1000缓慢,是由于高表达质粒所致;发酵过程葡萄糖控制1~2 g/L(曲线未给出);出发菌MH-1000经72 h发酵产L-缬氨酸35.2 g/L,MH-1031经72 h产37.3 g/L,比出发菌增长6.0%,MH-1032经72 h产L-缬氨酸38.4 g/L,比出发菌高9.1%,比MH-1031高2.9%(表3).

图6 分批发酵OD和产酸曲线Fig.6 The curve of OD and L-val in batch of fermentation

菌株/质粒L⁃缬氨酸(摇瓶)质量浓度/(g·L-1)增长率/%L⁃缬氨酸(50L罐)质量浓度/(g·L-1)增长率/%50L发酵糖酸转化率/%出发菌MH⁃100016.735.221.7MH⁃1031/pXMJ19⁃ilvBN′18.29.037.36.023.3MH⁃1032/pXMJ19⁃ilvBN′C′19.516.838.49.125.8
3 结 论
50 L分批补料发酵结果显示:出发菌株MH-1000 72 h产L-缬氨酸35.2 g/L,MH-1032 72 h产L-缬氨酸38.4 g/L,比出发菌株增长9.1%.对L-缬氨酸代谢通路的ilvBN,将AHAS小亚基别构中心的3 个氨基酸定点突变为Gly20Asp,Ile21 Asp和Ile22 Phe,能够完全解除3 种支链氨基酸对AHAS的反馈抑制作用[7].一分子葡萄糖通过EMP途径产生两分子丙酮酸作为合成L-缬氨酸的底物,而一分子葡萄糖通过HMP途径,通过多种酶作用,脱掉一分子碳生成五碳糖,产生的丙酮酸少于EMP途径.EMP途径甘油醛-3-磷酸脱氢酶的辅酶为NADH,HMP途径的葡萄糖-6-磷酸脱氢酶和6-磷酸葡萄糖酸脱氢酶的辅酶为NADPH.NADH辅酶的序列特征是GXGXXGXXXG(X代表一种氨基酸),而NADPH辅酶序列特征是GXGXXAXXXA,改变ilvC的氨基酸序列为Ser34Gly,Leu48Glu和Arg49Phe[1],AHAIR能够利用NADH作为辅酶代替NADPH,通过降低对NADPH的依赖以降低戊糖磷酸途径的物料消耗,相对较高浓度的NADH有助于反应向终产物L-缬氨酸方向进行,进而增加L-缬氨酸产量.
[1] HASEGAWA S, UEMATSU K, NATSUMA Y, et al. Improvement of the redox balance increases L-valine production byCorynebacteriumglutamicumunder oxygen deprivation conditions[J]. Applied & environmental microbiology, 2012,78(3):865-875.
[2] 徐大庆,谭延振,缪铭,等.一株黄色短杆菌基因工程菌株的构建及其L-缬氨酸积累[J].食品科学,2010,31(23):262-266.
[3] 熊明勇.L-缬氨酸产生菌的选育及其发酵条件研究[D].天津:天津科技大学,2002.
[4] 胡炎华,朱亚然,宫卫波.基因敲除降低L-缬氨酸发酵中亮氨酸和异亮氨酸含量的研究[J].发酵科技通讯,2013,42(2):4-8.
[5] 李秀敏,杨毅,姜绪林,等.L-缬氨酸产生菌的选育及其代谢流分析[J].生物技术,2003,13(6):19-21.
[6] 王均成,王可,张春宇.L-缬氨酸的应用和育种研究进展[J].发酵科技通讯,2012,41(1):30-34.
[7] 苏跃稳,张昕,王健.L-缬氨酸代谢工程研究进展[J].发酵科技通讯,2016,45(2):118-122.
[8] 雷剑芬,陆可,冯今亮,等.生长因子用量对缬氨酸发酵的影响[J].发酵科技通讯,2002,31(1):18-19.
[9] 冯容保.L-缬氨酸发酵需氧量的探讨[J].发酵科技通讯,2006,36(4):11.
[10] 徐庆阳,刘树海,陈宁.L-缬氨酸发酵影响因素的研究[J].发酵科技通讯,2006,35(2):15-17.
[11] 张伟国,钱和,乎守涛,等.L-缬氨酸高产菌XQ-8补料分批发酵的研究[J].食品工业科技,2012(2):192-194.
[12] 徐大庆.黄色短杆菌载体系统的构建及其产L-缬氨酸代谢工
程育种的初步研究[D].无锡:江南大学,2010.
[13] 侯小虎.L-缬氨酸代谢工程育种的研究[D].无锡:江南大学,2012.
[14] 萨姆布鲁克J,拉塞尔D W.分子克隆实验指南[M].3版.北京:科学出版社,2002.
[15] VAN DER REST M E, LANGE C, MOLENAAR D. A heat shock following electroporation induces highly efficient transformation ofCorynebacteriumglutamicumwith xenogeneic plasmid DNA[J]. Applied microbiology & biotechnology, 1999,52(4):541-545.
[16] 余秉琦,沈微,诸葛健.适用于异源DNA高效整合转化的谷氨酸棒杆菌电转化法[J].中国生物工程杂志,2005,25(2):78-81.
Site-directedmutagenesisofilvBNandilvCinBrevibacteriumflavumforimprovedproductionofL-valine
GONG Weibo, WANG Hailei, CHENG Guoping, ZHAO Jinjin
(MeiHua Biotech(Langfang) Co., Ltd., Langfang 065001, China)
Brevibacteriumflavum1000 was used as the original strain and site-specific mutagenesis was performed in itsilvBNgene, resulting in an anti-feedback inhibition geneilvBN′. The geneilvC′ encoding acetohydroxyacid isomeroreductase was obtained by site-directed mutagenesis fromilvC. The geneilvBN′C′ was obtained by overlap extension PCR fromilvBN′ andilvC, and then inserted intoE.coli-B.flavumshuttle expression vector pXMJ19 to construct a recombinant plasmid pXMJ19-ilvBN′C′. The recombinant plasmid was subsequently transformed intoB.flavumMH-1000, resulting in the strain MH-1032. The results from fed-batch fermentation experiments in 50 L fermenter indicated that the L-valine productivity of MH-1032 (38.4 g/L) was increased by 9.1% in contrast to that of MH1000 (35.2 g/L) in 72 hours, and the conversion of glucose to L-val increased from 21.7% to 25.8%.
L-valine;Brevibacteriumflavum; acetohydroxyacid synthase; acetohydroxyacid isomeroreductase
2017-08-02
宫卫波(1979—),男,河北邯郸人,硕士,研究方向为生物化学与分子生物学,E-mail:gongweibo@meihuagrp.com.
TQ922
A
1674-2214(2017)04-0228-05
朱小惠)

