微波-过氧化氢工艺处理含Cu-EDTA废水
王宏杰,曹喆,赵子龙,董文艺
(1哈尔滨工业大学深圳研究生院,广东 深圳 518055;2深圳市水资源利用与环境污染控制重点实验室,广东 深圳 518055)
微波-过氧化氢工艺处理含Cu-EDTA废水
王宏杰1,2,曹喆1,2,赵子龙1,2,董文艺1,2
(1哈尔滨工业大学深圳研究生院,广东 深圳 518055;2深圳市水资源利用与环境污染控制重点实验室,广东 深圳 518055)
采用微波-过氧化氢工艺处理含Cu-EDTA废水,考察反应时间、初始pH、H2O2投加量、微波功率以及共存物质等因素对该工艺处理效能的影响,并分析了氧化作用机制。结果表明,在初始pH为3,H2O2投加量为41 mmol·L-1,微波功率为210 W时,1.57 mmol·L-1Cu-EDTA反应10 min后,Cu和TOC去除率分别高达97.0%和60.7%,出水电导率低至1.8 mS·cm-1,产泥量仅为0.15 g·L-1。的存在对Cu-EDTA的氧化降解过程无明显影响,而和酒石酸对反应过程有一定的抑制作用。该工艺下反应4 min后Cu-EDTA基本氧化为中间产物,并在4~6 min内急剧降解,最终形成小分子羧酸类物质、NH3-N和无机碳。反应过程沉淀产物主要以CuO形式存在。相比Fenton工艺,该工艺在氧化效能、出水电导率及产泥量等方面有显著优势。
微波-过氧化氢;Cu-EDTA;氧化;废水;芬顿;污染
引 言
以 Cu-EDTA为典型代表的重金属络合物普遍存在于化学镀铜工业废水中,该类废水具有络合稳定性强、可生化降解性差和急性毒性强等特性,易对水体、土壤环境及人体健康造成严重威胁。目前,针对含 Cu-EDTA废水的处理方式主要包括化学沉淀[1]、离子交换[2]、物理吸附[3]、膜分离[4]和高级氧化(如光电催化[5-6]、臭氧氧化[7]和(类)芬顿氧化[8-9])等方法。其中以芬顿(Fenton)工艺应用最为广泛[10]。但反应过程中铁源的介入及Fe2+/Fe3+的循环转化也导致了该方法存在氧化效率低、出水电导率及产泥量高等诸多缺陷[11]。
近年来,微波(microwave,MW)辅助高级氧化工艺在水处理领域受到国内外学者广泛关注。研究表明,微波可实现分子水平加热,具有降低极性分子反应活化能和提高污染物处理效率等特点[12]。将微波与过氧化氢耦合(MW-H2O2),可强化H2O2解离生成⋅OH,并提高H2O2利用率,适用于阳离子染料[12]、苯酚[13]、磺化芳香化合物[14]、农药[15]等诸多难降解有机污染物的氧化降解。由于仅添加H2O2氧化剂,MW-H2O2工艺避免了Fe2+的二次污染及污泥产生,具有克服传统Fenton工艺缺陷的潜在优势。
截止目前,利用 MW-H2O2工艺处理含Cu-EDTA废水尚未有所报道。本文通过小试实验,探索MW-H2O2工艺氧化降解含Cu-EDTA废水的可行性。考察了反应时间、初始 pH、H2O2投加量、微波功率以及共存物质等因素对工艺处理效能的影响,并从去除效率、产泥量和出水电导率等方面与传统Fenton工艺进行对比,为实际化学镀铜废水的绿色高效处理提供理论依据。
1 实验材料和方法
1.1 试剂
主要试剂包括:五水硫酸铜(CuSO4·5H2O,分析纯,天津光复化学试剂厂);乙二胺四乙酸二钠(C10H16N2O8Na2,分析纯,阿拉丁试剂有限公司);过氧化氢(H2O2,分析纯,体积分数30%,阿拉丁试剂有限公司);七水硫酸亚铁(FeSO4·7H2O,分析纯,阿拉丁试剂有限公司);草酸钛钾(分析纯,阿拉丁试剂有限公司)等。
1.2 实验方法
(1)模拟废水配制:称取1.57 g CuSO4·5H2O和2.34 g C10H16N2O8Na2溶于4 L去离子水中,配制1.57 mmol·L-1Cu-EDTA 溶液,其中 Cu(Ⅱ)与 EDTA的摩尔比为 1:1。
(2)MW-H2O2工艺:量取100 ml Cu-EDTA溶液于250 ml锥形瓶,通过5% H2SO4或10% NaOH调节溶液pH,加入适量H2O2迅速摇匀后,置于微波化学反应器(WBFY-201,巩义市科瑞仪器,中国)中进行反应。定时取样,过0.45 μm滤膜后测定出水电导率、pH、NH3-N和H2O2浓度;调节试样pH至10,经沉淀过膜后测定TOC和Cu浓度。
(3)Fenton工艺:量取100 ml Cu-EDTA溶液于250 ml锥形瓶,调节溶液pH并加入适量FeSO4及H2O2,迅速摇匀后置于常温下反应。取样及分析方法同MW-H2O2工艺。
1.3 分析方法
TOC和IC浓度采用总有机碳检测仪(TOC-L CPN,岛津分析仪器,日本)进行测定,其中在酒石酸存在情况下,考虑其本身所含有机物对 TOC去除率的影响;利用电感耦合等离子体(Optima8000,PE,美国)测定Cu浓度;出水电导率通过电导率仪(FE30K,梅特勒-托利多,瑞士)进行测定;采用便携式pH测量仪(pH100,YSI,美国)测定溶液pH;基于纳氏试剂分光光度法和草酸钛钾分光光度法,利用紫外-可见光光度计(UV2600,岛津分析仪器,日本)测定NH3-N和H2O2浓度,并在190~400 nm波长范围内进行紫外-可见光光谱扫描;使用X射线光电能谱仪(XPS,PHI 5000 VersaProbe II,ULVAC-PHI,日本)及原位X射线粉末衍射仪(XRD,D8 advance,布鲁克光谱,德国)进行污泥组分分析;产泥量通过烘干称重法进行测定。
2 实验结果与讨论
2.1 初始pH对MW-H2O2工艺处理效率的影响
溶液pH直接决定反应过程中重金属的形态分布、催化剂的反应活性及过氧化氢的稳定性。当Cu-EDTA初始浓度为1.57 mmol·L-1,H2O2投加量为41 mmol·L-1,微波功率为210 W,反应时间为10 min时,初始pH(pH0)对MW-H2O2工艺处理效率的影响如图1所示。由图可知,受溶液pH、微波效应、重金属络合物形态变化[16]及过渡金属催化[17-18]等因素综合作用,反应过程中Cu和TOC去除率的变化较为复杂。但反应10 min后,其最终去除率随pH0的增加均呈先升后降的趋势,并在pH0为3时达到最佳,分别为97.1%和60.6%。结合相关文献可以推断,pH0较低时,受过量H+影响,H2O2发生无效损耗[式(1)]并生成反应活性较低的水合氢离子[式(2)][19],无法促成Cu-EDTA的有效降解,因而表现出较低的去除率。当pH0增加至3时,经微波及Cu2+催化作用,H2O2可实现⋅OH的稳定转化[式(3)~式(7)],且 Cu-EDTA 质子化产物CuHEDTA-更易与⋅OH结合,促进Cu和TOC的去除[7]。pH0大于3时,体系去除率明显降低,主要归因于(1)偏中性和碱性条件⋅OH氧化还原电位(E0)逐渐衰减[20];(2)pH0高于4.2时,游离态Cu(Ⅱ)逐渐沉淀,导致羟基自由基产生量不断减少;(3)碱性条件下氧化中间产物Cu(Ⅲ)成为主要活性物质,较⋅OH而言其活性偏低[21],不利于氧化破络和有机碳矿化的进行。

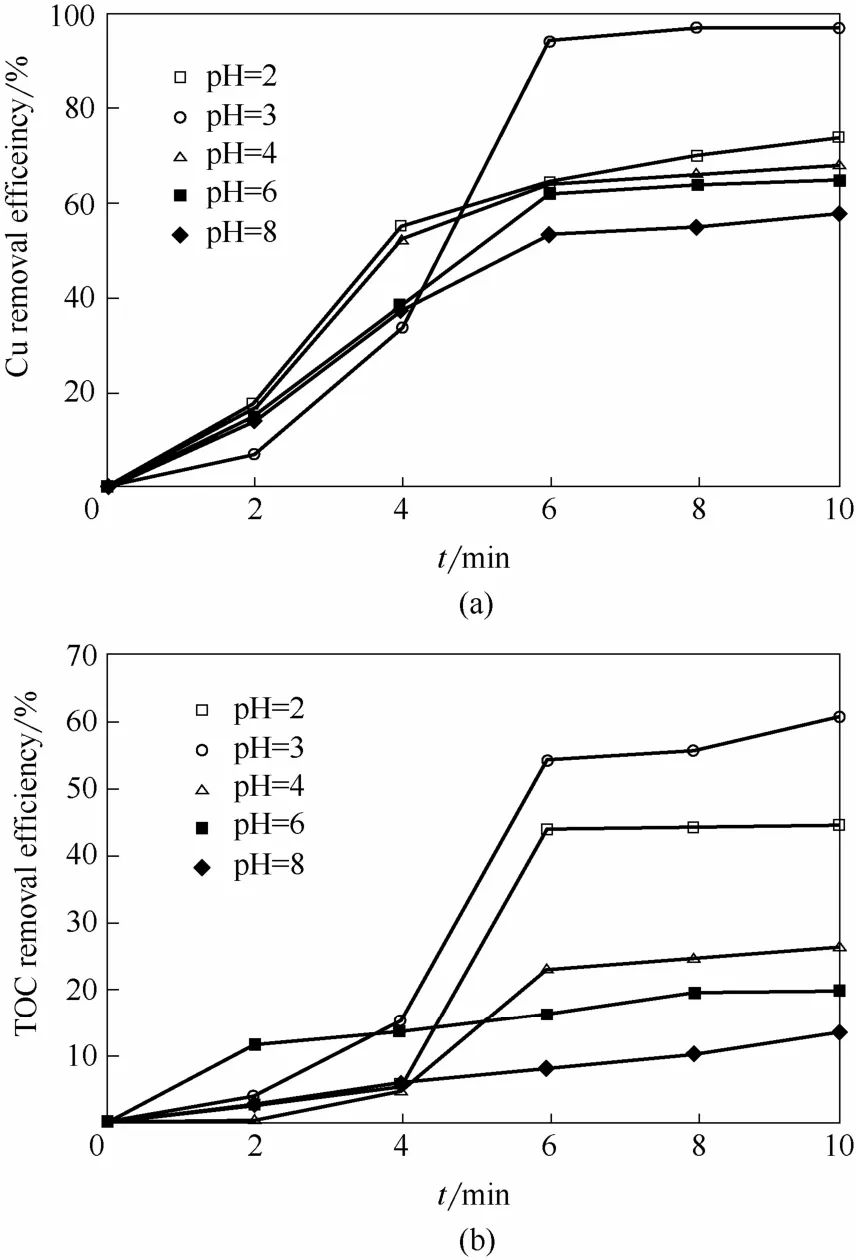
图1 初始pH对Cu和TOC去除效能的影响Fig.1 Effect of initial pH on removal efficiencies of Cu and TOC in MW-H2O2 systems(Cu-EDTA initial concentration=1.57 mmol·L-1,H2O2 dosage=41 mmol·L-1,micowave power=210 W)
2.2 H2O2投加量对MW-H2O2工艺处理效率的影响

图2 H2O2投加量对Cu和TOC去除效能的影响Fig.2 Effect of H2O2 dosage on removal efficiencies of Cu and TOC in MW-H2O2 systems (Cu-EDTA initial concentration=1.57 mmol·L-1,initial pH=3,microwave power=210 W)
在 Cu-EDTA 初始浓度为 1.57 mmol·L-1,pH0为3,微波功率为210 W,反应时间为10 min条件下,考察H2O2投加量对MW-H2O2工艺处理效率的影响。如图2所示,当H2O2投加量从8 mmol·L-1增加至41 mmol·L-1时,Cu去除率从55.0%提高至96.9%,TOC去除率从29.9%上升至60.6%。可以看出,适量浓度的H2O2有利于体系氧化效能的提高。过量 H2O2易与⋅OH 发生副反应[式(8)~式(10)],对 TOC去除率的进一步提高具有抑制效应[22],但对 Cu去除率影响较小。该条件下两者的变化差异主要归因于不同的去除机理。Kabdaşlı等[23]认为仅通过氧化部分有机物,即可破坏金属-络合物间的配位键,从而促进络合态重金属向游离态转变。因此,相对于有机物的完全矿化,络合态重金属的游离需要较少的羟基自由基。在本研究中,H2O2泯灭情况下产生的羟基自由基仍能满足络合体系的破络,但削弱了 TOC的去除能力,因而表现出不同氧化特性。综合污染物去除效率及经济性考虑,确定该初始条件下的最佳H2O2投加量为41 mmol·L-1。
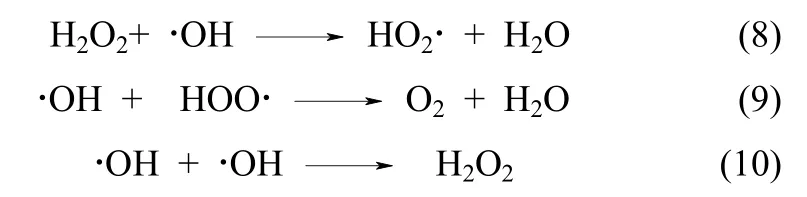
2.3 微波功率对MW-H2O2工艺处理效率的影响
在Cu-EDTA初始浓度为1.57 mmol·L-1,H2O2投加量为 41 mmol·L-1,pH0为 3,反应时间为 10 min时,微波功率对体系中Cu和TOC去除效率的影响如图 3(a)、(b)所示。随着微波功率的增强,污染物分子热运动加剧,反应体系升温速率明显加快,达到沸腾温度所需的时间迅速缩短[图3(c)]。Liu等[24]认为高温条件有利于加速H2O2解离形成⋅OH,增加污染物分子与⋅OH间的反应概率。因此,该反应阶段(即0~6 min范围内)微波功率的增强对体系中Cu和TOC的去除具有促进作用。然而,恒定温度条件下(即6~10 min范围内),微波功率的增强并未明显改变Cu和TOC的去除效率,当微波功率高于210 W时甚至表现出一定的降解抑制作用,这可能是由于在高微波功率下反应体系剧烈的分子热运动导致⋅OH之间的自由基终止反应。Zalat等[25]指出,微波的致热效应主要源于水及极性分子对微波能量的吸收,而非热效应则对应于温度及其他过程参数恒定条件下反应体系化学、生化或物理行为的改变。可以看出,MW-H2O2工艺氧化降解Cu-EDTA过程中,微波具有双重作用。考虑到高功率微波的能耗及其抑制作用,确定最佳微波功率为210 W。
2.4 共存物质对MW-H2O2工艺处理效率的影响
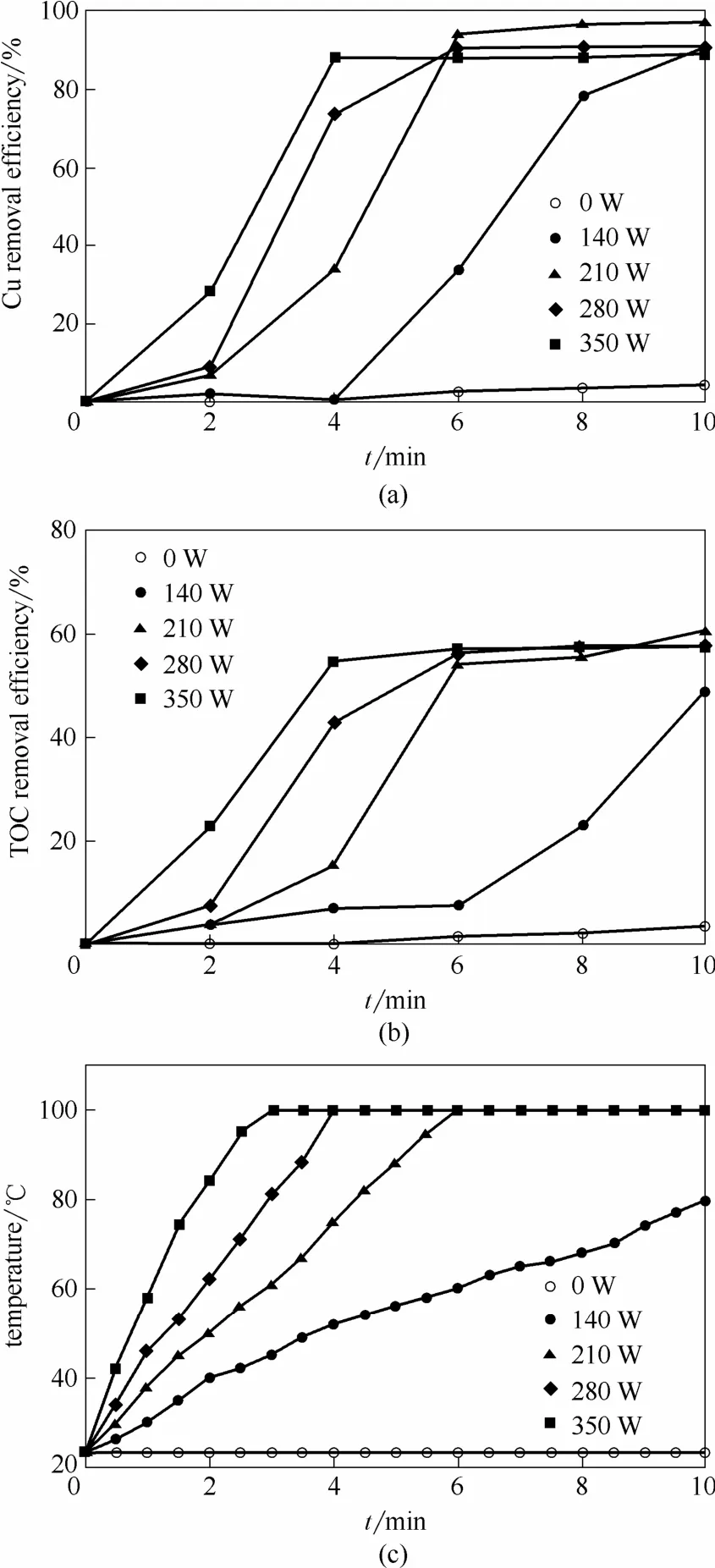
图3 微波功率对Cu和TOC去除效能的影响及反应体系温度的变化Fig.3 Effect of microwave power on removal efficiencies of Cu and TOC in MW-H2O2 systems and corresponding variation of temperature (Cu-EDTA initial concentration=1.57 mmol·L-1,initial pH=3,H2O2 dosage=41 mmol·L-1)
由图4可知,Cl-存在情况下,反应初期(< 4 min)Cu和TOC去除率明显降低,可能是因为Cl-与Cu-EDTA氧化破络释放的游离态Cu2+反应生成CuCl+、CuCl2等络合物,阻碍Cu2+催化H2O2产生⋅OH[26];随着体系温度不断上升,上述络合物逐渐失稳而重新解离,因此最终去除率与对照组几乎无差异。理论上,在酸性条件下,可以与 Cu+发生氧化反应,降低⋅OH 生成量[式(11)],对有机物的氧化降解具有抑制作用。然而,随着反应的进行,不断被消耗并以NO2气态形式逸出,表现为抑制作用的逐渐削减。在微波辐射作用下,Cu-EDTA的氧化破络过程受干扰较小,Cu和TOC去除率变化趋势几乎与对照组完全一致。由于具有还原性,易与Cu-EDTA争夺⋅OH[27],并被氧化为次磷酸根和磷酸根,因此反应初期 Cu及TOC去除率相对较低;而反应4 min后去除速率大幅增加,与对照组相比最终去除率略有提高,可能是因为 Cu2+与磷酸根生成的淡蓝色Cu3(PO4)2沉淀在微波作用下具有“热点”效应[28],从而增强了体系的氧化效能。
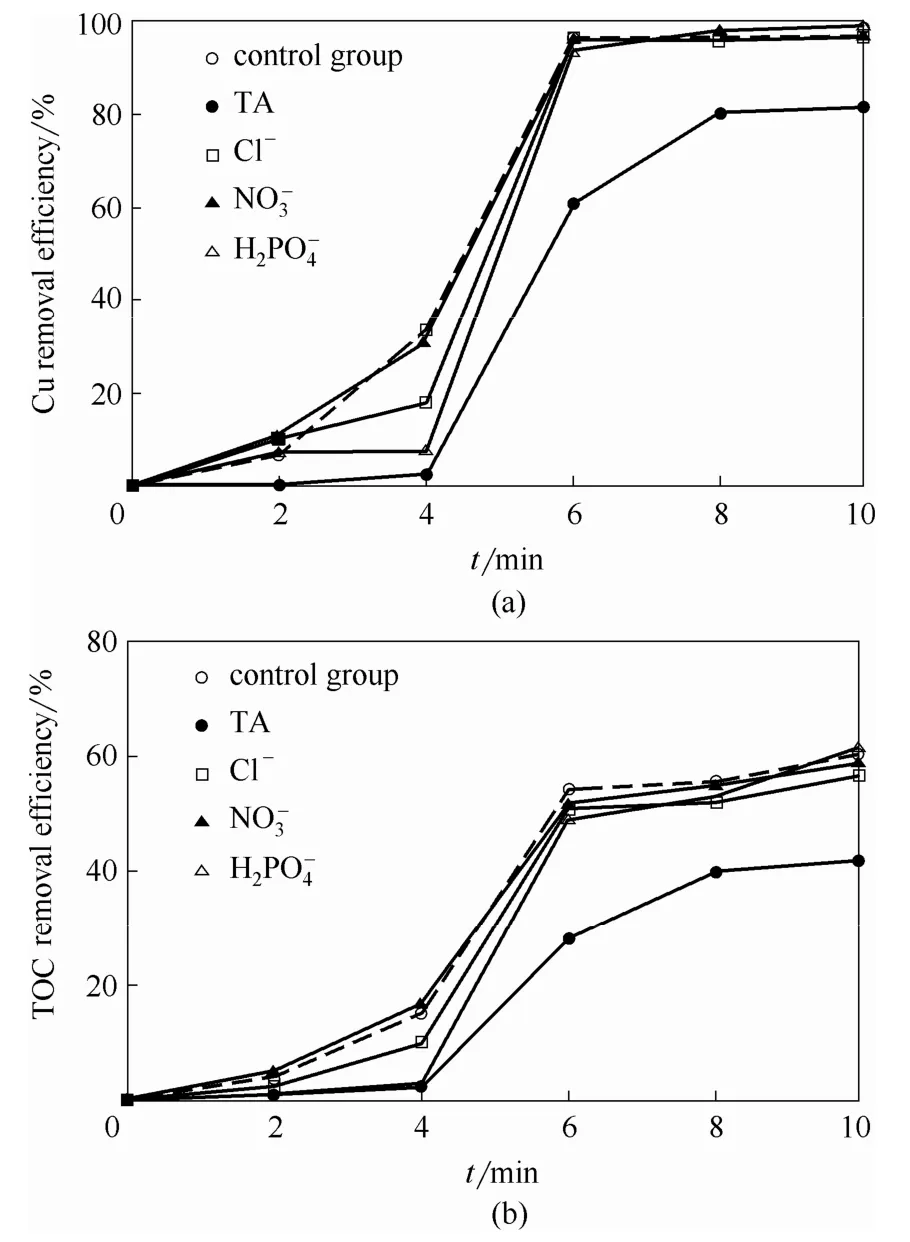
图4 共存物质对Cu和TOC去除效能的影响Fig.4 Effect of coexistent substances on removal efficiencies of Cu and TOC in MW-H2O2 systems (Cu-EDTA initial concentration=1.57 mmol·L-1,initial pH=3,H2O2 dosage=41 mmol·L-1,microwave power=210 W)

酒石酸作为有机络合剂,可以与Cu形成多配体络合物,不利于Cu以及TOC的去除;同时由于亲电子剂⋅OH几乎可以与富电子有机化合物进行非选择性反应[28],因此自身氧化降解过程中,酒石酸将竞争性消耗⋅OH,从而导致Cu-EDTA氧化降解过程中Cu和TOC去除效率的显著降低。
2.5 MW-H2O2工艺处理Cu-EDTA机制分析
为进一步了解MW-H2O2工艺处理Cu-EDTA的反应机制,在Cu-EDTA初始浓度为1.57 mmol·L-1,pH0为 3,H2O2投加量为 41 mmol·L-1,微波功率为210 W情况下,考察了Cu-EDTA降解过程中紫外-可见光吸收光谱随时间的变化,结果如图5所示。Cu-EDTA紫外特征吸收峰位于240 nm附近[29],主要归因于重金属-有机络合物体系中电子给体EDTA与电子受体Cu(Ⅱ)间产生的电荷转移跃迁。经MW-H2O2工艺氧化处理3 min后,该特征峰吸光度略有减少,表明部分 Cu-EDTA络合体系已被破坏。当反应时间延长至4 min时,240 nm处特征峰基本消失,主要特征吸收峰蓝移至210 nm附近,并在240 nm处伴有肩峰产生。Xu等[21]认为前者主要归属于Cu-ED2A和Cu-EDMA,而后者主要归属于 Cu-IMDA和 Cu-NTA。可以推测,在该阶段Cu-EDTA几乎被完全氧化,并生成 Cu-ED2A、Cu-EDMA、Cu-IMDA和Cu-NTA等多种中间产物。微波作用 4~6 min范围内,上述中间产物大幅降解,表现为主要特征吸收峰的不断蓝移及肩峰吸光度的显著降低,这与最佳条件下Cu和TOC的快速去除相吻合。当反应时间达到8~10 min时,反应基本达到平衡,仅206 nm处存在特征吸收峰。Huang等[7]指出,Cu-EDTA的降解路径主要是去羧基化,在矿化不彻底时生成羧酸类中间产物(如水合乙醛酸、草酸等)。因此,反应体系中仍有部分羧酸类物质未完全降解,这与TOC最终去除效率(60.7%)相一致。
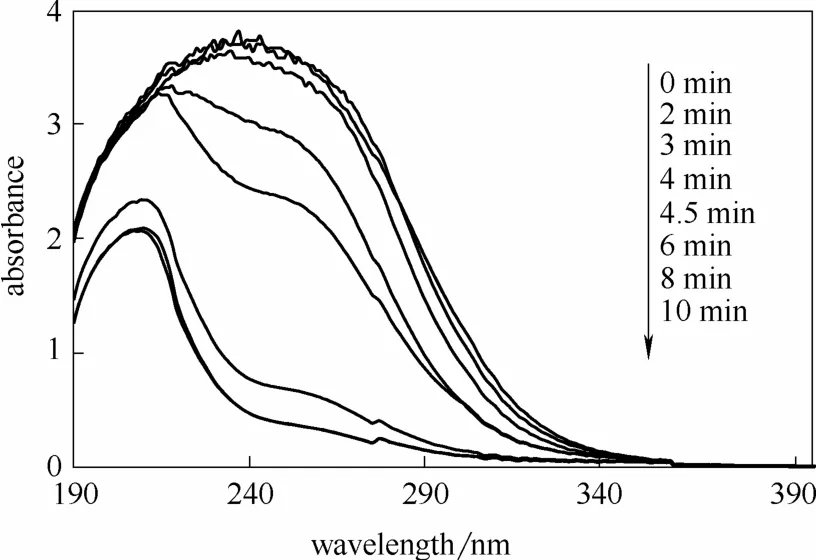
图5 Cu-EDTA降解过程紫外吸收光谱变化Fig.5 Variations of ultraviolet adsorption spectrums of Cu-EDTA oxidized by MW-H2O2 process(Cu-EDTA initial concentration=1.57 mmol·L-1,initial pH=3,H2O2 dosage=41 mmol·L-1,microwave power=210 W)
Cu-EDTA氧化降解过程中对应的氨氮(NH3-N)、无机碳浓度(IC)和pH变化如图6所示。随着反应时间的增加,NH3-N浓度不断累积。在微波作用2~4 min时其增长速率最为明显,表明经微波作用,Cu-EDTA分子结构中—N—(CH2—COOH)—官能团优先发生N—C断裂生成水合乙醛酸,并进一步氧化降解形成 NH3-N;而反应后期NH3-N浓度的增长则主要归因于Cu-EDTA脱酸中间产物形成的小分子有机酸的进一步降解。对应于NH3-N浓度的变化,反应体系pH从初始值3自发增长至8,可以推测其增加原因主要是NH3-N的生成以及脱酸中间体的质子化作用[7,30]。此外,IC随时间增加呈缓慢增长趋势,表明有机物矿化产生的CO2对反应体系pH的变化影响较小。
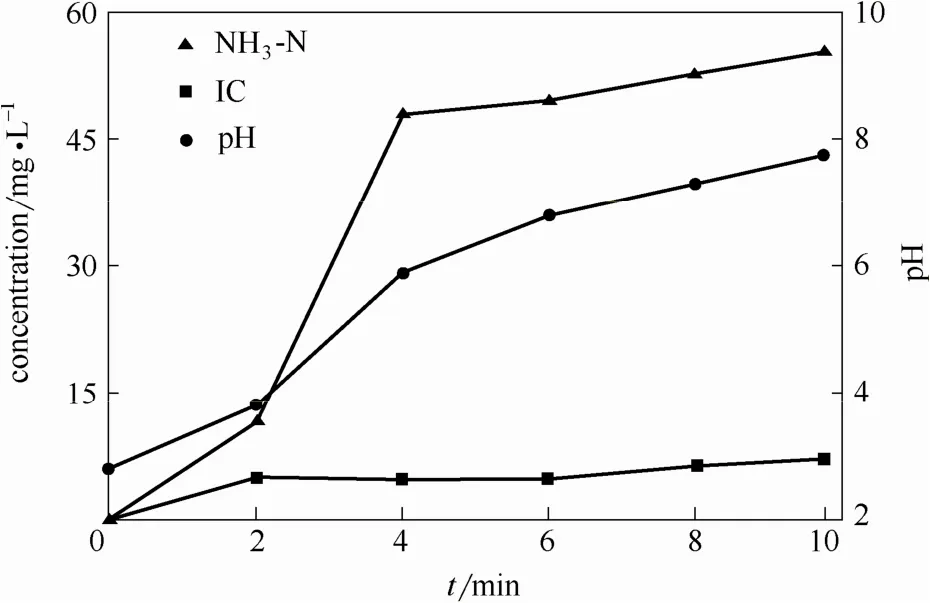
图6 Cu-EDTA氧化降解过程NH3-N、IC浓度及pH变化Fig.6 Variations of NH3-N,IC and pH in MW-H2O2 systems for Cu-EDTA treatment(Cu-EDTA initial concentration=1.57 mmol·L-1,initial pH=3,H2O2 dosage=41 mmol·L-1,microwave power=210 W)
2.6 污泥组成分析
对MW-H2O2工艺污泥产物组成进行了XPS分析,结果如图7(a)所示。由图7(a)可知,沉淀产物主要由Cu和O两种元素构成,其中Cu元素结合能在933.6和953.7 eV处存在显著特征峰,且在962.2和941.4 eV处具有明显的震激伴峰[图7(b)],表明Cu元素主要以+2价形式存在[31-32]。O元素结合能在529.9eV处存在最高吸收峰,对应于CuO中O的结合能[1,33],因此推断沉淀污泥的主要成分为CuO。
此外,污泥产物的XRD谱图如图8所示。通过MDI-Jade软件分析,其与CuO晶型理论衍射峰基本相同[21],这与XPS结果相一致。综合上述结论,推测在Cu-EDTA降解过程中,络合态Cu逐渐转换为游离态Cu,并形成氢氧化物沉淀,但受微波致热效应影响,Cu(OH)2在高温条件下分解为 CuO与 H2O[34]。
2.7 不同处理工艺性能比较
在 Cu-EDTA 浓度为 1.57 mmol·L-1,初始 pH为3,H2O2投加量为41 mmol·L-1,反应时间为10 min同等条件下,从氧化效能、出水电导率、产泥量及H2O2残余浓度角度,综合对比MW-H2O2工艺(微波功率为210 W)与Fenton工艺(Fe2+浓度为26.8 mmol·L-1)处理性能。
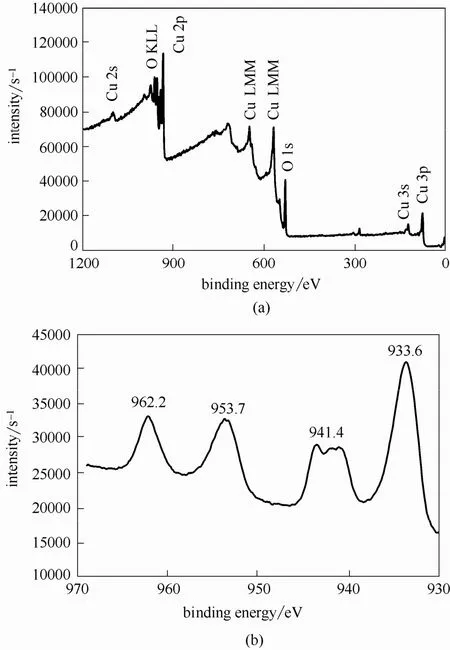
图7 污泥产物的XPS全谱及Cu元素窄谱Fig.7 Full XPS spectrum of sludge formed in MW-H2O2 process and narrow spectrum of Cu element(Cu-EDTA initial concentration=1.57 mmol·L-1,initial pH=3,H2O2 dosage=41 mmol·L-1,microwave power=210 W)
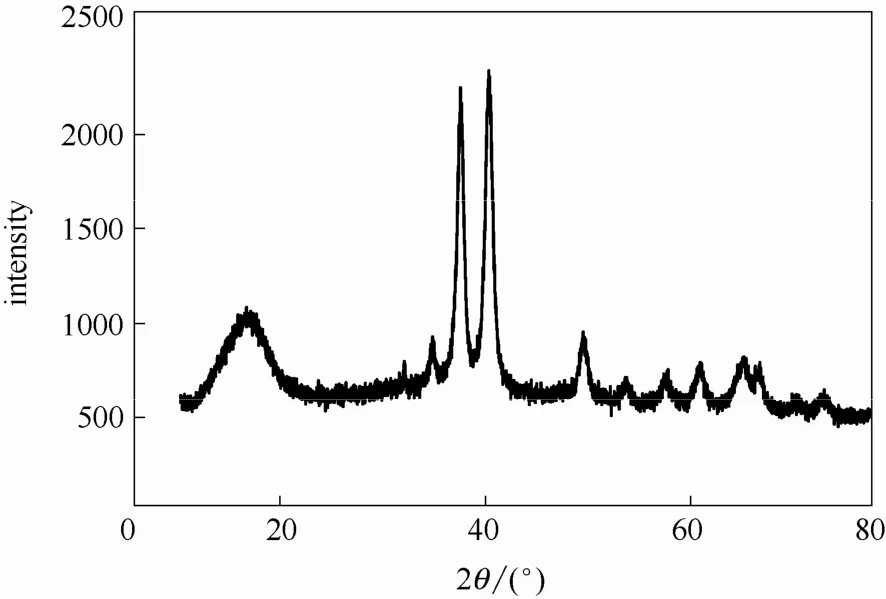
图8 污泥产物的XRD谱图Fig.8 XRD pattern of sludge formed in MW-H2O2 process(Cu-EDTA initial concentration=1.57 mmol·L-1,initial pH=3,H2O2 dosage=41 mmol·L-1,microwave power=210 W)
如表1所示,相比Fenton工艺,MW-H2O2工艺表现出对过氧化氢的高效利用,具有优越的氧化效能,反应10 min后Cu和TOC去除率高达97.0%和60.7%。由于未额外投加Fe2+催化剂,其出水电导率及产泥量均较低,分别为 1.8 mS·cm-1和0.15 g·L-1,这无疑有利于生化反应及污泥的后续处理。因此,针对含Cu-EDTA废水的氧化处理,MW-H2O2工艺较传统Fenton更具优势。

表1 不同工艺处理Cu-EDTA的氧化效能、出水电导率、产泥量及过氧化氢残余浓度比较Table 1 Comparison of oxidation efficiency,effluent conductivity,sludge yield and residual H2O2 concentration in different systems for Cu-EDTA treatment
3 结 论
(1)采用 MW-H2O2工艺处理 1.57 mmol·L-1Cu-EDTA,当初始 pH 为 3,H2O2投加量为 41 mmol·L-1,微波功率为210 W时,反应时间10 min后Cu和TOC去除率分别达到97.1%和60.6%,出水电导率低至 1.8 mS·cm-1,产泥量仅为 0.15 g·L-1。
(3)微波作用4 min后,Cu-EDTA基本完全氧化,并生成多种中间降解产物,其在4~6 min内急剧降解,最终形成小分子羧酸类物质、NH3-N和无机碳;反应过程沉淀产物主要以CuO形式存在。
(4)与传统Fenton工艺相比,MW-H2O2工艺在氧化效能、出水电导率及产泥量等方面表现出显著优势,可克服其存在的诸多缺陷。
[1]SHIH Y J,LIN C P,HUANG Y H.Application of Fered-Fenton and chemical precipitation process for the treatment of electroless nickel plating wastewater[J].Separation and Purification Technology,2013,104:100-105.
[2]PRIYA P G,BASHA C A,RAMAMURTHI V,et al.Recovery and reuse of Ni(II) from rinsewater of electroplating industries[J].Journal of Hazardous Materials,2009,163:899-909.
[3]LEE C G,LEE S,PARK J A,et al.Removal of copper,nickel and chromium mixtures from metal plating wastewater by adsorption with modified carbon foam[J].Chemosphere,2017,166:203-211.
[4]HOSSEINI S S,BRINGAS E,TAN N R,et al.Recent progress in development of high performance polymeric membranes and materials for metal plating wastewater treatment:a review[J].Journal of Water Process Engineering,2016,9:78-110.
[5]AL-SHANGNAG M,AL-QODAH Z,BANI-MELHEM K,et al.Heavy metal ions removal from metal plating wastewater using electrocoagulation:kinetic study and process performance[J].Chemical Engineering Journal,2015,260:749-756.
[6]MOUSSAVI G,JIANNI F,SHEKOOHIYAN S.Advanced reduction of Cr(Ⅵ) in real chrome-plating wastewater using a VUV photoreactor:batch and continuous-flow experiments[J].Separation and Purification Technology,2015,151:218-224.
[7]HUANG X F,XU Y,SHAN C,et al.Coupled Cu(Ⅱ)-EDTA degradation and Cu(Ⅱ) removal from acidic wastewater by ozonation:performance,products and pathways[J].Chemical Engineering Journal,2016,299:23-29.
[8]LI T,WANG H J,DONG W Y,et al.Phosphate removal during Fe(Ⅱ)oxidation in the presence of Cu(Ⅱ):characteristics and application for electro-plating wastewater treatment[J].Separation and Purification Technology,2014,132:388-395.
[9]KABDAŞLI I,ARSLAN T,ARSLAN-ALATON I,et al.Organic matter and heavy metal removals from complexed metal plating effluent by the combined electrocoagulation/Fenton process[J].Water Science & Technology,2010,61:2617-2624.
[10]BABUPONNUSAMI A,MUTHUKUMAR K.A review on Fenton and improvements to the Fenton process for wastewater treatment[J].Journal of Environmental Chemical Engineering,2014,2:557-572.
[11]PLIEGO G,ZAZO J A,GARCIA-MUÑOZ P,et al.Trends in the intensification of the Fenton process for wastewater treatment:an overview[J].Critical Reviews in Environmental Science and Technology,2015,45:2611-2692.
[12]JU Y M,YANG S G,DING Y C,et al.Microwave-enhanced H2O2-based process for treating aqueous malachite green solutions:intermediates and degradation mechanism[J].Journal of Hazardous Materials,2009,171(1/2/3):123-132.
[13]PRASANNAKUMAR B R,REGUPATHI I,MURUGESAN T.An optimization study on microwave irradiated decomposition of phenol in the presence of H2O2[J].Journal of Chemical Technology &Biotechnology,2009,84(1):83-91.
[14]RAVERA M,BUICO A,GOSETTI F,et al.Oxidative degradation of 1,5-naphthalenedisulfonic acid in aqueous solutions by microwave irradiation in the presence of H2O2[J].Chemosphere,2009,74(10):1309-1314.
[15]BI X Y,YANG H Y,SUN P S.Microwave-induced oxidation progress for treatment of imidacloprid pesticide wastewater[J].Applied Mechanics & Materials,2012,229/230/231:2489-2492.
[16]马莹莹.铜类芬顿反应对电镀废水中有机物降解的研究[D].南昌:南昌航空大学,2016:72.MA Y Y.Study on degradation of organic pollutants in electroplating waste water by Fenton-like reaction catalyzed by copper ions[D].Nanchang:Nanchang Hangkong University,2016:72.
[17]WANG N N,ZHENG T,JIANG J,et al.Cu(Ⅱ)-Fe(Ⅱ)-H2O2oxidative removal of 3-nitroaniline in water under microwave irradiation[J].Chemical Engineering Journal,2015,260:386-392.
[18]ZHONG X,BARBIER J,DUPREZ D,et al.Modulating the copper oxide morphology and accessibility by using micro-/mesoporous SBA-15 structures as host support:effect on the activity for the CWPO of phenol reaction[J].Applied Catalysis B:Environmental,2012,121:123-134.
[19]NIDHEESH P V,GANDHINATHI R.Trends in electro-Fenton process for water and wastewater treatment:an overview[J].Desalination,2012,299:1-15.
[20]KIM S M,VOGELPOHL A.Degradation of organic pollutants by the photo-Fenton-process[J].Chemical Engineering Technology,1998,21(2):187-191.
[21]XU Z,SHAN C,XIE B H,et al.Decomplexation of Cu(Ⅱ)-EDTA by UV/persulfate and UV/H2O2:efficiency and mechanism[J].Applied Catalysis B:Envrionmental,2017,200:439-447.
[22]SUN J H,SUN S P,FAN M H,et al.A kinetic study on the degradation ofp-nitroaniline by Fenton oxidation process[J].Journal of Hazardous Materials,2007,148(1/2):172-177.
[23]KABDAŞLI I,ARSLAN T,ÖLMEZ-HANCI T,et al.Complexing agent and heavy metal removals from metal plating effluent by electrocoagulation with stainless steel electrodes[J].Journal of Hazardous Materials,2009,165(1/2/3):838-845.
[24]LIU S T,HUANG J,YE Y,et al.Microwave enhanced Fenton process for the removal of methylene blue from aqueous solution[J].Chemical Engineering Journal,2013,215/216:586-590.
[25]ZALAT O A,ELSAYED M A.A study on microwave removal of pyridine from wastewater[J].Journal of Environmental Chemical Engineering,2013,1:137-143.
[26]STASINAKIS A S.Use of selected advanced oxidation processes(AOPs) for wastewater treatment—a mini review[J].Global NEST Journal,2008,10(3):376-385.
[27]马莹莹,吴跃辉,李锦卫,等.镀铜废水中Cu-H2O2体系氧化降解硝基苯[J].环境工程学报,2016,10(9):4775-4782.MA Y Y,WU Y H,LI J W,et al.Oxidative degradation of nitrobenzene catalyzed by Cu2+-H2O2system in copper rinse water[J].Chinese Journal of Environmental Engineering,2016,10(9):4775-4782.
[28]WANG N N,WANG P.Study and application status of microwave in organic wastewater treatment—a review[J].Chemical Engineering Journal,2016,283:193-214.
[29]孟令芝,龚淑玲,何永炳,等.有机波谱分析[M].4版.武汉:武汉大学出版社,2016:330-338.MENG L Z,GONG S L,HENG Y B,et al.Organic Spectrum Analysis[M].4th ed.Wuhan:Wuhan University Press,2016:335-338.
[30]ZHAO X,GUO L,ZHANG B,et al.Photoelectrocatalytic oxidation of Cu(Ⅱ)-EDTA at the TiO2electrode and simultaneous recovery of Cu(Ⅱ) by electrodeposition[J].Environmental Science & Technology,2013,47(9):4480-4488.
[31]MOULDER J F,STICKLE W F,SOBOL P E.Handbook of X-Ray Photoelectron Spectrometers[M].Minnesota:Perkin-Elemer Corporation Physical Electronics Division,1992:32-35
[32]VASQUEZ R P.CuO by XPS[J].Surface Science Spectra,1998,5(4):262-266.
[33]LAN S,XIONG Y,TIAN S,et al.Enhanced self-catalytic degradation of Cu-EDTA in the presence of H2O2/UV:evidence and importance of Cu-peroxide as a photo-active intermediate[J].Applied Catalysis B:Environmental,2016,183:371-376.
[34]AKHAVAN O,AZIMIRAD R,SAFA S,et al.CuO/Cu(OH)2hierarchical nanostructures as bactericidal photocatalysts[J].Journal of Materials Chemistry,2011,21(26):9634.
date:2017-06-15.
Dr.ZHAO Zilong,berthillon@hotmail.com
supported by the Urban Water Pollution Control and Management Generic Technology Integrated Program (2012ZX07206-002)and the Knowledge Innovation Program of Shenzhen Basic Research Project(JCYJ20160318093930497).
Treatment of Cu-EDTA containing wastewater by microwave-H2O2process
WANG Hongjie1,2,CAO Zhe1,2,ZHAO Zilong1,2,DONG Wenyi1,2
(1School of Civil and Environmental Engineering,Harbin Institute of Technology Shenzhen Graduate School,Shenzhen518055,Guangdong,China;2Shenzhen Key Laboratory of Water Resource Application and Environmental Pollution Control,Shenzhen518055,Guangdong,China)
In the present study,microwave-H2O2(MW-H2O2) process was applied for the treatment of Cu-EDTA containing wastewater.The effects of reaction time,initial pH,H2O2dosage,microwave power and coexistent substances were investigated in detail.The corresponding degradation mechanism of Cu-EDTA was also described.The results showed that for the elimination of 1.57 mmol·L-1Cu-EDTA,the highest removal efficiencies of Cu(97.0%) and TOC (60.7%) were achieved under the optimum conditions (i.e.initial pH 3,H2O2dosage 41 mmol·L-1,microwave power 210 W,and reaction time 10 min).In this situation,the effluent conductivity decreased to 1.8 mS·cm-1,and only 0.15 g·L-1of the sludge yield was generated.The presence of coexistent substances such ashad nearly no effects on the degradation processes,while Cl-,and tartaric acid were unfavorable to the oxidation degradation of Cu-EDTA.After treated for 4 min,Cu-EDTA was almost totally oxidized to various Cu-intermediates,which rapidly degraded within 4—6 min,leading to the final formation of low molecular organic acids,NH3-N,and inorganic carbon.The solid sludge mainly presented in the forms of CuO.Compared with traditional Fenton process,MW-H2O2process exhibited more excellent performance in terms of oxidation efficiency,effluent conductivity and sludge yield.
microwave- hydrogen peroxide; Cu-EDTA; oxidation; wastewater; Fenton; pollution
X 78
A
0438—1157(2017)12—4756—08
10.11949/j.issn.0438-1157.20170776
2017-06-15收到初稿,2017-08-11收到修改稿。
联系人:赵子龙。
王宏杰(1983—),男,博士,副研究员。
国家水体污染控制与治理科技重大专项(2012ZX07206-002);深圳市科技计划项目(JCYJ20160318093930497)。

