乌头碱的热解及半衰期研究
刘叶,张锋,李宗孝
(陕西省植物化学重点实验室,陕西 宝鸡 721013)
乌头碱的热解及半衰期研究
刘叶,张锋,李宗孝
(陕西省植物化学重点实验室,陕西 宝鸡 721013)
采用微量热技术及热重法,结合液质联用技术,探讨了乌头碱的热降解机理、水解机理的热效应等,求出乌头碱的半衰期。结果表明,乌头碱在空气氛围中不稳定,碱性溶液中易水解t1/2=0.973 h。空气环境中热分解分3步,其分解温度区间分别为185~213℃,248~468℃和484~579℃。相应的反应级数分别为n=1/4、n=4、n=2。对应的活化能分别是154.53,100.97和120.08 kJ·mol-1。乌头碱应尽可能储存于低温干燥并隔绝空气的环境中。
乌头碱;水解;热解;半衰期;微量热技术;热力学
引 言
天然植物杀虫剂的研究随着人们对农药残留的重视而受到青睐。利用植物资源,开发和创造新农药,已成为现代农药开发的重要途径之一。学者已从辫根七、川乌及附子中分离出了具有代表性的双酯型生物碱:乌头碱(aconitine)、次乌头碱(hypaconitine)、新乌头碱(mesaconitine)[1-13]。近年来一些研究者在新乌头碱结构中引入磺酰基[14-16],如许源等[14]将新乌头碱引入烷酰基,王晓东等[15]合成3,13-酯基新乌头碱,并进行杀虫活性测试,力图进行结构修饰以改善其特性。目前,乌头碱的研究主要集中在分离提取、合成方法探讨及结构修饰、活性测定等几个方面,对于热解及降解机理涉及较少。为了探讨乌头碱热分解、水解及自然条件下的降解与各种因素之间的依赖关系,从乌头碱自身结构分析入手,依据乌头碱分子中存在多个羟基,两个酯基,易形成分子内氢键和分子间氢键[17],水解时由于基团的改变可引起分子几何构型、电子电荷、前线分子轨道改变,进而使毒性发生变化的特点[18],采取热分析动力学的方法和微量热技术,借助乌头碱的结构性质,探讨乌头碱的热降解机理、水解机理以及土壤环境中的热效应,求解半衰期,得到乌头碱在不同环境中的变化特性,为其衍生化研究提供有意义的参考。
1 材料与方法
1.1 仪器与材料
Pyris Diamond TG/DTA SⅡ热重差热热分析仪(Perkin Elmer公司),C80微量量热仪[法国塞塔拉姆(Setaram)],LC-MS(AB Sciex公司),HPLC 98%乌头碱(宝鸡辰光生物科技有限公司),结构见图1。

图1 乌头碱分子结构图Fig.1 Molecular structure of aconitine
1.2 实验方法
1.2.1 TG法测乌头碱的热降解机理 采用热重分析技术(thermogravimetric analysis,TG),通过测定空气、氮气气氛中的热降解机理来对比乌头碱在两种气氛中的稳定性。取一定量的乌头碱于 70 μl Al2O3坩埚内,以相同规格的空坩埚作为参比,分别在空气和氮气气氛下,在 30~700℃,控制升温速率分别为 3、5、10、15和 20℃·min-1得到热降解曲线和数据。
将利用单速率升温,β=5℃·min-1的实验数据分别用多种动力学机理函数代到 Coats-Redfern方程式(1)[19],同时采用 Flynn-Wall-Ozawa方程式(2)[20-24],通过数据拟合、计算和逻辑选择最终获得乌头碱在两种环境下的热降解机理。

1.2.2 微量热法测乌头碱在液态环境中的反应特性采用微量量热法[25-30],控制温度为20℃,依次取30、40、50和 60 μl乌头碱的甲醇溶液(8.55×10-6mol·L-1)与1.5 ml土壤滤液反应作为测量组,对应测量组的配比依次取30、40、50和60 μl甲醇溶液与1.5 ml土壤滤液作为参比,测其热量变化。同上述方法测量同浓度的乌头碱在纯水中的热量变化,得到乌头碱反应的热量变化曲线及焓变,求得反应的摩尔焓变,通过 LC-MS对照验证,确定液态氛围中乌头碱的特性。
以纯水作参比,选取pH 7.4的土壤滤液及自然水进行半衰期的研究。采用测得的数据,以物质的量n对热量Q作图,可得到乌头碱分别在水、土壤滤液中反应的热量与物质的量之间的关系图,若将乌头碱在土壤滤液中的热变化过程看作n级反应,则有式(3)和式(4)

式中,α=H/H0,由式(3)和式(4)可得式(5)
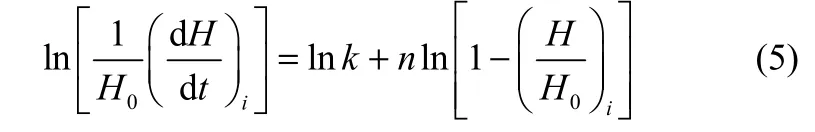
将实验过程中不同质量的乌头碱在土壤滤液中反应所得到数据(dH/dt)i和(H/H0)i代入式(5)中,分别以ln[1/H0(dH/dt)i]对ln[1-(H/H0)i]作图,由斜率可得反应级数n,截距可得lnk,后将k、n的平均值代入式(3)和式(4),得到乌头碱在纯水和 pH 7.4的土壤滤液中反应动力学方程,最终求得半衰期。
2 结果与讨论
2.1 空气、氮气气氛中的热降解机理
采用1.2.1节实验方法即热重法(TG)得乌头碱的热降解曲线如图2。
图2是升温速率为5℃·min-1的TG曲线,其他升温速率下的TG曲线与5℃·min-1的TG曲线图形类似,只是随升温速率的增大TG曲线向高温段移动,对物质热降解的机理无影响。

图2 乌头碱的TG曲线Fig.2 TG curve of aconitine
由图2中发现,乌头碱热分解时,空气气氛下分在3个阶段,而在氮气气氛下只有两个阶段。空气氛围中,温度在185~213℃出现第1个平台,失重率为 10.50%(理论计算为 9.14%),这可能是乌头碱失去了C9位上的酯基所致(—COOCH3,—H);温度在248~468℃为第2阶段,该段乌头碱分子结构发生较大变化,失重率为57.62%,这是由于乌头碱分子骨架大规模分解的缘故(C—C、N—C断裂;—OH、—OMe、—COOPh、—H失去);当温度处于484~579℃,空气气氛下的乌头碱较氮气气氛中多一个步骤的热降解,失重率为31.88%,这是因为空气中的氧气可能将已分解为小分子含C化合物进一步氧化生成碳氧化合物,剩余骨架被完全氧化分解。
氮气气氛中乌头碱热分解分为两个阶段:①温度在188~252℃,失重率为9.50%(—COOCH3,—H);② 温度在283~580℃,失重率为74.27%(多个C—C、N—C断裂;—OH、—OMe、—COOPh、—H失去)。在600℃附近时,可看出空气中的乌头碱热分解曲线已经趋于平缓,且乌头碱剩余几乎为零,说明其热分解过程已完成。而此时氮气气氛下,乌头碱在剩余20%的量以后就不受温度影响,不再发生降解行为,说明乌头碱未被完全氧化分解。温度在191~339℃,乌头碱受热失重的程度为空气中大于氮气中;温度在339~519℃,乌头碱受热失重的程度为空气中小于氮气中;温度在 519℃以上,乌头碱受热失重的程度为空气中大于氮气中。这是由于乌头碱在两种气氛中的热降解机理不同所致。
2.1.1 单升温速率的非等温法 将β=5℃·min-1的实验数据分别用 36种动力学机理函数代到Coats-Redfern方程式(1)中,经线性拟合结果见表1。
表1 -对应36种机理函数线性回归结果Table 1 Linear regression results of -
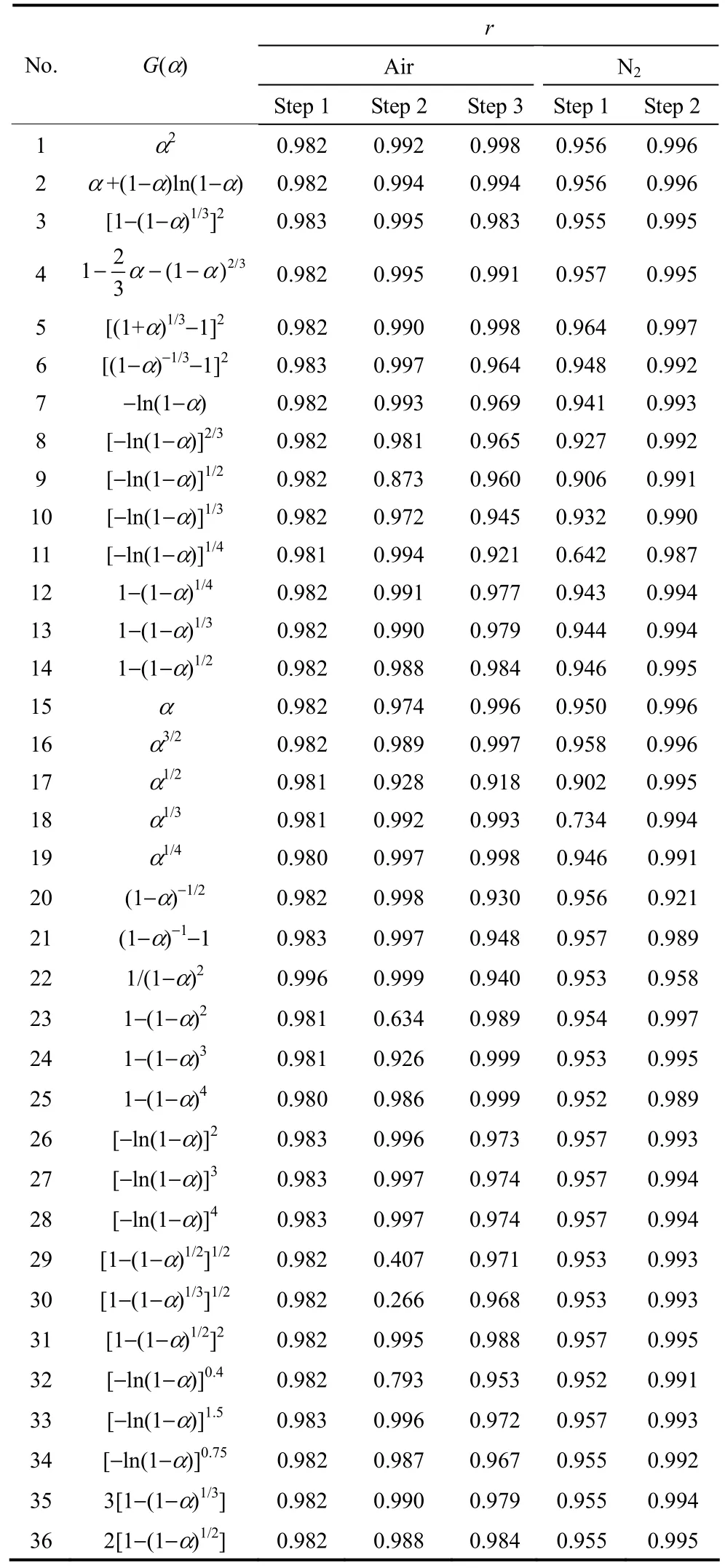
表1 -对应36种机理函数线性回归结果Table 1 Linear regression results of -
r No.G(α)Air N2Step 1 Step 2 Step 3 Step 1 Step 2 1 α2 0.982 0.992 0.998 0.956 0.996 2 α +(1-α)ln(1-α) 0.982 0.994 0.994 0.956 0.996 3 [1-(1-α)1/3]2 0.983 0.995 0.983 0.955 0.995 41 3α α2/3- -(1- ) 0.982 0.995 0.991 0.957 0.995 2 5 [(1+α)1/3-1]2 0.982 0.990 0.998 0.964 0.997 6 [(1-α)-1/3-1]2 0.983 0.997 0.964 0.948 0.992 7 -ln(1-α) 0.982 0.993 0.969 0.941 0.993 8 [-ln(1-α)]2/3 0.982 0.981 0.965 0.927 0.992 9 [-ln(1-α)]1/2 0.982 0.873 0.960 0.906 0.991 10 [-ln(1-α)]1/3 0.982 0.972 0.945 0.932 0.990 11 [-ln(1-α)]1/4 0.981 0.994 0.921 0.642 0.987 12 1-(1-α)1/4 0.982 0.991 0.977 0.943 0.994 13 1-(1-α)1/3 0.982 0.990 0.979 0.944 0.994 14 1-(1-α)1/2 0.982 0.988 0.984 0.946 0.995 15 α 0.982 0.974 0.996 0.950 0.996 16 α3/2 0.982 0.989 0.997 0.958 0.996 17 α1/2 0.981 0.928 0.918 0.902 0.995 18 α1/3 0.981 0.992 0.993 0.734 0.994 19 α1/4 0.980 0.997 0.998 0.946 0.991 20 (1-α)-1/2 0.982 0.998 0.930 0.956 0.921 21 (1-α)-1-1 0.983 0.997 0.948 0.957 0.989 22 1/(1-α)2 0.996 0.999 0.940 0.953 0.958 23 1-(1-α)2 0.981 0.634 0.989 0.954 0.997 24 1-(1-α)3 0.981 0.926 0.999 0.953 0.995 25 1-(1-α)4 0.980 0.986 0.999 0.952 0.989 26 [-ln(1-α)]2 0.983 0.996 0.973 0.957 0.993 27 [-ln(1-α)]3 0.983 0.997 0.974 0.957 0.994 28 [-ln(1-α)]4 0.983 0.997 0.974 0.957 0.994 29 [1-(1-α)1/2]1/2 0.982 0.407 0.971 0.953 0.993 30 [1-(1-α)1/3]1/2 0.982 0.266 0.968 0.953 0.993 31 [1-(1-α)1/2]2 0.982 0.995 0.988 0.957 0.995 32 [-ln(1-α)]0.4 0.982 0.793 0.953 0.952 0.991 33 [-ln(1-α)]1.5 0.983 0.996 0.972 0.957 0.993 34 [-ln(1-α)]0.75 0.982 0.987 0.967 0.955 0.992 35 3[1-(1-α)1/3] 0.982 0.990 0.979 0.955 0.994 36 2[1-(1-α)1/2] 0.982 0.988 0.984 0.955 0.995
2.1.2 Flynn-Wall-Ozawa法 在空气气氛下,控制升温速率β=3、5、10和20℃·min-1,分别进行扫描得到实验结果如图3所示。
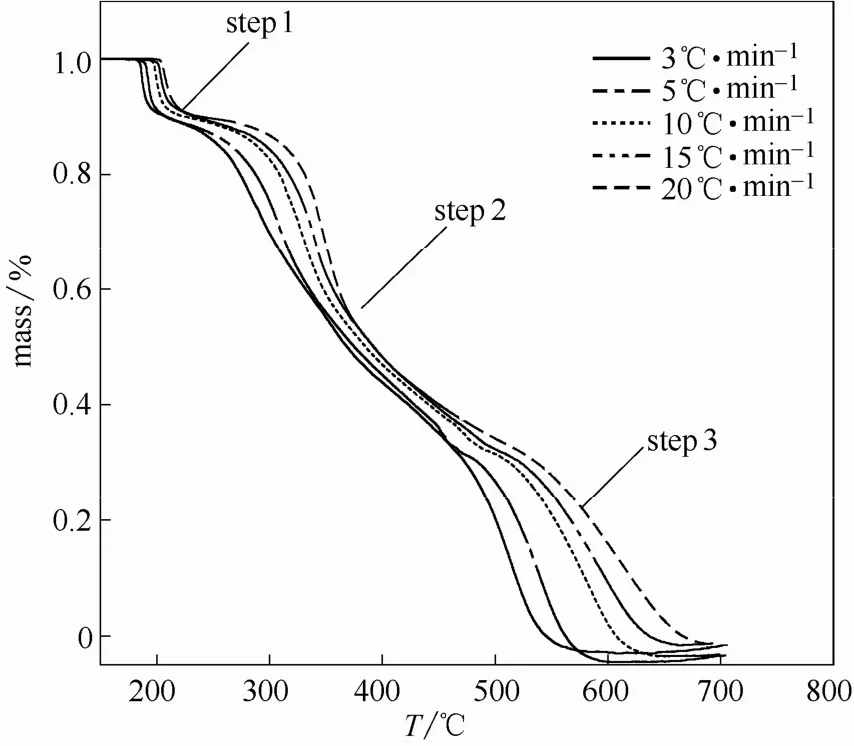
图3 空气气氛下乌头碱在不同升温速率下的TG曲线Fig.3 TG curve of aconitine in air
图3显示,随着升温速率的升高,反应朝高温方向移动。取不同升温速率下,实验数据中转换率相等处的数据,采用Flynn-Wall-Ozawa公式,以lgβ对1/T作图(图4),由斜率得活化能E。
由图4可知,同一反应阶段中任意转换率下,lgβ对 1/T作图得到直线斜率近似相等,因此活化能可由任意直线斜率求得,结果见表2。

表2 空气气氛下Ozawa公式得到的活化能Table 2 Ea of Ozawa formula in air atmosphere
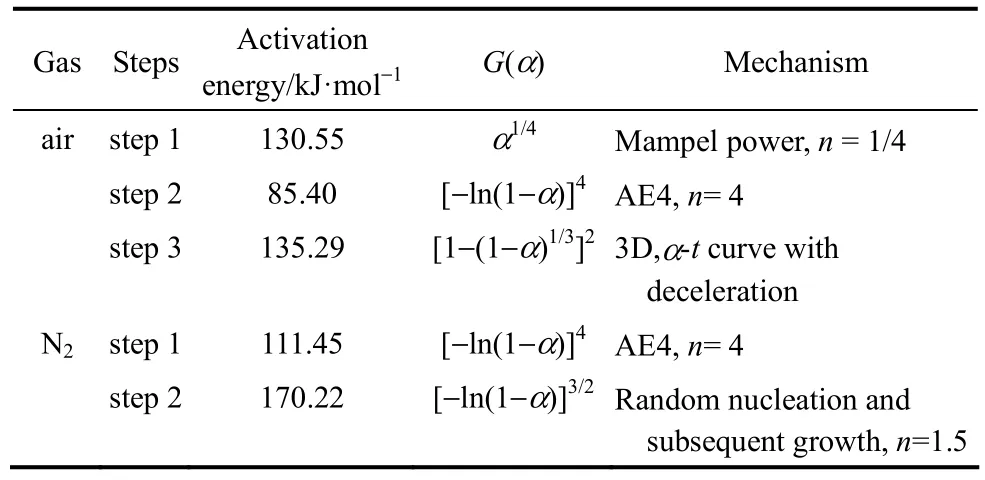
表3 乌头碱的热降解参数Table 3 Thermal degradation parameters of aconitine
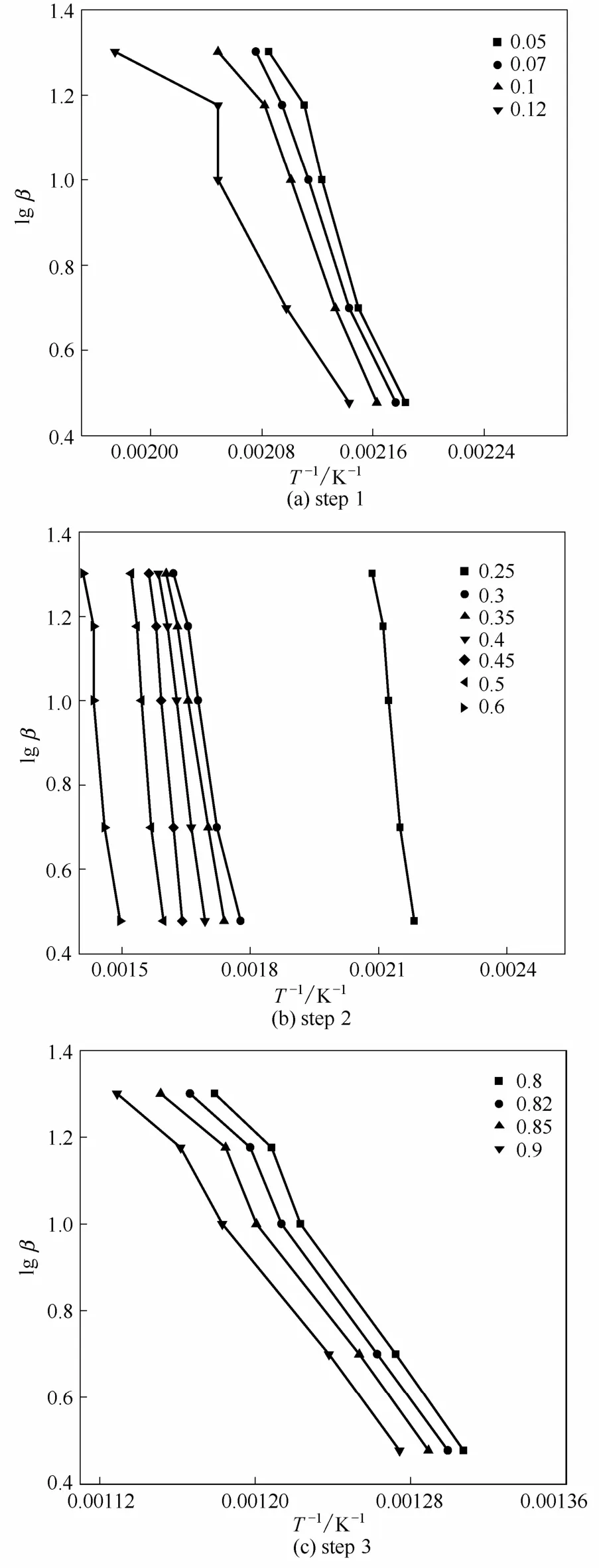
图4 lgβ-的关系Fig.4 Relationship of lgβvs
表3显示,乌头碱在空气和氮气气氛下的热降解机理不同,一般而言反应级数越大其反应越复杂越不易进行。然而乌头碱在空气气氛中3个阶段的热降解过程反应级数依次为n=1/4、n=4、n=2,且第2阶段较高级数的反应其活化能小于第1和第3阶段的简单反应的活化能,这可能与反应的最佳路径有关。同时对比两种气氛下乌头碱第1阶段热降解得到的机理函数微分式,发现氧气中反应级数n=1/4,而氮气中n=4,说明乌头碱在空气中的热稳定性较之氮气中要小,即乌头碱在空气中容易被降解。
2.2 液态环境下乌头碱的特性
利用 1.2.2节方法测得乌头碱在液态氛围中反应的热量变化曲线及焓变如图5、表4所示。
从表4可知,乌头碱在纯水和土壤滤液中的焓变不随乌头碱的量变而变化,因此其反应的摩尔焓变可用平均摩尔焓变替代,即ΔHm,纯水为 3.647×103kJ·mol-1,ΔHm,土壤滤液为 1.860×103kJ·mol-1。
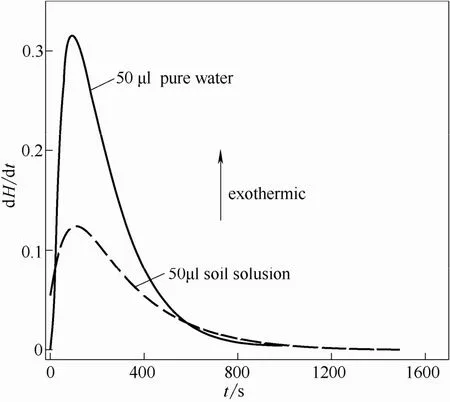
图5 乌头碱放热速率的变化Fig.5 Heat release rate (dH/dt) in entire reaction process of aconitine
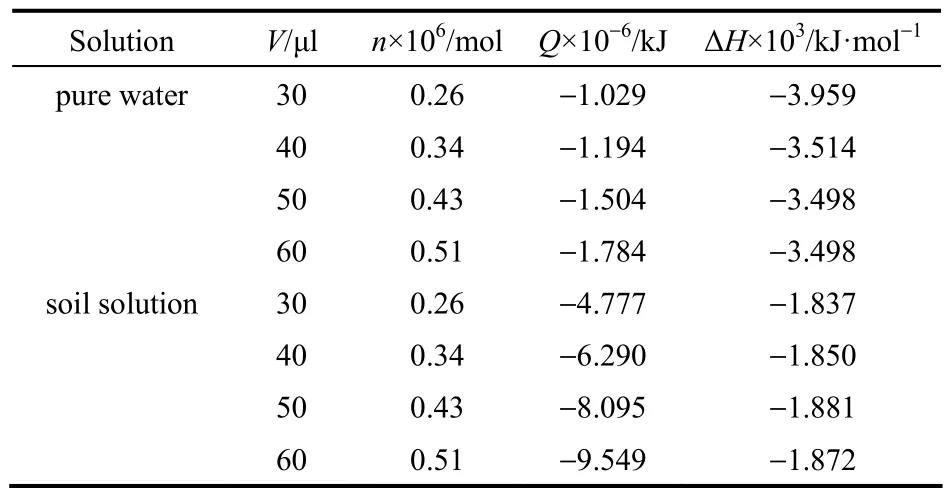
表4 乌头碱反应的焓变Table 4 Enthalpy variation of aconitine in entire reaction process
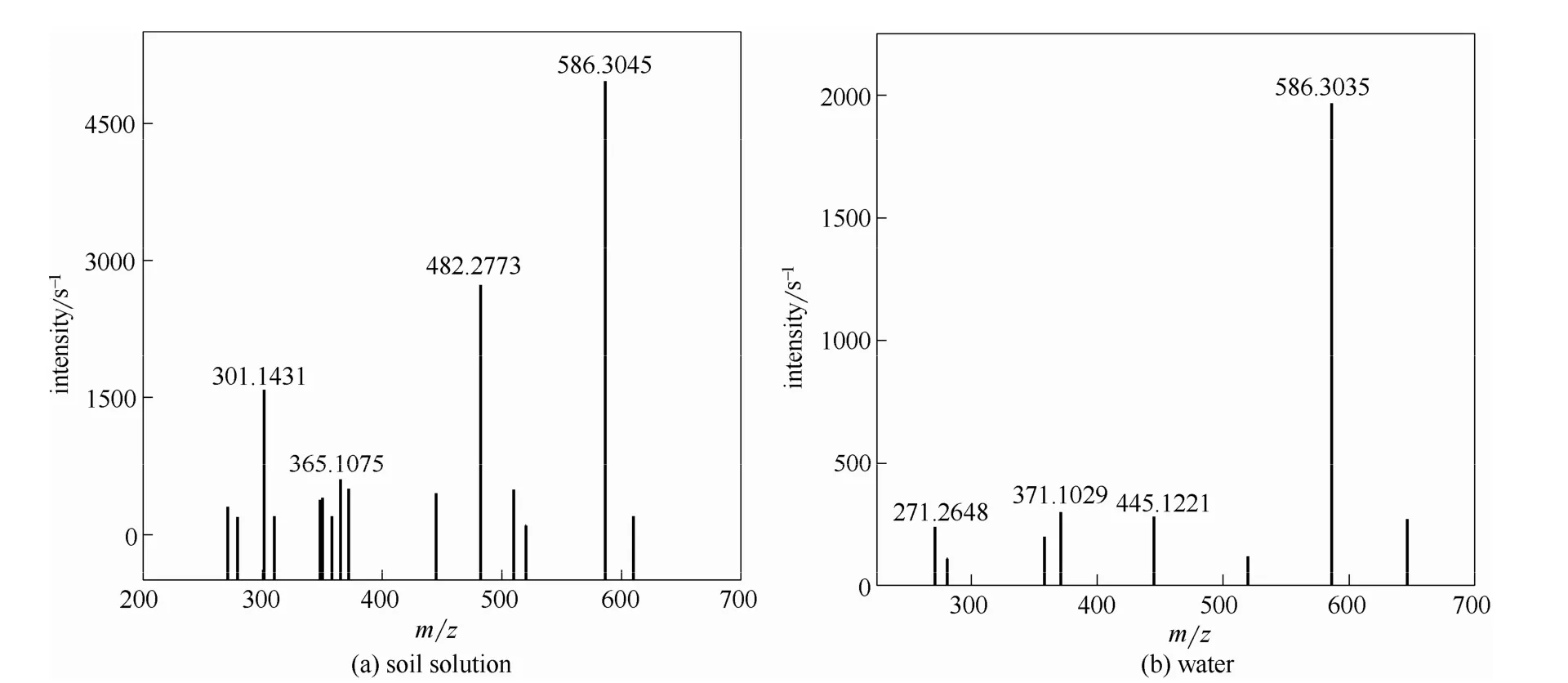
图6 乌头碱反应产物的质谱图Fig.6 Spectrum of aconitine reaction product
由图5可以看出,乌头碱在纯水和土壤滤液两种环境中均为放热反应,但热量变化却存在明显差异。首先,在0~580 s之间时,乌头碱在纯水中引起的热量变化远大于土壤滤液中热量变化,而580 s以后,土壤滤液环境的热量变化却大于纯水。其次,二者的峰形也存在差异,乌头碱与纯水反应形成的量热峰尖而窄,相反,乌头碱与土壤滤液反应形成的峰形矮而宽。造成这两点明显差异的原因,可能是由于反应初期主要发生了乌头碱的溶解行为,在纯水中乌头碱溶解较快,放出大量的热;在土壤滤液中存在其他物质使得乌头碱的溶解较慢,放热也相对较少;反应到一定时间,乌头碱在这两种环境中的溶解行为减弱,逐渐转变为其他形式的反应,由于土壤滤液的环境比纯水要复杂,与乌头碱发生其他作用的机会较大,因此出现了580 s之后的现象,而产生这种现象可能是因为乌头碱在这两种环境中的分解行为所致。为证明以上推论,通过液质联用仪LC-MS,将乌头碱标准品以及两种反应12 h后的物质进行检测得到谱图,如图6所示。
对比发现,乌头碱在纯水中和土壤滤液中反应12 h后,其646.3242(乌头碱的特征峰)处的特征峰消失,说明乌头碱已被全部裂解;其次,在两种反应产物MS图中可以看出,乌头碱的裂解碎片有所不同以及碎片的响应程度也不同,与纯水反应后586.3045处的碎片响应程度大于土壤滤液中的碎片响应,同时土壤滤液中小分子量的碎片响应大于纯水,说明乌头碱在土壤滤液中更易裂解。由此证明上述对于乌头碱在两种液体环境中随时间的变化行为的描述是正确的。
2.3 温度和pH对乌头碱水解的影响
2.3.1 温度对水解的影响 取 50μl浓度为8.55×10-6mol·L-1乌头碱的甲醇溶液与 1.5 ml土壤滤液(pH 7.4)反应作为测量组,另取50 μl甲醇溶液与1.5 ml土壤滤液(pH 7.4)作为参比,采用微量热仪,测定不同温度下乌头碱反应的热量变化,得结果如表5。

表5 乌头碱与土壤滤液(pH 7.4)作用的焓变Table 5 Enthalpies of aconitine reaction in soil filtrate (pH 7.4)
从表5可以看出,整体而言,乌头碱在土壤滤液中发生水解反应放出的热量随着温度的升高而降低。但由于伴随化学反应的发生,各温度段热量变化幅度不尽相同。当开始升温时,ΔH变化较大,这是因为水解过程中,旧键破坏和新键重组时反应热竞争的结果。
2.3.2 pH对水解的影响 采用微量量热技术,温度为 20℃,取 50 μl浓度为 8.55×10-6mol·L-1乌头碱的甲醇溶液分别与1.5 ml pH不同的土壤滤液反应作为测量,另取50 μl甲醇溶和1.5 ml pH不同的土壤滤液反应作为参比,测其热量变化,得到焓变值如表6。

表6 乌头碱与不同pH土壤滤液作用的焓变Table 6 Enthalpy of aconitine in different pH soil filtrate

图7 不同pH下乌头碱反应产物的质谱图Fig.7 Spectrum of aconitine reaction product in different pH soil filtrate
由表6可见,在不同pH时土壤滤液中的热量变化不同,其放出的热量顺序为碱性>中性>酸性。同样,将反应1.5 h后的样品测量LC-MS,如图7所示。
图7显示,乌头碱的646.3242特征峰在3种溶液中响应强度不同,其响应强度:pH 6.4 > pH 7.4 >pH 8.5;而且随pH的增大,图中出现更多的碎片离子峰(646、586、493、429、348、301和274依次对应 C34H47NO11H+、C32H43NO9H+、C29H34NO6H+、C27H26NO4H+、C25H17NOH+、C21H18NOH+和C20H19NH+)。由此说明乌头碱在碱性的土壤滤液中分解最彻底,中性次之,酸性最弱。而作为杀虫剂,既要在相对较长的时间内保持其活性,以便发挥出足够好的杀虫效果。又要在相对较短的时间内能被自然所降解,不会对环境造成污染。因此,在中性范围的土壤条件下,乌头碱能最大程度地发挥其作为杀虫剂的优势。
2.4 乌头碱半衰期的计算
采用表6数据,以物质的量n对热量Q作图,如图8。
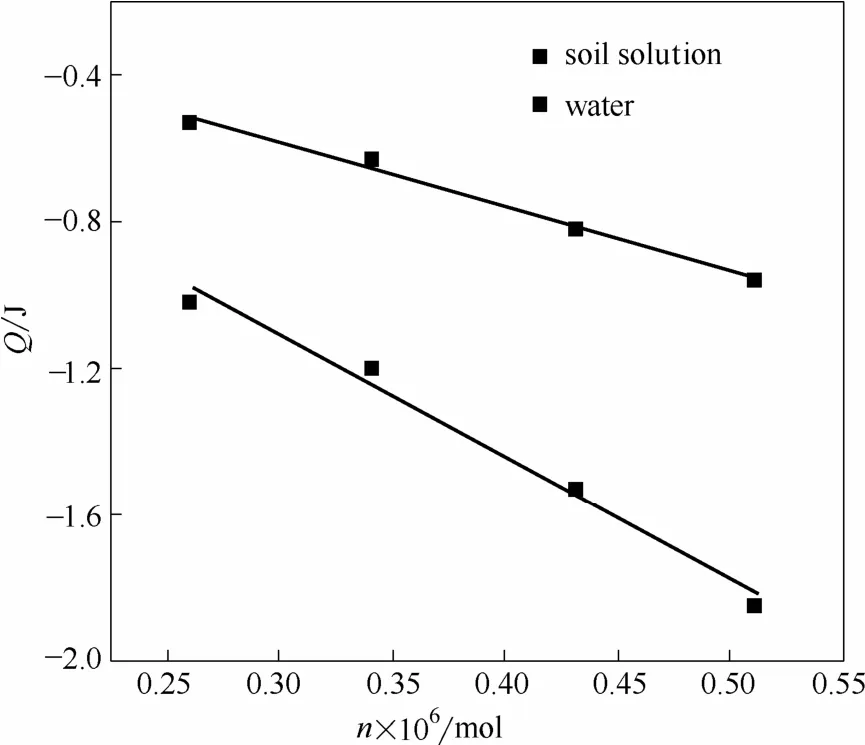
图8 乌头碱反应热与物质的量间关系Fig.8 Relationship between amount of aconitine( n) and heat(Q)
图8显示n-Q间有良好的线性关系。且反应放出的热量均随物质的量的增加而增大。
将实验过程中不同质量的乌头碱在土壤滤液中反应所得到数据 (dH/dt)i和(H/H0)i代入式(5)中,分别以ln[1/H0(dH/dt)i]对ln[1-(H/H0)i]作线性回归,得到反应级数n,k,结果见表7。
将k、n的平均值代入式(3)和式(4),得到乌头碱在水和pH 7.4的土壤滤液中反应动力学方程分别为式(6)和式(7)
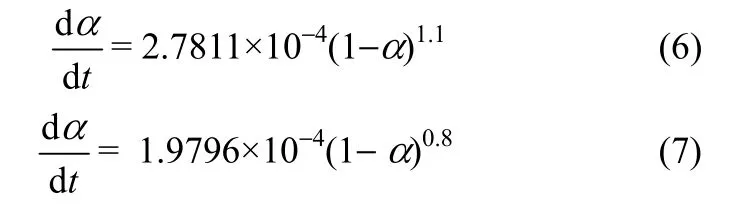
因此,若按准一级反应处理,乌头碱的半衰期t1/2,水=0.691 h,t1/2,土壤滤液=0.973 h。

表7 常压及20℃下乌头碱反应的动力学参数Table 7 Kinetic data of reaction of aconitine at 20℃under atmospheric pressure
3 结 论
采用微量热技术及热重法,结合液质联用仪,研究了乌头碱的热降解机理、水解特性及热效应,得到以下结论。
(1)通过乌头碱稳定性研究发现其在空气中不稳定,自然环境中可降解。
(2)微量热法测得乌头碱在纯水及土壤滤液中的溶解过程其半衰期为t1/2,水=0.691 h,t1/2,土壤滤液=0.973 h。发现乌头碱在水中易水解。
(3)乌头碱在不同pH土壤滤液中的稳定性不同,其规律为酸性>中性>碱性。显然,乌头碱若应用在非酸性土壤中,其极易被自然条件有效分解。
[1]OHNO Y J.Toxicol[J].Toxin Rev.,1998,17(1):1-11.
[2]LEI Q F.Chemical constituents of aconiti lateralis radix praeparata[J].Chinese Traditional and Herbal Drugs,2013,44(6):655-659.
[3]WANG Y G.Alkaloids of the Chinese drugs,aconitum SPP.ⅩⅢalkaloids from Pei Cao WU,aconitum kusnezoffii[J].Acta Pharmaceutica Sinica,1989,15(9):526-531.
[4]LI Y X.To determinate content of in radix aconiti,kusnezoffii monkshood aconitum by acid dye colorimetry[J].Chinese Traditional Patent Medicine,2000,22(9):662-663.
[5]XU Y H.Biological activity of aconite alkaloids against spodoptera exigua[J].Hubei Agricultural Sciences,2007,46(6):1015-1018.
[6]LU M X,ZENG H P.Recent progress in pesticidal alkaloids[J].Chinese Journal of Pesiticides,2004,43(6):249-252.
[7]ULUBELIN A,MERICLI A,KILINGER N.Insect repellent activity of diterpenoid alkaloids[J].Phytother.Res.,2001,15(2):170-171.
[8]AZUCENA G,MATIAS R,ALBERTO M,et al.Structural diversity and defensive properties of norditerpenoid alkaloids[J].J.Chem.Ecol.,2004,30(7):1393-1408.
[9]LIU C Z,WANG G L.The toxicity test and control effect of sophora alopecuroides and Aconitum alkaloids for peach aphid[J].Plant Protection,2000,26(6):20-22.
[10]HAO D C,GU X J,XIAO P G,et al.Recent advances in the chemical and biological studies of Aconitum pharmaceutical resources[J].Journal of Chinese Pharmaceutical Sciences,2013,22(3):209-221.
[11]王瑞,刘芳,孙毅坤,等.不同附子炮制品中乌头碱、新乌头碱、次乌头碱含量的 HPLC测定[J].药物分析杂志,2006,26(10):1160-1363.WANG R,LIU F,SUN Y K,et al.Quantitative analysis of mesaconiyine,hypaconitine in different radix aconiti lateralis praeparata[J].Chin.J.Pharm.Anal.,2006,26(10):1160-1363.
[12]孙兰,周海燕,赵润怀,等.HPLC法同时测定附子中6种单酯和双酯型生物碱[J].中草药,2009,40(1):131-134.SUN L,ZHOU H Y,ZHAO R H,et al.Determination of six kinds of monoesterand diester alkaloids in radix aconitii lateralis praeparata by HPLC[J].Chinese Traditional and Herbal Drugs,2009,40(1):131-134.
[13]张聿梅,鲁静,蒋渝,等.川乌和制川乌中单酯及双酯型生物碱成分的含量测定[J].药物分析杂志,2005,25(7):807-812.ZHANG Y M,LU J,JIANG Y,et al.HPLC determination of aconitum alkaloids and their hydrolysis pronducts in radix aconiti and its preparata[J].Chin.J.Pharm.Anal.,2005,25(7):807-812.
[14]许源,侯大斌,杨海君,等.中乌头碱衍生物的合成及其杀虫活性测定[J].安徽农业科学,2009,37(9):3890-3892.XU Y,HOU D B,YANG H J,et al.Synthesis and bioactivity of derivatives from mesaconitine[J].Journal of Anhui Agricultural Sciences,2009,37(9):3890-3892.
[15]王晓东,袁小红,杨海君,等.3,13-酯基中乌头碱衍生物的合成及其杀虫活性的研究[J].安徽农业科学,2009,37(21):9830-9848.WANG X D,YUAN X H,YANG H J,et al.Synthesis and insecticidal activity of derivants of 3,13-ester mesaconitine[J].Agricultural Sciences & Technology,2009,37(21):9830-9848.
[16]王惠,侯大斌,杨海君,等.中乌头碱结构中磺酰基的引入及其杀虫活性测定[J].湖北农业科学,2009,48(3):718-720.WANG H,HOU D B,YANG H J,et al.Sulfoacylation of mesaconitine and its insecticidal activity[J].Hubei Agricultural Sciences,2009,48(3):718-720.
[17]PU X H,LIU Y,GOU X X,et al.Refinement of the crystal structure of aconitine[J].Chinese J.Struct.Chem.,2017,36(4):605-608.
[18]洪波,仇永清.附子中双酯型乌头碱类成分水解减毒机理的密度泛函理论研究[J].分子科学学报,2008,24(3):216-219.HONG B,QIU Y Q.Theoretical study on the decreased toxicity mechanism of aconitine analogs in aconitum carmichaeli by density functional theory[J].Journal of Molecular Science,2008,24(3):216-219.
[19]COAT A W,REDFERN J P.Kinetic parameters from thermogravimetricdata[J].Nature,1964,201:68-69.
[20]OZAWA T.A new method of analyzing thermogravimatric data [J].Bull.Chem.Soc.,Jpn.,1965,38(1):1881-1886.
[21]胡荣祖,史启桢.热分析动力学[M].北京:科学出版社,2001:50-51.HU R Z,SHI Q Z.Kinetics of Thermal Analysis[M].Beijing:Science Press,2001:50-51.
[22]YANG C M,FANG Z,LIU J B,et al.A study on the kinetics of thermal decomposition of polyaniline[J].Thermochimica Acta,2000:352-353.
[23]SHEN X Q,LI Z J,ZHANG H Y,et al.Mechanism and kinetics of thermal decomposition of 5-benzylsulfanyl-2-amino-1,3,4-thiadiazole[J].Thermochimica Acta,2005,428:77-81.
[24]ZHAN D,CONG C J,DIAKITE K,et al.Kinetics of thermal decomposition of nickel oxalate dihydrate in air[J].Thermochimica Acta,2005,430:101-105.
[25]WADSÖ I.Isothermal microcalorimetry in applied biology[J].Thermochimica Acta,2002,394(19):305-311.
[26]薛亮,赵凤起,邢晓玲,等.1,3,3-三硝基氮杂环丁烷在乙酸乙酯和N,N-二甲基甲酰胺中的溶解行为[J].物理化学学报,2009,25(12):2413-2416.XUE L,ZHAO F Q,XING X L,et al.Dissolution properties of 1,3,3-trinitroazetidine in ethyl acetate andN,N-dimethylformamide[J].Acta Phys.Chim.Sin.,2009,25(12):2413-2416.
[27]ZHAO W W,CUI B,PENG H X,et al.Novel method to investigate the interaction force between etoposide and APTES-functionalized Fe3O4@nSiO2@mSiO2nanocarrier for drug loading and release processes[J].J.Phys.Chem.C,2015,119(8):4379-4386.
[28]LI Z X,ZHAO W W,PU X H.Study on the oscillation dissolved behavior of oxysophocarpine in water[J].Thermochimica Acta,2012,537:76-79.
[29]THOMAS G B,MI Z H.Ethyl substitution at the 7 position extends the half-life of 10-hydroxycamptothecin in the presence of human serum albumin[J].J.Med.Chem.,1993,36(17):2580-2582.
[30]SU T L,CHOU T C,KIN J Y.9-substituted acridine derivatives with long half-life and potent antitumor activity:synthesis and structure-activity relationships[J].J.Med.Chem.,1995,38(17):3226-3235.
date:2017-06-27.
Prof.LI Zongxiao,mingtian8001@163.com
supported by the Key Laboratory of Shaanxi Province (12JS006).
Study on pyrolysis and half-life of aconitine
LIU Ye,ZHANG Feng,LI Zongxiao
(Shaanxi Key Laboratory for Photochemistry,Baoji721013,Shaanxi,China)
By using the microcalorimetry techniques,thermogravimetric analysis and LC-MS,the mechanism of the thermal degradation of aconitine,hydrolysis mechanism and the heat change of aconitine in the soil environment was explored,and the half-life of aconitine was determinated (t1/2=0.973 h).While,aconitine is unstable and easily degradable in air,also easy to hydrolyze in alkaline solution.The thermal decomposition of aconitine in air displays three stages.The temperature range in the three stages,respectively,is 185—213℃,248—468℃,484—579℃.The corresponding reaction order isn=1/4,n=4,n=2 in the three stages; the activation energy in the three stages is 154.53 kJ·mol-1,100.97 kJ·mol-1,120.08 kJ·mol-1.Aconitine should be stored as far as possible in the low temperature,dry and isolated air environment.
aconitine; hydrolysis; pyrolysis; half-life; microthermal technology; thermodynamics
TQ 45; TQ 031
A
0438—1157(2017)12—4500—08
10.11949/j.issn.0438-1157.20170825
2017-06-27收到初稿,2017-08-30收到修改稿。
联系人:李宗孝。
刘叶(1993—),女,硕士研究生。
陕西省重点实验室基金项目(12JS006)。

