基于侧流富集/主流强化的CANON工艺处理常温低氨氮废水的稳态控制
曹丽娟,陈杰,姜广萌,常青龙,王亚宜
(同济大学环境科学与工程学院,污染控制与资源化研究国家重点实验室,上海 200092)
基于侧流富集/主流强化的CANON工艺处理常温低氨氮废水的稳态控制
曹丽娟,陈杰,姜广萌,常青龙,王亚宜
(同济大学环境科学与工程学院,污染控制与资源化研究国家重点实验室,上海 200092)
采用侧流富集/主流强化方式,研究了全程自养脱氮工艺(CANON)用于常温(25℃)、低氨氮(约60 mg主流线生物脱氮的可行性。结果表明,通过7 d更换主流反应器40%污泥混合液方式可实现维持主流反应器总氮去除负荷(TNRR)在80 g N·m-3·d-1左右,总氮去除率(TNRE)在70%左右,主流反应器厌氧氨氧化比活性持续升高。16S rDNA高通量测序结果表明,主流和侧流 CANON系统中起亚硝化作用的氨氧化细菌(AOB)主要是Nitrosomonas属,进行Anammox反应的厌氧氨氧化菌(AnAOB)主要是CandidatusJettenia属,60 d的运行过程中主流反应器Nitrospira属的亚硝酸盐氧化菌(NOB)丰度始终小于1%。可见在本实验条件下,采用7 d为频率主流和侧流换泥方式,能够保证主流反应器中Anammox活性,确保主流CANON反应器的脱氮性能。
CANON;侧流富集/主流强化;常温低氨氮;高通量测序
引 言
全程自养脱氮工艺(CANON)将亚硝化与厌氧氨氧化(Anammox)耦合于一个体系中,利用好氧氨氧化细菌(AOB)和厌氧氨氧化菌(AnAOB)的协同作用,在不消耗有机碳源的条件下实现脱氮[1],具有细胞产率低、污泥产量少和成本降低等优势[2]。目前CANON工艺主要用于高温(>30℃)高氨氮废水处理,包括污泥消化液[3]、垃圾渗滤液[4]、畜禽废水[5]等,截至2014年,已有100多座应用Anammox技术处理高氨氮废水的污水处理厂成功运行[6]。
CANON工艺在污泥消化液侧流线的处理应用已日趋成熟,然而其在市政污水主流线的应用方面依然面临很大挑战,主要存在2个问题:(1)常温低氨氮条件下如何维持稳定的短程硝化。短程硝化控制关键在于创造有利于AOB而不利于NOB(亚硝酸盐氧化细菌)的生境,实现的稳定积累。侧流线条件下能维持稳定的短程硝化首先得益于侧流线高氨氨浓度(500~1500 mg·L-1)[6]形成的FA与FNA浓度均高于NOB抑制浓度(FA=0.08~0.82此外,侧流线高温条件下AOB生长较NOB快[8],可有效淘洗出NOB。然而,市政污水氨氮浓度较低(30~100 mg·L-1)[9],同时污水处理厂生反池开放式运行导致了温度波动(10~30℃),都使得短程硝化稳定控制较为困难。(2)常温下如何保障CANON功能微生物的活性。AnAOB最佳生长温度通常为30~40℃[10-11],降低温度会导致厌氧氨氧化活性显著下降[12-14]。这无疑限制了CANON工艺在常温下的高效应用。
目前实验室常温低氨氮条件下的研究中,通过对反应器构型和污泥形态的优化,CANON功能微生物活性可得到有效保障,成功实现CANON工艺的稳定运行[15-18]。实际工程中对自养脱氮工艺在污水厂主流线的应用也处于探索阶段。奥地利的Strass污水处理厂通过水力旋流器分离来自侧流脱氮系统的 AOB和厌氧氨氧化污泥,随后将其补充到主流自养脱氮系统中,以此维持主流系统可持续的硝化活性[19]。这对于CANON在市政污水脱氮处理中的应用有很大的启发。
本实验借鉴污水处理厂为确保冬季好氧池硝化活性而采用的侧流富集/主流强化工艺新思路[20-21],通过侧流线(高温、高氨氮)富集CANON颗粒污泥,移泥入主流线用于强化主流线(常温、低氨氮)CANON反应器生物活性并且达到抑制 NOB活性增长的目的。为此,本研究使用SBR分别建立主流和侧流CANON反应器,通过定期交换2个反应器中部分污泥混合液方式达到侧流富集/主流强化的效果,确保主流反应器的脱氮性能。最后通过高通量测序技术分析运行过程中微生物种群的变化来验证侧流富集/主流强化工艺的可行性与稳定性,为CANON工艺在市政污水主流线中的应用提供理论依据和技术支撑。
1 材料与方法
1.1 实验装置与运行
采用两个完全相同的序批式反应器(SBR),分别模拟主流和侧流线污水自养脱氮生物反应器。SBR反应器为圆柱形有机玻璃容器,有效容积为2.5 L,充水比为0.5。反应器底部设曝气头,连接气泵供气,供气管路中间设置流量计控制曝气量。反应器内部设置搅拌桨,以100 r·min-1的速度均匀搅拌保持反应器内部混合均匀;采用水浴方式保证反应器的恒温条件(主流反应器为25℃,侧流反应器为30℃)。
主流和侧流反应器共运行60 d。其中第7、14、29、37、44和53 天的周期末互换主侧流反应器中1 L污泥混合液,即采用污泥投配比为0.4。主流和侧流反应器在运行过程中控制 DO在 0.1~0.2 mg·L-1内。主流反应器进水mg·L-1,温度一直控制在25℃,采用间歇曝气方式运行,其中每个周期分为进水、反应、静沉、出水和闲置5个阶段。启动一周内,为了达到脱氮平衡,反应器每天运行6个周期,每个周期4 h,1个周期的曝气时间根据脱氮情况控制在 60~80 min;8~46 d时间段内,一天运行3个周期,每个周期8 h,1个周期内总曝气时间70~80 min;47~60 d时间段内,一天运行4个周期,每个周期6 h,1个周期内总曝气时间144 min。
1.2 污泥来源与实验用水
接种污泥是本实验室已经驯化成熟的 CANON颗粒污泥,取自本实验室中稳定运行的CANON母反应器。分别接种2 L污泥混合液至主流和侧流反应器。
实验用水采用人工合成无机废水(不含COD),由蠕动泵在进水阶段连续泵入反应器中。进水桶中配有加热棒,保证维持与反应器中相同的恒定温度。配水组分如下(以 g·L-1为单位):KH2PO40.05,CaCl20.3,MgSO4·7H2O 0.3,NaHCO31.25,FeSO4·7H2O 0.00625,Na2EDTA 0.00625 以及 1.25 ml·L-1的微量元素。微量元素具体组分如下(以g·L-1为单位):Na2EDTA 15,H3BO40.014,MnCl2·4H2O 0.99,CuSO4·5H2O 0.25,ZnSO4·7H2O 0.43,NiCl2·6H2O 0.19,Na2SeO4·10H2O 0.21,Na2MoO4·2 H2O0.22 , Na2WO4·2H2O 0.050 。 以NH4Cl为基质,投加量根据所需进水桶中的浓度确定。通过滴加 0.2 mol·L-1的 HCl和 0.2 mol·L-1的NaOH来调节进水桶中的pH,使其稳定在8.0左右。
1.3 样品采集与分析方法
1.3.1 样品采集 第 15、31、45、60 天周期末分别从主流和侧流反应器中取出50 ml污泥混合液测定MLVSS。第15、25、31、38、45、52、58、60 天测定了主流反应器中最大比厌氧氨氧化活性。此外,对接种CANON污泥以及第60 天的主流和侧流反应器中的污泥进行了16S rDNA高通量测序。
1.3.2 基于16S rDNA的Illumina平台高通量测序
(1)样品采集及保存
在所需测试的时间点提取微生物样品,一般为改变工况前的1个周期末。为了保证取样均匀,从反应器的3个不同高度取样混合,将取得的15 ml的污泥混合液置于10 ml离心管中,离心去除上清液,将离心管按顺序编号,存放于-20℃冰箱保存,待实验全部完成后将全部样品送到美吉生物科技医药公司(上海)进行高通量测序的分析。
(2)实验流程
① DNA抽提:采用DNA提取试剂盒对预处理后的污泥样品进行DNA提取,然后利用1%的琼脂糖凝胶电泳检测获得的基因组DNA,从而确定基因组 DNA的完整性,在经过试剂盒定量后,确定PCR反应加入的DNA量。
② PCR扩增:针对细菌的16S rDNA的V3~V4区,合成带有barcode的特异引物。采用融合F引物的341F(CCTACACGACGCTCTTCCGATCTN)和融合 R引物的 805R (GACTACHVGGGTATCTAATCC)进行PCR扩增。
全部污泥样本按照正式实验条件进行,每个污泥样本3个重复,将同一污泥样本的PCR产物混合后用 2%琼脂糖凝胶电泳检测,使用 AxyPrepDNA凝胶回收试剂盒(AXYGEN公司)切胶回收 PCR产物,Tris_HCl洗脱;2%琼脂糖电泳检测。
③ 荧光定量:参照电泳初步定量结果,将PCR产物用 QuantiFluor™-ST蓝色荧光定量系统(Promega公司)进行检测定量,之后按照每个污泥样本的测序量要求,进行相应比例的混合。
④ 构建Illumina平台文库,采用Illumina平台测序。
⑤ 序列优化处理:为了获得质量更高的序列,需对各污泥样本序列做质量控制处理。包括如下 4个步骤:去除各污泥样本中的 barcode;去除小于50 bp短片段序列;去除低复杂度序列;提取高质量的测定序列。对原始数据进行过滤处理后,得到优化序列。然后在去除嵌合体序列后进行 OTU聚类分析,对OTU的代表序列作分类学分析。
1.3.3 水质指标 根据反应器的性能每周进行 3~4次典型周期监测,水质指标包括浓度以及MLSS和MLVSS浓度,这些指标的检测均根据国家环保局发布的标准方法,分别如下。纳氏试剂分光光度法;N-(1-萘基)-乙二胺光度法紫外分光光度法;总氮马弗炉燃烧减重法。DO浓度使用溶解氧探头在线监测(WTW Multi350i,WTW公司);pH采用pH探头在线监测(WTW Multi350i,WTW公司)。
1.3.4 比厌氧氨氧化速率(SAA)测定 在测定SAA批次实验时,先将不含基质的配水加入反应器(其他成分与常规进水相同),然后用 100% N2充气20 min,吹脱体系中的溶解氧;之后快速向2.5 L反应器中加入25 ml已配置好的浓缩液(1 g·L-1),使得体系浓度均为 100 mg·L-1;同时使用 0.2 mol·L-1的 HCl和 0.2 mol·L-1的NaOH调节初始pH为7.0。反应开始后,每隔30 min取一个水样,测定其和浓度。
1.4 指标计算
功能微生物理论原位活性:对脱氮微生物活性计算过程,本研究采用了理论活性计算公式,有两个假设条件,首先由于本实验未引入有机物,因此可认为系统为自养脱氮系统,即认为系统中氮素减少全部由AnAOB通过Anammox反应以N2形式脱除;其次,本计算完全按照Anammox的理论计量学方程式[22][式(1)]推算,即(2.04表示转换1对应总氮的换算系数)。表征功能微生物理论原位活性的指标包括,氨氧化速率(AOR)、亚硝酸盐氧化速率(NOR)、脱氮速率(NRR)、最大比厌氧氨氧化速率(SAA)。
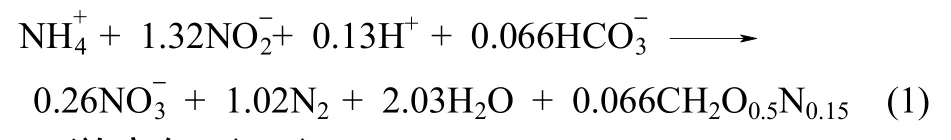
1.5 游离氨(FA)
本实验中按式(2)计算FA浓度[7]
2 结果与讨论
2.1 侧流富集/主流强化过程中脱氮性能的变化
2.1.1 主流反应器的脱氮性能 图1(a)显示了主流反应器在60 d运行过程的脱氮效果。可以看出,通过7 d一周期更换主流反应器40%污泥混合液的方式能够使主流反应器 TNRR维持在 80 g N·m-3·d-1左右,TNRE 在 70%左右。反应器出水浓度一直小于1 mg·L-1。前一周内(第1~7 天)为反应器脱氮性能调试阶段,进水桶中浓度配置偏高,保证出水有足够因此反应器TNRE较低,维持在42%左右。前一周每天总曝气时间在360~480 min,TNRR 为 100 g N·m-3·d-1。第 8~14天,将反应器周期调整为 8 h,一天总曝气时间为240 min,进水桶浓度回到设定值(65±4)mg·L-1,TNRE上升至80%左右。然而,反应器整体脱氮性能后续出现了较明显的下降。第 14 天,TNRR下降至70 g N·m-3·d-1,出水升高至10.95 mg·L-1。由此可见,常温、低氨氮条件对CANON反应器性能的稳定维持影响较大。整个过程中,反应器内几乎未见积累,可以推断本阶段反应器内 NOB比较活跃,由 AOB氧化生成的部分可能被NOB利用生成了使得AnAOB可利用的的量减少,最终导致TNRR降低。
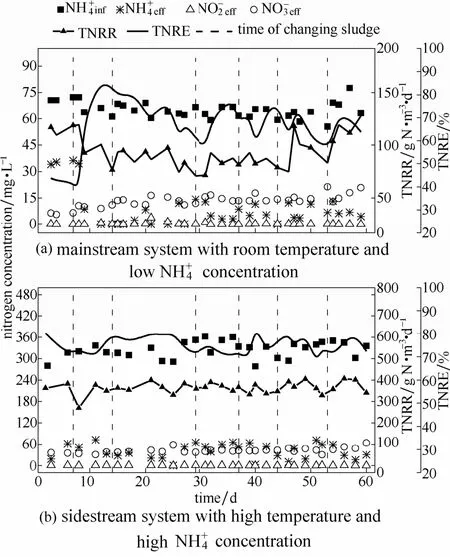
图1 CANON反应器运行过程氮素(进、出水浓度、出水浓度和出水浓度)转化以及TNRR和TNRE的变化Fig.1 Profiles of nitrogen compounds (expressed as influent and effluent ammonium concentration,effluent nitrite concentration and effluent nitrate concentration),TNRR and TNRE of CANON system over 60 days’ operation
为维持CANON反应器的高效脱氮,第14 天将主流反应器中40%的污泥更换为侧流反应器中的污泥。换泥后主流CANON反应器的TNRR逐渐回升,最高可达90 g N·m-3·d-1,证明了换泥的确可以强化主流反应器性能。如图1(a)所示,主流反应器换泥后的第1周(15~21 d),反应器TNRR稳定在80 g N·m-3·d-1左右,TNRE在70%以上。但是在第2周(22~29 d),CANON反应器性能开始下降,反应器在第 29 天时的 TNRR降低至 60 g N·m-3·d-1,TNRE 降低至 60%。以上结果表明,2周换泥频率不足以保证主流反应器脱氮性能。值得注意的是,此阶段CANON反应器出水基本保持稳定,说明 NOB活性已得到有效抑制。此外,TNRR、TNRE各项性能指标的变化情况也反映了换泥后的一周内,主流反应器的厌氧氨氧化性能得到了有效增强。
接下来两周时间(30~44 d),每隔7 d主流和侧流反应器换一次泥,反应器运行稳定,TNRR稳定在80 g N·m-3·d-1左右,TNRE达到70%左右。出水和分别稳定在5 mg·L-1左右和14.6 mg·L-1左右。可见,通过换泥主流反应器可至少在一周内维持稳定运行。为进一步提高反应器脱氮性能,第47~60天将周期时间调整为6 h,每天曝气总时间576 min。如图1(a)所示,反应器TNRR逐渐升高至100 g N·m-3·d-1左右。同时曝气时间增加后,反应器出水浓度也有所上升,曝气时间对NOB的影响还有待进一步研究。
2.1.2 侧流反应器的脱氮性能 图1(b)显示了侧流CANON反应器60 d的脱氮效果。侧流CANON反应器TNRR在60 d内运行稳定,保持在(370±30)g N·m-3·d-1,TNRE 也都高于 70%。同时可以看到,反应器出水浓度维持稳定,说明反应器NOB活性稳定。可见,以7 d为频率的换泥方式未对侧流反应器的性能产生显著影响,侧流反应器运行良好,脱氮稳定。
2.2 侧流富集/主流强化过程中功能微生物活性变化
2.2.1 主流反应器中功能微生物活性变化 图 2(a)显示了主流 CANON反应器运行过程各功能微生物的活性变化。前两周(第1~14天)内AOR基本保持稳定,维持在(7.4±0.8)g N·m-3·h-1,未出现显著下降。接下来 2周内(15~29 d),AOR出现了明显下降,即从第15天的7.7 g N·m-3·h-1降至第29天的4.7 g N·m-3·h-1,降低幅度达到40%。以时间为横轴,AOR为纵轴直线拟合 15~21 d的活性数据得到R2≪0.1;同样拟合21~29 d数据得到斜率为-0.43(R2=0.99)。拟合结果说明,第1周内的AOR基本稳定,而第2周AOR呈直线下降。
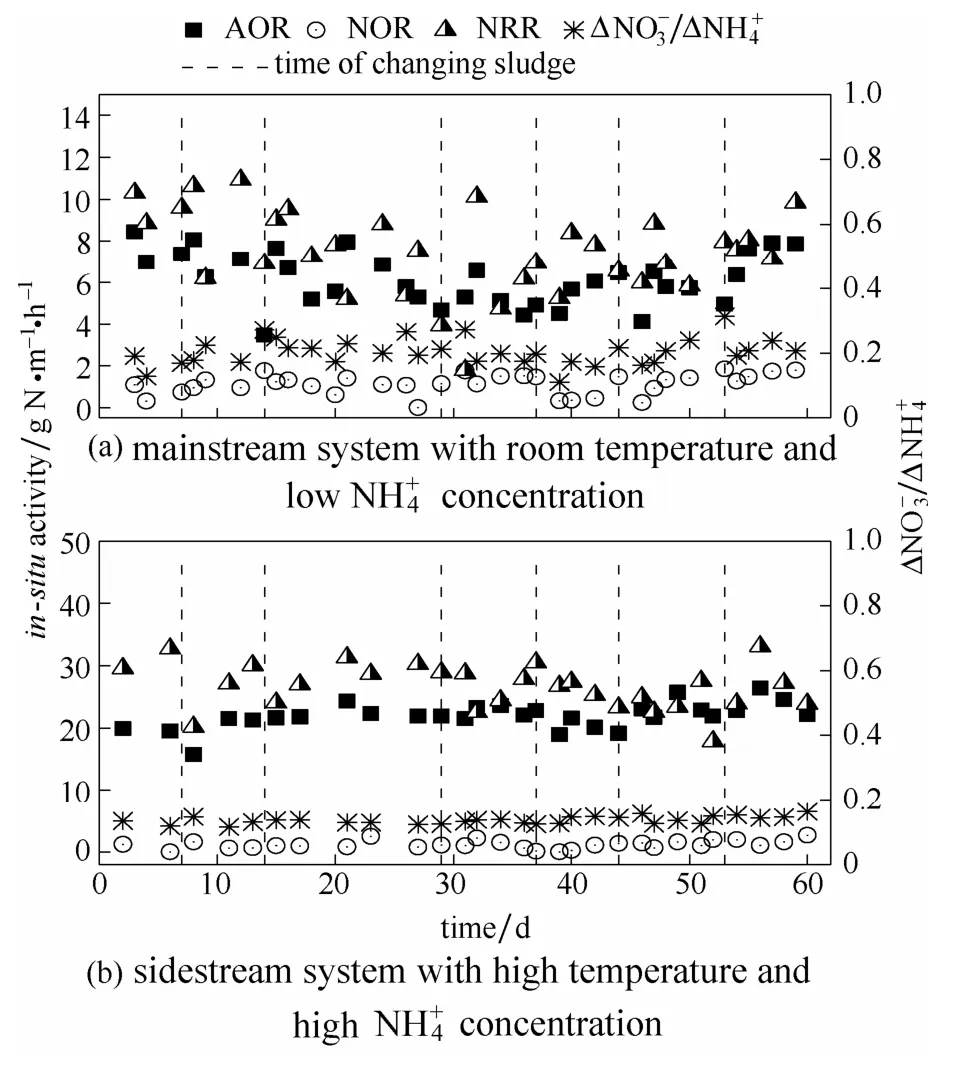
图2 CANON反应器运行过程中AOR、NOR、NRR 以及比值变化Fig.2 Changes of AOR,NOR,NRR and ratio of CANON system over 60 days of operation
接下来的两周内(30~44 d)恢复7 d一次的换泥频率,可以看出 AOR在这两周内保持稳定,维持在(5.4±0.8)g N·m-3·h-1。但是 30~44 d 内的AOR却低于1~14 d内的AOR。这可能是由于周期的变化使得一天内总曝气时间从 1~14 d 的480 min降至30~44 d的210 min所致。但总体来看,保持7 d换泥频率可以保证主流CANON反应器中AOR的稳定。接下来的两周(45~59 d)内,AOR有所上升,AOR基本维持在(7.4±0.7)g N·m-3·h-1,该值与 1~14 d的 AOR 值接近,高于30~44 d的(5.4±0.8)g N·m-3·h-1。这是由于周期改变之后,一天的总曝气时间从8~46 d的210~240 min增加至46~60 d的576 min,可见AOR与曝气时间呈正比。
运行过程中NOR变化不大,且基本小于2 g N·m-3·h-1[图 2(a)],说明 NOB 活性已得到有效抑制的比值也被认为是衡量厌氧氨氧化性能的一个重要指标,Miao等[23]的研究发现,NOB活性得到有效抑制时,的比值为0.30。从图2(a)中可以看到,本研究中主流反应器的比值在整个过程中基本稳定在0.2左右,虽然略高于CANON系统厌氧氨氧化反应的理论值 0.11[1],但比值的稳定表明主流反应器中NOB活性已得到有效抑制。
如图2(a)所示,NRR在1~14 d内基本保持稳定,维持在 9.0 g N·m-3·h-1左右。15~29 d 内 NRR出现了显著下降,从第15天的9.0 g N·m-3·h-1降低至第29天的3.9 g N·m-3·h-1,下降了56%。同样,在换泥后第 1 周(15~21 d),NRR 维持在(7.8±1.7)g N·m-3·h-1;而后一周(21~29 d)的 NRR 在(6.4±2.2)g N·m-3·h-1。可见第 2周内 NRR 波动更厉害,表明2周14 d左右的运行时间会消极影响主流AnAOB活性。在接下来的几周内,换泥频率恢复至7 d一次,NRR基本稳定在(7.3±1.5)g N·m-3·h-1。因此,本实验中7 d换泥频率可以维持主流反应器AnAOB的活性。
2.2.2 侧流反应器中功能微生物活性变化 与脱氮性能相似,侧流反应器在运行过程中各微生物活性保持稳定[图2(b)]。这再次证明了7 d换泥频率对侧流反应器影响不大,侧流反应器运行稳定。本实验中侧流反应器进、出水FA浓度分别为20.8~和整个反应过程中FA普遍高于NOB抑制浓度(FA=0.08~0.82 mg N·L-1)[7],并且侧流反应器温度一直控制在30℃,接近AnAOB的最佳生长温度[24],说明侧流高温高氨氮条件能很好地维持CANON反应器稳定运行。
2.3 侧流富集/主流强化脱氮效果分析
图3显示了运行过程中(60 d)主流和侧流反应器污泥浓度的变化以及主流 CANON反应器中SAA的变化。主流反应器在15~60 d中MLVSS基本稳定在(1.32±0.06)g·L-1,说明主流反应器污泥得到了较好持留效果。侧流反应器污泥浓度持续升高,从第15天的1.5 g·L-1上升至第60天的2.7 g·L-1。说明侧流工艺污泥增长良好,达到了很好的侧流富集CANON污泥(包括亚硝化菌和厌氧氨氧化菌)的效果。
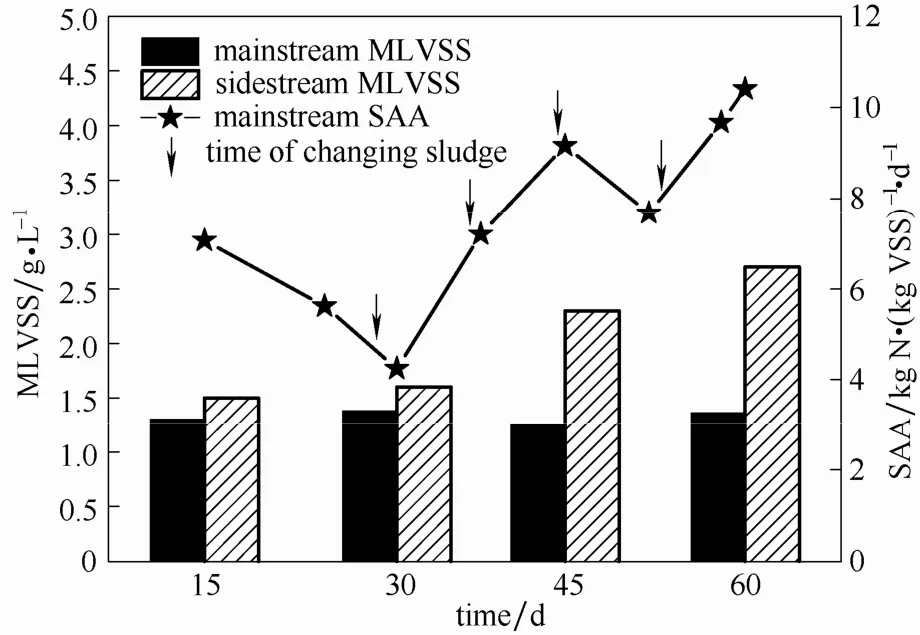
图3 主侧流反应器运行过程中MLVSS变化以及主流反应器运行过程中SAA的变化Fig.3 Changes of MLVSS of mainstream and sidestream CANON system and SAA of mainstream CANON system over 60 days’ operation
如图3所示,主流CANON反应器SAA从第15 天的 7.07 kg N·(kg VSS)-1·d-1降低至第 31 天的4.24 kg N·(kg VSS)-1·d-1,即 SAA 逐渐降低了近40%,可见,AnAOB在主流反应器中面临着常温低基质浓度的不利条件活性降低非常明显。但当反应器采取了7 d一次的换泥措施后,SAA逐渐上升;到第 60 天上升至 10.4 kg N·(kg VSS)-1·d-1。可见在本实验条件下,采用7 d为频率的换泥方式,能够保证主流反应器中Anammox活性,有利于AnAOB的生长,确保主流CANON反应器的脱氮性能。
2.4 侧流富集/主流强化系统功能微生物群落结构的变化
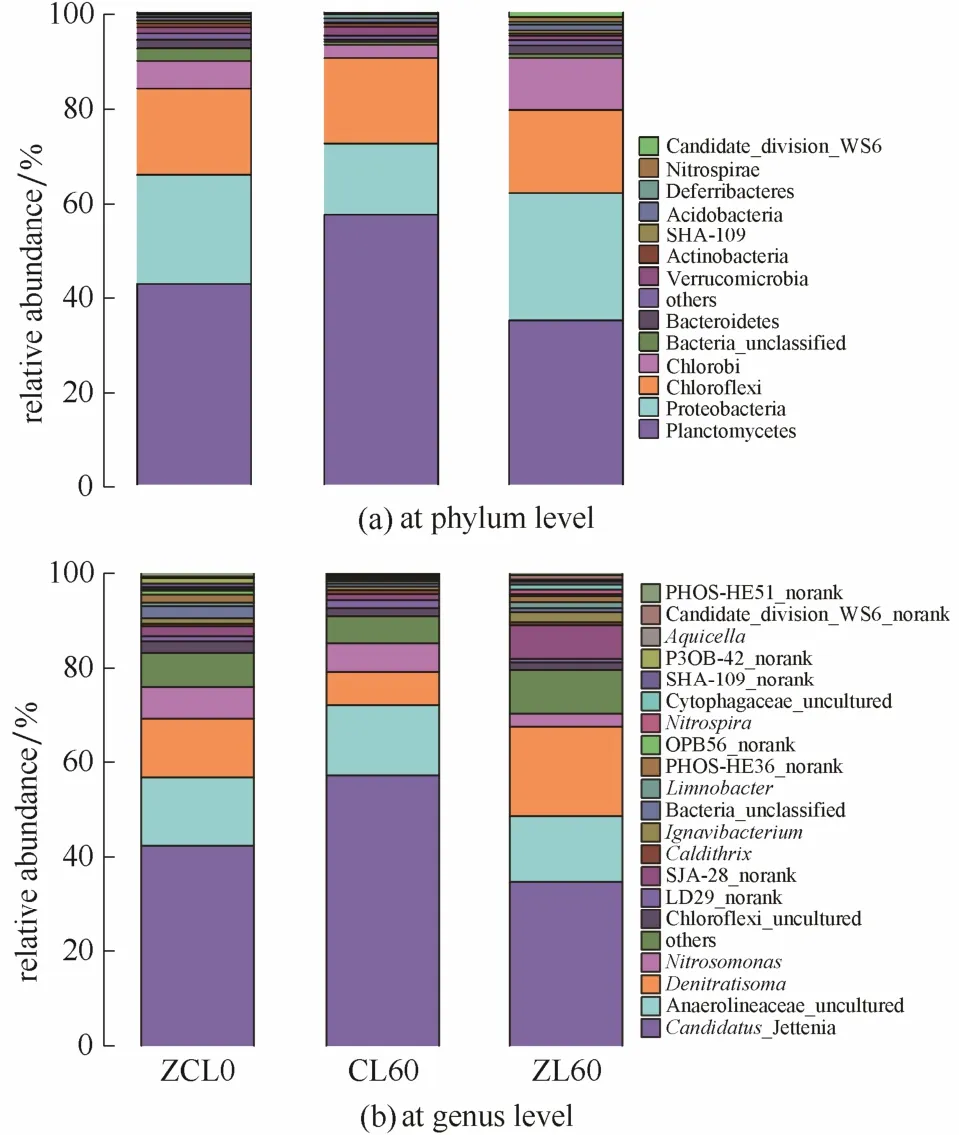
图4 ZCL0、CL60、ZL60 3个污泥样品微生物群落结构组成变化Fig.4 Changes of microbial community taxonomic compositions from three samples of ZCL0,CL60 and ZL60(Mainstream and sidestream reactor were inoculated with sludge from mother CANON reactor on day 0,named ZCL0;sludge samples of mainstream and sidestream reactor on day 60 were named ZL60 and CL60 respectively)
本实验在第0天和第60天分别从主流和侧流反应器中取泥样进行16S rDNA高通量测序分析。图4(a)显示了16S rDNA高通量测序结果在门分类水平的丰度对比。其中浮霉菌门(Planctomycetes)和变形菌门(Proteobacteria)两者总和超过了50%,说明这两个菌门在系统中占优势地位,而这正是CANON系统中的功能微生物 AnAOB(属于Planctomycetes门)和AOB(属于Proteobacteria门)所在的两个菌门。除此之外,绿弯菌门(Chloroflexi)和绿菌门(Chlorobi)这两类环境中常见的不产氧光合细菌在系统中的丰度也较高。这两类细菌在自养系统中广泛存在[25],它们被认为通过利用自养菌的可溶性细胞产物(SMP)和胞外多聚物(EPS)存活。同时系统中还存在少量(<1%)的硝化螺菌门(Nitrospirae)(部分NOB,如Nitrospira属属于Nitrospirae门)。
图4(b)显示了16S rDNA高通量测序结果在属分类水平的丰度对比。结果表明,本实验CANON系统中起亚硝化作用的 AOB主要是Nitrosomonas属,进行 Anammox反应的 AnAOB主要为CandidatusJettenia属,这两类菌种常作为主要的脱氮功能微生物出现在CANON系统中[26];同时系统中还存在少量Nitrospira属的NOB(<1%)。值得注意的是,在主流反应器中,Denitratisoma和SJA-28_norank两类微生物的丰度发生了较为显著的变化,分别从 12.38%、2.21%上升至 18.92%、7.08%,这两类异养微生物在 CANON系统中都有所报道[27]。SJA-28_norank属于Chlorobi门,该菌门的微生物被报道具有降解复杂有机物的能力[28]。主流反应器中温度低,基质浓度低,微生物容易处于衰减状态。因此SJA-28_norank和Denitratisoma可能协同合作,SJA-28_norank降解衰亡微生物供Denitratisoma使用,从而影响主流系统主要脱氮功能微生物的丰度。
如图 4(b)所示,侧流反应器中CandidatusJettenia丰度随运行时间呈明显提高趋势,从第0天的42.3%上升至第60天的57.2%,可见AnAOB在驯化过程中均处于优势地位;Nitrosomonas丰度有小幅下降,从6.65%下降到5.97%。结合脱氮效果[图1(b)],可以发现侧流CANON反应器在运行过程得到不断强化。同时注意到侧流反应器中Denitratisoma和SJA-28_norank丰度降低而主流增加,可见在侧流反应器中由于功能微生物生长良好使得这些异养菌没有生存空间,无法成为优势菌种。而主流反应器中CandidatusJettenia在常温低氨氮条件下运行并采用换泥强化后,丰度略有下降,从42.3%下降到 34.7%;Nitrosomonas的丰度也从6.65%下降到 2.67%,但是其脱氮效果并未大幅下降,TNRR 维持在 80 g N·m-3·d-1左右,TNRE 在70%左右[图1(a)]。这一结果说明,采用7 d换泥一次方式,主流反应器低氨氮和常温条件下的自养脱氮效果得到了强化。同时注意到整个过程中主流反应器Nitrospira丰度虽有一定程度的增加,但始终小于1%,可见NOB已得到有效控制,证明了本实验中侧流富集/主流强化的方式有效抑制了 NOB增殖,有效控制了NOB丰度。
3 结 论
(1)通过侧流富集/主流强化工艺能够实现CANON工艺在常温(25℃)、低浓度(约60 mg·L-1)条件下的稳定运行。在60 d运行过程中,通过7 d更换主流反应器40%污泥混合液的方式能够维持主流反应器总氮去除负荷在 80 g N·m-3·d-1左右,总氮去除率在70%左右,也可有效维持主流反应器中Anammox活性,主流反应器SAA持续升高。说明采用侧流富集/主流强化的运行方式来实现CANON工艺在市政污水主流线的应用是可行的。换泥频率可以根据实际运行情况调节优化。
(2)16S rDNA高通量测序结果表明,主流和侧流CANON系统中起亚硝化作用的AOB主要是Nitrosomonas属;进行Anammox反应的AnAOB 主要是CandidatusJettenia属。通过控制低DO(0.1~0.2 mg·L-1)和侧流富集/主流强化手段有效抑制了NOB增殖,有效控制了NOB丰度,60 d运行过程中主流反应器Nitrospira丰度一直小于1%。换泥方式没有影响侧流反应器 AnAOB的优势地位,CandidatusJettenia的丰度明显提高。
[1]SLIEKERS A O,DERWORT N,GOMEZ J C,et al.Completely autotrophic nitrogen removal over nitrite in one single reactor[J].Water Res.,2002,36(10):2475-2482.
[2]VAN LOOSDRECHT M C M,SALEM S.Biological treatment of sludge digester liquids[J].Water Science & Technology,2006,53(12):11-20.
[3]JOSS A,SALZGEBER D,EUGSTER J,et al.Full-scale nitrogen removal from digester liquid with partial nitritation and anammox in one SBR[J].Environmental Science & Technology,2009,43(14):5301-5306.
[4]SRI SHALINI S,JOSEPH K.Nitrogen management in landfill leachate:application of SHARON,ANAMMOX and combined SHARON-ANAMMOX process[J].Waste Manag.,2012,32(12):2385-2400.
[5]KINDAICHI T,AWATA T,MUGIMOTO Y,et al.Effects of organic matter in livestock manure digester liquid on microbial community structure andin situactivity of anammox granules[J].Chemosphere,2016,159:300-307.
[6]LACKNER S,GILBERT E M,VLAEMINCK S E,et al.Full-scale partial nitritation/anammox experiences—an application survey[J].Water Res.,2014,55:292-303.
[7]ANTHONISEN A,LOEHR R,PRAKASAM T,et al.Inhibition of nitrification by ammonia and nitrous acid[J].Journal(Water Pollution Control Federation),1976,48(5):835-852.
[8]HELLINGA C,SCHELLEN A,MULDER J W,et al.The SHARON process:an innovative method for nitrogen removal from ammonium-rich waste water[J].Water Science and Technology,1998,37(9):135-142.
[9]METCALF,EDDY,BURTON F L,et al.Wastewater Engineering:Treatment and Reuse [M].McGraw Hill,2003.
[10]STROUS M,KUENEN J G,JETTEN M S.Key physiology of anaerobic ammonium oxidation[J].Applied and Environmental Microbiology,1999,65(7):3248-3250.
[11]EGLI K,FANGER U,ALVAREZ P J,et al.Enrichment and characterization of an anammox bacterium from a rotating biological contactor treating ammonium-rich leachate[J].Archives of Microbiology,2001,175(3):198-207.
[12]DOSTA J,FERNANDEZ I,VAZQUEZ-PADIN J R,et al.Short- and long-term effects of temperature on the Anammox process[J].J.Hazard.Mater.,2008,154(1/2/3):688-693.
[13]ISAKA K,DATE Y,KIMURA Y,et al.Nitrogen removal performance using anaerobic ammonium oxidation at low temperatures[J].FEMS Microbiol.Lett.,2008,282(1):32-38.
[14]VAZQUEZ-PADIN J R,FERNANDEZ I,MORALES N,et al.Autotrophic nitrogen removal at low temperature[J].Water Sci.Technol.,2011,63(6):1282-1288.
[15]GILBERT E M,AGRAWAL S,KARST S M,et al.Low temperature partial nitritation/anammox in a moving bed biofilm reactor treating low strength wastewater[J].Environ.Sci.Technol.,2014,48(15):8784-8792.
[16]LOTTI T,KLEEREBEZEM R,HU Z,et al.Simultaneous partial nitritation and anammox at low temperature with granular sludge[J].Water Res.,2014,66:111-121.
[17]LAURENI M,FALAS P,ROBIN O,et al.Mainstream partial nitritation and anammox:long-term process stability and effluent quality at low temperatures[J].Water Res.,2016,101:628-639.
[18]MORALES N,VAL DEL RÍO Á,VÁZQUEZ-PADÍN J R,et al.The granular biomass properties and the acclimation period affect the partial nitritation/anammox process stability at a low temperature and ammonium concentration[J].Process Biochemistry,2016,51(12):2134-2142.
[19]WETT B,OMARI A,PODMIRSEG S M,et al.Going for mainstream deammonification from bench to full scale for maximized resource efficiency[J].Water Sci.Technol.,2013,68(2):283-289.
[20]SALEM S,BERENDS D,HEIJNEN J,et al.Model-based evaluation of a new upgrading concept for N-removal[J].Water Science and Technology,2002,45(6):169-176.
[21]SALEM S,BERENDS D,HEIJNEN J,et al.Bio-augmentation by nitrification with return sludge[J].Water Res.,2003,37(8):1794-1804.
[22]STROUS M,HEIJNEN J,KUENEN J G,et al.The sequencing batch reactor as a powerful tool for the study of slowly growing anaerobic ammonium-oxidizing microorganisms[J].Applied Microbiology and Biotechnology,1998,50(5):589-596.
[23]MIAO Y,ZHANG L,YANG Y,et al.Start-up of single-stage partial nitrification-anammox process treating low-strength swage and its restoration from nitrate accumulation[J].Bioresource Technology,2016,218:771-779.
[24]VAN HULLE S W H,VANDEWEYER H J P,MEESSCHAERT B D,et al.Engineering aspects and practical application of autotrophic nitrogen removal from nitrogen rich streams[J].Chemical Engineering Journal,2010,162(1):1-20.
[25]VÁZQUEZ-PADÍN J R,POZO M J,JARPA M,et al.Treatment of anaerobic sludge digester effluents by the CANON process in an air pulsing SBR [J].J.Hazard.Mater.,2009,166(1):336-341.
[26]CHU Z R,WANG K,LI X K,et al.Microbial characterization of aggregates within a one-stage nitritation-anammox system using high-throughput amplicon sequencing[J].Chemical Engineering Journal,2015,262:41-48.
[27]WU S,BHATTACHARJEE A S,GOEL R.Evaluation of single stage hybrid deammonification reactor for filtrate treatment:start-up and performance [J].Proceedings of the Water Environment Federation,2014,2014(16):4060-4069.
[28]GONZALEZGIL G,SOUGRAT R,BEHZAD A R,et al.Microbial community composition and ultrastructure of granules from a full-scale anammox reactor [J].Microbial Ecology,2015,70(1):118-131.
date:2017-05-22.
Prof.WANG Yayi,wyywater@126.com
supported by the National Natural Science Foundation of China (Outstanding Young Foundation)(51522809).
Controlling strategy for a CANON system treating wastewater with low ammonium concentration at room temperatureviabio-augmentation batch enhance method
CAO Lijuan,CHEN Jie,JIANG Guangmeng,CHANG Qinglong,WANG Yayi
(State Key Laboratory of Pollutant Controlling and Resource Reuse,College of Environmental Science and Engineering,Tongji University,Shanghai200092,China)
The feasibility of the completely autotrophic nitrogen removal over nitrite (CANON) process for removal of nitrogen from mainstream wastewater (~60 mg) at room temperature (25℃) was investigated using bio-augmentation batch enhanced (BABE) controlling strategy.The results indicated that through changing 40% sludge of the mainstream reactor from sidestream reactor every 7 d,the total nitrogen removal rate (TNRR) and the total nitrogen removal efficiency (TNRE) stabilized at about 80 g N·m-3·d-1and 70%.The specific anammox activity in mainstream reactor increased continuously.16S rDNA gene high-throughput sequencing results showed that the functional microorganisms involved in both mainstream and sidestream reactor wereCandidatusJettenia like anammox bacteria andNitrosomonaslike ammonia-oxidizing bacteria (AOB),and the abundance ofNitrospiralike nitrite-oxidizing bacteria (NOB) always maintained below 1% during 60 days’ operation.It can be concluded that the operational mode of changing sludges between mainstream and sidestream every 7 d guarantees anammox activity and good nitrogen removal performance of mainstream CANON reactor under the experimental conditions herein.
CANON; bio-augmentation batch enhanced; room temperature and low ammonium concentration;high-throughput sequencing
X 703.1
A
0438—1157(2017)12—4723—08
10.11949/j.issn.0438-1157.20170663
2017-05-22收到初稿,2017-07-15收到修改稿。
联系人:王亚宜。
曹丽娟(1993—),女,硕士研究生。
国家自然科学基金(优秀青年基金)项目(51522809)。

