兽骨明胶的新提取工艺研究
许立新, 李恒月, 赵东旭
(北京理工大学 生命学院, 北京 100081)
兽骨明胶的新提取工艺研究
许立新, 李恒月, 赵东旭
(北京理工大学 生命学院, 北京 100081)
对传统明胶提取工艺进行改造有助于提高生产效率。以破碎后的兽骨骨粒为原料,利用超声波辅助技术提取明胶,对提取的明胶性质进行表征。通过单因素试验探讨了盐酸浓度、超声功率、浸泡时间、浸酸料液比对原料矿物质去除的影响,确定去除矿物质的条件为:盐酸浓度为3%,超声功率为1000 W,浸酸料液质量比为1∶10,浸酸时间为3 d。在随后的浸碱操作中,研究了浸碱时间、超声功率、水提pH、水提料液比对明胶提取率的影响。最终优化明胶提取条件为:浸碱时间6 d,超声功率为1000 W,水提pH 5,水提料液质量比为3∶10。在最佳浸碱和提胶条件下,明胶的提取率达14.52%。以SDS-PAGE电泳和BCA法作为检测手段检测明胶分子相对分子质量和提取率。最终结果表明:明胶的分子质量主要分布在20.0~94.4 ku之间,在60℃下蛋白提取率较高。
兽骨;明胶;超声波
明胶是由动物体的皮、骨等结缔组织经预处理后,在适当温度下提取出来的具有水溶性和能凝冻的一类物质的总称[1],不仅作为食品添加剂运用到各种食品加工过程中,同时还被应用在医药、生化、印刷、感光工业等其它领域[2-5]。
皮明胶与兽骨明胶的制备有较大区别,皮组织只需较低的盐酸溶液浓度且浸泡时间短,就可以使其吸水膨胀,具备一定的弹性;而兽骨的组织坚硬,需要较高浓度的盐酸溶液浸泡较长时间,从而延长了生产周期[6]。传统的兽骨明胶制备工艺流程为:兽骨→酸处理→检测→碱处理→检测→提胶→胶液净化→浓缩→干燥→明胶成品[7]。为改善兽骨明胶的制备工艺,将超声波技术应用于兽骨明胶的生产中,超声波产生的空化效应等多重效应可以加快物质间的化学反应,促进蛋白的溶出,缩短实验周期,在兽骨明胶的制备中具有良好的应用前景[8]。本文利用超声波技术确定了兽骨下脚料中明胶矿物质的去除以及浸碱和提胶的最佳工艺条件。
1 材料与方法
1.1 材料
原料杂骨由安徽蚌埠丰原明胶有限公司提供,室温保存。
1.2 试剂与仪器
HCl(北京化工厂);NaOH(西陇化工股份有限公司);氧化钙(国药集团化学试剂有限公司);考马斯亮蓝R-250均购于北京凯诺春天生物科技有限公司;BCA蛋白质定量试剂盒购自TIANGEN公司;其他试剂均为国产分析纯。
超声波仪器的改装说明:由于常规的超声波清洗器的容量及功率的限制,我们改装了板振式超声波清洗器。为了控制温度,在清洗器上改装了两个水龙头,一个在上方,另一个在下方,用水流的方式有效地控温。其中,下方是作为主要出水口,而上方的出水口是为了消除安全隐患。同时,在主机上连接了一个电磁继电器,能够控制具体的超声时间。此外,在超声振板上方安装了一个金属篮,固定高度,方便实验的进行。
1.3 方法
1.3.1 兽骨中明胶的提取
取30 g原料兽骨,加入一定浓度的盐酸溶液浸泡以除去兽骨中的矿物质,随后用饱和石灰水浸泡除去兽骨中的杂蛋白,每24 h换1次液。经浸酸浸碱处理后的兽骨水洗3~4遍,调节pH,采取“分道提胶”的方法,在不同温度下提胶,得到明胶提取液。在4℃,10 000 r/min的条件下,离心10 min,澄清明胶提取液,干燥后即得到明胶。明胶提取率(%)=(明胶干重/样品干重)×100%。
1.3.2 单因素试验确定去除兽骨矿物质的条件
采用1.3.1中的方法提取明胶,通过测定骨素干重,确定去除兽骨矿物质的条件。提取条件为:固定反应条件为原料30 g,料液质量比为30∶300,超声功率为1000 W,超声时间为每小时20 min。考察不同盐酸浓度(2%、3%和4%)对原料矿物质去除的影响;固定反应条件为原料30 g,盐酸浓度为3%,超声功率为1000 W,超声时间为每小时20 min。考察不同料液比(30∶100、30∶300和30∶500)对原料矿物质去除的影响;固定反应条件为原料30 g,盐酸浓度为3%,料液比为30∶300,超声时间每小时为20 min。考察不同超声功率(800 W、1000 W和1200 W)对原料矿物质去除的影响。
1.3.3 明胶最佳浸碱及水提工艺条件的确定
在单因素试验的基础上设计了浸碱时间分别为5 d、6 d和7 d,超声功率分别为600 W、800 W和1000 W,水提pH分别为5、7和9,水提料液比分别为3∶8、3∶10及3∶12的四因素三水平的正交试验,各因素的3个水平采用-1,0,1进行编码,如表1。
1.3.4 SDS-PAGE 电泳分析
采用十二烷基磺酸钠-聚丙烯酰胺凝胶电泳对明胶样品进行电泳分析。样品按照1∶1的比例加入样品缓冲液,于100℃加热5 min 使蛋白质变性,待测。采用3%的浓缩胶、12%分离胶对已处理样品进行电泳分析。采用考马斯亮蓝对聚丙烯酰胺凝胶进行染色后,用10%甲醇及10%冰醋酸的混合溶液脱色[9]。
1.3.5 BCA法测蛋白提取率
分别取25 μL新鲜配制的BSA标准液和待测明胶样品,加入到96孔板中。加入200 μL的BCA工作液,并充分混匀;加盖,37℃孵育30 min后冷却至室温或室温下放置2 h;用酶标分析仪于562 nm处检测其吸光度;根据标准曲线计算出样品中的蛋白浓度[10]。

表1 正交试验因素水平和编码
2 结果与分析
2.1 单因素试验确定去除兽骨矿物质的条件
2.1.1 不同盐酸浓度对原料杂骨中的矿物质去除的影响
由图1可知,随着盐酸浸泡时间的延长,骨素干重逐渐减少。盐酸浓度为 2%浸泡后骨素干重始终大于盐酸浓度为3%和4%浸泡后的骨素干重。这说明盐酸浓度为2%时,并没有完全除去原料中矿物质。当盐酸浓度为3%时,即可充分除去原料中的矿物质。故确定去除原料杂骨时浸泡的盐酸浓度为3%。
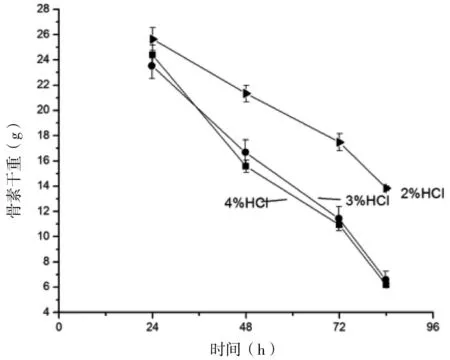
图1 不同浓度的盐酸浸泡后骨素的干重变化
2.1.2 不同料液比对原料杂骨的矿物质去除的影响
由图2可知,从各个时间段的骨素干重来看,在48 h之前,由于盐酸量充足,不同料液比浸泡后的骨素干重相差不大;当反应进行到72 h时,料液比为30∶100时的骨素干重明显大于料液比为30∶300和30∶500时的骨素干重,且在此时,料液比为30∶100时的骨素干重减少量明显小于料液比为30∶300和30∶500时的骨素干重的减少量。这是由于随着反应的进行,料液比为30∶100的盐酸量逐渐不足。当反应进行到84 h时,料液比为30∶100的骨素干重减少量远小于料液比30∶300和30∶500时的骨素干重减少量,因料液比小,盐酸的量过少,在盐酸与骨素的内部反应时因盐酸的量不够而导致反应停止,料液比为30∶300和30∶500时均能在理想的时间除去矿物质,故选取30∶300为最适料液比。
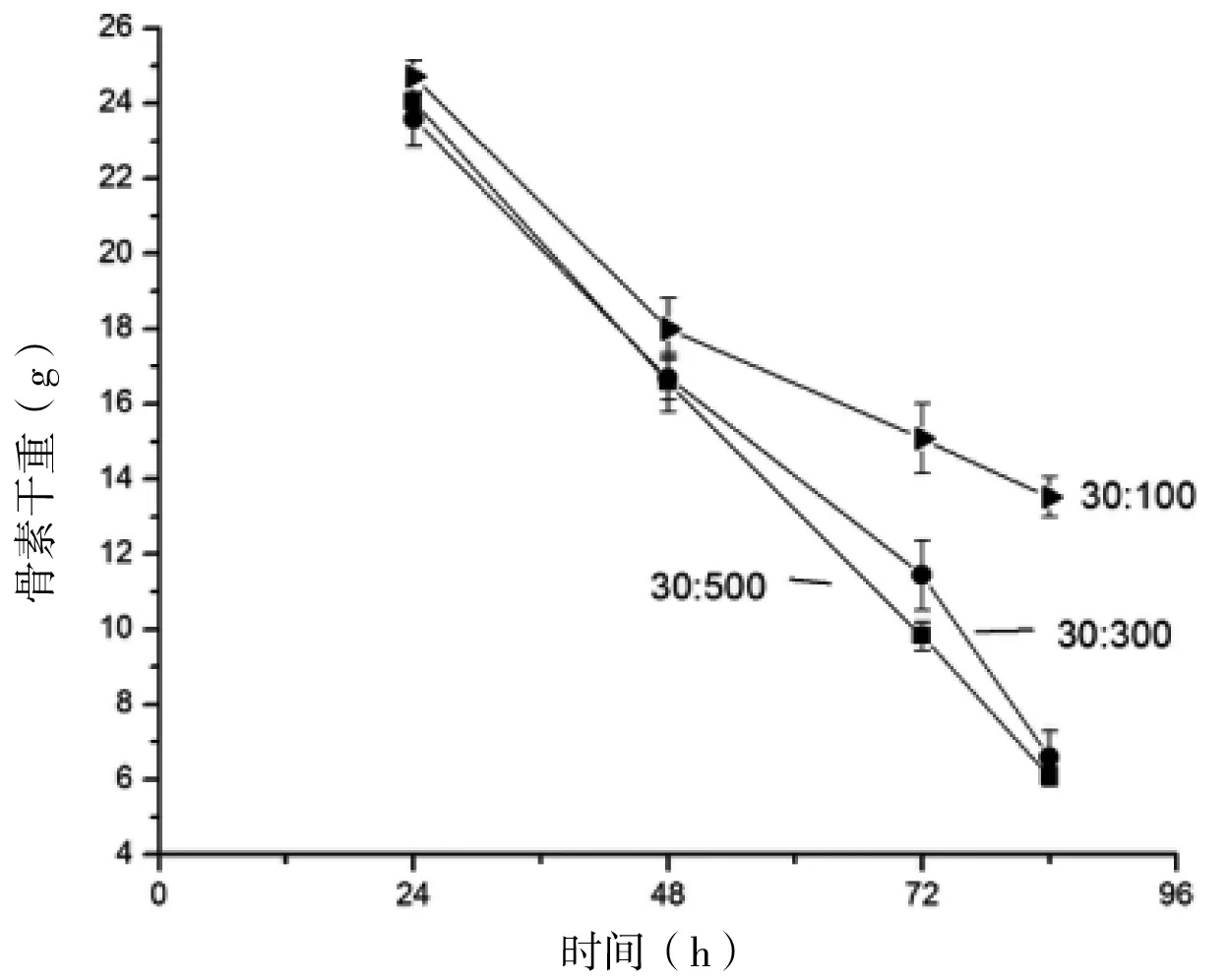
图2 不同料液比的盐酸浸泡后骨素的干重
2.1.3 不同超声功率对原料杂骨中矿物质去除的影响
由图3可知,随着超声功率的增大,各时间段骨素的干重逐渐减少。在48 h之前,骨素干重的减少量差异不显著,在48 h之后骨素的干重减少量差异显著。原因是刚开始时原料表面与盐酸反应,需要渐渐地盐酸渗透到原料内部,反应速度减慢。增大超声功率能够增加矿物质去除速度,但是超声功率为1000 W和超声功率为1200 W时相差不大。并且在72 h时,超声功率为1000 W和1200 W时的剩余盐酸浓度相差不大(图4),但超声功率为1200 W时的骨素干重过低,推测在超声功率1200 W时,由于功率过大而破坏了骨素的内部结构,使骨素流失,故超声功率为1000 W时较佳。
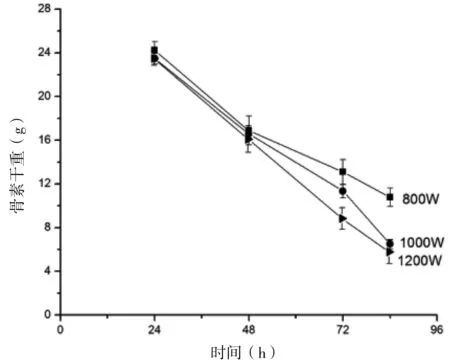
图3 不同超声功率作用下的骨素干重变化
综上所述,增大盐酸浓度、料液比和超声功率都能在一定程度提高去除原料中矿物质的效率。按照原料30 g来计算,则理论上其中矿物质的含量为18~22 g。在上述实验确定的最佳条件下(盐酸浓度为3%,浸酸时间为72 h,料液比为30∶300,超声功率为1000 W),反应后的骨素干重在8 g以下(图3),即矿物质去除量达90%以上。

图4 不同超声功率作用下的盐酸剩余浓度曲线
2.2 明胶最佳浸碱及水提工艺条件的确定
以浸碱时间、超声功率、水提pH、水提料液比为考察因素,每个因素3个水平,按照L9(34)正交试验设计表设计实验,结果见表2。
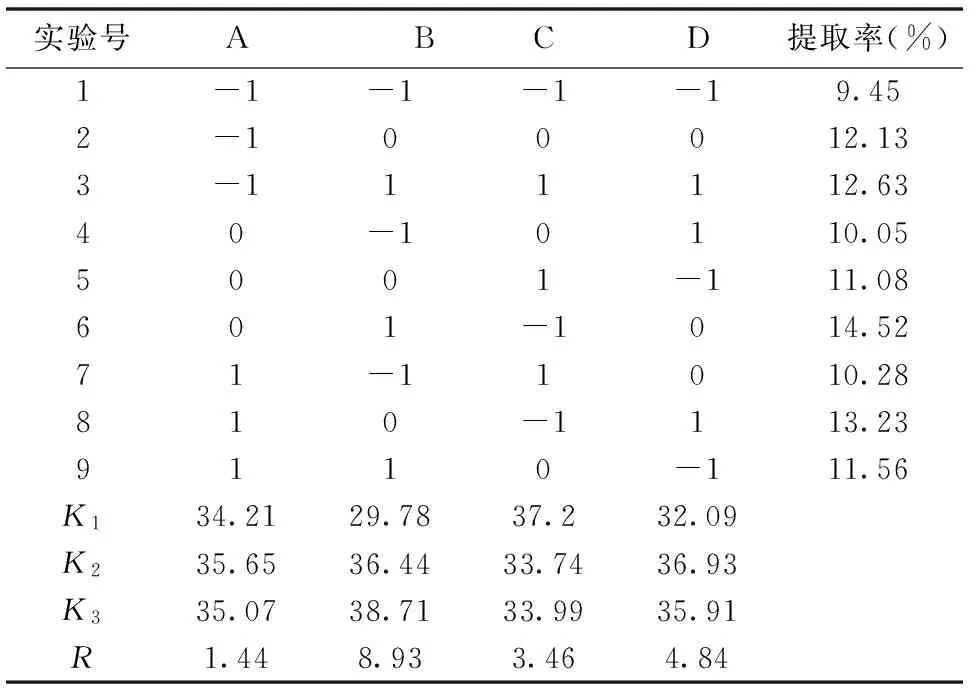
表2 正交试验设计以及明胶提取率
由表2的实验结果R值分析可知,各因素对明胶提取率的影响从大到小依次为超声功率、水提料液比、水提pH、浸碱时间。当超声功率为第三水平时,明胶的提取率最高,在第一水平时,明胶的提取率最低。由此可知,超声在明胶的处理过程中扮演着重要角色,且超声功率越大,明胶的提取效率越高。因此,超声功率定为1000 W。
当水提料液比为第一水平时,明胶提取率较低,当水提料液比为第二水平和第三水平时,明胶的提取率较高。由明胶的提取过程中可以推测,在不断产生明胶的过程中继续加热会使已经生成的明胶也有可能逐渐水解成多肽。因此在相同条件下,料液比越高在热水提胶过程中残留下的明胶越多。综合考虑提取率和资源,水提料液比定为3∶10。
当水提pH为第一水平时,提取率最高,而当水提pH为第二水平和第三水平的差别不明显。热水提胶时,骨胶原螺旋体会慢慢解体,使原本相互缠绕的链彼此松开,形成许多无规则的线团,断裂成明胶碎片,融入溶液中,形成明胶溶液。同时,明胶提取是在胶原纤维的热收缩温度上进行的,提取温度越高于收缩温度,胶原越容易转变成明胶。而胶原纤维的收缩温度受pH的影响,在中性溶液中的收缩温度高于酸性和碱性条件下的收缩温度。所以,在溶液pH为中性时,胶原纤维的结构稳定,胶原转变为明胶较困难,故明胶的提取量少。酸性环境对明胶纤维结构的去稳定性比碱性强,所以在酸性环境下,明胶的提取率更高。故水提pH定为5。
浸碱过程是除去杂蛋白的过程,使骨素颜色发白,并具有一定的弹性。当浸碱时间为第二水平时,明胶提取率较大。理论上应该是适当延长浸碱时间,更有利于提高明胶的提取率。实际上,当浸碱时间为第三水平时,明胶的提取率反而下降。原因是浸碱时间过长,会破坏骨素的高级结构,降低骨素的弹性。因此,浸碱时间定为6 d。
经综合分析,浸碱和提胶的最佳条件为,浸碱时间为6 d,超声功率为1000 W,水提pH为5,水提料液比为3∶10。在此条件下明胶的提取率可达14.52%。
2.3 SDS-PAGE 电泳分析所提明胶的相对分子质量分布
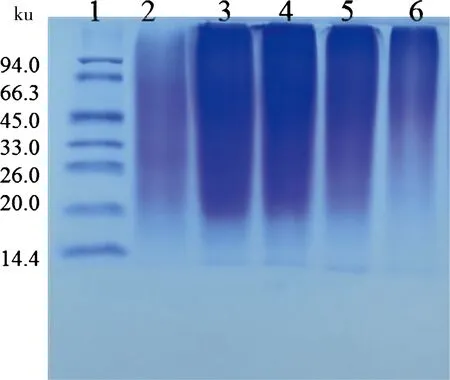
图5 SDS-PAGE法测定不同温度下提取的明胶的分子质量
注:1代表标准蛋白;2~6分别代表在50℃、60℃、70℃、80℃和90℃下提取的明胶
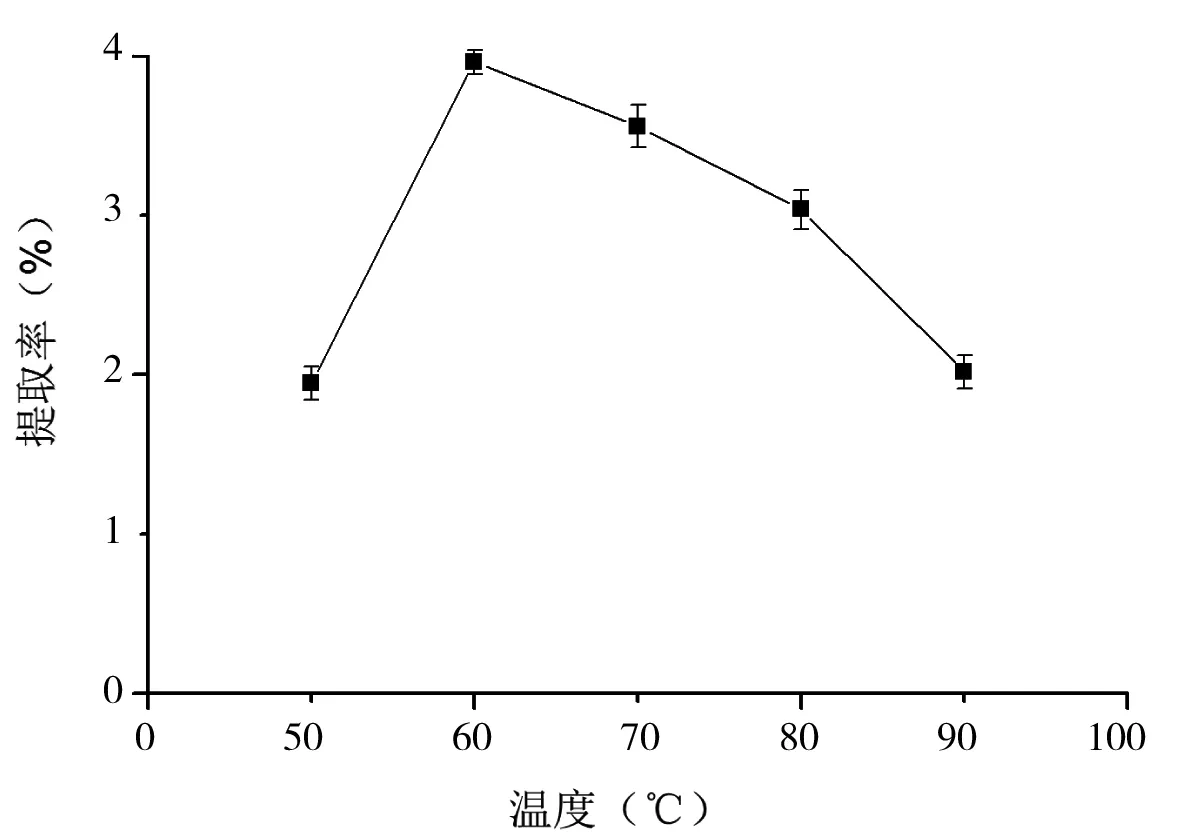
图6 不同温度下的明胶提取率
明胶在SDS-PAGE电泳图上均呈连续分布,没有明显的电泳条带,说明这些明胶的相对分子质量分布具有分散性。但主要分布在20~94.4 ku之间(图5)。
2.4 BCA法测定蛋白提取率
由图6可以看出,明胶在60℃下提取率较高,而当温度为50℃、90℃时,蛋白提取率相对较低。这点在图5的SDS-PAGE电泳图也可以看出,第2、6条带颜色较浅,这可能是由于提胶温度较低时,溶出的蛋白含量较少;而提胶温度过高则又引起部分蛋白降解。
3 结论
本文研究了盐酸浓度、超声功率、浸酸时间、浸酸料液比对兽骨中矿物质去除的影响,确定最佳的去除矿物质的条件为盐酸浓度为3%,超声功率为1000 W,浸酸时间为3 d,浸酸料液比为30∶300,矿物质去除量达90%以上。在确定最佳的去除矿物质条件后,研究了浸碱时间、超声功率、水提pH、水提料液比对明胶提取率的影响,确定最佳的浸碱和提胶条件为浸碱时间6 d,超声功率为1000 W,水提pH为5,水提料液比为3∶10。此时明胶的提取率达14.52%。通过SDS-PAGE图可知,明胶的分子质量具有分散性,但主要分布在20.0~94.4 ku之间,明胶提取率在60℃达到最高。
本文从兽骨的下脚料中提取明胶,既能解决环境污染问题,又能增加兽骨加工的附加值。同时,本文的研究为从兽骨中提取明胶提供了理论基础,利用超声波辅助提取技术给兽骨明胶的提取提供了新的方法。
[1]薛佳佳. 基于明胶的生物弹性体及生物医用膜材料的制备与性能研究[D]. 北京:北京化工大学, 2015.
[2]HAUG I J, DRAGET K I, SMIDSRØD O, et al. Physical and rheological properties compared to mammalian gelatin[J]. Food Hydrocolloids, 2004, 18(2):203-213.
[3]ROSS-MURPHY S B. Structure and rheology of gelatin gels[J]. The Imaging Science Journal, 1997, 45(3):205-209.
[4]CHO S M, GU Y S, KIM S B. Extracting optimization and physical properties of yellow fin tuna skins preserved by different methods[J]. Food Hydrocolloids, 2005, 19(2):221-229.
[5]LIU H, LI D, GUO S. Rheological properties of channel catfish gelatin from fish skins preserved by different methods[J].LWT-Food Science and Technology, 2008, 41(8):1425-1430.
[6]张换换,李明霞,李文飞,等.明胶的制备及其在日用化学品中的应用[J]. 口腔护理用品工业,2011,21(2):29-31.
[7]刘安军,石 清,朱振元,等.猪骨明胶的提取工艺研究[J]. 现代食品科技, 2010, 26(5):519-522.
[8]LI D F, MU C D, CAI S M, et a1. Ultrasonic irradiation in the enzymatic extraction of collagen[J].Ultrasonics Sonochemistry, 2009, 16(5):605-609.
[9]张 兵,王毅虎,王 颖, 等. 酸法明胶、碱法明胶及酶法明胶的分子量分布分析[J]. 明胶科学与技术,2012(4):180-189.
[10]刘雅超,刘 旭,白鸿源,等. 蛋白质定量分析的研究进展[J].中国民族民间医药, 2009(8):49-50.
Studyonthenewextractiontechnologyofgelatininanimalbone
XU Li-xin, LI Heng-yue, ZHAO Dong-xu
( School of Life Sciences, Beijing Institute of Technology, Beijing 100081, China )
The improvement of the traditional gelatin extraction process can help to improve the production efficiency. We used animal bones to extract gelatin by ultrasonic technique. Based on the single factor experiments, the influence of the hydrochloric acid concentration, ultrasonic power, pickling time, ratio of liquid to materials for removing minerals was determined. The bone was desalted with HCl on the best conditions as follows: HCl concentration, 3%; ultrasonic power, 1000 W; pickling time 3 d, the weight of bone: the weight of HCl 1∶10. The best condition for the gelatin extraction yield was determined as follows: alkali soaking time, 6 d; ultrasonic power, 1000 W; water extraction pH 5; the weight of bone∶the weight of water, 3∶10. The gelatin extraction yield was 14.52% under the best condition. The distribution of gelatin molecules was measured by SDS-PAGE, while the relative content mass was measured by BCA method. The SDS-PAGE results showed that distribution of gelatin molecules was within a range from 20.0 to 94.4 ku. The protein extraction rate was higher at 60℃.
animal bone; gelatin; ultrasonic wave
2016-11-22;
2016-12-12
面向公共安全用纳米材料及诊断技术的研发(2013AA032204)
许立新,硕士研究生,专业方向为生物学,E-mail:xulixin1993@126.com
赵东旭,博士,研究生导师,研究方向为生物活性成分的分离分析,E-mail:zhaodx@bit.edu.cn
10.3969/j.issn.2095-1736.2017.06.089
TS251.94
B
2095-1736(2017)06-0089-04

