鲍鱼内脏β-葡萄糖苷酶中试规模制备研究
陈胜男, 张 利, 石贤爱, 2, 陈金梅, 蔡振辉
(1. 福州大学生物科学与工程学院, 福建 福州 350116; 2. 福建省医疗器械和医药技术重点实验室, 福建 福州 350002)
鲍鱼内脏β-葡萄糖苷酶中试规模制备研究
陈胜男1, 张 利1, 石贤爱1, 2, 陈金梅1, 蔡振辉1
(1. 福州大学生物科学与工程学院, 福建 福州 350116; 2. 福建省医疗器械和医药技术重点实验室, 福建 福州 350002)
采用胶体磨匀浆、 高速管式离心、 陶瓷复合膜过滤、 超滤、 DEAE-琼脂糖离子交换层析和CM-琼脂糖离子交换层析的中试制备工艺, 从鲍鱼内脏中分离纯化得到β-葡萄糖苷酶. 研究发现: 胶体磨匀浆所得匀浆液总酶活为12 174.21 U, 比活力为0.158 U·mg-1; 高速管式离心两次后得到粗酶液, 酶比活力为0.247 U·mg-1; 陶瓷复合膜过滤后所得清液的酶比活力为0.133 U·mg-1; 超滤浓缩脱盐后所得浓缩液的酶比活力为0.249 U·mg-1; DEAE-琼脂糖阴离子交换层析洗脱缓冲液的最佳pH值为7.5, CM-琼脂糖阳离子交换层析洗脱缓冲液的最佳pH值为6.0; DEAE-琼脂糖阴离子交换层析后收集酶活性组分的酶比活力为0.492 U·mg-1, CM-琼脂糖阳离子交换层析收集酶活性组分的酶比活力为1.709 U·mg-1, 纯化倍数为10.78, 收率为5.0%.
鲍鱼内脏;β-葡萄糖苷酶; 中试; 纯化
0 引言
β-葡萄糖苷酶(β-glucosidase, CE3.2.1.21)能够催化水解芳基和烃基与糖基原子团之间的糖苷键并生成葡萄糖[1-2], 是水解纤维素及合成红景天苷的关键酶[3]. 目前关于β-葡萄糖苷酶的研究多集中于微生物[4-8], 也有部分水生生物[9-11].
鲍鱼内脏酶主要集中在消化酶. 廖金花等[12]采用离子交换柱层析及分子筛技术从杂色鲍内脏分离纯化得到碱性磷酸酶. 文献[13]采用盐析、 透析及柱层析等技术从鲍鱼内脏中得到纤维素酶及琼脂酶. 宫国君等[14]从皱纹盘鲍内脏分离纯化得到β-1, 3-葡聚糖酶. 石贤爱等[15]从鲍鱼内脏中分离纯化得到β-葡萄糖苷酶. 目前关于从鲍鱼内脏中提取纯化各种酶类均处于实验室规模的研究, 尚未见在中试规模制备β-葡萄糖苷酶的报道. 本研究在前期实验室规模研究的基础上, 采用多功能胶体磨、 高速管式离心机、 陶瓷复合膜过滤设备、 超滤设备、 DEAE-琼脂糖层析柱和CM-琼脂糖层析柱, 研究从鲍鱼内脏中制备β-葡萄糖苷酶的中试工艺, 以期为更大规模β-葡萄糖苷酶的分离纯化奠定基础.
1 材料与方法
1.1 药品和试剂
鲍鱼内脏, 由福建莆田汇丰食品公司提供; 对硝基苯基-β-D-葡萄糖苷(pNPG纯度98%以上)、 DEAE-琼脂糖、 CM琼脂糖购自上海源叶生物科技有限公司; 牛血清蛋白(BSA)购自生工生物工程(上海)股份有限工司, 纯度99.9%以上; 其他试剂均为分析纯, 购自国药集团.
1.2 实验方法
1.2.1 β-葡萄糖苷酶活力测定及蛋白含量测定
按照文献[15]描述的方法测定β-葡萄糖苷酶活力及蛋白含量.β-葡萄糖苷酶液活力定义: 在一定条件下, 1.0 mL酶液1 min内催化水解pNPG生成1微摩尔数pNP定义为一个活力单位(U).
1.2.2 粗酶提取
1) 胶体磨匀浆. 取冷冻鲍鱼内脏8.0 kg(先将内脏剪碎), 以1∶3加入冰冷Tris-HCl缓冲液(50 mmol·L-1, pH 7.0)24.0 L, 在多功能胶体磨中匀浆后, 加入210.0 g的NaCl, 使之终浓度为0.15 mol·L-1. 将匀浆液置于4 ℃, 搅拌抽提2.0 h后, 静置过夜.
2) GQ75B高速管式离心. 将上述匀浆液通入GQ75B高速管式离心机(蠕动泵流速0.55 L·min-1, 分离筒转速20 000 r·min-1)高速离心1 h去除大颗粒固体残渣, 收集上清液. 上清液再次高速离心得到粗酶液.
1.2.3 酶分离纯化
1) 陶瓷复合膜过滤. 将粗酶液转入陶瓷复合膜(膜管为19通道, 外径30 mm, 长度1 016 mm)进行错流过滤.
2) 超滤脱盐、 浓缩. 将过滤得到的清液进行超滤浓缩, 超滤膜截留分子量为10 kD, 待所有清液经超滤浓缩至3 L浓缩液后, 用10% AgNO3溶液检测脱盐是否彻底. 每12 h补充清液至超滤罐满. 在超滤3、 17、 32、 46、 60、 70 h时取样分别测定浓缩液和透出液的酶活力和蛋白含量.
3) DEAE-琼脂糖柱层析. 用Tris-HCl缓冲液(pH=7.5、 50 mmol·L-1)平衡后上样, 上样体积为1 L, 然后用Tris-HCl缓冲液(pH=7.5, 50 mmol·L-1, 含0~0.4 mol·L-1NaCl)进行梯度洗脱, 流速为20.0 mL·min-1, 每5 min收集一管, 分别测定各管酶活力和蛋白含量, 收集活性组分进行CM-琼脂糖柱层析.
4) CM-琼脂糖柱层析. 用Tris-HCl缓冲液(pH=6.0, 50 mmol·L-1)平衡后上样, 然后用Tris-HCl缓冲液(pH=6.0、 50 mmol·L-1, 含0~0.3 mol·L-1NaCl)进行梯度洗脱, 流速为20.0 mL·min-1, 每5 min收集一管. 分别测定各管酶活力和蛋白含量并收集活性组分.
2 结果与讨论

图1 鲍鱼内脏β-葡萄糖苷酶中试规模制备流程图Fig.1 The flow diagram of pilot-plant scale preparation of β-glucosidase from abalone viscera
常规的实验室规模制备鲍鱼内脏β-葡萄糖苷酶的工艺为: 微型组织匀浆、 硫酸铵沉淀、 透析、 DEAE-纤维素柱层析和Sephadex G-100柱层析[15]. 由于微型组织匀浆、 透析只适用于实验室规模, 硫酸铵分段盐析对于中试来说成本太大、 操作不便, 因而本研究采用如图1所示的中试工艺.
匀浆设备改为胶体磨匀浆, 离心设备由高速冷冻离心机改至高速管式离心机, 离心量从50 mL扩大至30~40 L, 而转速从15 000增加至20 000 r·min-1. 陶瓷复合膜过滤设备(过滤精度0.05 μm)用于去除未被分离的微小颗粒物质. 改用超滤设备进行脱盐浓缩, 操作简便且清洗简单. 由于鲍鱼内脏中纤维素酶和葡聚糖酶含量较高[13], 且Sephadex G-100的上样量有限, 因而改用DEAE-琼脂糖和CM-琼脂糖(床层体积φ5.5 cm×45 cm), 以替代DEAE-纤维素和Sephadex G-100的方案.
2.1 胶体磨匀浆
将8.0 kg鲍鱼内脏匀浆后获得32.6 L匀浆液, 总酶活为12 174.21 U, 总蛋白为76 812.16 mg, 比活力为0.158 U·mg-1.
2.2 高速管式离心
高速管式离心结果如表1所示. 从表1可知, 第二次高速管式离心后获得的粗酶液比活较第一次离心稍高, 为0.247 U·mg-1,纯化倍数为1.56,收率为79.2%,但粗酶液仍很浑浊.

表1 高速管式离心分离效果Tab.1 Separation results with high speed tubular centrifuge
2.3 陶瓷膜过滤
陶瓷膜过滤是在外压作用下, 粗酶液在膜通道内流动, 酶及其他可溶性物质透过膜并形成清液, 微小颗粒物被膜截留并形成浓液回流至原料罐. 如此不断循环达到分离纯化的目的. 结果如表2所示.
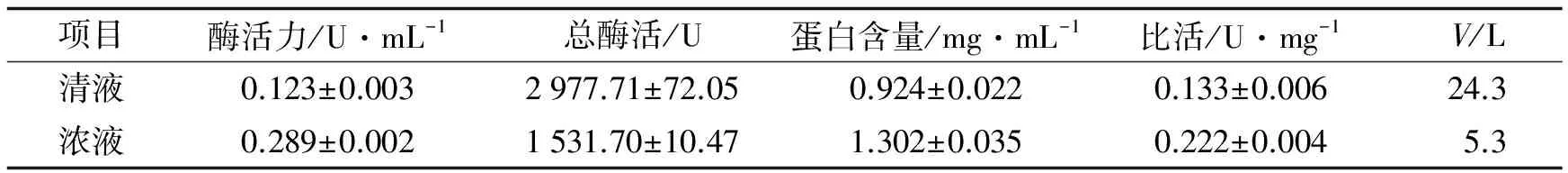
表2 陶瓷复合膜过滤结果Tab.2 Filtration results with ceramic composite membrane
从表2可知, 所得清液总酶活为2 977.71 U, 浓液的总酶活为1 531.70 U. 陶瓷复合膜设备在运作过程产生的冲击力会导致酶活损失严重, 因而在开始运作时需确保设备通量减少运作时间, 且在高速离心时应尽量去除大分子固体颗粒以增加陶瓷膜的通量. 部分酶被截留在浓液中, 因而应收集浓液留待下次膜过滤时继续处理或者加水稀释尽量使酶透过膜, 提高酶活的总回收率.
2.4 超滤浓缩脱盐
超滤的主要目的是将陶瓷复合膜滤出的清液进行浓缩并脱盐以便进行离子交换. 由于陶瓷复合膜过滤出的清液有24.3 L, 而超滤的通量为0.292 L·h-1, 所以超滤至3 L需72 h, 每12 h补充清液至超滤罐满. 超滤结果如表3所示. 随着超滤时间增加, 浓缩液的酶活力及比活力也逐步增加, 但超滤72 h后其比活力却减少了, 其原因是超滤设备的机械剪切力导致部分酶的蛋白结构被破坏而失活. 因此超滤前应检验超滤的通量是否正常, 如超滤的通量太小应对超滤膜进行清洗或及时更换超滤膜, 尽量减少超滤时间, 减少酶失活. 而透出液的酶活力都很微弱, 说明截留相对分子质量为10 kD的超滤膜是适用的, 不会使酶大量流失.

表3 超滤浓缩结果Tab.3 Result of ultrafiltration
续表3
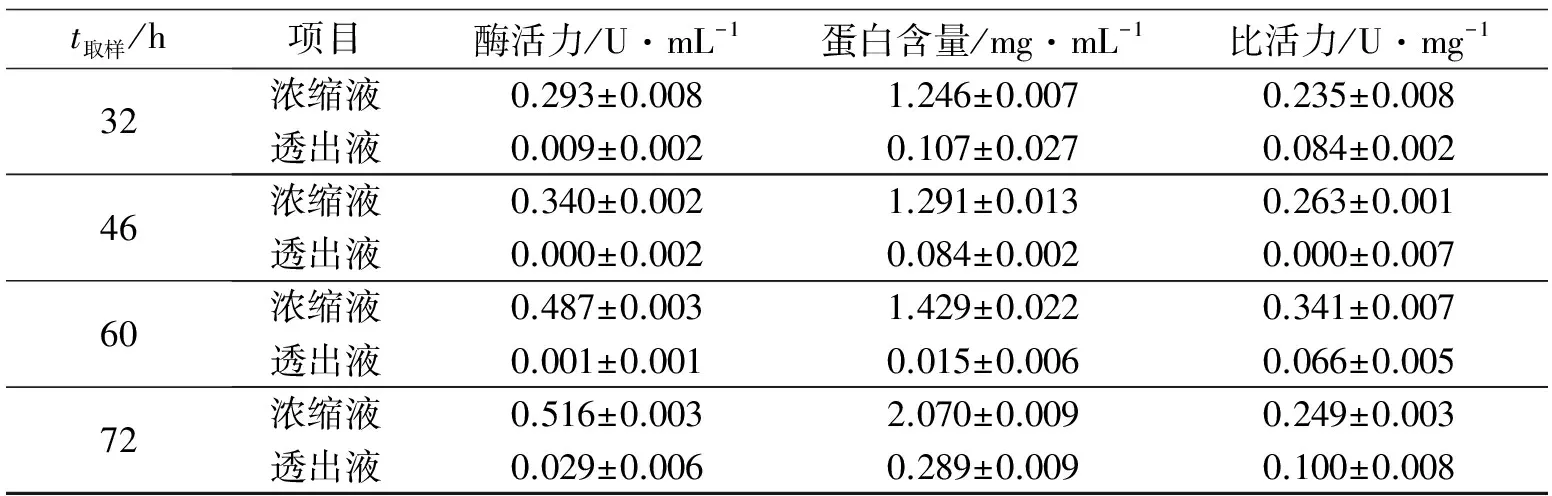
t取样/h项目酶活力/U·mL-1蛋白含量/mg·mL-1比活力/U·mg-132浓缩液0.293±0.0081.246±0.0070.235±0.008透出液0.009±0.0020.107±0.0270.084±0.00246浓缩液0.340±0.0021.291±0.0130.263±0.001透出液0.000±0.0020.084±0.0020.000±0.00760浓缩液0.487±0.0031.429±0.0220.341±0.007透出液0.001±0.0010.015±0.0060.066±0.00572浓缩液0.516±0.0032.070±0.0090.249±0.003透出液0.029±0.0060.289±0.0090.100±0.008
2.5 弱碱性阴离子DEAE-琼脂糖柱层析
2.5.1 洗脱缓冲液pH的选择
从DEAE-琼脂糖层析柱中穿透出来的酶活力回收率与洗脱缓冲液pH值的关系(如图2所示)可知, 当pH值为7.5时, 酶活回收率最高, 为78.3%. 因此当进行弱碱性阴离子DEAE-琼脂糖柱层析纯化时, 应选择pH7.5的洗脱缓冲液.

图2 洗脱缓冲液pH值对酶活回收率的影响 图3 DEAE-琼脂糖柱层析洗脱图谱Fig.2 Effect of elution buffer pH on recovery of enzymatic activity Fig.3 Elution diagram of DEAE-sepharose chromatography
2.5.2 弱碱性阴离子DEAE-琼脂糖柱层析纯化效果
将浓缩脱盐后的酶液1.0 L上样后, 用0~0.4 mol·L-1NaCl、 50 mmol·L-1Tris-HCl缓冲液(pH 7.5)梯度洗脱如图3所示. 从图3可以看出, 用pH 7.5缓冲液洗脱时, 大部分β-葡萄糖苷酶直接从柱中洗脱出来, 形成蛋白峰II-1、 II-2、 II-3、II-4以及酶活力峰I-1和I-2(其中, OD410表示酶活力的吸光值,OD595表示蛋白的吸光值,下同). 由于I-1酶活力峰峰值最大, 且相对蛋白含量较低, 故收集I-1峰处活性组分共1.33 L. 经过DEAE-琼脂糖柱层析将大部分杂蛋白与β-葡萄糖苷酶分离达到纯化目的.
2.6 弱酸性阳离子CM-琼脂糖柱层析
2.6.1 洗脱缓冲液pH的选择
从CM-琼脂糖层析柱中穿透出来的酶活力回收率与洗脱缓冲液pH值的关系(如图4所示)可知, 当pH值为6.0时, 酶活回收率最高, 为84.6%. 因此CM-琼脂糖柱层析应选择pH6.0的洗脱缓冲液.

图4 洗脱缓冲液pH值对酶活回收率的影响 图5 CM-琼脂糖柱层析洗脱图谱Fig.4 Effect of elution buffer pH on recovery of enzymatic activity Fig.5 Elution diagram of CM-sepharose chromatography
2.6.2 弱酸性阳离子CM-琼脂糖柱层析纯化效果
收集过DEAE-琼脂糖柱层析后的最大活性峰组分1.33 L过CM-琼脂糖柱层析. 洗脱结果如图5所示. 其中, 蛋白洗脱峰II-1中检测到极少的酶活力和很高的蛋白含量, 说明杂蛋白居多; 蛋白洗脱峰II-2检测到很高的酶活力和极少的蛋白含量, 说明II-2中的酶纯度高. 而蛋白洗脱峰II-1和酶活力峰I-2基本吻合, 说明该峰就是含β-葡萄糖苷酶的洗脱峰.
2.7 β-葡萄糖苷酶的中试纯化效果
β-葡萄糖苷酶的具体纯化效果如表4所示. 经上述纯化步骤后, 从鲍鱼内脏分离纯化得到纯度较高的β-葡萄糖苷酶, 纯化倍数10.78倍, 收率5.0%, 酶的比活力为1.709 U·mg-1. 高速管式离心的收率较高, 但获得的粗酶液很浑浊, 效果不如高速冷冻离心, 这就是中试规模和实验室的规模的差异, 也是中试规模提取β-葡萄糖苷酶的难度所在.采用陶瓷复合膜过滤能将未被分离的微小颗粒截留, 但在整个纯化步骤中, 该步骤的酶活损失最严重, 应尽量减少过滤时间, 收集浓液留至下次继续分离纯化或者加水稀释浓液尽量将酶透过膜. 超滤能使酶液浓缩脱盐以便于上层析柱, 与透析相比其回收率较低. 而DEAE-琼脂糖柱层析和CM-琼脂糖柱层析纯化效果皆与实验室规模的效果差不多.
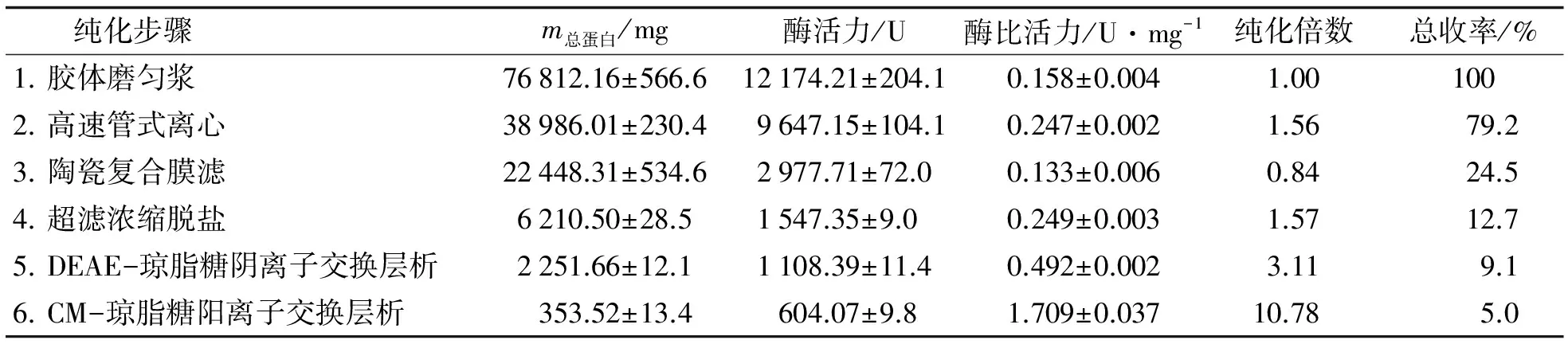
表4 β-葡萄糖苷酶的纯化效果Tab.4 Summary of purification of β-glucosidase from abalone viscera
3 结论
采用胶体磨匀浆、 高速管式离心、 陶瓷复合膜过滤、 超滤、 DEAE-琼脂糖阴离子交换层析和CM-琼脂糖阳离子交换层析的中试制备工艺, 从鲍鱼内脏中分离纯化得到一种β-葡萄糖苷酶. 进行柱层析纯化时, DEAE-琼脂糖阴离子交换层析洗脱缓冲液的最佳pH值为7.5, CM-琼脂糖阳离子交换层析洗脱缓冲液的最佳pH值为6.0. 经以上纯化步骤后, 纯化倍数为10.78, 收率为5.0%, 酶比活力为1.709 U·mg-1. 该工艺的纯化倍数和收率与文献[11]相比,其数值不够高, 并未达到最优效果, 仍然具有提高的空间, 将在后续研究中加以改进.
β-葡萄糖苷酶作为纤维素降解的限速酶及合成多种糖苷的关键酶有很高的工业价值. 而鲍鱼内脏作为鲍鱼加工的下脚料, 可利用其开发饲料、 调味料等, 同时可对其所含的消化酶及多糖等进行生产开发, 因此具有很高的经济价值. 探索出一套纯化倍数高、 酶活损失率低的适合工业化的β-葡萄糖苷酶分离纯化方法, 可为鲍鱼内脏综合利用提供参考作用.
[1] SINNOTT M L. Catalytic mechanisms of enzymic glycosyl transfer[J]. Chemical Reviews, 1990, 90: 1 171-1 202.
[2] PAL S, BANIK S P, GHORAI S,etal. Purification and characterization of a thermostable intra-cellularβ-glucosidase with transglycosylation properties from filamentous fungus termitomyces clypeatus[J]. Bioresource Technology, 2010, 101(7): 2 412-2 420.
[3] 史玲玲, 王莉, 张艳霞, 等. 红景天苷的生物合成及其关键代谢酶研究[J]. 生命科学, 2008, 20(2): 287-290.
[4] WANG L M, QI B, LIU X J. Purification and charaeterization of beta-glueosidase from newly Isolated aspergillus sp MT-0204[J]. African Joumal of Biotechnology, 2009, 8(10): 2 367-2 374.
[5] HANG Y D, WOODAMS E E. Apple pomace: a potential substrate for production ofβ-glucosidases by aspergillus foetidus[J]. Lebensm-Technol, 1994, 27(6): 587-589.
[6] 邓敏, 邬小兵, 李倩一, 等. 灰绿曲霉β-葡萄糖苷酶的分离及特性[J]. 生物技术, 2009, 19(6): 61-63.
[7] 陈红漫, 赵璐. 芽孢杆菌β-葡萄糖苷酶的分离纯化及特性研究[J]. 河北农业大学学报, 2009, 32(3): 39-42.
[8] KOROTKOVA O G, SEMENOVA M V, MOROZOVA V V,etal. Isolation and properties of fungal beta-glucosidases[J]. Biochemistry-Moscow, 2009, 74(5): 569-577.
[9] 石艳,吴谋胜,陈清西. 蝾螺β-葡萄糖苷酶性质的初步研究[J]. 厦门大学学报(自然科学版), 2004, 43(增1): 32-35.
[10] 刘欣, 杨凌, 戴晓冬, 等. 一种来源于蜗牛酶的β-葡萄糖苷酶的纯化[J]. 中国微生态学杂志, 2010, 22(12): 1 103-1 106.
[11] 张喆, 赵红, 周兴旺, 等. 福寿螺β-葡萄糖苷酶的分离纯化及性质的初步研究[J]. 厦门大学学报(自然科学版), 1999, 38(2): 287-291.
[12] 廖金花, 陈巧, 林丽蓉, 等. 鲍鱼碱性磷酸酶的分离纯化和性质研究[J]. 厦门大学学报(自然科学版), 2005, 44(2): 272-275.
[13] 康平, 汪秋宽, 宋琳琳, 等. 皱纹盘鲍内脏酶的酶学性质及褐藻胶裂解酶的分离纯化[J]. 水产学报, 2007, 31(1): 15-16.
[14] 宫国君, 朱蓓薇, 杨静峰, 等. 皱纹盘鲍内脏β-1, 3-葡聚糖酶的提取及其酶学性质研究[J]. 食品工业科技, 2012, 33(3):110-113.
[15] 石贤爱, 张利, 刘震, 等. 南日鲍β-葡萄糖苷酶分离纯化及表征[J]. 福州大学学报(自然科学版), 2014, 12(3): 480-485.
Studyonthepilot-plantscalepreparationofβ-glucosidasefromabaloneviscera
CHEN Shengnan1, ZHANG Li1, SHI Xian’ai1, 2, CHEN Jinmei1, CAI Zhenhui1
(1. College of Biological Science and Technology, Fuzhou University, Fuzhou, Fujian 350116, China;2. Fujian Key Laboratory of Medical Instrument and Pharmaceutical Technology, Fuzhou, Fujian 350002, China)
Theβ-glucosidase fromabalonevisceralwas separated, purified through a pilot scale technique combination including homogenation in colloid mill, centrifugation in high speed tubular centrifuge, filtration upon ceramic composite membrane, ultrafiltration, anion-exchange chromatography of DEAE-agarose and cation-exchange chromatography of CM-agarose. It was demonstrated that the total enzyme activity in the homogenate was 12 174.21 U and the specific activity was 0.158 U·mg-1as well as the specific activity of crude enzyme in the supernatant obtained by 2 times of high speed tubular centrifugation was 0.247 U·mg-1. It was demonstrated that the specific activity of permeate from ceramic composite membrane filtration and concentrate from ultrafiltration were 0.133 U·mg-1and 0.249 U·mg-1, respectively. Through the study on the elution pH gradient in anion exchange chromatography of DEAE- agarose and cation exchange chromatography of CM- agarose, it was also demonstrated that the best elution pH was about 7.5 and 6.0. The specific activities ofβ-glucosidase collected from anion-exchange chromatography of DEAE-agarose and cation-exchange chromatography of CM-agarose were 0.492 U·mg-1and 1.709 U·mg-1, respectively, with a final purification fold was 10.78, and the yield was 5.0%.
abaloneviscera;β-glucosidase; pilot scale; purification
10.7631/issn.1000-2243.2017.05.0731
1000-2243(2017)05-0731-05
Q814.1
A
2016-03-08
石贤爱(1971-), 教授, 主要从事海洋生物活性物质及生物检测等研究, shixa@fzu.edu.cn
国家海洋公益性行业科研专项子课题(201205022-3)
(责任编辑: 林晓)

