毕赤酵母工程菌发酵生产重组Cu/Zn-SOD的工艺研究
朱 凡, 林 娟, 李仁宽, 叶秀云
(福州大学生物科学与工程学院, 福建省海洋酶工程重点实验室, 福建 福州 350116)
毕赤酵母工程菌发酵生产重组Cu/Zn-SOD的工艺研究
朱 凡, 林 娟, 李仁宽, 叶秀云
(福州大学生物科学与工程学院, 福建省海洋酶工程重点实验室, 福建 福州 350116)
系统考察毕赤酵母工程菌GS115表达重组铜锌超氧化物歧化酶(Cu/Zn-SOD)的发酵工艺参数, 优化后5 L发酵罐上生产工艺为: 采用BSM培养基, 接种量5%(体积分数), 发酵温度35 ℃, 诱导期搅拌转速900 r·min-1, pH值为6.0、 维持溶氧(DO)水平为饱和值的20%以上. 经过142 h发酵实验, SOD活力最高可达102.789 kU·mL-1, 比优化前提高3.5倍. 采用毕赤酵母工程菌能实现高效、 大量制备优质动物来源的Cu/Zn-SOD重组蛋白, 具有良好的产业化潜力和广泛的应用前景.
超氧化物歧化酶; 毕赤酵母; 重组蛋白; 发酵工艺优化
0 引言
超氧化物歧化酶(SOD, E.C. 1.15.1.1)是机体活性氧自由基清除反应过程中第一个发挥作用的抗氧化酶, 在延缓衰老以及其他由自由基引起的疾病方面有很好的预防和治疗功效. 目前已知的超氧化物歧化酶有4种类型: 铜锌超氧化物歧化酶(Cu/Zn-SOD)、 锰超氧化物歧化酶(Mn-SOD)、 铁超氧化物歧化酶(Fe-SOD)和镍超氧化物歧化酶(Ni-SOD), 其中Cu/Zn-SOD广泛存在于大多数的哺乳动物和真菌[1]等真核生物细胞质、 叶绿体和过氧化氢酶体内, 是自然界中分布最为广泛的一种超氧化物歧化酶, 同时也是目前应用最为广泛的超氧化物歧化酶[2-3].
目前市场上大多数超氧化物歧化酶(SOD)产品主要来源于动物血液、 内脏等, 由于原材料有限、 纯化困难等原因, 导致SOD的纯度低、 产量少; 特别是随着世界各地疯牛病、 禽流感、 口蹄疫以及由动物传播的SARS等恶性传染病的疫情不时发生, 生产动物源血液制品的风险加大; 此外, 对产品纯度要求的提高也增加了生产成本. 随着基因工程技术的发展, 微生物、 植物和动物等不同来源的SOD基因被克隆表达, 其中人和动物源的SOD因为酶分子量较小和同源性高, 具有良好的应用前景. Yu[4]将Saccharomycescerevisiae中的Cu/Zn-SOD导入Pichiapastoris中表达, 重组酶活力大约为1 000 U·mL-1. 施惠娟等[5]以人胎肝组织总RNA为模板, 逆转录扩增了cDNA, 构建表达质粒后转入E.coli, 经诱导表达酶活可达1 797 U·mL-1. 实验室前期构建了表达梅花鹿源铜锌超氧化物歧化酶的重组工程菌PichiapastorisGS115-pPIC9K-SOD, 5 L发酵罐上初步实验重组酶表达量可达3 500 U·mL-1[6], 若能通过对发酵工艺参数的优化提供有效科学数据, 进一步提高生产强度, 缩短发酵周期, 可为重组铜锌超氧化物歧化酶的工业化生产及应用奠定良好基础.
1 材料与方法
1.1 材料
1.1.1 菌株
表达梅花鹿源铜锌超氧化物歧化酶的重组工程菌PichiapastorisGS115-pPIC9K-SOD由福州大学福建省海洋酶工程重点实验室自行构建并保存.
1.1.2 培养方法
10*D溶液: 200 g·L-1葡萄糖溶液.
YP培养基: Yeast Extract 10 g·L-1, Tryptone 20 g·L-1.
YPD培养基: 灭菌后的YP加入10%(体积分数)的10*D溶液, YPD斜面及固体培养基中加入20 g·L-1琼脂.
基础盐培养基(basal salts medium, BSM)及PTM1: 参照Invitrogen公司的毕赤酵母发酵手册[7]配制.
基础盐培养基(BSM): CaSO40.93 g·L-1, K2SO418.20 g·L-1, KOH 4.13 g·L-1, MgSO4·7H2O 14.90 g·L-1, Glucose 40.00 g·L-1, H3PO426.70 mL·L-1, PTM1 4.35 mL·L-1, 0.20 g·L-1生物素4.35 mL·L-1, CuSO4·5H2O 0.125 g·L-1, ZnCl20.068 g·L-1, 工业级消泡剂1.00 mL·L-1.
PTM1溶液: CuSO4·5H2O 6.00 g·L-1, NaI 0.08 g·L-1, MnSO43.00 g·L-1, Na2MoO4·2H2O 0.20 g·L-1, 硼酸0.02 g·L-1, CoCl20.50 g·L-1, ZnCl220.00 g·L-1, FeSO465.00 g·L-1, 生物素0.20 g·L-1, H2SO45.00 g·L-1.
补料培养基: 称取100 g无水葡萄糖溶解于蒸馏水中并定容至500 mL, 再加入12 mL·L-1PTM1溶液.
甲醇溶液: 含PTM1溶液1.2%(体积分数)的甲醇.
发酵: 5 L台式小型玻璃发酵罐(上海洋格生物工程设备有限公司), 装液比40%(体积分数), 接种量5%(体积分数, 以下同), pH值、 温度和搅拌转速均采用控制系统自动控制.
1.1.3 主要药品与试剂
Cu/Zn-SOD活性测试盒购自南京建成科技有限公司(羟胺法); Yeast Extract 和Tryptone 购自OXOID公司; 生物素购自生工生物工程(上海)股份有限公司; 甲醇、 葡萄糖及其它常规药品均为国产分析纯试剂.
1.2 实验方法
1.2.1 SOD活力测定方法
按照南京建成科技公司超氧化物歧化酶测试盒说明书(货号: A001-1羟胺法)操作.
酶活力单位定义为: 每毫升反应液中SOD抑制率达对照值的50%时所对应的SOD量为一个活力单位(U).
酶活力单位计算:
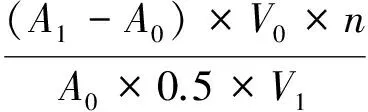
式中:μ为SOD酶活力, U·mL-1;A0为对照管550 nm下吸光值;A1为样品管550 nm下吸光值;V0为反应液体积, mL;V1为样品液体积, mL;n为样品稀释倍数.
1.2.2 菌体生物量的测定
采用湿重法测定发酵过程中的菌体生长情况. 取2 mL发酵液于已烘干并称重的2 mL离心管内, 10 000 r·min-1离心10 min, 弃上清, 称量沉淀的质量, 每样测3组平行. 设菌体湿重为ρ(g·L-1), 则ρ为:

式中:m为离心后沉淀的质量, g;V为离心前发酵液的体积, mL.
2 结果与讨论
2.1 5 L发酵罐中毕赤酵母工程菌GS115生长曲线和产酶曲线的测定

图1 发酵罐中毕赤酵母工程菌的生长和产酶曲线Fig.1 Profile of Cu/Zn-SOD production by Pichia pastoris in fermentors
将毕赤酵母工程菌GS115先经过YPD种子培养基(初始pH 值6.0)培养15 h, 再以5%接种量接入BSM培养基(初始pH 值5.0), 培养温度30 ℃, 参考Siegel等提出的毕赤酵母发酵生产重组蛋白的工艺确定发酵条件参数[7], 测定发酵过程中菌体湿重与酶活力的变化曲线, 见图1.
在起始阶段-菌体生长阶段, 用氨水维持pH值为5.0培养23 h, 期间溶氧逐渐下降时, 逐渐增大转速至600 r·min-1使溶氧在不低于饱和值20%的范围内波动. 初始碳源耗尽后溶氧会快速上升至高于饱和值的80%, 此时以18 mL·h-1的速度连续流加200 g·L-1的葡萄糖溶液8 h, 并增大通气量至0.6 L·min-1, 维持溶氧在饱和值的20%以上的范围内波动, 到该阶段末期(31 h左右), 菌体湿重达140 g·L-1.
在诱导阶段, 以6 mL·h-1的速度流加甲醇溶液, 使培养基中甲醇终浓度不高于0.3% (体积分数), 采用搅拌转速与溶氧水平关联控制, 维持溶氧在饱和值的20%以上的范围内波动. 发酵190 h时, 菌体湿重达314 g·L-1, 重组SOD的表达水平达22.727 kU·mL-1.
2.2 搅拌转速对重组SOD表达量的影响
毕赤酵母在诱导阶段氧需求量很高, 溶氧往往成为诱导阶段的限制因子[8]. 发酵过程中的转速、 通气量、 罐压、 补料速率等都会影响溶氧量, 在通气量(0.3~0.9 L·min-1)和罐压调整范围有限的前提下, 搅拌转速的改变将成为决定发酵过程DO值的主要因素.
实验设置3组平行实验, 除了诱导期的搅拌转速分别设定为700、 800和900 r·min-1以外, 其余发酵条件均保持一致: 装液量2 L, 接种量5%, 发酵温度30 ℃, pH值为5.0, 罐压0.02~0.03 MPa, 取样测定发酵过程菌体湿重和酶活力变化, 实验结果如图2、 3所示.
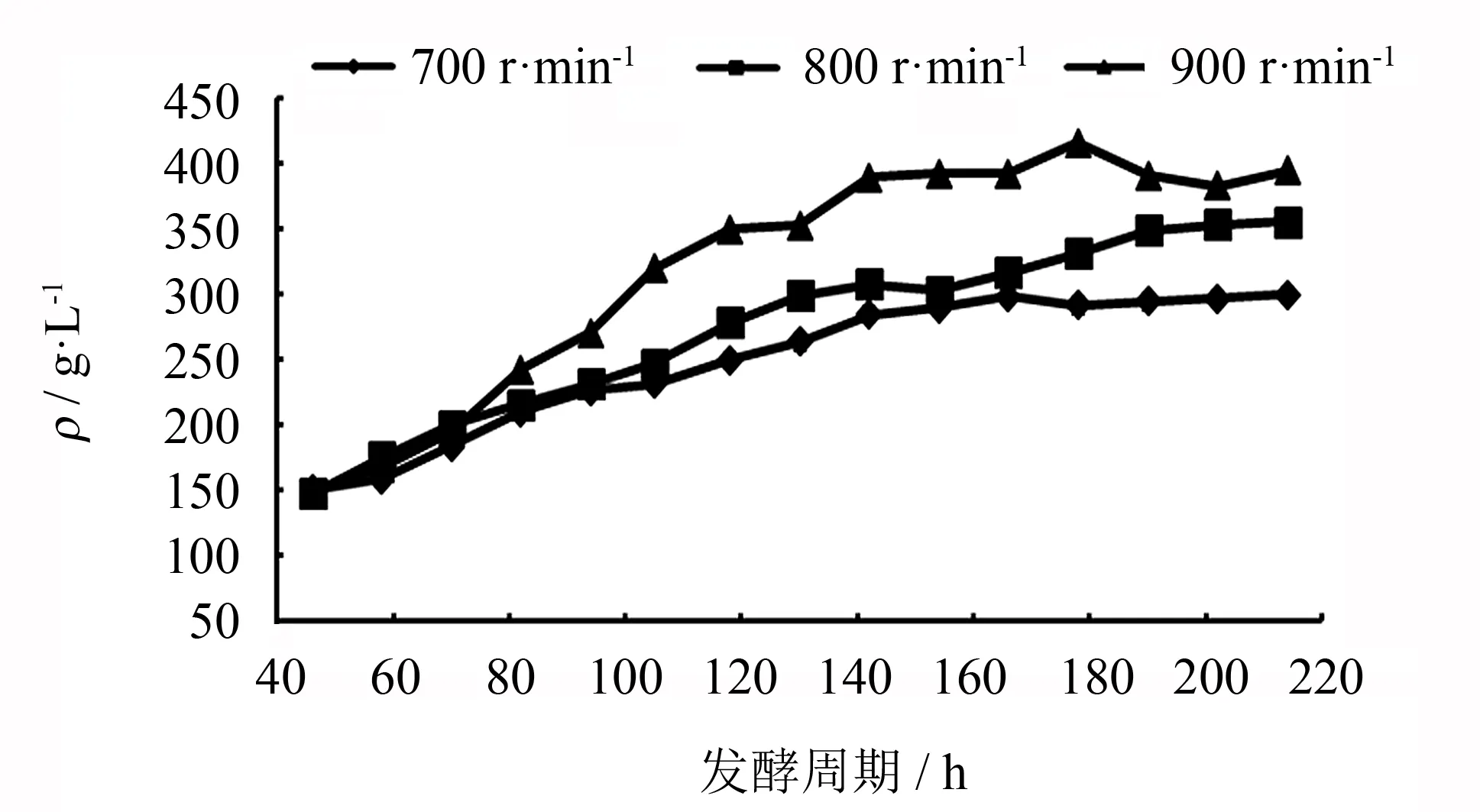
图2 不同搅拌转速下毕赤酵母工程菌的生长情况Fig.2 Effects of agitation rate on the growth of Pichia pastoris in fermentors
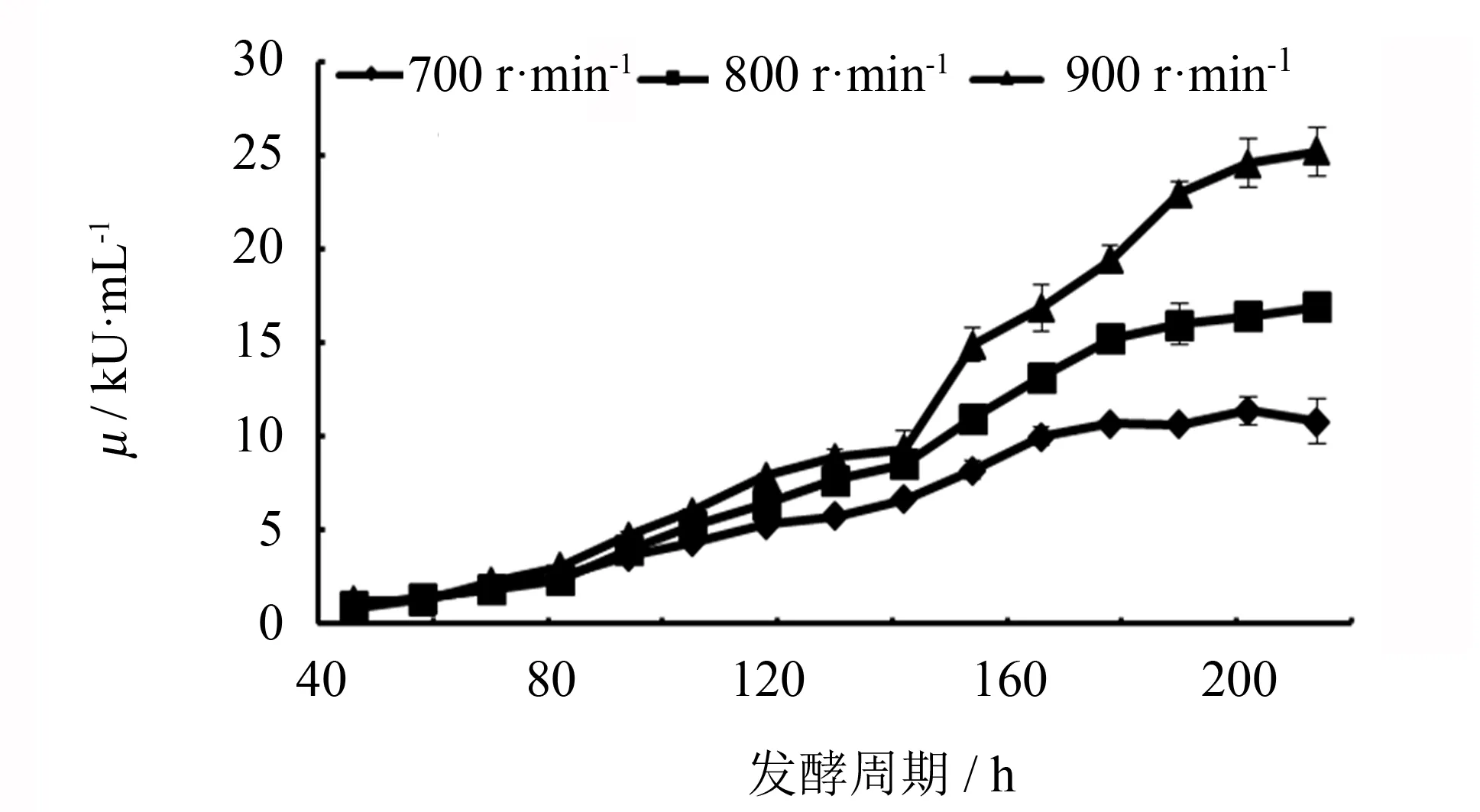
图3 不同转速对毕赤酵母工程菌的产酶影响Fig.3 Effects of agitation rate on the enzyme production of Pichia pastoris in fermentors
由图2可知, 菌体生长阶段至49 h, 菌体湿重已累积达150 g·L-1. 随后进入诱导期, 700 r·min-1转速实验组菌体湿重缓慢增加, 最大湿重值为299 g·L-1, 仅为900 r·min-1转速实验组最大湿重值(415 g·L-1)的72%; 800 r·min-1转速实验组最大湿重值为355 g·L-1, 介于另外两个实验组的数据之间. 由此可见, 在菌体剪切力承受的合理范围内, 随着诱导期搅拌转速的提高, 发酵罐内溶氧量增加, 菌体代谢速率加快, 菌体累积量提高.
由图3可知, 进入诱导期后不同转速实验组样品中SOD活力都随着时间的延长而增加. 在诱导期的前60 h不同转速实验组的SOD酶活力相差不大, 发酵至142 h左右, 酶活开始快速增加, 并且在190 h左右出现峰值并维持相对稳定. 700 r·min-1转速实验组最大酶活力为22.727 kU·mL-1; 800 r·min-1转速实验组最大酶活力为33.865 kU·mL-1, 是700 r·min-1转速实验组最大酶活力的1.5倍; 900 r·min-1转速实验组最大酶活力为50.431 kU·mL-1, 是700 r·min-1转速实验组的2.24倍, 是800 r·min-1转速实验组的1.49倍. 以上实验结果表明, 在一定范围内, 搅拌转速越高, 发酵罐中溶氧量越多, 毕赤酵母生长越好, SOD表达量也越高.
2.3 pH值分段控制对重组SOD表达量的影响
发酵环境的pH值不仅影响着菌体的生长和目标蛋白的活性及表达量, 同时对表达蛋白的分泌和发酵液中蛋白酶的活力均有影响. 毕赤酵母在pH值 3~7范围内均可生长及表达目的蛋白, 降低 pH值有利于抑制发酵液中蛋白酶活性, 所以对于蛋白酶敏感的酶系, 降低发酵 pH值可以有效提高目的蛋白的表达量; 但偏低的pH环境会导致毕赤酵母体内部分酶系的酶活力下降, 并且降低pH值会影响目的蛋白的稳定性及降解程度[9]. 综上, 虽然毕赤酵母耐受pH值的范围较宽, 但在实际发酵生产过程中pH值一般选用4~6[10].
为考察不同pH值对毕赤酵母工程菌发酵生产重组SOD过程生长阶段和诱导阶段的影响, 实验在控制其余发酵条件不变的情况下, 设置分段控制pH值范围的策略, 列于表1, 所得实验结果如图4、 5所示.

表1 不同pH值控制策略对重组SOD表达的影响Tab.1 Effects of different pH value controlling strategies in 5L fermentors
由实验结果可知, 在菌体生长阶段, 升高pH值导致菌体生长加快, 提前进入诱导期, 但诱导期最高菌体湿重值反而略有下降. 而随着pH值升高, 重组SOD活力显著增加. 全程控制pH 值6.0发酵172 h后重组SOD最大活力为78.152 kU·mL-1, 分别是全程控制pH值 5.0实验组的2.01倍和分段控制pH值实验组的1.12倍. 可见, 选择合适的诱导pH值条件可以大幅度提高重组SOD的表达量, 优化后的发酵过程pH值确定为6.0.

图4 pH值分段控制对毕赤酵母工程菌生长的影响Fig.4 Effects of different pH value controlling strategies on the growth of Pichia pastoris

图5 pH值分段控制对重组SOD表达量的影响Fig.5 Effects of different pH value controlling strategies on the expression of recombinant SOD
2.4 温度对重组SOD表达量的影响
前期工作中发现, 摇瓶实验中的温度对毕赤酵母表达目的蛋白有重要影响[6], 实验在控制其余发酵条件不变的情况下, 比较了不同培养温度对发酵过程的影响, 实验结果如图6、 7所示. 由图6可知, 控制发酵温度为30和35 ℃, 对生物量累积影响不大, 35 ℃下生物量略有降低; 但在35 ℃下SOD活力(102.789 kU·mL-1)比30 ℃下(78.512 kU·mL-1)提高了30.9%, 而且在35 ℃下发酵达到产酶高峰所需的时间(142 h)要比30 ℃下(190 h)减少48 h, 显著缩短了发酵周期.

图6 发酵温度对毕赤酵母工程菌生长的影响Fig.6 Effects of different fermentation temperatures on the growth of Pichia pastoris

图7 发酵温度对重组SOD表达量的影响Fig.7 Effects of different fermentation temperatures on the expression of recombinant SOD
据文献[10-12]报道, 在诱导阶段适当降低温度有利于提高蛋白稳定性和表达重组蛋白, 这主要是因为: ① 发酵温度会影响毕赤酵母的代谢速率, 温度过低会抑制其生长, 造成发酵周期延长等不利影响[12]; ② 毕赤酵母GS115并非蛋白酶缺陷型菌株, 不可避免地会产生蛋白酶, 发酵条件的变化对发酵液中蛋白酶含量产生影响, 从而影响重组蛋白的积累, 比如采用较低温度、 较低pH值、 甘油-甲醇混饲都能一定程度缓解由于蛋白酶酶解目标蛋白造成的产物活力不高的问题; ③ 温度降低时摄氧率(OUR)和二氧化碳释放率(CER)、 醇氧化酶(AOX)基因转录水平均有所提高, 从而影响外源蛋白产量; ④ 诱导温度会影响外源蛋白的聚合情况, 低温时有利于外源蛋白的正确折叠, 有研究表明随着温度的增高, 重组蛋白单体通过二硫键形成二聚体蛋白量大大增加[13-14].
而实验却发现毕赤酵母在35 ℃下产酶能力更高, 分析其原因, 可能是: 随着温度的升高, 含有半胱氨酸的重组SOD大量形成二硫键, 从而增加蛋白的聚合度, 形成二聚体甚至多聚体. 二硫键断开或者还原都可能导致蛋白发生构象变化, 引起酶活力增加或者减少甚至消失[15]. 实验中表达的梅花鹿来源Cu/Zn-SOD蛋白天然状态下在梅花鹿体内以二聚体或多聚体形式存在, 二硫键或二聚体的形成有可能改善了目的蛋白SOD的结构稳定性和催化效率, 从而促进酶活力的提高.
3 结语
采用微生物工程菌重组表达SOD已有大量报道[1-2], 但对梅花鹿来源Cu/Zn-SOD的研究较少, 限制了其应用的推广. 为进行鹿源Cu/Zn-SOD的大量制备, 系统考察毕赤酵母工程菌GS115的发酵过程各项参数, 优化后的5 L发酵罐生产工艺为: 采用BSM培养基, 控制在pH值 6.0、 溶氧不低于饱和值的20%、 搅拌转速900 r·min-1、 温度35 ℃下发酵142 h, 重组Cu/Zn-SOD的最高活力可达102.789 kU·mL-1, 比优化前(22.727 kU·mL-1)提高了3.5倍. 为实现梅花鹿Cu/Zn-SOD重组蛋白的工业化生产, 可考虑以成本更低、 产量稳定的培养基替代价格较高的基础盐培养基BSM, 并采用搅拌转速与通气联动的控制方式进一步强化发酵过程中的传氧效率, 同时深入研究温度影响毕赤酵母工程菌产酶能力的相关机制. 实验获得的目标蛋白可以减少对自然资源的依赖, 消除动物疾病所带来的负面影响, 提高超氧化物歧化酶的应用安全性; 同时, 超氧化物歧化酶产业化的实施将大大降低该酶的生产成本和市场价格, 使其应用范围更加广阔, 也将带来很好的经济和社会效益.
[1] 陈祥娥, 凌沛学, 张天民. 超氧化物歧化酶的应用[J]. 食品与药品, 2013, 15(4): 283-285; 286.
[2] 徐靖. 超氧化物歧化酶及其应用的研究进展[J]. 食品工业科技, 2013, 34(12): 387-391.
[3] KODYDKOVA J, VAVROVA L, STANKOVA B,etal. Antioxidant status and oxidative stress markers in pancreatic cancer and chronic pancreatitis[J]. Pancreas, 2013, 42(4): 614-621.
[4] YU P. A new approach to the production of the recombinant SOD protein by methylotrophicPichiapastoris[J]. Applied Microbiology and Biotechnology, 2007, 74(1): 93-98.
[5] SHI H, FAN L, WEI D,etal. Cloning, sequencing and expression of human copper, zinc-superoxide dismutase cDNA[J]. Acta Biochimica et Biophysica Sinica, 1999, 31(1): 16-18.
[6] LI R K, FU C L, CHEN P,etal. High-level expression of a sika deer (Cervusnippon) Cu/Zn superoxide dismutase inPichiapastorisand its characterization[J]. Environmental Toxicology & Pharmacology, 2013, 35(2): 185-192.
[7] SIEGEL R S, BRIERLEY R A. Methylotrophic yeastPichiapastorisproduced in high-cell-density fermentations with high cell yields as vehicle for recombinant protein production[J]. Biotechnol Bioeng, 1989, 34(3): 403-404.
[8] 李洪淼, 王红宁, 许钦坤. 毕赤酵母高密度发酵研究进展[J]. 生物技术通讯, 2005, 16(2): 210-212.
[9] 范志华, 梁鹏, 田国军, 等. 酵母菌受胁迫条件影响积累SOD的研究[J]. 食品与发酵工业, 2009, 35(11): 60-63.
[10] 闵兆升, 郭会明, 颜旭, 等. 巴斯德毕赤酵母(P.pastoris)高密度发酵研究进展[J]. 生物技术通报, 2014(3): 42-49.
[11] 林福来. 基因剂量及培养温度对β-甘露聚糖酶在毕赤酵母中表达的影响[D]. 长沙: 中南大学, 2013.
[12] 廖锡豪, 陈明祥, 谢万勇, 等. 低温诱导对毕赤酵母表达重组外源蛋白的影响[J]. 中国酿造, 2013, 32(2): 9-12.
[13] 王同春, 喻晓蔚, 徐岩. 诱导温度调控华根霉(Rhizopuschinensis)前导肽脂肪酶的表达及稳定性研究[J]. 工业微生物, 2010, 40(4): 34-39.
[14] 史琪琪, 郝玉有, 吴康, 等. 诱导相温度对毕赤酵母表达重组人复合α干扰素聚合的影响[J]. 生物工程学报, 2006, 22(2): 311-315.
[15] 徐国恒. 二硫键与蛋白质的结构[J]. 生物学通报, 2010, 45(5): 5-7.
OptimizationofrecombinantCu/Zn-SODproductionbyPichiapastorisinbench-topfermentors
ZHU Fan, LIN Juan, LI Renkuan, YE Xiuyun
(Fujian Provincial Key Laboratory of Marine Enzyme Engineering,College of Biological Science and Technology,Fuzhou University, Fuzhou, Fujian 350116, China)
In this study, detailed investigations were performed on effective production in 5 L bench-top fermentor of a sika deer Cu/Zn-SOD byPichiapastoris. The process parameters of recombinant SOD production were optimized to set up an appropriate fermentation procedure as follows: BSM medium, inoculum rate of 5%(volume fraction), temperature of 35 ℃, agitation rate of 900 r·min-1during the induction stage, pH value of 6.0, DO level above 20% of the saturated value, and the cultivation period of 142 h. Under the optimal conditions, the SOD activity in the broth could reach as high as 102.789 kU·mL-1, which was increased by 3.5 folds. The results above established a highly effective fermentation procedure for industrial production of the recombinant sika deer Cu/Zn-SOD byPichiapastoristhat presented significant application prospect in future.
superoxide dismutase;Pichiapastoris; recombinant proteins; fermention optimization
10.7631/issn.1000-2243.2017.05.0736
1000-2243(2017)05-0736-06
TQ920.6
A
2016-03-12
林娟(1970-), 教授, 主要从事微生物资源开发与利用方面的研究, ljuan@fzu.edu.cn
福建省高校产学合作重大资助项目(2013N5005)
(责任编辑: 洪江星)

