基于线粒体COⅠ序列的泥螺群体遗传多样性研究
赵 丹,刘 莹,宋爱环,刘梦侠,王 慧,刘洪军
( 1.山东农业大学 动物科技学院, 山东 泰安 271018;2. 山东省海洋生物研究院, 山东 青岛 266104;3.青岛市海洋生物种质资源挖掘与利用工程实验室, 山东 青岛 266104 )
基于线粒体COⅠ序列的泥螺群体遗传多样性研究
赵 丹1,刘 莹2,3,宋爱环2,3,刘梦侠2,3,王 慧1,刘洪军2,3
( 1.山东农业大学 动物科技学院, 山东 泰安 271018;2. 山东省海洋生物研究院, 山东 青岛 266104;3.青岛市海洋生物种质资源挖掘与利用工程实验室, 山东 青岛 266104 )
为初步研究泥螺的遗传多样性和群体结构,探讨其遗传多样性的产生背景和维持机制,便于今后更好地保护泥螺种质资源,本研究对辽宁、山东、江苏、浙江四省7个泥螺群体的线粒体细胞色素氧化酶亚基Ⅰ(COⅠ)部分序列进行了测定与分析,经过处理得到145条631 bp长度的核苷酸片段,分析显示A、G、T、C、A+T的平均含量分别为23.83%、18.93%、41.60%、15.64%、65.43%,AT 含量高于 GC 含量。单倍型总数47,共享单倍型数目12。用Arlequin 3.5 软件进行AMOVA 分析,表明7个群体间 COⅠ总遗传分化系数为0.7893(P<0.001), 群体间遗传分化大于群体内遗传分化。用邻接法构建的系统发育进化树显示,7个地理群体的泥螺互相聚在一起,同一群体之间没有明显独立聚在一起的情况。分子方差分析表明群体间出现明显的遗传分化。
泥螺;线粒体COⅠ基因;遗传多样性
泥螺(Bullactaexarata),属软体动物门、腹足纲、后鳃亚纲、头楯目、阿地螺科,贝壳呈白色,光滑半透明,壳型卵圆形,广泛分布于我国沿海的潮间带滩涂[1],且生长快、适应力强[2]、繁殖周期短。泥螺于2001年首次被引入黄河三角洲东营海区,其后分布范围迅速扩大,并且成为该地区的优势物种,对当地渔业资源的发展也产生一定影响,已经成为当地事实上的入侵物种。
分子标记是检测物种群体遗传结构以及系统地理格局的有效方法,可以从基因水平上直接反映遗传变异状况,而不受生活环境、地理因素以及基因表达的限制[3]。其中线粒体DNA作为一种分子标记,具有严格遵守母系遗传、几乎不发生重组、进化速度快等特点,被广泛用于遗传学研究[4]。COⅠ序列较为保守,在近缘物种间构建系统发育关系时能发挥重要作用,主要用于无脊椎动物的种群遗传结构以及多样性研究[5-7]。根据基因序列包含的信息可以推测泥螺的进化过程,探讨其遗传多样性的产生背景和维持机制[8]。
目前,我国对于泥螺的研究大部分集中于生长、发育、繁殖以及其生物入侵风险评价等生理生态方面,对其遗传多样性研究较少,杜慧霞等[9]曾进行过泥螺微卫星开发的研究。笔者基于线粒体COⅠ序列对我国南北沿海不同地区的泥螺群体进行了遗传多样性及群体遗传结构分析,以期为泥螺资源的合理利用以及制定渔业资源保护措施、防止外来物种基因入侵等提供理论依据。
1 材料与方法
1.1 采样
于2015年8月,分别从辽宁大连,山东东营、莱州、黄岛,江苏南通,浙江舟山、宁波7个滩涂海域采集泥螺个体,样品均经过形态学鉴定, 以95%酒精保存。选择阿地螺科短丽罗螺(Liloacurta)作为外群进行遗传学分析。
1.2 基因组DNA的提取与PCR扩增
取泥螺腹足部肌肉约30 mg,采用TIANGEN海洋动物组织基因组DNA提取试剂盒获得基因组DNA,溶于TE缓冲液,4 ℃保存备用。使用线粒体DNA无脊椎动物COⅠ序列通用引物:LCO1490(5′-GGTCAACAATCATAAAGATATTGG-3′)和HCO2198(5′-TAAACTTCAGGGTGACCAAAAAATCA-3′),由上海桑尼生物科技有限公司合成。PCR反应体系总体积25 μL,其中包括:DNA模板1 μL,正反向各1 μL,无菌水9.5 μL,MIX溶液12.5 μL。PCR 反应条件为:95 ℃预变性3 min,然后进行35个循环,每个循环包括95 ℃变性30 s,45.8 ℃退火1 min,72 ℃延伸30 s,最后72 ℃延伸10 min。所有的PCR反应均在Eppendorf (Master cycler 5333)扩增仪上进行。
取5 μL PCR产物用1.5%的琼脂糖凝胶进行电泳检测,对于扩增效果良好的样品送往上海桑尼生物科技有限公司进行纯化后单向测序。
1.3 数据分析
各个泥螺序列利用DNASTAR软件进行比对,并进行人工校正。用Mega 5.1 软件[10]分析群体的转换/颠换值、碱基组成、变异位点、两两群体之间的遗传距离;采用Arlequin 3.5软件计算单倍型多样度、核苷酸多样度和两两序列比对平均核苷酸差异数;进行P检验,并计算群体间的遗传分化指数,检验群体遗传分化。采用中性检验和核苷酸不配对分布分析两种方法,检测群体历史动态。用邻接法构建系统进化树,系统树各结点的支持率以序列数据集1000次重复抽样检验的自引导值表示。用NetWork 4.6.1.1 Median joining计算方法构建所有单倍型的网络图。
2 结 果
2.1 线粒体COⅠ基因片段序列分析以及单倍型分析
对泥螺7个群体共145个个体进行PCR扩增得到长度为631 bp的片段,分析共包含67个多态性位点,变异百分率为10.62%。检测到61处转换和8处颠换,转换高于颠换,说明各群体分歧时间短,亲缘关系近。碱基组成显示A、G、T、C、A+T的平均含量分别为23.83%、18.93%、41.60%、15.64%、65.43%,T>A>G>C,AT含量高于GC含量。
单倍型分布情况见表1,黄岛单倍型种类最多,有15种单倍型;其次为大连、东营和南通,单倍型种类最少为舟山和宁波;总共47种单倍型,COⅠ单倍型的GenBank登录号为:KX304014~KX304060。群体间共享单倍型有12种,35种独有单倍型,各群体都有独有单倍型。不存在与其他种群没有共享单倍型的群体,但不存在所有群体共有的单倍型,黄岛除了不与大连存在交叉外,与其他群体均有共享型,多数群体出现的共享单倍型只存在部分种群中。出现频率最高的单倍型是单倍型13和单倍型28,说明这两个单倍型为泥螺在长期进化中形成的较为稳定的优势基因型。

表1 泥螺各群体间单倍型分布情况
2.2 泥螺群体多样性分析
总体单倍型多样性为0.913±0.014,核苷酸多样性0.016±0.008,各群体单倍型多样性为0.432~0.910,大连单倍型多样性最高,莱州、南通次之,舟山单倍型多样性最低;核苷酸多样性为0.001~0.017,莱州、南通的核苷酸多样性最高,舟山、宁波核苷酸多样性最低(表2)。

表2 泥螺遗传多样性参数
2.3 种群之间的遗传分化
群体间遗传距离为0.001~0.017,宁波和舟山遗传距离最小,黄岛和舟山、宁波之间遗传距离最大。泥螺群体遗传分化指数范围为0.000~0.996,参照资料遗传分化指数为0~0.05,群体间无遗传分化;0.05~0.15为中等遗传分化;0.15~0.25为高度遗传分化;大于0.25则遗传分化极显著[11]。东营和黄岛遗传分化指数较小,其次为舟山与宁波,均无遗传分化,东营与宁波、舟山遗传分化指数最大,遗传分化极为显著(表3)。通过 PAUP 和Modeltest 软件计算,得到泥螺最佳替换模型为HKY+I+G(G=0.016) 。总遗传分化系数为0.7893,群体间遗传分化大于群体内遗传分化(表3)。

表3 泥螺群体之间的遗传分化指数及其对应的P值
注:对角线左下方为遗传分化指数值,右上方为遗传分化指数对应的P值.
2.4 群体历史动态分析
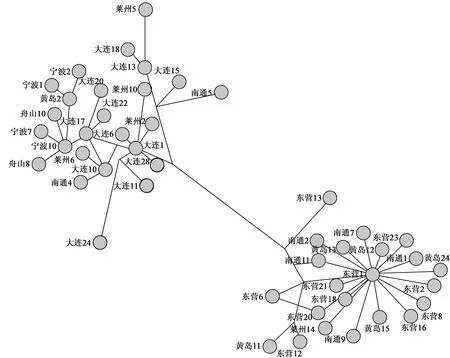
经Tajima′s D[12-13]和Fu′s FS[14]检验,总体Tajima′D值为-0.526,Fs值为-1.480,P>0.1,偏离中性但不显著。种群可能受到了基因随机漂变的因素影响,中性检验的值为负值说明群体在进化的过程中可能出现过群体急速扩张的事件。对各个地理群体进行中性检验,结果显示黄岛、东营为明显的负值且统计检验是极显著的(表4)。核苷酸不配对分布图(图1)上出现明显的单峰,进一步证明泥螺发生过群体扩张。通过公式τ=2ut转化为实际的扩张时间,τ=16.85。参照无脊椎动物核苷酸碱基的突变率值 图1 泥螺线粒体COⅠ核苷酸不配对分布 构建基于 COⅠ基因片段的邻接系统发生树(图2),不存在群体内个体明显首先聚在一起的情况,各个群体的个体交叉存在于系统树中。采用邻接法构建的系统树显示无显著的遗传拓扑结构,单倍型在各个群体中的频率分布也未出现以某种单倍型为主的明显的地理分支。单倍型网络图(图3)显示不同群体的单倍型分散相连聚集在一起,未形成谱系结构。分子方差分析表明群体间出现明显的遗传分化,推测群体尚未在迁移与漂变间达到平衡是未检测到显著地理谱系结构的主要原因。 表4 群体历史动态部分参数 图2 以短丽罗螺为外群构建的泥螺线粒体COⅠ序列构建的单倍型邻接关系树 郭奕惠等[15]通过分析罗非鱼(Oreochromis)不同种群包括尼罗罗非鱼(O.niloticus)、奥利亚罗非鱼(O.aureus)、莫桑比克罗非鱼(O.mossambicus)、杂交种尼奥罗非鱼(O.niloticus♀×O.aureus♂)、奥尼罗非鱼和红罗非鱼(O.niloticus×O.mossambicus)的线粒体COⅠ序列来研究种间亲缘关系,张龙岗等[16]也利用COⅠ基因分析了澳洲虫纹鳕鲈(Maccullochellapeelii)群体遗传多样性,反映了COⅠ基因研究种群关系的可行性。本文通过比较不同种群以及群体内部COⅠ序列的差异,对泥螺的分子系统地理结构进行了初步研究,结果显示大部分地区的泥螺群体有较高的遗传多样性,群体间出现明显的遗传分化。总体来看,长江以北群体遗传多样性较高,以南的舟山、宁波两个群体遗传多样性非常低,推测两群体很少与其他地区的泥螺进行杂交。东营与黄岛,舟山与宁波之间无遗传分化,说明两两群体之间发生了频繁的基因交流或者两群体是由同一群体通过种群扩张发展而来。但是两地区并不存在空间上的连续性,可知人类活动是造成基因流的主要因素。泥螺的系统进化树、单倍型网络图显示出大的遗传分化但没有出现相应的地理分支,原因可能是人为干扰从远距离引进泥螺进行培育改变了泥螺分布的空间格局。另一种原因是现有的群体都来源于共同的祖先,生存环境的相似导致没有出现显著的地理分支。历史动态分析种群扩张时间为中更新世时期,当时的气候环境、地质发生了剧烈变化,会导致一定程度的遗传分化。随着人类活动的影响,各群体之间的基因交流使得遗传分化变小,因此没有形成显著的地理结构。AMOVA分析种群间遗传分化大于种群内部,可能与泥螺自身的迁移能力以及庞大的群体数目大大降低了种内个体间的遗传差异。黄河三角洲地区的泥螺具有较高的遗传多样性,据记载该地区原本不存在泥螺,2001年8月垦利县从江苏、辽宁引进种苗进行泥螺养殖[17-18],后逐渐传播至黄河以北地区。泥螺繁殖力强,产下的卵袋随潮涨落,使泥螺向四周迅速扩散。由于当地泥螺不受投苗措施的控制,天敌少,其分布范围迅速扩大,逐渐形成现有的稳定群体。所以,除了种群自然分布因素外,养殖是造成各地区泥螺遗传多样性指数差异的主要原因。 目前,由于泥螺存在交叉引进的现象,土著种越来越少,人类干扰导致的非自然的杂交过程对物种的生存、进化也会产生负面影响。一方面,杂交育种有利于提高泥螺的遗传多样性,为物种进化提供原材料[19]。但另一方面当小种群与大种群发生杂交时,小种群很易受遗传同化的影响而灭绝[20-21]。当本地泥螺竞争能力弱、个体数目少、生殖壁垒不强时,其他地区泥螺与本地种的杂交会威胁到本地泥螺基因组的完整性和原始性,可能在很短的几个世代内就能直接或间接地导致当地泥螺濒危甚至灭绝[22]。因此,为避免近交衰退而导致的遗传多样性水平的进一步降低,应制定科学的泥螺引种操作规程,在保证泥螺养殖可持续发展的同时,又要避免泥螺过度繁殖对当地渔业资源造成的负面影响。 图3 单倍型网络关系 [1] 张永普, 周化斌, 尤中杰, 等. 浙江洞头海产贝类图志[M]. 北京:海洋出版社, 2012:25. [2] 李树国.泥螺的生物学[J].水利渔业, 2005, 25(4): 42-43. [3] Whitehead A, Anderson S L, Kuivila K M, et al. Genetic variation among interconnected populations ofCatostomusoccidentalis: implications for distinguishing impacts of contaminants from biogeographical structuring [J]. Molecular Ecology, 2003, 12(10): 2817-2833. [4] Meyer A. Evolution of mitochondrial DNA in fishes[G]// Hochachka P W, Mommsen T P. Biochemistry and molecular biology of fishes, Amsterdam: Elsevier, 1993:1-38. [5] Ragionieri L, Cannicci S, Schubart C D, et al. Gene flow and demographic history of the mangrove crabNeosarmatiummeinerti: a case study from the western Indian Ocean[J]. Estuarine, Coastal and Shelf Science, 2010, 86(2):179-188. [6] 邓园, 宋娜, 刘名, 等.基于线粒体 DNA Cyt b 序列的双齿围沙蚕群体遗传多样性分析[J]. 水产学报,2014,38(3):597-601. [7] 李玉龙,王彬,王文波,等. 基于COⅠ基因分析辽东湾海蜇群体遗传多样性[J]. 水产科学,2016,35(4):404-409. [8] 宋娜, 宋林, 高天翔, 等.斑尾复虾虎鱼群体遗传多样性比较分析[J]. 水产学报, 2011, 35(3):321-326. [9] 杜慧霞,孙鲁阳,彭薇,等. 泥螺(BullactaexarataPhilippi 1848)微卫星标记的筛选[G]∥中国动物学会、中国海洋湖沼学会贝类学会分会第十四次学会研讨会论文摘要汇编,2009. [10] Tamura K, Peterson D, Peterson N, et al. MEGA5: Molecular Evolutionary Genetics Analysis using Maximum Likelihood, Evolutionary Distance, and Maximum Parsimony Methods[J]. Molecular Biology and Evolution, 2011,28(10):2731-2739. [11] Wright S.Evolution in mendelian populations[J].Genetics, 1931,16(2):97-159. [12] Tajima F. Statistical-method for testing the neutral mutation hypothesis by DNA polymorphism[J]. Genetics, 1989, 123(3):585-595. [13] Tajima F. The effect of change in population size on population DNA polymorphism[J]. Genetics, 1989, 123(3):597-601. [14] Fu Y X. Statistical tests of neutrality of mutations against population growth, hitchhiking and background selection[J]. Genetics, 1997(147):915-925. [15] 郭奕惠,喻达辉,黄桂菊,等.中国主要养殖罗非鱼亲缘关系的COⅠ序列分析[J].华中农业大学学报, 2009, 28(1):75-79. [16] 张龙岗,杨玲,李娴,等.利用 mtDNA COⅠ基因序列分析引进的澳洲虫纹鳕鲈群体遗传多样性[J].水产学杂志, 2013, 26(2):14-18. [17] 苑春亭,刘金明,薄学锋,等.东营市潮间带泥螺增养殖调查报告[J].齐鲁渔业, 2006, 23(3):25-26. [18] 蒋万钊.黄河三角洲泥螺分布、生长规律的演变及控制技术研究[J]. 河北渔业, 2014(4):11-12. [19] Nettel A, Dodd R S, Afzal-Rafii Z, et al. Genetic diversity enhanced by ancient introgression and secondary contact in East Pacific black mangroves[J]. Molecular Ecology, 2008, 17(11):2680-2690. [20] Levin D A, Francisco-Ortega J, Jansen R K. Hybridization and the extinction of rare plant species[J]. Conservation Biology, 1996,10(1):10-16. [21] 闫晓慧, 胡世俊.自然杂交对植物物种生存进化的影响[J]. 重庆师范大学学报, 2012, 29(2):85-86. [22] 张田, 李作洲, 刘亚令.猕猴桃属植物的 cpSSR 遗传多样性及其同域分布物种的杂交渐渗与同塑[J]. 生物多样性, 2007, 15(1):1-22. GeneticDiversityofSnailBullactaexarataPopulationsBasedonMitochondrialDNACOⅠ ZHAO Dan1, LIU Ying2,3, SONG Aihuan2,3, LIU Mengxia2,3, WANG Hui1, LIU Hongjun2,3 ( 1. College of Animal Science and Technology, Shandong Agricultural University, Tai′an 271018, China; 2. Marine Biology Institute of Shandong Province,Qingdao 266104,China;3.Qingdao Engineering Laboratory of Exploration and Utilization of Marine Germplasm Resources,Qingdao 266104, China ) The mitochondrial DNA COⅠsequences were detected in snailBullactaexaratafrom seven populations in Liaoning, Shandong, Jiangsu and Zhejiang provinces insight on genetic diversity and population structure to understand mechanism of the genetic diversity and to protect snail germplasm resources. The analysis of 145 pieces of fragments with the length of 631 bp revealed that the average contents of A, G, T, C, and A + T were 23.83%, 18.93%, 41.60%, 15.64%, and 65.43%, respectively and AT level higher than the GC content. The number of haploid genotype was 47 sharing type haploid number of 12. AMOVA analysis showed that the total genetic differentiation coefficient of COⅠ (Fst) from seven groups was 0.7893 (P<0.001), the genetic differentiation among populations was greater than that within population. The phylogenetic evolution tree constructed by NJ showed that individuals from seven geographic populations stayed together with each other and the same group had no obvious independent aggregation. Molecular variance analysis manifested that obvious genetic differentiation appeared between groups. Bullactaexarata; mitochondrial DNA COⅠ; genetic diversity 10.16378/j.cnki.1003-1111.2017.03.016 S917 A 1003-1111(2017)03-0353-06 2016-03-14; 2016-07-28. 国家海洋公益性行业科研专项(201305027);山东省农业良种工程重大课题项目(2014-2016); 中海油公益基金资助项目(2015-2017);青岛市市南区科技发展项目(2014-14-094-2H). 赵丹(1991-),女,研究生;研究方向:动物遗传育种. E-mail:sdhzmdzd@163.com.通讯作者: 刘洪军(1964-),男,研究员;研究方向:渔业资源. E-mail:yzskyk@126.com.
2.5 系统发生关系


3 讨 论