高原地区成年藏绵羊和小尾寒羊附睾组织中eNOS差异表达研究
成旭东,范文刚,赵振娜,汉武娇,袁莉刚
(甘肃农业大学动物医学院,甘肃兰州 730070)
高原地区成年藏绵羊和小尾寒羊附睾组织中eNOS差异表达研究
成旭东,范文刚,赵振娜,汉武娇,袁莉刚*
(甘肃农业大学动物医学院,甘肃兰州 730070)
采用免疫组化SP法结合IPP统计分析法,比较高原地区成年藏绵羊和小尾寒羊附睾组织中eNOS的定位及分布特征。平均光密度数据统计表明,eNOS的平均光密度值在藏绵羊附睾尾部显著高于附睾头和附睾体(P<0.05),藏绵羊附睾头和附睾体之间无显著差异(P>0.05),但在小尾寒羊附睾体显著高于附睾头(P<0.05)。小尾寒羊附睾体的平均光密度值显著高于藏绵羊(P<0.05),附睾头和附睾尾之间无显著差异(P>0.05)。结果表明,eNOS的活性在附睾尾部最高,提示NO与精子运输相关,对于高原地区不同品种绵羊附睾中eNOS分布较大差异的原因尚需深入研究。
内皮型一氧化氮合酶;藏绵羊;小尾寒羊;附睾;免疫组织化学SP法
一氧化氮合酶(nitric oxide synthase,NOS)有神经元型(nNOS)、诱导型(iNOS)和内皮型(eNOS)三个同工酶亚型。eNOS参与合成一氧化氮(NO),而NO作为一种调节多种生理过程的信号分子,其中与附睾局部分泌及精子发生等生理活动均有密切关系。目前关于NOS的研究方向包括氧化应激[1-2]、锌缺乏与细胞免疫应答[3-4]、缺血再灌注[5]。Ha T Y等[6]发现,上述3种NOS定位于马附睾上皮;Zini A等[7]发现eNOS蛋白共定位阳性区域取决于NADPH黄递酶的活性,eNOS定位于人的附睾和输精管上皮。附睾为精子成熟提供了特殊的酸性环境,精子成熟主要通过精子与附睾管腔液蛋白的相互作用改变精子膜表面成分。Herrero M B等[8]应用免疫荧光技术发现NOS主要分布在人和小鼠精子的顶体和尾部,提示 NO与精子的运动、获能以及顶体反应密切相关。
藏绵羊是我国畜种遗传资源中宝贵的基因库,其总群体具有丰富的遗传多样性。小尾寒羊属蒙古羊系,其遗传性能稳定、生长发育快、繁殖力及适应性强,被国家定为名畜良种,蒙古羊与藏绵羊间具有一定的遗传亲缘关系,二者在青海、甘肃等地均能正常生长繁育。本研究通过免疫组织化学技术研究了成年藏绵羊和小尾寒羊附睾eNOS的表达分布特点,分析高原地区不同品种绵羊附睾中eNOS的分布及变化特点。
1 材料与方法
1.1 材料
1.1.1 试验用动物 2015年1 月份在甘肃省武威天祝牧区通过外科去势手术分别采集成年藏绵羊和小尾寒羊(经齿龄鉴别法确定3岁龄)睾丸(附有附睾)各10 对,40 mL/L多聚甲醛溶液固定。
1.1.2 主要药品试剂 兔抗羊内皮型一氧化氮合酶抗体(bs-0163R),北京博奥森生物技术有限公司产品;免疫组化染色试剂盒(SP-0023),北京博奥森生物技术有限公司产品;DAB 显色试剂盒(ZLI-9018),北京中杉金桥生物技术有限公司产品。
1.2 方法
1.2.1 组织化学样本制备和观察 新鲜组织样品经40 mL/L多聚甲醛溶液固定,修成1 cm×1 cm×0.6 cm 大小,常规梯度酒精脱水,石蜡包埋,Epon812包埋机进行包埋,LKB8800型超薄切片机连续切片,切片厚5 μm,进行苏木精-伊红(H.E)常规染色。
1.2.2 免疫组化染色 采用免疫组化SP(streptavidin-perosidase)法进行染色。石蜡切片常规脱蜡,梯度酒精分化;高压修复抗原后,加30 g/L H2O2水溶液封闭过氧化物酶10 min,正常山羊血清白蛋白孵育15 min 后;每张切片滴加50 μL一抗内皮型一氧化氮合酶(eNOS) (稀释度1∶100),37℃孵育2 h,PBS振洗后每张切片滴加50 μL二抗生物素标记山羊抗兔IgG工作液,后加50 μL辣根酶标记链霉卵白素工作液,37℃孵育滴加新鲜配制DAB显色液,常规脱水透明、封片,阴性对照以PBS替代一抗进行染色。

2 结果
2.1 eNOS在成年藏绵羊附睾组织的分布
高原型藏绵羊各附睾管上皮均可见主细胞呈高柱状分布(图1A),管周肌样细胞胞核呈长梭形围绕各附睾管固有膜外周(图1B),间质结缔组织发达,附睾头和附睾体管腔内纤毛较长,而附睾尾管腔内纤毛较短(图1C)。
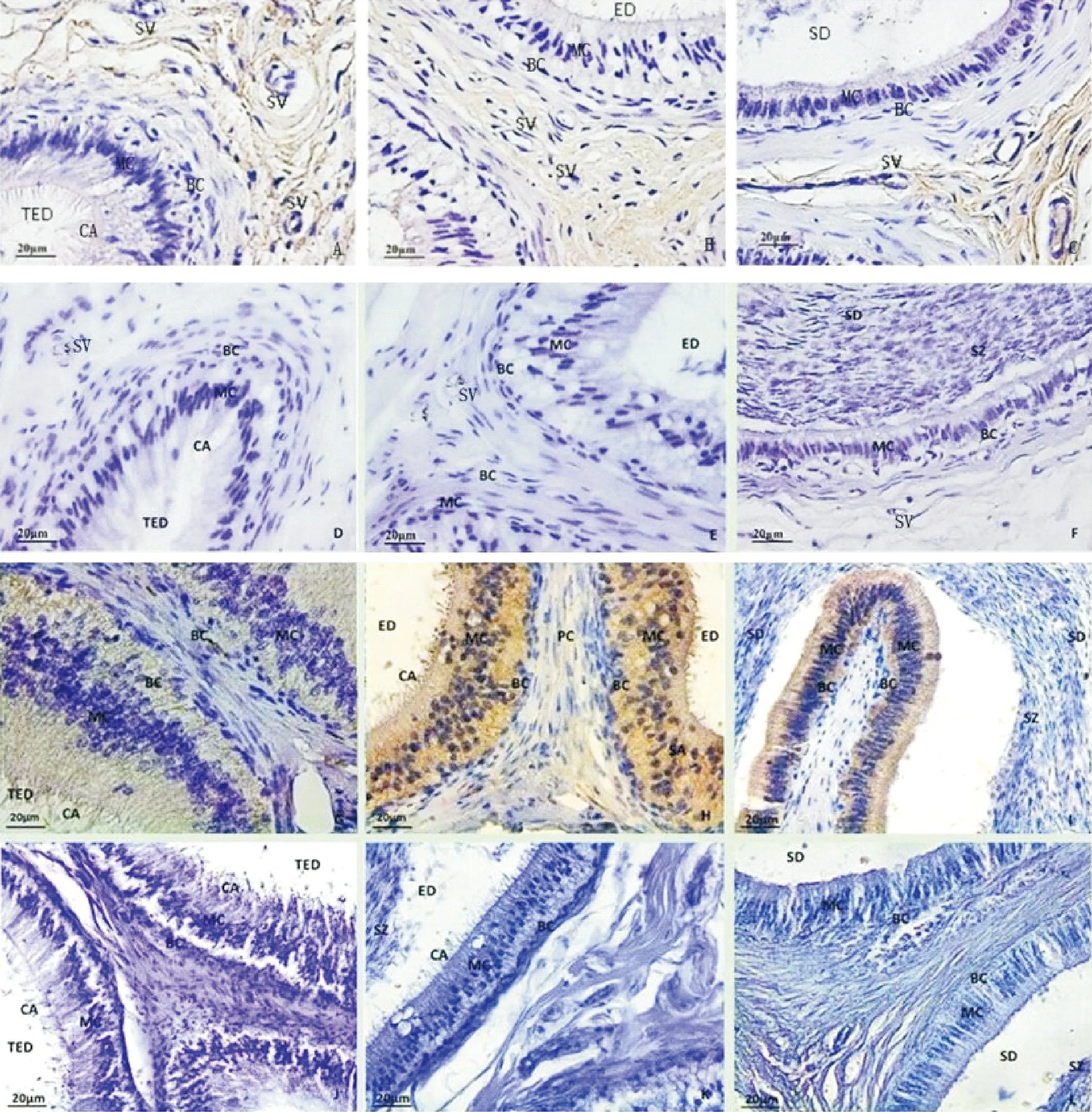
A~C.eNOS在成年藏绵羊附睾头、体、尾部的免疫组织化学染色,标尺示20 μm;G~I.eNOS在成年小尾寒羊附睾头、体、尾部的免疫组织化学染色,标尺示20 μm;D~F,J~L均为相应免疫组化染色阴性对照,标尺示20 μm;TED.睾丸输出管;ED.附睾管;SD.输精管;MC.主细胞;BC.基细胞;PC.管周肌样细胞;SV.小血管(↑);SZ.精子;CA.纤毛
A-C.Immunohistochemical staining of eNOS in Plateau adult Tibet sheep Epididymis.Bar= 20 μm;G-I.Immunohistochemical staining of eNOS in Plateau Small-TailHan sheep Epididymis.Bar= 20 μm;D-F,J-L.Immunohistochemical negative contrast,Bar= 20 μm;TED.Testicular efferent duct;ED.Epididymal duct;SD.Seminiferous duct; MC.Main cells;BC.Base cells.PC.Peritubular myoid cells;SV.Small vessel (↑);SZ.Spermatozoon;CA.Cilia
图1 eNOS在高原地区成年藏绵羊与小尾寒羊附睾免疫组织化学染色比较(400×)
Fig.1 Immunohistochemical staining of eNOS in epididymis of plateau adult Tibet sheep and small-tail Han sheep(400×)
免疫组织化学结果显示,eNOS免疫反应阳性产物呈淡黄色,定位于血管壁与附睾间质,细胞核经苏木素复染呈淡蓝色。附睾头部管腔内未见明显精子分布,400倍显微镜下间质组织阳性表达明显,血管内皮细胞呈强阳性表达(图1A),阴性对照无表达(图1D);附睾体间质可见阳性表达,400倍镜下间质的血管内皮细胞呈强阳性表达,间质可见阳性表达(图1B),阴性对照无表达(图1E);附睾尾部,400倍镜下间质的血管内皮细胞呈强阳性表达,间质可见强阳性表达,腔内可见精子分布(图1C),阴性对照无表达(图1F)。管腔上皮和精子表面均未见明显表达(图 1A、B、C)。
2.2 eNOS在小尾寒羊附睾组织上的分布
光镜下,高原地区小尾寒羊附睾各管腔上皮主细胞呈高柱状分布(图1G)管周肌样细胞胞核呈长梭形围绕各附睾管固有膜外周(图1H),大量成熟精子分布于腔面,附睾尾管腔内纤毛较附睾头和附睾体短(图1I),与藏绵羊附睾管腔上皮纤毛结构类似。
免疫组织化学结果显示,eNOS主要定位于管腔上皮。附睾头部睾丸输出管间质可见微弱阳性表达,400倍镜下管腔上皮可见微弱阳性表达,腔内未见精子分布(图1G),阴性对照无表达(图1J);附睾管间质可见弱阳性表达,400倍镜下管腔上皮可见强阳性表达(图1H),阴性对照无表达(图1K);附睾尾部输精管管腔内可见大量精子分布,管腔上皮可见阳性表达(图1I),阴性对照无表达(图1L)。血管内皮细胞和精子表面均未见明显表达(图 1G、H、I)。
2.3 eNOS在高原地区成年藏绵羊和小尾寒羊附睾组织平均光密度统计
免疫组化结果统计学分析显示(表1,图2),横向比较,eNOS的平均光密度值在藏绵羊附睾尾部显著高于附睾头和附睾体(P<0.05),藏绵羊附睾头和附睾体之间的平均光密度值无显著差异(P>0.05)。但在小尾寒羊附睾体的平均光密度值显著高于附睾头(P<0.05)。纵向比较,藏绵羊和小尾寒羊相比,小尾寒羊附睾体的平均光密度值显著高于藏绵羊(P<0.05),附睾头和附睾尾之间的平均光密度值无显著差异(P>0.05)。
3 讨论
3.1 eNOS在成年藏绵羊和小尾寒羊附睾头部表达的分布比较
附睾头作为睾丸输出部,其管腔上皮为假复层柱状纤毛上皮,管腔呈规则椭圆形且未见有游离精子分布,具有大量较浓密的长纤毛,其分泌吸收功能主要由主细胞承担完成。钟垒等[9]发现,在雌激素α受体(ERα)介导下的雌激素对睾丸输出管管腔液的重吸收具有重要的调节作用,推测可通过介导ERα增加睾丸输出管中NO的产生来调节精子的成熟与发育。苏杰等[10]发现雄激素能上调原代培养的大鼠附睾头部上皮细胞中Bin1b(β防御素样分子)的表达,而β防御素可能在宿主天然防御和精子成熟过程中双重作用[11]。结合本研究,与藏绵羊相比,小尾寒羊eNOS在附睾头部的表达主要定位于睾丸输出管管腔上皮细胞,其柱状纤毛上皮呈强阳性表达。
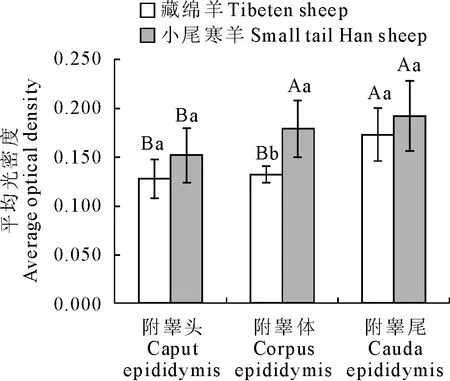
与附睾尾部及小尾寒羊分别进行横向和纵向比较,同行(大写)或同列(小写)所标字母大小写不同表示差异性显著(P<0.05)
Compared with the AOD of the cauda epididymis and small-tail han sheep,peer (capital) or the same column (lowercase) of the letters of different sizes indicate significant difference (P<0.05)
图2高原地区成年藏绵羊和小尾寒羊附睾中eNOS的平均光密度检测
Fig.2 The AOD of eNOS in epididymis of plateau adult Tibet sheep and small-tail Han sheep
3.2 eNOS在成年藏绵羊和小尾寒羊附睾体部表达的分布比较
研究表明,附睾体作为未成熟精子到成熟精子的过渡部位,在精子获得运动能力过程中起关键作用[12]。NO可以通过作为细胞内外信使,激活鸟苷酸环化酶sGC生成第二信使cGMP,从而完成信号转导[13],控制附睾上皮基膜和间质合成和分泌细胞外基质蛋白,最终完成其对精子成熟的调控。罗红梅等[14]发现,eNOS在小鼠附睾间质、血管及平滑肌细胞中均有表达。这与本研究eNOS在藏绵羊附睾的定位分布一致。Dun NJ[15]发现,NOS 在附睾内的分布与乙胆碱酯酶在附睾内的分布极为相似,这表明NO可能与腺体的分泌及平滑肌的收缩密切相关,推测NO作为舒血管因子,通过对血管平滑肌的控制,完成对附睾局部微循环的调节。本研究中藏绵羊附睾体eNOS的表达主要见于血管内皮细胞,提示NO在此处可能参与局部微循环调节。与此相比,eNOS在小尾寒羊的表达主要定位于附睾管管腔上皮细胞,其假复层柱状上皮的纤毛呈强阳性表达。1978年,Eng[16]在兔精浆中提取出了附睾体部主细胞合成分泌的顶体稳定因子(ASF),其主要作用是维持精子在附睾成熟过程中的去能状态。
3.3 eNOS在成年藏绵羊和小尾寒羊附睾尾部表达的分布比较
附睾尾作为输精管前部,其分泌吸收功能主要由主细胞和亮细胞承担完成。李聪等[17-18]发现,高原地区成年藏绵羊和小尾寒羊附睾尾间质胶原纤维和网状纤维的分布较附睾头和附睾体多,附睾各部分中PAS的反应强弱与附睾上皮分泌功能的变化密切相关,附睾尾输精管和附睾头的分泌功能均较附睾体增强。杨栋慧等[19]发现高原哺乳动物成年牦牛附睾管腔外周网状纤维与胶原纤维分布一致,且在附睾尾较为丰富,可能与其收缩能力较强及精子运输有关,推测NO参与运输精子可能与其丰富的管腔外周纤维相关。研究发现,成年雄性Sprague Dawley大鼠NOS的活性在附睾尾段和输精管最高,与本研究eNOS在小尾寒羊附睾的定位相一致,推测NO与精子运输相关。
本研究表明,eNOS在藏绵羊附睾的表达定位于附睾间质和血管内皮细胞,与藏绵羊相比,小尾寒羊附睾eNOS的表达与分布有其独特性,其主要定位于管腔上皮;eNOS的活性在小尾寒羊附睾体部比藏绵羊高,推测其可能与管腔上皮的分泌相关。eNOS的活性在附睾尾部最高,推测NO与精子运输相关,对于高原地区不同品种绵羊附睾中eNOS分布较大差异的原因尚需深入研究。
[1] Alpcan S,Baar H,Aydos T R,et al.Apoptosis in testicular tissue of rats after vasectomy:evaluation of eNOS,iNOS immunoreactivities and the effects of ozone therapy[J].Turk J Urol,2014,40(4):199-206.
[2] Moosavi S J,Habibian M,Peeri M,et al.Protective effect ofFerulagummosahydroalcoholic extract against nitric oxide deficiency-induced oxidative stress and inflammation in rats renal tissues[J].Clin Exp Hypertens,2015;37(2):136-141.
[3] Tomat A L,Veiras L C,Aguirre S,et al.Mild zinc deficiency in male and female rats:early postnatal alterations in renal nitric oxide system and morphology[J].Nutrition,2013,29(3):568-573.
[4] Miyazaki T,Takenake T,Inoue T,et al.Lipopolysaccharide-induced overproduction of nitric oxide and overexpression of iNOS and interleukin-1β proteins in zinc-deficient rats[J].Biol Trace Elem Res,2012,145(3):375-381.
[5] Zhang Y,Lv Y,Liu Y J,et al.Hyperbaric oxygen therapy in rats attenuates ischemia-reperfusion testicular injury through blockade of oxidative stress,suppression of inflammation,and reduction of nitric oxide formation[J].Urology,2013,82(2):489.e9-489.e15.
[6] Ha T Y,Kim H S,Shin T.Expression of constitutive endothelial,neuronal and inducible nitric oxide synthase in the testis and epididymis of horse[J].J Vet Med Sci,2004,66(4):351-356.
[7] Zini A,O'bryan M K,Magid M S,et al.Immunohistochemical localization of endothelial nitric oxide synthase in human testis,epididymis,and vas deferens suggests a possible role for nitric oxide inspermatogenesis,sperm maturation,and programmed cell death[J].Biol Reprod,1996,55(5):935-941.
[8] Herrero M B,Martinez S P,Viggiaon J M,et al.Localizati on by indirect immunofluorescence of nitric oxide synthase in mouse and human spermatozoa[J].Reprod Fertil Dev,1996,8(5):931-934.
[9] 钟 垒,主 性,冯 杰,等.己烯雌酚对幼年香猪睾丸与附睾雌激素受体和一氧化氮合酶表达和分布的影响[J].解剖学报,2015,46(3):373-378.
[10] 苏 杰,卢 建,黄高翔,等.甾类激素对原代培养附睾头部上皮细胞中Bin1b表达的影响[J].第二军医大学学报,2016,37(1):22-26.
[11] Dorin J R,Barratt C L.Importance of β-defensins in sperm function[J].Mol Hum Reprod,2014,20:821-826.
[12] 周宗瑶,王一飞.附睾精子成熟功能研究进展[J].生殖与避孕,2003(4):238-243.
[13] Muller D,Mukhopadhyay A K,Davidoff M S,et al.Cyclic GMP signaling in rat urinary bladder,prostate,and epididymis:tissue-specific changes with aging and in response to Leydig cell depletion[J].Reproduction,2011,142(2):333-343.
[14] 罗红梅,贺丽萍,汪 翼,等.一氧化氮合酶在大鼠附睾内的表达及其可能的作用[J].解剖科学进展,2003(1):23-24.
[15] Dun N J,Dun S L,Huang R L,et al.Distribution of origin of nitric oxide synthase-immunoreactive nerve fibers in the rat epididymis[J].Brain Res,1996,738(2):292-300 .
[16] Eng L A,Oliphant G.Rabbit sperm reversible decapacitation by membrane stabilization with a highly purified glycoprotein from seminal plasma[J].Biol Reprod,1978(9):1083.
[17] 李 聪,袁莉刚,路琪中,等.高原型藏绵羊附睾细胞外基质的组织化学研究[J].畜牧兽医学报,2016,47(4):820-827.
[18] 李 聪,袁莉刚,张 勇.高原地区小尾寒羊附睾细胞外基质相关蛋白分布特征研究[J].畜牧兽医学报,2016,47(8):565-573.
[19] 杨栋慧,袁莉刚,李 聪,等.不同繁殖季节成年牦牛附睾组织特征比较[J].中国畜牧兽医,2016,43(10):2672-2679.
DifferentialDistributionofeNOSinEpididymistissuesofPlateauAdultTibetanSheepandSmall-TailHanSheep
CHENG Xu-dong,FAN Wen-gang,ZHAO Zhen-na,HAN Wu-jiao,YUAN Li-gang
(CollegeofVeterinaryMedicine,GansuAgriculturalUniversity,Lanzhou,Gansu,730070,China)
Immunohistochemical SP method combined with Image-Pro Plus was used to compare the distribution of eNOS in the epididymis of plateau adult Tibetan sheep and small-tail Han sheep.The AOD data showed that eNOS in the cauda epididymis is significantly higher than that in caput and corpus epididymis (P<0.05),and no significant difference between the caput and corpus epididymis in the Tibetan sheep (P>0.05).But eNOS in the corpus epididymis is significantly higher than in caput epididymis of small-tail Han sheep (P<0.05).eNOS in the corpus epididymis of small-tail Han sheep is significantly higher than that of Tibetan sheep(P<0.05),and there are no significant difference between the caput and cauda epididymis(P>0.05).The highest activity of eNOS in the cauda epididymis may relate to transporting sperm.The reasons for the distribution difference need further study on eNOS in the epididymis of different breeds of plateau sheep.
endothelial nitric oxide synthase (eNOS); Tibetan sheep; small-tail Han sheep; epididymis; immunohistochemical SP method
2017-03-24
国家自然科学基金项目(31160488);甘肃省基本科研业务项目基金(2012);甘肃省农业大学大学生科研训练项目(20150323)
成旭东(1993-),男,甘肃天水人,硕士,主要从事动物发育生物学研究。*
S858.24
A
1007-5038(2017)11-0061-05