PMA结合ddPCR检测食品中沙门氏菌
王 静,秦 燕, 张慧敏,刘玉敏,魏 玮,贾俊涛
(1.威海出入境检验检疫局 检验检疫技术中心,山东 威海264205;2.山东出入境检验检疫局,山东 青岛266500)
PMA结合ddPCR检测食品中沙门氏菌
王 静1,秦 燕1, 张慧敏1,刘玉敏1,魏 玮1,贾俊涛2
(1.威海出入境检验检疫局 检验检疫技术中心,山东 威海264205;2.山东出入境检验检疫局,山东 青岛266500)
建立一种快速、灵敏的微滴式数字PCR方法,用于检测食品中沙门氏菌活菌。利用叠氮溴化丙锭(PMA)对死菌预处理,PMA可以选择性穿过死菌细胞膜,在光照条件下与死菌DNA发生共价交联反应,进而阻止其DNA进行PCR扩增,提取细菌基因组DNA进行微滴式数字PCR(ddPCR)检测。结果表明,强烈光照15.0 min,可以使PMA与死菌DNA共价交联,同时钝化游离的PMA;PMA终质量浓度为40.0 μg/mL可以有效抑制105CFU/mL的沙门氏菌死菌DNA的PCR扩增;不抑制活菌DNA扩增的PMA最高浓度是50.0 μg/mL。利用PMA处理死活菌混合液时,PMA-ddPCR可以在死菌存在的条件下,定量检测活菌,降低了“假阳性”结果的出现。灵敏度检测结果显示:PMA-ddPCR灵敏度是0.4 copy/μL。利用PMA-ddPCR检测人工污染的鳕鱼样品,最低可检出102CFU/mL的沙门氏菌,精密度和稳定性良好。
叠氮溴化丙锭;微滴式数字PCR;沙门氏菌;活菌
目前,检测沙门氏菌的方法有很多[1-5],比如实时荧光聚合酶链式反应[6]、荧光染色[7]、免疫学方法[8]、生物学方法[9]等,虽然这些方法相比于传统培养法有一些优势[10-11],但是还存在一些无法克服的缺点,诸如操作繁琐费时,灵敏度低,不能真实反映样品的污染水平,出现“假阳性”的结果等。因此,开发定量检测活菌的方法是非常有必要的。作者将基于核酸共价交联技术从分子水平寻找细菌活的状态的标志物,建立活菌的检测方法。叠氮溴化丙锭(PMA)是一种能和DNA共价交联的光敏材料,光照可以使PMA的光敏基团转化为氮宾自由基,其可以和DNA发生共价交联,进而阻断DNA分子的PCR扩增,并且PMA只能选择性的渗透死菌的细胞膜,因此PMA和PCR技术相结合在定量检测活菌方面有巨大的发展潜力。
微滴式数字PCR系统(ddPCR)是近年来发展起来的核酸分子绝对定量检测技术,该方法在传统的PCR扩增前将含有核酸分子的反应体系进行微滴化处理,形成上万个纳升级的微滴,通过PCR扩增和荧光信号的积累读取阳性微滴数目,再通过泊松分布计算出样本的DNA分子数目。作得首次将PMA与ddPCR技术相结合,以沙门氏菌为例,开发了高灵敏和高选择性的检测食源性致病菌的新方法。
1 材料与方法
1.1 菌种
菌株:沙门氏菌 Salmonella(ATCC13311)。
1.2 试剂与仪器
PMA:1 mg:溶解于 1.0 mL质量分数 20%的DMSO溶液,得到1 mg/mL储备液,于-20℃避光保存;细菌基因组DNA提取试剂盒:北京Tiangen公司产品;引物、探针:生工生物工程(上海)股份有限公司合成;荧光定量PCR反应体系及有关试剂:罗氏公司产品;微滴式数字PCR反应体系及有关试剂:美国伯乐公司产品。
QX200微滴式数字PCR系统:美国伯乐公司产品;实时荧光定量PCR系统(7900HT Fast):美国应用生物系统公司产品;CF16RXII高速冷冻离心机:日本日立公司产品。
1.3 方法
1.3.1 细菌培养及不同胁迫条件下受损细菌的制备 用接种环沾取甘油管保存的菌液,在营养琼脂平板上划线,于37℃下培养24 h。挑取单菌落接种于营养肉汤液体培养基,37℃培养至对数生长期。
受损细菌的制备:吸取3份处于对数期的细菌培养液于离心管中,分别沸水浴5 min,体积分数70%异丙醇处理30 min,30 W紫外灯照射30 min,吸取1mL涂布于平板计数培养基,37℃下培养24 h观察是否有菌落长出。
1.3.2 最佳PMA浓度的选取 取500 μL受损细菌于1.5 mL离心管中,分别加入PMA使其终浓度为 0.0、2.0、5.0、10.0、20.0、40.0、50.0 μg/mL,充分混匀后暗处孵育15 min,每隔5 min颠倒混匀,使PMA最大限度进入受损细胞内。将离心管置于500 W卤钨灯下20 cm处曝光15 min(管口朝上,置于冰上),期间每隔5 min混匀,以使样品溶液曝光均匀。随后用试剂盒法提取基因组DNA,进行荧光定量PCR检测。取500 μL沙门氏菌活菌作为对照组,处理同实验组。设置3个重复。
1.3.3 最佳曝光时间的选取 取500 μL受损细菌于1.5 mL离心管中,加入终浓度40.0 μg/mL PMA后暗处孵育15 min,置于卤钨灯下方20 cm处,分别曝光 0.0、2.0、5.0、10.0、15.0、20.0 min, 随后用试剂盒法提取基因组DNA,进行荧光定量PCR检测。
1.3.4 PMA-qPCR及PMA-ddPCR检测 本实验采取试剂盒法得到基因组DNA。分别利用7900HT Fast实时荧光定量PCR系统和QX200微滴式数字PCR系统进行检测。参考SN/T 1870-2007合成引物、探针。 上游引物(19bp):5′-GCGGCGTTGGAGA GTGATA-3′,下游引物(21 bp):5′-AGCAATGGAA AAAGCAGGATG-3′, 探针:5′-FAM-CATTTCTTA AACGGCGGTGTCTTTCCCT-TAMRA-3′。
PMA-qPCR 反 应 体 系 (25.0 μL):12.5 μL LightCycler® 480 Probes Master;10 μmol/L 上、下游引物各 1.0 μL;10 μmol/L 探针 0.5 μL; 模板 DNA 2.0 μL;最后用 DEPC 水补充至 25.0 μL。qPCR 扩增条件为:95 ℃、3 min;94 ℃、5 s,60 ℃、40 s,40 个循环,同时收集FAM荧光。
PMA-ddPCR 反 应 体 系 (20.0 μL):10.0 μL ddPCRTMSupermix for Probes (No dUTP);10 μmol/L上、 下游引物各 1.0 μL;10 μmol/L 探针 0.5 μL;模板 DNA 4.0 μL; 最后用 DEPC 水补充至 20.0 μL。ddPCR 扩增循环条件为:95 ℃,5min;94 ℃,10 s,60℃,45 s,40 个循环;98 ℃,10 min。
1.3.5 qPCR、PMA-qPCR、PMA-ddPCR 检测不同比例活菌的比较 配制活菌比例为100%,50%,25%,10%,0%的沙门氏菌菌悬液,分别取500 μL于1.5 mL离心管中,qPCR组不加入 PMA,PMA-qPCR、PMA-ddPCR组用PMA处理 (PMA终质量浓度为40.0 μg/mL,曝光 15 min),按照试剂盒法提取基因组DNA,进行qPCR、PMA-qPCR、PMA-ddPCR检测。
1.3.6 PMA-qPCR、PMA-ddPCR检测沙门氏菌的灵敏度 将106CFU/mL的沙门氏菌菌液依次稀释10 倍制 得浓度 为 106、105、104、103、102、101CFU/mL的菌液,分别标记为S6~S1。在优化条件下,进行PMA-qPCR、PMA-ddPCR检测。
1.3.7 PMA-qPCR、PMA-ddPCR检测人工污染鳕鱼样品中沙门氏菌 取25.0 g新鲜鳕鱼样品,用均质器制成鳕鱼匀浆,加入105CFU/mL死菌,然后人工污染101~106CFU/mL的沙门氏菌菌液,由于实际样品基质复杂,透光率下降,动物组织破裂后可能释放少量游离核酸,因此提高PMA用量至50.0 μg/mL,延长曝光时间至30 min,保证PMA与死菌DNA充分结合并钝化游离的PMA。在优化条件下进行PMA-qPCR、PMA-ddPCR检测。
2 结果与讨论
2.1 不同受损条件下,PMA的处理效果
如图1所示,未加PMA处理的对照组中,热、异丙醇、紫外灯照射处理得到的沙门氏菌死细胞DNA的PCR扩增没有明显差异。加PMA处理的实验组中,紫外灯照射对沙门氏菌细胞DNA的PCR扩增几乎没有影响,原因是紫外照射只破坏了细胞中的核酸结构,没有破坏细菌的细胞膜;与对照组相比,热处理组和异丙醇处理组CT值均明显升高,说明PMA进入了死菌细胞,抑制了其DNA的PCR扩增。
2.2 最佳PMA浓度的优化
如图2所示,随着PMA浓度的增大,死菌DNA qPCR扩增的CT值明显升高,当PMA浓度超过40.0 μg/mL时,CT值几乎不再发生变化。当PMA浓度增加到50.0 μg/mL时,活菌DNA qPCR扩增的CT值略微高于不加PMA的对照组,说明高浓度PMA影响了活菌DNA的qPCR扩增。作者选用40.0 μg/mL PMA为最佳浓度。

图1 不同致死方式对PMA进入细胞膜的影响Fig.1 Effects of different lethal modes on PMA into the cell membrane

图2 不同质量浓度PMA对活菌和热灭活菌的影响Fig.2 Effect of PMA concentration on live and deadSalmonella
2.3 最佳曝光时间的优化
如图3所示,随着光照时间的增加,体系的CT值迅速升高,光照时间超过15.0 min后,体系的CT值不发生明显变化,说明PMA和DNA发生了共价交联反应,多余的PMA与水溶液反应生成没有活性的羟胺。作者选取15.0 min作为最佳光照时间。

图3 曝光时间对PMA处理死细胞的影响Fig.3 Optimization of different light exposure
2.4 qPCR检测沙门氏菌的线性曲线
如图4所示,CT值与沙门氏菌的浓度在102~108CFU/mL范围内呈现良好的线性关系 (R=0.995 2),其线性回归方程为:y=42.14-3.52x,方程中 y代表DNA qPCR扩增的CT值,x代表沙门氏菌的浓度对数值。
PMA-qPCR的检测限是102CFU/mL(S/N=3)

图4 沙门氏菌qPCR标准曲线Fig.4 Standard curve of Salmonella qPCR
2.5qPCR、PMA-qPCR、PMA-ddPCR检测不同比例活菌的比较
将活菌/热灭活菌按图5所示比例混合后,在优化条件下,用PMA对样品预处理,按照试剂盒法提取DNA后,进行qPCR、PMA-qPCR、PMA-ddPCR检测。不论活菌比例如何变化,qPCR检测结果都为死活菌的总浓度;随着活菌比例的增加,PMA-qPCR和PMA-ddPCR检出结果也相应增加,但是PMA-ddPCR检出结果与平板计数结果更加靠近,由于PMA-ddPCR把样本分成成千上万个微滴,增加了检测结果的准确度。

图5 不同比例活死菌混合液的检测Fig.5 Detection of different proportion of living dead bacteria mixture
2.6PMA-ddPCR、PMA-qPCR检测沙门氏菌的灵敏度
将3.5×106CFU/mL的沙门氏菌菌液10倍梯度稀释,分别标记为 S6~S1,进行 PMA-ddPCR、PMA-qPCR检测。PMA-ddPCR所有反应生成的微滴数目均大于10 000(图6(a)),表明所有反应微滴生成正常,保证了后续定量分析的准确性。从一维散点图(图6(b))上可以看出S1至S6生成的阳性微滴数分布,阳性微滴数目随着浓度的升高而逐渐增多。此外,阴性对照(NTC)中没有检测到阳性微滴,可见该体系中没有污染或非特异性扩增,PMA-ddPCR检测沙门氏菌有良好的特异性。直方图(图6(c))中阳性峰和阴性峰显著分开,表明该扩增体系适合对沙门氏菌进行定量分析。PMA-ddPCR灵敏度是8.0 copy/20 μL,并在 0.4~0.082×104copy/μL 呈良好的线性(R=0.999 4)(图 6(d))。 PMA-qPCR 最少可检出 102CFU/mL 的沙门氏菌(图 6(e)) ,将 S1~S6测得CT值代入2.4标准曲线计算浓度值作图,PMA-qPCR线性相关系数R=0.998 7。PMA-ddPCR线性优于PMA-qPCR。

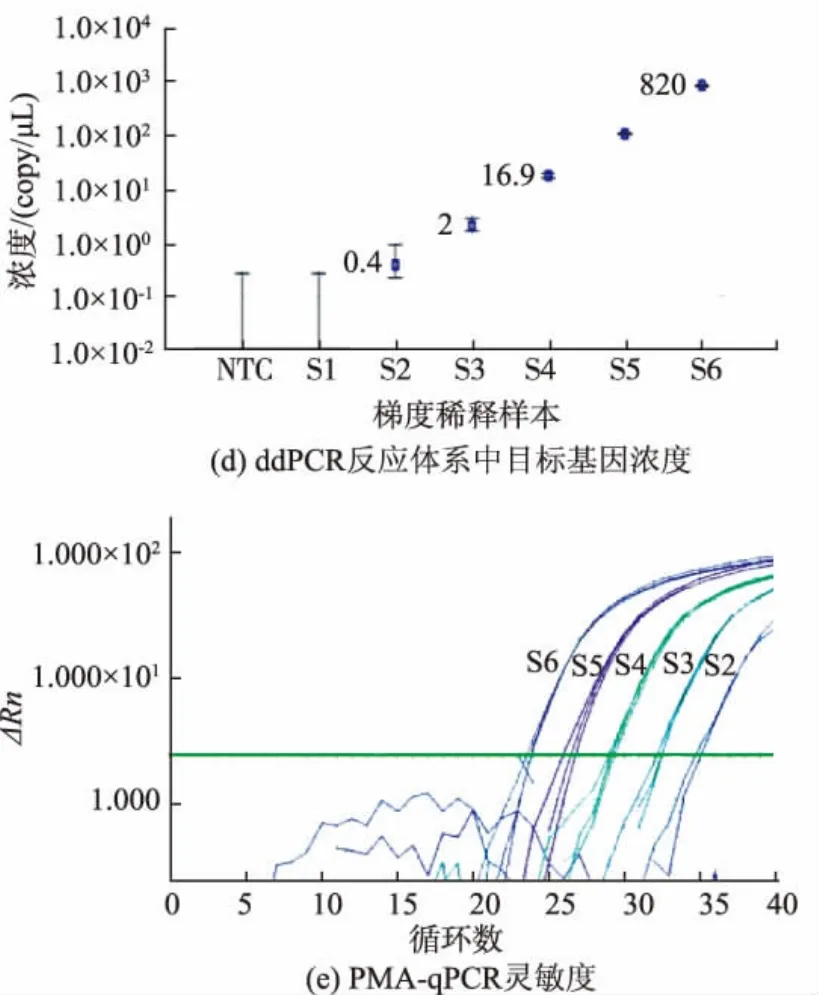
图6PMA-ddPCR、PMA-qPCR检测沙门氏菌的灵敏度Fig.6 Sensitivity of Listeria monocytogenes by PMA-ddPCR and PMA-qPCR detection
2.7 PMA-ddPCR检测人工污染样品中沙门氏菌
对不同染菌量人工污染的鳕鱼样品进行PMA-qPCR、PMA-ddPCR检测,如图7所示,PMA-ddPCR检测人工染菌鳕鱼样品,最低可检出102CFU/mL的沙门氏菌,而PMA-qPCR测得值与理论添加值偏差较大。PMA-ddPCR对样品检测的RSD均小于5.0%。人工污染死菌的样本37℃下放置两周,测得样本的CT值变化小于1.0%。

图7 检测人工污染样本中沙门氏菌的比较Fig.7 Salmonella detection of different methods
3 结语
PMA与ddPCR相结合的方法,可以在死菌存在的条件下定量检测沙门氏菌活菌,消除了“假阳性”结果的出现。与PMA-qPCR方法相比,PMA-ddPCR在检测低浓度染菌的样品时,具有准确性高、精密度好等优点。
[1]JUN H,OHAMI K.ParkImmunosensors combined with a light microscopic imaging system for rapid detection of Salmonella[J].Food Control,2016,56:780-786.
[2]ZHENG Q W,KRAJNIK M M,SOUZA C D.et al.Growth of healthy and sanitizer-injured Salmonella cells on mung bean sprouts in different commercial enrichment broths[J].Food Microbiology,2015,52:159-168.
[3]MAJOWICZ S E,MUSTO J,SCALLAN E,The global burden of nontyphoidal Salmonella gastroenteritis[J].Clinical Infectious Diseases,2010,50(6):882-889.
[4]BURNSA A M,LAWLOR P G,GILLIAN E,et al.GardinerSalmonella occurrence and Enterobacteriaceae counts in pig feed ingredients and compound feed from feed mills in Ireland[J].Preventive Veterinary Medicine,2015,121(3-4):231-239.
[5]ZHANG H M,SHI L,GUO S Y,et al.Identification andcharacterization of class 1 integron resistance gene cassettes among Salmonella strains isolated from healthy humans in China[J].Microbiology and Immunology,2004,48(9):639-645.
[6]MASTER C I,SHALLCROSS J A,MACKEY B M,et al.Effect of stress treatments on the detection of Listeria monocytogenes and enterotoxigenic Escherichia coli by the polymerase chain reaction[J].Journal of Applied Bacteriology,1994,77(1):73-79.
[7]HE X X,CHONG H,QIAN G,et al.Rapid and ultrasensitive Salmonella Typhimurium quantification using positivedielectrophoresis driven on-line enrichment and fluorescentnanoparticleslabel[J].Biosensors and Bioelectronics,2013,42:460-466.
[8]XIE Xueqin,YANG Xingying,GAO Jing,et al.Near IIIfrared fluorescent probes and their applications in immunoassay[J].Journal of Food Science and Biotechnology,2015,34(3):225-230.(in Chinese)
[9]ZHAO Xin,WANG Yong,LAN Qingkuo,et al.Study and applicationon detection of four kinds of food-borne pathogenic bacteria by pyrosequencing technology[J].Journal of Food Science and Biotechnology,2013,32(2):182-188.(in Chinese)
[10]ARICIND A,BHAGWAT A A.Simultaneous detection of Escherichiacoli O157:H7,Listeria monocytogenes and Salmonella strains by real-time PCR[J].International Journal of Food Microbiology,2003,84:217-224.
[11]MALORNY B,BUNGE C,HELMUTH R.A real-time PCR for the detection of Salmonella enteritidis in poultry meat and consumption eggs[J].Journal of Microbiological Methods,2007,70(2):245-251.
Detection of Salmonella in Food Based on PMA-ddPCR
WANG Jing1,QIN Yan1,ZHANG Huimin1, LIU Yumin1,WEI Wei1,JIA Juntao2
(1.Weihai Entry-Exit Inspection and Quarantine Inspection and Quarantine Technology Center,Weihai 264205,China;2.Shandong Entry-Exit Inspection and Quarantine Bureau,Qingdao 266500,China)
The research aimed to establish a fast method to detect of live Salmonella in food with high sensitity.Propidium monoazide (PMA) permeated in the injured cells,then PMA and DNA conducted covalent cross-linking reaction,which could inhibit PCR amplification.Finally,bacterial genome DNA was extracted to detect by ddPCR.The optimization of experimental parameters showed that a final PMA concentration of 40.0 μg/mL and exposure of 15 min could restrain DNA amplification of 105CFU/mL dead cells,and the maximum PMA against DNA amplification from live Salmonella cells was 50.0 μg/mL.Under the different live/dead bacteria proportion,only live Salmonella cells was detected by PMA-ddPCR even in the existence of dead Salmonella cells.The detection limit was 8.0 copy/20 μL.PMA-ddPCR could detect 102CFU/mL Salmonella cells in the codfish polluted by manual work.Furthermore,PMA-ddPCR showed better accuracy and stability.In conclusion,PMA-ddPCR showed huge potential in foodborne pathogenic bacteria detection.
Propidium monoazide,ddPCR,Salmonella,live cells
TS 207.4
A
1673—1689(2017)10—1059—05
2015-10-13
国家质量监督检验检疫总局科技计划项目(2014IK114)。
王 静(1975—),女,山东威海人,理学硕士,高级工程师,主要从事食品安全检测研究。E-mail:15705959793@163.com
王静,秦燕,张慧敏,等.PMA结合ddPCR检测食品中沙门氏菌[J].食品与生物技术学报,2017,36(10):1059-1063.

