毒死蜱/乙基纤维素微胶囊的制备及其缓释性能
徐华,林粤顺,周红军,周艺宇,陈喜,周新华
毒死蜱/乙基纤维素微胶囊的制备及其缓释性能
徐华,林粤顺,周红军,周艺宇,陈喜,周新华
(仲恺农业工程学院化学化工学院,广州市农用化学品高效利用重点实验室,广东广州 510225)
以乙基纤维素为壁材、毒死蜱为模型药物,采用乳化-溶剂挥发法制备毒死蜱/乙基纤维素微胶囊。利用FTIR、SEM和DSC表征了微胶囊的结构和形貌以及毒死蜱的分布形态,运用单因素法考察芯材比、聚乙烯醇(PVA)质量分数、PVA与十二烷基硫酸钠(SDS)质量比和搅拌速度对微胶囊的载药量和包封率的影响,并探究芯材比和PVA质量分数对微胶囊的药物释放性能的影响。结果表明,毒死蜱/乙基纤维素微胶囊具有较为致密的球形结构,而毒死蜱以结晶态分布于微胶囊中。当芯材比为2∶3、PVA质量分数为1.5%、PVA与SDS质量比为3∶2和转速为1500r/min,其载药量和包封率相对较好,分别为44.41%和82.42%。该载药微胶囊具有良好的缓释性能,其释药行为可用Korsmeyer-Peppas动力学模型来描述,且药物释放受Fickian扩散控制。
乙基纤维素;毒死蜱;微胶囊;溶剂挥发法;缓释
毒死蜱是世界上应用最广泛的有机磷杀虫剂之一,作为农用杀虫剂可有效防治粮食、蔬菜、果树等多种作物上的百余种害虫,又可作为卫生杀虫剂用于防治白蚁、蟑螂等动物[1-2]。目前市场上毒死蜱的主要剂型为含有机溶剂的乳油,存在有效成分释放速度快、药物持效时间短、生态污染严重等亟需解决的问题[3]。此外,毒死蜱对光敏感,会引起其药效下降。为了解决上述问题,人们不断对现有的农药进行加工以及加工剂型的不断改进,开发其新的用途,因此农药缓释剂也应运而生[4]。
乙基纤维素及其衍生物是制备微胶囊的优良壁材,属于一类生物质材料,具有价格低廉、易降解、生物相容性好、化学稳定性好等优点,已被广泛地用作药物载体材料[5-6]。钱余义等[7]采用乳化-溶剂挥发法制备了黄芩苷乙基纤维素鼻用微球,着重考察了微球在体外的释放性能,并探究了黄芩苷药物的释放行为;结果表明,黄芩苷原药在7h内累积释放率接近90%,而黄芩苷微球仅为75%,该微球具有一定的缓释作用。THAWATCHAI等[8]以乙基纤维素为壁材,采用溶剂交换法制备了盐酸多西环素、甲硝唑和苄基过氧化物抗菌胶囊,并考察了该胶囊的抗菌活性和治疗牙周炎效果;结果表明,该胶囊表现出抗菌活性和具有潜在的治疗牙周炎效果。虽然,乙基纤维素已被广泛地应用于生物医学领域[9-10];但是,目前乙基纤维素在农药缓释领域的应用还鲜见报道,具有潜在的应用价值。
本文以乙基纤维素为壁材、毒死蜱为模型药物,采用乳化-溶剂挥发法制备毒死蜱/乙基纤维素微胶囊,考察了芯材比、聚乙烯醇(PVA)质量分数、PVA与十二烷基硫酸钠(SDS)质量比、搅拌速度等因素对微胶囊的载药量和包封率的影响,并着重探究了芯材比和PVA质量分数对微胶囊的药物释放性能的影响,以期为乙基纤维素应用于农药缓释载体材料中提供参考。
1 实验部分
1.1 实验试剂
乙基纤维素(ethyl cellulose,EC)、PVA、SDS,分析纯,天津市大茂化学试剂厂;二氯甲烷,分析纯,天津市富宇精细化工有限公司;毒死蜱,纯度≥98%,江苏景宏化工有限公司;去离子水,自制。
1.2 实验仪器
85-2A型恒温磁力搅拌器,金坛市城东新瑞仪器厂;Spectrum100型傅里叶变换红外光谱仪,美国珀金埃尔默公司;TQ200型差示扫描量热仪,美国TA公司;SU8020型扫描电子显微镜,日本日立有限公司;Agilent 1200型高效液相色谱仪,美国安捷伦科技公司;T6新世纪紫外-可见分光光度计,北京普析通用仪器有限公司。
1.3 毒死蜱/乙基纤维素微胶囊的制备
1.3.1 聚乙烯醇溶液的制备
称取一定质量的PVA于烧杯中,加入去离子水,在80℃下磁力搅拌至完全溶解,后用容量瓶定容,配置一定浓度的PVA溶液,常温放置,备用。
1.3.2 毒死蜱/乙基纤维素溶液的制备
称取一定质量的乙基纤维素和毒死蜱于烧杯中,加入适量二氯甲烷,搅拌使其完全溶解后备用。
1.3.3 毒死蜱/乙基纤维素微胶囊的制备
称取上述制得的PVA溶液于烧杯中,加入一定量的SDS,磁力搅拌至完全溶解;选取一定的搅拌速度,向烧杯中滴加毒死蜱/乙基纤维素溶液,继续搅拌至二氯甲烷挥发完全,过滤、洗涤、干燥,制得毒死蜱/乙基纤维素微胶囊。具体各参数配比见 表1。

表1 微胶囊的制备工艺参数
1.4 结构表征
采用KBr压片法,利用红外光谱分析微胶囊的结构,扫描波长范围为450~4000cm–1;使用差示扫描量热仪分析毒死蜱在微胶囊的结晶情况,升温范围为30~100℃,升温速率为10℃/min;氮气气氛,流量为25mL/min;利用扫描电子显微镜观察微胶囊的形貌和粒径,将样品分散于导电胶上面,并进行喷金处理。
1.5 载药量和包封率的测试
采用高效液相法(HPLC)测量毒死蜱/乙基纤维素微胶囊中药物的含量。称取载药微胶囊50mg于25mL容量瓶中,加入甲醇至刻度线,定容,超声溶解20min,摇匀,备用。测试条件:流动相为甲醇水,(甲醇)∶(水)=80∶20,流速为1.0mL/min,柱温为40℃,检测波长为230nm,进样10μL;根据对照品的保留时间、峰面积与浓度的关系,= 0.0290251.29,2= 0.9995,并依据式(1)和式(2)分别计算微胶囊中的载药量(loading content)和包封率(encapsulation efficiency)。


式中,为HPLC测量出毒死蜱的浓度,mg/L;为微胶囊在制备中毒死蜱的投入量,mg;为制备中所得到微胶囊的总质量,mg。
1.6 缓释性能的测试
毒死蜱/乙基纤维素微胶囊的缓释性能参考文献[11]方法测定。称取一定质量(1)的微胶囊,放置于锥形瓶中,加入100mL体积分数为30%甲醇水溶液,间隔一定时间(),用移液枪移取1mL样品液于25mL容量瓶中,并补加1mL原溶液。在波长为230nm下用UV扫描并通过标准工作曲线=2000.0571,2=0.9914,计算其浓度,毒死蜱随时间的累积释放率为R,绘制t-R曲线作为毒死蜱的缓释动力学曲线,详见公式(3)。

式中,ρ为第次取出液中毒死蜱的浓度,mg/L。
2 结果与讨论
2.1 结构表征
2.1.1 FTIR分析
图1为毒死蜱、乙基纤维素和毒死蜱/乙基纤维素微胶囊的FTIR图。谱线a为毒死蜱,在1413cm–1和1548cm–1处分别为毒死蜱上吡啶环C==N和芳环C==C的伸缩振动峰[13]。谱线b为乙基纤维素,在2800~3000cm–1处出现的双峰为亚甲基的伸缩振动峰,在3450cm–1处为羟基的特征吸收峰,在1120cm–1处为醚键的伸缩振动峰[12]。谱线c为毒死蜱/乙基纤维素微胶囊,其与谱线a和b相比较,在1413cm–1和1548cm–1处出现了毒死蜱的特征吸收峰,且在3450cm–1和1120cm–1处出现了乙基纤维素的特征吸收峰,这说明已制备了毒死蜱/乙基纤维素微胶囊。
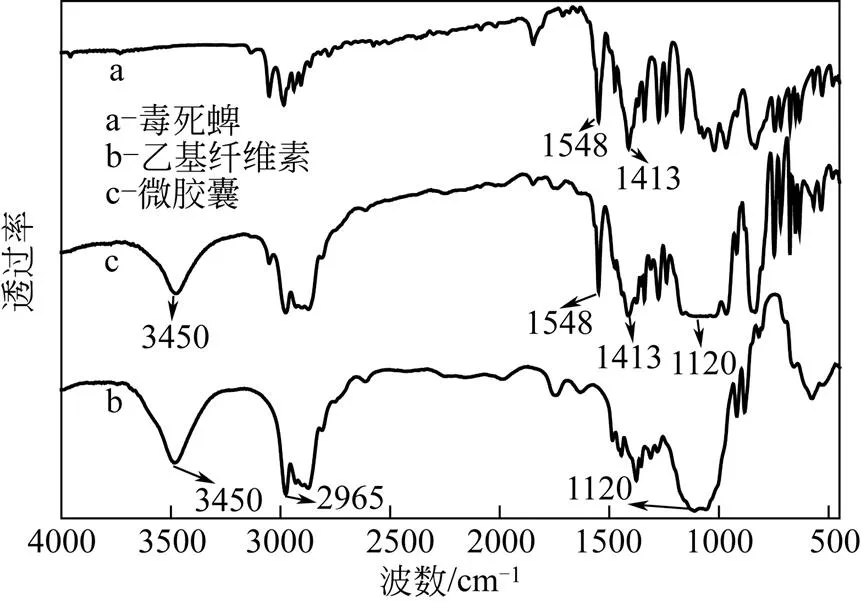
图1 毒死蜱、乙基纤维素和微胶囊的FTIR图
2.1.2 DSC分析
图2为毒死蜱和不同芯材比的毒死蜱/乙基纤维素微胶囊的DSC图。从图2可见,毒死蜱在43.2℃出现强吸热峰是毒死蜱熔融所致,此为毒死蜱的熔融峰。不同芯材比的毒死蜱/乙基纤维素微胶囊也出现了类似的吸热熔融峰,说明在微胶囊中,毒死蜱仍以结晶态存在;同时,其毒死蜱的熔点相对于纯毒死蜱的熔点有所下降,说明该毒死蜱的结晶受到壁材的影响,导致其结晶的完善度有所下降。
2.1.3 SEM分析
图3为芯材比为2∶3、PVA质量分数为1.5%、PVA与SDS质量比为3∶2和转速为1500r/min条件下不同放大倍数的毒死蜱/乙基纤维素微胶囊的SEM图。从图3(a)可见,微胶囊的粒径较均一,呈现出球形的结构,通过计算其平均粒径为6µm。进一步观察,微胶囊的表面结构较为致密,但又出现一些微孔[见图3(b)],这可能是由于在搅拌蒸发溶剂过程中所带入的空气和微胶囊的干燥所致。

图2 毒死蜱和不同芯材比微胶囊的DSC图

图3 微胶囊在不同放大倍数下的SEM图
2.2 工艺参数对微胶囊的影响
2.2.1 芯材比对微胶囊的影响
图4为不同芯材比时微胶囊的载药量和包封率图。由图4可见,当芯材比从1∶3增加至2∶3时,微胶囊的包封率和载药量呈现递增的趋势,其载药量由29%增加至50.5%,增加幅度为74.1%。因为芯材比越大,说明制备微胶囊时加入的毒死蜱药物越多,而在一定条件下,投药量越多,微胶囊所包封的药物越多,其载药量增大,包封率也相应增加。然而,继续增大芯材比,药物的投入量相对于壁材处于过饱和状态,导致部分药物未被完全包封于微胶囊中而随后续处理流失,导致其包封率反而下 降[14]。因此,芯材比应选择为2∶3。

图4 芯材比对包封率和载药量的影响
2.2.2 PVA质量分数对微胶囊的影响
图5为不同PVA质量分数时微胶囊的载药量和包封率图。从图5可知,随着PVA质量分数的增加,微胶囊的包封率逐渐增大,由50.8%增加至76.7%。因为PVA起到分散剂和稳定剂的作用,当分散剂PVA质量分数过低时,降低溶液的黏度,使得微胶囊之间的碰撞阻力减小,从而引起油相液滴无法均匀分散于水相中,部分液滴会凝聚在一起,导致微胶囊的粒径增大,其包封率降低[15]。当PVA的质量分数为2.5%时,溶液的黏度仍合适,不会存在由于溶液的黏度过高而引起不易制备和分离微胶囊。然而,微胶囊的载药量随着PVA质量分数的增加呈现先增大后减小的趋势,且当PVA质量分数为1.5%时,载药量达到最大值,为64.11%。这可能是由于PVA的质量分数过大,导致微胶囊的粒径过小,微胶囊中的药物与水相的接触机会增多,那么微胶囊的载药量减小[16]。曹德勇[17]在研究毒死蜱微胶囊化时也发现PVA的质量分数过大,其载药量反而减小。因此,PVA的质量分数应选择为1.5%。

图5 PVA质量分数对包封率和载药量的影响
2.2.3 PVA与SDS质量比对微胶囊的影响
图6为不同PVA与SDS质量比时微胶囊的载药量和包封率图。由图6可见,随着乳化剂SDS用量的增加,微胶囊的载药量由36.9%增加至50.2%,增加幅度为36.0%,而包封率呈现先增加后减小的趋势,其最大值为67.3%。因为乳化剂SDS用量的增加,改善体系的乳化效果,导致生成油相液滴的粒径会变小,而在一定条件下会促使微胶囊的包封率和载药量的增加[15]。但是,当乳化剂用量过大时,会在水相中形成胶束粒子,增加药物在水相中的溶解力,从而会降低微胶囊的包封率[16]。综上所述,PVA与SDS质量比选择为3∶2。

图6 PVA与SDS质量比对包封率和载药量的影响
2.2.4 转速对微胶囊的影响
图7为不同转速时微胶囊的载药量和包封率图。由图7可知,随着转速的增加,微胶囊的包封率由61.4%增加至82.4%,增加幅度为34.2%,而载药量从36.9%增加至50.2%,略有增加。因为搅拌速度越大,其剪切力越大,一方面能够使油相液滴很好地分散且粒径变小,另一方面能够使二氯甲烷的挥发速度增加,导致微胶囊的干燥时间缩短和形成一个致密的外表面,减少了药物在水相中的溶解,故其包封率和载药量都会增大[9,18]。因此,搅拌速度应选择为1500r/min。

图7 转速对包封率和载药量的影响
2.3 缓释性能
2.3.1 芯材比对缓释性能的影响
图8为不同芯材比微胶囊的药物释放曲线图。从图8可见,芯材比对毒死蜱微胶囊的释药性能有很大的影响,芯材比越大,药物的释放速率越快。因为芯材比越大,说明单位质量壁材所包覆的药物越多,即微胶囊的壁材厚度越薄,药物从微胶囊向缓释介质扩散所克服的阻力越小,药物更容易释放,故芯材比为1∶3时,毒死蜱/乙基纤维素微胶囊的药物释放性能相对最好。

图8 芯材比对微胶囊的药物释放曲线图
为了进一步探究不同芯材比微胶囊的释药行为,对其药物释放数据分别进行了Zero-order、First-order、Higuchi和Korsmeyer-Peppas动力学模型方程的拟合。结果见表3。由表3可见,上述4种不同芯材比微胶囊的释药曲线均与Korsmeyer-Peppas动力学模型的拟合度最好,2大于0.96,且释放指数<0.45,说明其药物释放主要受Fickian扩散机理控制。
2.3.2 PVA质量分数对缓释性能的影响
图9为不同PVA质量分数时微胶囊的药物释放曲线图。从图9可见,分散剂PVA的质量分数越大,微胶囊中药物的释放速度越快。因为PVA的质量分数越大,越有利于生成更多粒径小的微胶囊,导致微胶囊的比表面积增加而使其壁材厚度减 小[15],故其药物释放速率会增大。

表3 不同芯材比微胶囊的药物释放曲线拟合结果
注:a、b、c和d分别代表芯材比为1∶1、2∶3、1∶2和1∶3的毒死蜱/乙基纤维素微胶囊。

图9 PVA质量分数对微胶囊的药物释放曲线图
3 结论
以乙基纤维素为壁材,毒死蜱为模型药物,采用乳化-溶剂挥发法制备了毒死蜱/乙基纤维素微胶囊,呈现出较为致密和球形的结构,具有较为均一的粒径分布,而毒死蜱以结晶态分布于微胶囊中。通过分析芯材比、PVA质量分数、PVA与SDS质量比等因素对微胶囊的载药量和包封率的影响,发现各因素对载药量和包封率均有较大影响,在芯材比为2∶3、PVA质量分数为1.5%、PVA与SDS质量比为3∶2和转速为1500r/min,其载药量和包封率分别为44.41%和82.42%。毒死蜱/乙基纤维素微胶囊具有良好的缓释性能,且芯材比或PVA质量分数越小,其药物释放速率相对越慢。此外,该载药微胶囊的释药曲线比较符合Korsmeyer-Peppas动力学模型,其药物释放符合Fickian扩散机理。
[1] WANG Y,GAO Z,SHEN F,et al. Physicochemical characteristics and slow release performances of chlorpyrifos encapsulated by poly(l acrylate--styrene) with the cross-linker ethylene glycol dimethacrylate[J]. Journal of Agricultural and Food Chemistry,2015,63(21):5196-5204.
[2] PASZKIEWICZ M,SIKORA A,BOGUS M I,et al. Effect of exposure to chlorpyrifos on the cuticular and internal lipid composition of blattella germanica males[J]. Insect Science,2016,23(1):94-104.
[3] NAEENIA M H,YAMINIA Y,REZAEEB M. Combination of supercritical fluid extraction with dispersive liquid-liquid microextraction for extraction of organophosphorus pesticides from soil and marine sediment samples[J]. Journal of Supercritical Fluids,2011,57(3):219-226.
[4] 周新华,廖列文,张志祥,等. 农药缓释微球的制备及其改性研究进展[J]. 农药,2010,49(12):862-867.
ZHOU X H,LIAO L W,ZHANG Z X,et al. Progress on preparation and its modification of microspheres for slow-release pesticides[J]. Agrochemicals,2010,49(12):862-867.
[5] UM-I-ZAHRA S,SHEN X X,LI H,et al. Study of sustained release drug-loaded nanofibers of cellulose acetate and ethyl cellulose polymer blends prepared by electrospinning and theirdrug release profiles[J]. Journal of Polymer Research,2014,21(12):602-613.
[6] FENGA K,HOUA L,SCHOENERB C A,et al. Exploring the drug migration process through ethyl cellulose-based films from infrared-spectral insights[J]. European Journal of Pharmaceutics and Biopharmaceutics,2015,93:46-51.
[7] 钱余义,张刘红,郭立玮,等. 黄芩苷乙基纤维素微球鼻腔给药系统的制备研究[J]. 中国中药杂志,2014,36(24):4787-4791.
QIAN Y Y,ZHANG L H,GUO L W,et al. Studies on baicalin ethylcellulose microspheres for intranasal administration[J]. China Journal of Chinese Materia Media,2014,36(24):4787-4791.
[8] PHAECHAMUDA T,MAHADLEKB J. Solvent exchange-induced in situ forming gel comprising ethyl cellulose-antimicrobial drugs[J]. International Journal of Pharmaceutics,2015,494(1):381-392.
[9] 王建筑,郝吉福,李菲,等. 乳化-溶剂挥发法制备阿司匹林乙基纤维素微囊[J]. 西北药学杂志,2013,28(2):188-191.
WANG J Z,HE J F,LI F,et al. Preparation of aspirin microcapsules from ethyl cellulose by emulsion solvent evaporation method[J]. Northwest Pharmaceutical Journal,2013,28(2):188-191.
[10] HU J,LI H Y,WILLAMS G R,et al. Electrospun poly(- isopropylacrylamide)/ethyl cellulose nanofibers as thermoresponsive drug delivery systems[J]. Journal of Pharmaceutical Sciences,2016,105(3):1104-1112.
[11] 林粤顺,周红军,周新华,等. pH响应性PAA/毒死蜱/氨基化介孔硅缓释体系的制备与性能[J]. 化工学报,2016,67(10):4500-4507.
LIN Y S,ZHOU H J,ZHOU X H,et al,Preparation and properties of pH-responsive control release system of PAA/chlorpyrifos/amino functionalized mesoporous silica[J]. CIESC Journal,2016,67(10):4500-4507.
[12] KANG H,LIU R,HUANG Y. Synthesis of ethyl cellulose grafted poly(-isopropylacrylamide) copolymer and its micellization[J]. Acta Chimica Sinica,2013,71(1):114-120.
[13] 林粤顺,周新华,周红军,等. 共缩聚法制备氨基化介孔硅及其对毒死蜱的缓释性能[J]. 农药学学报,2016,18(5):643-649.
LIN Y S,ZHOU X H,ZHOU H J,et al. Slow-release performance of chlorpyrifos of an amino functionalized mesoporous silica prepared by the-condensation method[J]. Chinese Journal of Pesticide Science,2016,18(5):643-649.
[14] 郑海瑛,刘德坤,牟洪征,等. 溶剂挥发法制备甲氨基阿维菌素苯甲酸盐微球[J]. 农药学学报,2012,14(5):557-564.
ZHENG H Y,LIU D K,MOU H Z,et al. Preparation of emamection-benzoate microcapsules by solvent evaporation method[J]. Chinese Journal of Pesticide Science,2012,14(5):557-564.
[15] 邵文尧,何彩云,冯艳玲,等. 乳化-溶剂挥发法制备聚乳酸载药微球[J]. 功能材料,2015,46(3):3121-3126.
SHAO W Y,HE C Y,FENG Y L,et al. Make microspheres through emulsion-solvent evaporation method[J]. Functional Materials,2015,46(3):3121-3126.
[16] 张海龙,林建强. 乳化溶剂挥发法在微球制备中的应用[J]. 西北药学杂志,2007,22(2):3-4.
ZHANG H L,LIN J Q. Application of emulsification solvent volatile method in preparation of microspheres[J]. Northwest Pharmaceutical Journal,2007,22(2):3-4.
[17] 曹德勇. 毒死蜱的微胶囊化[D]. 天津:天津大学,2006.
CAO D Y. Microcapsules of chlorpyrifos [D]. Tianjin:Tianjin University,2006.
[18] 许艳玲,苏智扬,杨春强,等. 乙基纤维素/多效唑微胶囊的制备与表征[J]. 天津农学院学报,2011,18(3):28-30.
XU Y L,SU Z Y,YANG C Q,et al. Preparation and characterization of paclobutrazol microcapsules with ethyl cellulose [J]. Journal of Tianjin Agricultural University,2011,18(3):28-30.
Preparation and sustained release of chlorpyrifos/ethyl cellulose microcapsules
XU Hua,LIN Yueshun,ZHOU Hongjun,ZHOU Yiyu,CHEN Xi,ZHOU Xinhua
(Guangzhou Key Laboratory of Efficient Utilization of Agrochemicals,College of Chemistry and Chemical Engineering,Zhongkai University of Agriculture and Engineering,Guangzhou 510225,Guangdong,China)
Chlorpyrifos/ethyl cellulose microcapsules were prepared by mulsification-solvent evaporation method with the ethyl cellulose as wall material and the chlorpyrifos as model drug. The structures and morphologies of microcapsules,form of chlorpyrifos were characterized by FTIR,SEM and DSC. The effect of core material ratio,PVA concentration,PVA to SDS mass ratio and stirring speed on loading content(LC)and encapsulation efficiency(EE)were studied using single factor method. Besides,the effects of core material ratio and PVA concentration on sustained release of chlorpyrifos were also discussed. The results showed that chlorpyrifos/ethyl cellulose microcapsules had a more condensed spherical structure,and the crystalline chlorpyrifos was distributed in microcapsules. When the core material ratio was 2∶3,PVA concentration was 1.5%,the mass ratio of PVA∶SDS was 3∶2 and stirring speed was 1500 r/min,the LC and EE were better,which were 44.41% and 82.42%,respectively. Meanwhile,the microcapsules had good sustained release properties,and their releasing curves could be described by Korsmeyer-Peppas equation indicating that the drug release was controlled by Fick diffusion.
ethyl cellulose;chlorpyrifos;microcapsules;emulsification-solvent evaporation method;sustained release
TQ450.6
A
1000–6613(2017)12–4622–06
10.16085/j.issn.1000-6613. 2017-0472
2017-03-21;
2017-05-01。
广东省科技计划(2015A020209197,2015A020209185)、花都区科技计划(HD15CXY002)及广东省大学生创新创业训练计划(201611347048)项目。
徐华(1983—),男,博士。
周新华,教授,主要从事农药缓释剂的制备及其应用研究。E-mail:cexinhuazhou@ 163.com。

