共沸蒸馏法制备Ni/Al2O3催化剂及其肉桂醛加氢反应性能
秦跻龙,王非,蔡金鹏,胡建恒,刘雯雯,姜兴茂
共沸蒸馏法制备Ni/Al2O3催化剂及其肉桂醛加氢反应性能
秦跻龙1,王非1,蔡金鹏1,胡建恒1,刘雯雯1,姜兴茂1,2
(1常州大学石油化工学院,江苏常州 213164;2武汉工程大学化工与制药学院,湖北武汉 430073)
利用共沸蒸馏法制备了金属Ni高度分散的Ni/Al2O3催化剂,并利用X射线粉末衍射仪(XRD)、透射电子显微镜(TEM)和全自动比表面积和孔径分析仪(BET)对其进行了一系列表征。实验过程中,选用肉桂醛(CAL)加氢反应来考察该催化剂的催化性能。结果表明,共沸蒸馏法制备出的Ni/Al2O3催化剂较浸渍法而言,其金属Ni的粒径较小且高度分散,同时催化剂对肉桂醛加氢生成3-苯丙醛(HCAL)具有良好的催化效果。在反应温度为150℃、反应压力为2MPa、负载量为15%时,3-苯丙醛的产率高达77.24%。此外,该催化剂在循环使用了5次后3-苯丙醛的产率并未出现明显下降的趋势,通过循环过后的XRD和TEM表征显示其前后的数据并没有发生改变,这说明该催化剂具有良好的循环稳定性。
镍;三氧化二铝;共沸蒸馏法;肉桂醛;加氢
3-苯丙醛(HCAL)是一种重要的化工原料,广泛运用于各种香精的调配[1-2]。3-苯丙醛通常是由肉桂醛(CAL)加氢得到,选择肉桂醛加氢反应作为模型反应来研究催化剂的性能,无论是对反应理论的研究还是工业应用都有重要意义[3-7]。肉桂醛加氢反应通常有3种反应产物(反应过程见图1):①仅通过C==C键加氢生成3-苯丙醛;②仅通过C==O键加氢生成肉桂醇(COL);③通过C==C键和C==O键加氢生成3-苯丙醇(HCOL)[8]。
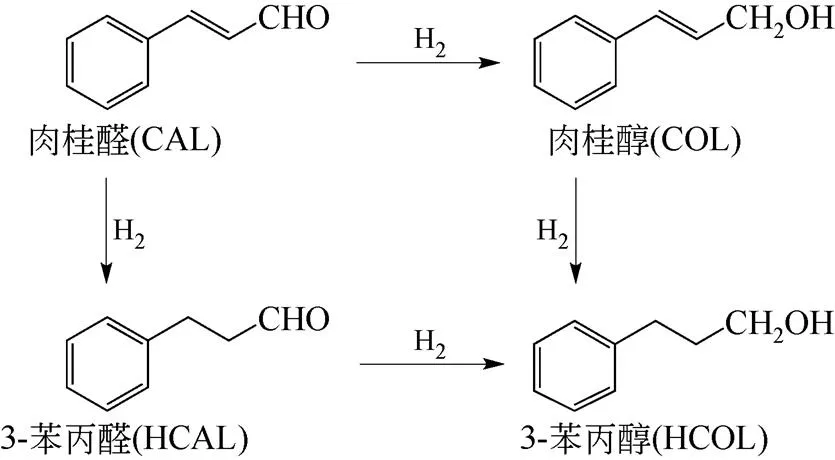
图1 肉桂醛加氢反应过程图
C==C键的键能为615kJ/mol,C==O键的键能为715kJ/mol,所以C==C键比C==O键加氢要容易得多[9]。为了提高肉桂醛的转化率和3-苯丙醛的选择性,科研工作者在催化剂的选取和制备方法上进行了很多尝试,如李辉等[10]成功制备出了Ni38.1Co26.3B35.6非晶态合金催化剂,肉桂醛的转化率可达到64.6%,3-苯丙醛的选择性为97.6%;韩晓祥等[11]在进行肉桂醛加氢反应时以PtNi/ZrO2作为催化剂,苯丙醛的收率可达62.8%;HAMMOUDEH等[12]系统地研究了Pd/SiO2催化剂在加入Sn作为助剂对肉桂醛加氢性能的影响,结果显示Sn的加入能够很好的提高3-苯丙醛的选择性。
根据相关文献报道,Ni基催化剂是一种常见廉价的加氢催化剂且对C==C键加氢具有较高的选择性,因此被广泛用于各种加氢反应中[13]。浸渍法是一种最简单也是最常用制备催化剂的方法。传统浸渍法制备的Ni基催化剂粒径不均一而且在后期高温煅烧的处理过程中金属Ni颗粒容易发生团聚现象,从而使得催化效果较为一般[14]。此外,浸渍法制备的催化剂常常在循环使用过程中容易出现活性物质流失,从而导致催化活性下降[15]。针对上述问题,本文作者利用共沸蒸馏法制备出了Ni/Al2O3催化剂,该方法的优点在于制备出的催化剂金属颗粒大小均一催化活性好,并且由于金属Ni被嵌入了Al2O3所形成的堆积结构中,使得其在循环过程中不易流失从而表现出良好的循环稳定性。
1 实验部分
1.1 主要试剂与仪器
六水合硝酸镍[Ni(NO3)2·6H2O]、十六烷基三甲基溴化铵(C19H42BrN)、苯(C6H6)、异丙醇铝(C9H21AlO3)、肉桂醛(C9H80)、无水乙醇(C2H6O),均为分析纯。X射线粉末衍射仪(D/max 2200PC型,日本理学),透射电子显微镜(JEM-2100型,日本株式会社);快速全自动比表面和孔径分析仪(Autosorb-iQ2-MP型,美国康塔仪器公司);气相色谱仪(XSP-GC950,上海分析仪器厂)。
1.2 催化剂的制备
催化剂的制备过程如图2所示,首先称取0.4328g的Ni(NO3)2·6H2O于三口烧瓶中,再向其中加入8mL水使其溶解。接着,加入0.7800g表面活性剂(C19H42BrN)和70mL的C6H6并加入转子。然后将加入药品的三口烧瓶放入恒温(70℃)油浴锅中,并开启搅拌功能使其一边加热一边搅拌形成油包水的微乳液。搅拌大约6h后,将油浴锅的温度升高到100℃,利用苯和水形成共沸物将先前加入的水慢慢蒸出。大约在搅拌3h后,直至分水器里的苯和水出现明显的分层且上层苯内不再含有水,三口烧瓶里的溶液颜色均一,再向三口烧瓶内加入异丙醇铝(2.3333g)继续加热搅拌。在持续搅拌一段时间后,将三口烧瓶中均一的溶液趁热加入水热釜中,然后将其放入180℃烘箱中保温12h。接着取出水热釜冷却至室温,并将其中的料液倒入烧杯中,在100℃下将苯蒸去。将得到的灰白色固体放入马弗炉550℃煅烧5h除去表面活性剂,最后将所得到的固体研磨在550℃下氢气还原5h即得到最终产物Ni/Al2O3催化剂。

图2 共沸蒸馏法制备Ni/Al2O3催化剂的示意图
1.3 肉桂醛加氢反应
催化剂的催化性能通过肉桂醛加氢反应来表征。在50mL高压反应釜中,称取0.1g Ni/Al2O3催化剂加入到1mL肉桂醛和20mL乙醇的混合溶液中。随后向反应釜中充入2MPa的氢气,调节并维持反应釜的温度至实验所需温度并且在快速搅拌的条件下进行反应。达到反应温度后,每30min取一次样,最后通过气相色谱来检测反应液中各组分的含量。
2 结果与讨论
2.1 XRD物相分析
2.1.1 不同方法制备催化剂的XRD表征
图3是用共沸蒸馏法制备的γ-Al2O3、15%Ni/Al2O3样品以及利用浸渍法制备出的15% Ni/ γ-Al2O3样品的XRD图谱。图3的γ-Al2O3样品的谱图分别在2为37.0°、45.5°、67.0°出峰,这与γ-Al2O3的(311)、(400)和(440)晶面相对应(JCPDS 10-0425);15%Ni/Al2O3样品分别在2为44.4°、51.8°、76.3°出峰,这与Ni的(111)、(200)、(220)晶面相对应(JCPDS 65-2865),由于该样品中的Al2O3为无定形氧化铝所以图谱中未出现γ-Al2O3的特征峰;而15% Ni/γ-Al2O3样品由于是利用浸渍法制备出来的,所以图谱中既出现γ-Al2O3的特征峰也会有金属Ni的特征峰。

图3 γ-Al2O3、15%Ni/Al2O3和15%Ni/γ-Al2O3样品的XRD
2.1.2 不同负载量的Ni/Al2O3催化剂的XRD表征
图4是利用共沸蒸馏法制备的不同负载量催化剂的XRD图。从图4中可以看出,在负载量为5%时,所制备出的催化剂样品XRD图谱中既出现了γ-Al2O3的特征峰也出现了金属Ni的特征峰,说明此时所制备出的催化剂为γ-Al2O3负载的金属Ni催化剂。而Ni的负载量在10%、15%和20%时γ-Al2O3的特征峰逐渐消失,只出现金属Ni的特征峰,这是由于共沸蒸馏法是在原位的基础上制备出的Ni/Al2O3催化剂,随着负载量的增加,导致了Al2O3的结晶度降低从而在高负载量时不出现γ-Al2O3的特征峰。同时,该现象也很好地解释了在图3中利用共沸蒸馏法所制备的催化剂样品XRD谱图上不出现γ-Al2O3的特征峰,而利用浸渍法所制备的催化剂样品的XRD图谱中出现γ-Al2O3特征峰的 原因。
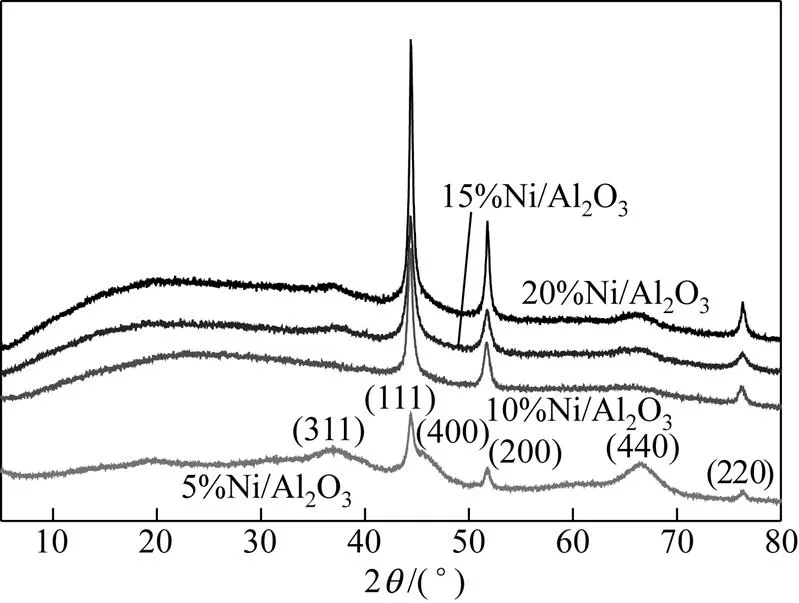
图4 共沸蒸馏法制备的不同负载量催化剂的XRD
2.2 不同方法制备催化剂的TEM表征
图5是共沸蒸馏法制备的5%Ni/γ-Al2O3样品的TEM[图5(a)、(b)]、15%Ni/Al2O3样品的TEM[图5(c)、(d)]和粒径分布图5(e)以及浸渍法制备的15%Ni/γ-Al2O3样品的TEM[图5(f)、(g)]。对比5%Ni/ γ-Al2O3样品与15%Ni/Al2O3样品的TEM图可知,负载量为5%的样品其Al2O3的结晶度明显高于负载量为15%的样品,因为此时所制备出的催化剂样品中的载体Al2O3为γ-Al2O3,这与2.1.2节中的XRD测试结果相对应。从图5(c)和5(d)中可以看出金属Ni颗粒被成功地负载到Al2O3上,大小均一且单分散性好。从图5(e)可以看出,用共沸蒸馏法制备的Ni/Al2O3催化剂金属颗粒具有较窄的粒径分布,Ni的平均粒径大约在10nm。而从图5(f)和图5(g)中可以看出浸渍法制备出的催化剂其金属Ni的尺寸大小不均一且颗粒较大,这是由于在浸渍法制备催化剂的过程中金属Ni分布不均匀且在高温还原的过程中金属Ni出现团聚现象导致。对比两种方法制备出来的催化剂的TEM图可以很明显地看出:利用共沸蒸馏法制备出来的催化剂较浸渍法而言,金属颗粒要小得多且单分散性好,大小也比较均匀。
2.3 N2吸脱附测试
图6分别是γ-Al2O3和15%Ni/Al2O3样品的氮气吸附脱附等温曲线及孔径分布图。从图6中可以看出γ-Al2O3和15%Ni/Al2O3样品均属于第Ⅲ类吸附等温曲线,其滞后环属于H3型,这说明所形成孔道都是由Al2O3颗粒堆积形成的夹缝孔。这与15%Ni/Al2O3样品的TEM表征结果一致,即金属Ni颗粒被嵌入到Al2O3所形成的堆积结构中且分散均匀。两种样品的比表面积、平均孔容和平均孔径相关数据见表1。

图5 共沸蒸馏法制备催化剂的TEM和粒径分布以及浸渍法制备催化剂的TEM

图6 γ-Al2O3和15 %Ni/Al2O3样品的N2吸附脱附等温曲线及孔径分布

表1 γ-Al2O3和15 %Ni/Al2O3样品的比表面、平均孔容和平均孔径
2.4 催化剂活性的评价
2.4.1 不同金属负载量对反应的影响
图7是在反应温度为150℃下不同负载量的Ni/Al2O3催化剂对肉桂醛加氢反应的转化率及各产物的产率情况。从图7可以看出在相同时间内,肉桂醛的转化率随着负载量的增加而增加,这是由于负载量的增加使得活性中心的数量增加,在相同时间内有更多的肉桂醛可以与金属Ni颗粒接触加氢反应使得转化率提高。图8是不同负载量催化剂对肉桂醛加氢的转化率以及产物3-苯丙醛的产率和选择性。对比4个不同负载量催化剂的反应结果可知,3-苯丙醛作为主要产物在负载量为20%时,其产率在反应1.5h后达到一个最高值78.39%,继续反应后3-苯丙醛开始转化为3-苯丙醇。在负载量为15%反应2h,苯丙醛的产率达到77.24%。考虑到经济性的原因,选取负载量为15%的样品作为研究对象继续考察不同温度下该催化剂对肉桂醛的加氢 效果。
2.4.2 不同温度对反应的影响
图9是负载量为15%的Ni/Al2O3催化剂在不同温度下对肉桂醛加氢的反应结果图。从图9中可以看出,随着反应温度的提高加快了反应速率,从而使得在相同时间内肉桂醛的转化率逐渐增加。对比不同温度下的反应结果可知,在低温(130℃和140℃)下肉桂醇和3-苯丙醇的产率较低且肉桂醇的产率高于3-苯丙醇,而在反应达到一定温度时(150℃和160℃)3-苯丙醇的产率开始大于肉桂醇的产率,这是因为:①在较高的温度下,反应速率增加使得肉桂醛在较短的时间内反应完全,生成的 3-苯丙醛和肉桂醇继续反应深度加氢生成3-苯丙醇;②高温下分子的热运动加剧使得刚刚加氢生成的肉桂醇和3-苯丙醛再次被吸附到活性物质表面继续加氢生成3-苯丙醇。图10是不同反应温度下催化剂对肉桂醛加氢的转化率以及产物3-苯丙醛的产率和选择性。结合图9和图10可知,在反应温度为160℃反应1.5h后3-苯丙醛的产率可达87.87%,但随后其产率开始急剧下降。为了使得反应不至于太过剧烈,同时又可获得一个比较高的3-苯丙醛产率,实验选取反应温度为150℃,反应时间为2h,继续研究该催化剂的循环性能。

图7 150℃下不同负载量Ni/Al2O3催化剂对肉桂醛加氢的转化率及各产物的产率

图8 不同负载量催化剂对肉桂醛加氢的转化率以及产物3-苯丙醛的产率和选择性
2.4.3 催化剂的循环性能测试
图11是15%Ni/Al2O3催化剂的循环使用性能图。从图中可知3-苯丙醛的产率在催化剂循环5次后并没有出现明显下降的趋势,且在循环5次之后其产率仍能够达到75.75%。这是由于金属Ni颗粒被嵌入了Al2O3中并分散均匀,使得催化剂在循环过程中活性中心并未出现团聚和流失的现象。结合图12可知,15%Ni/Al2O3催化剂在循环5次后其前后的XRD图谱并未出现较大的变化;从图13的TEM图可知,在循环5次后其金属Ni活性位并未出现大量流失的现象,且仍然良好的分散在Al2O3载体中。通过这些表征与对比,验证了利用共沸蒸馏法制备出的催化剂具有良好的循环稳定性。
3 结论
利用共沸蒸馏法成功制备了Ni/Al2O3催化剂。该催化剂具有粒径小、尺寸均一以及循环稳定性好等优点。在负载量为15%、反应温度为150℃、氢气压力为2MPa、反应2h条件下,3-苯丙醛的产率可以达到77.24%,且催化剂在循环到第5次3-苯丙醛的产率仍然能够达到75.75%。可见,这种简单实用的方法未来也能够用于其他负载型催化剂的 制备。
[1] YUAN Y,YAO S Y,WANG M N,et al. Recent progress in chemoselective hydrogenation of,-unsaturated aldehyde to unsaturated alcohol over nanomaterials[J]. Current Organic Chemistry,2013,17(4):400-413.
[2] BERTOLINI G R,CABELLO C I,MUÑOZ M,et al. Catalysts based on Rh(III)-hexamolybdate/γ-Al2O3and their application in the selective hydrogenation of cinnamaldehyde to hydrocinnamaldehyde [J]. Journal of Molecular Catalysis A:Chemical,2013,366:109-115.
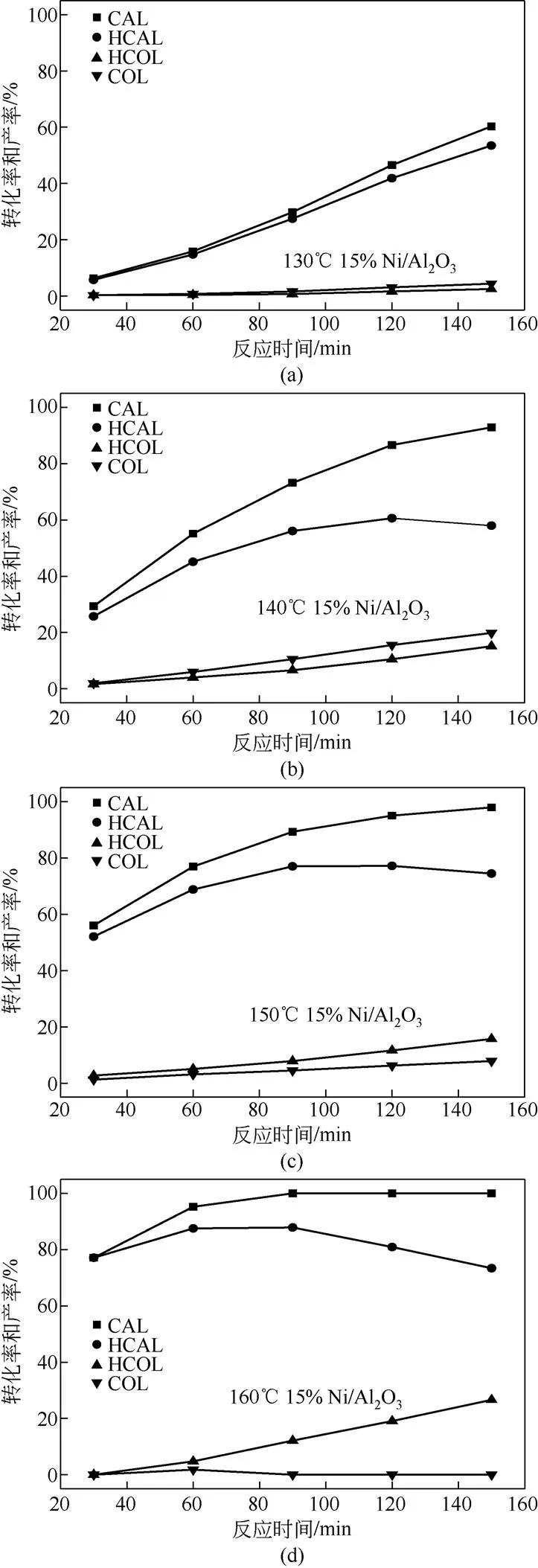
图9 不同反应温度下15%Ni/Al2O3催化剂对肉桂醛加氢的转化率及各产物的产率
[3] STANKOVICH S,DIKIN D A,DOMMETT G H B,et al. Graphene-based composite materials[J]. Nature,2006,442(7100):282-286.

图10 不同反应温度下催化剂对肉桂醛加氢的转化率以及产物3-苯丙醛的产率和选择性
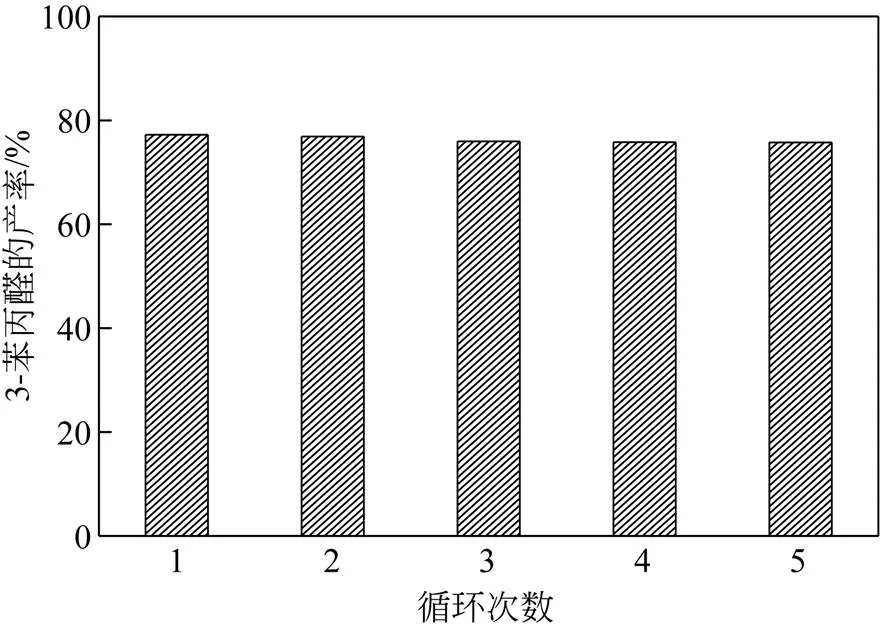
图11 15%Ni/Al2O3的循环性能

图12 循环5次后15%Ni/Al2O3样品和初始Ni/Al2O3样品的XRD
[4] GEIM A K,NOVOSELOV K S. The rise of graphene[J]. Nature Materials,2007,6(3):183-191.
[5] HE L,YU F J,LOU X B,et al. A novel gold-catalyzed chemoselective reduction of,-unsaturated aldehydes using CO and H2O as the hydrogen source[J]. Chemical Communications,2010,46(9):1553-1555.
[6] ZHU Y,QIAN H F,DRAKE B A,et al. Atomically precise Au25 (SR) 18 nanoparticles as catalysts for the selective hydrogenation of,-unsaturated ketones and aldehydes[J]. Angewandte Chemie,2010,122(7):1317-1320.
[7] MERLO A B,MACHADO B F,VETERE V,et al. PtSn/SiO2catalysts prepared by surface controlled reactions for the selective hydrogenation of cinnamaldehyde[J]. Applied Catalysis A:General,2010,383(1):43-49.

图13 循环5次后15%Ni/Al2O3样品的TEM
[8] DELBECQ F,SAUTET P. Competitive C==C and C==O adsorption of,-unsaturated aldehydes on Pt and Pd surfaces in relation with the selectivity of hydrogenation reactions: a theoretical approach[J]. Journal of Catalysis,1995,152(2):217-236.
[9] NOLLER H,LIN W M. Activity and selectivity of Ni-Cu/Al2O3catalysts for hydrogenation of crotonaldehyde and mechanism of hydrogenation[J]. Journal of Catalysis,1984,85(1):25-30.
[10] 李辉,马春景,李和兴. Ni-Co-B非晶态合金催化肉桂醛常压加氢制3-苯丙醛的研究[J]. 化学学报,2006,64(19):1947-1953.
LI H,MA C J,LI H X. Study on cinnamaldehyde hydrogenation to 3-phenylpropyl aldehydeat atmospheric pressure over Ni-Co-B amorphous alloys[J]. Acta Chimica Sinica,2006,64(19):1947-1953.
[11] 韩晓祥,周仁贤,郑小明. 负载Pt催化剂在卤代硝基苯氢化反应中的催化性能研究[J]. 复旦学报(自然科学版),2003,42(3):428-430.
HAN X X,ZHOU R X,ZHENG X M. Study on the hydrogenation properties of chloronitrobenzenne over supported platinum catalysts[J]. Journal of Fudan University(Natural Science),2003,42(3):428-430.
[12] HAMMOUDEH A,Mahmoud S. Selective hydrogenation of cinnamaldehyde over Pd/SiO2,catalysts: selectivity promotion by alloyed Sn[J]. Journal of Molecular Catalysis A:Chemical,2003,203(1/2):231-239.
[13] CHIN S Y,LIN F J,KO A N. Vapour phase hydrogenation of cinnamaldehyde over Ni/γ-Al2O3catalysts: interesting reaction network[J]. Catalysis Letters,2009,132(3/4):389-394.
[14] SATTERFIELD C N. 实用多相催化[M]. 庞礼,译. 北京:北京大学出版社,1990:98-102.
SATTERFIELD C N.Heterogeneous catalysis in practice[M]. Pang L,Trans. Beijing:Peking University Press,1990:98-102.
[15] WANG F,REN J,CAI Y L,et al. Palladium nanoparticles confined within ZSM-5 zeolite with enhanced stability for hydrogenation of-nitrophenol to-aminophenol[J]. Chemical Engineering Journal,2016,283:922-928.
Synthesis of Ni/Al2O3catalysts by azeotropic distillation for hydrogenation of cinnamaldehyde
QIN Jilong1,WANG Fei1,CAI Jinpeng1,HU Jianheng1,LIU Wenwen1,JIANG Xingmao1,2
(School of Petrochemical and Engineering,Changzhou University,Changzhou 213164,Jiangsu,China;2School of Chemical Engineering and Pharmacy,Wuhan Institute of Technology,Wuhan 430073,Hubei,China)
Highly dispersed nickel nanoparticles supported on Al2O3catalysts were successfully prepared by azeotropic distillation assisted fabrication. The physical and chemical properties of the catalysts were characterized by XRD,TEM,N2sorption and BJH pore size analyses. Liquid phase selective hydrogenation of cinnamaldehyde was selected as model reactions to study the catalytic behavior of Ni/Al2O3catalysts. In comparison with the catalysts prepared by impregnation,the catalysts prepared by azeotropic distillation assisted fabrication exhibited high activity in the hydrogenation reaction of cinnamaldehyde because of its smaller particle size and high dispersion. Yield of hydrocinnamic aldehyde was up to 77.24% at 150℃under 2 MPa(loading of nickel was 15%). In addition,Ni/Al2O3catalysts maintained high activity for hydrogenation of cinnamaldehyde to hydrocinnamic aldehyde after five consecutive runs and its XRD and TEM were the same as before,which revealed that as-prepared Ni/Al2O3catalysts had a remarkable recycling stability.
nickel;aluminium oxide;azeotropic distillation;cinnamaldehyde;hydrogenation
O643.3
A
1000–6613(2017)12–4468–07
10.16085/j.issn.1000-6613.2017-0220
2017-02-14;
2017-03-08。
国家自然科学基金项目(21503023,21373034,U1463210)。
秦跻龙(1990—),男,硕士研究生,研究方向为纳米材料的制备及应用研究。E-mail:13775610275@163.com。
王非,博士,讲师,研究方向为纳米催化剂的开发及应用研究。E-mail:wangfei@cczu.edu.cn。姜兴茂,博士,教授,研究方向为能源纳米材料。E-mail:jxm@cczu.edu.cn。

