论电解质溶液复习教学中的理性思维
应化德
浙江
论电解质溶液复习教学中的理性思维
应化德

本文的理性思维是指对电解质溶液的相关概念的理解方式,掌握电解质问题的相对处理方法、近似处理方法、抓主放次的处理方法,树立微粒观、守恒观、变化观、平衡观、离子相互牵制观,分析判断离子反应的反应顺序和定量关系,形成理解电解质溶液性质的相对思想和绝对思想等。只有这样,解决电解质溶液问题时才能游刃有余。
一、概念的理解方式
化学学科体系由基本概念和基本原理构成,概念的学习并不是把概念的定义记住,而是要理解概念的意义,知道其内涵与外延,并有相应的概念理解方式。人们对物质的认识有相对性,概念自身也可不断地发展与丰富。
电解质溶液涉及一些重要的概念,如电解质、非电解质、强弱电解质、pH、电离平衡常数、盐类水解等。下面谈电解质的理解方法:
电解质是在水溶液或熔融状态下能导电的化合物,首先电解质是化合物而非混合物,是能够导电的化合物,是在水溶液或熔融状态下导电,而非本身能导电。
电解质→化合物→能导电的→水溶液或熔融状态。
为进一步理解电解质的内涵和一些物质的性质,可以设计如下问题:
1.如何评价“电解质本身往往是不导电的”?
如HCl在气态、液态、固态时均不能导电,但它是电解质。NaCl在固体时不能导电,但熔融状态时能导电,物质三态的性质有所不同,离子化合物在常温时均为固态,所以上述描述相对正确。
2.NH3一般认为是非电解质,但实验证明,液态氨气与H2O的电导率接近,且与水一样也是双聚电离,问:
(1)NH3是电解质吗?
(根据信息,按定义判断是电解质)
(2)写出NH3的电离方程式。

(3)Na能与NH3发生反应,写出化学方程式。

3.液态的SO2也会发生与H2O相似的电离,写出电离方程式。

4.CH3CH2OH是非电解质,但工业上用乙醇和NaOH反应制备乙醇钠(需及时吸收生成的水),乙醇能与Na反应生成H2。
(1)上述事实说明乙醇有什么性质?(有电离的倾向,有酸的倾向)
(2)C2H5ONa水解溶液呈什么性?用离子方程式表示。

物质的分类,主要依据物质的组成和性质,人们在不同的阶段对物质性质的认识存在相对性。电解质与非电解质的区分也是相对的。
二、问题处理方式
1.相对处理方法
相对处理方法是指以某种物质的性质做参照物,与其互相对比,或两个过程相互抵消而得出结论的思维方法。
例如:在CH3COOH和CH3COONa的混合溶液中,c(Na+)与c(CH3COO-)的大小问题,可采用相对处理的方法,可以快速得出结论,分析如下:


当溶液pH<7时,可认为CH3COO-不水解而CH3COOH电离,水解被电离抵消,所以c(CH3COO-)>c(Na+)
当溶液pH=7时,可认为CH3COOH电离、CH3COO-水解都不产生,只有CH3COONa的电离,所以c(CH3COO-)=c(Na+)
当溶液pH>7时,可认为只有水解而CH3COOH不电离,所以c(CH3COO-) 再如:NH3·H2O的Kb=1.8×10-5,CH3COOH的Ka=1.8×10-5,CH3COONH4溶液呈中性,那么NH4NO2溶液、NH4CN溶液的酸碱性如何呢? 以CH3COONH4为参照物,由于HNO2的酸性(Ka=4.6×10-4)比CH3COOH强,而HCN的酸性(Ka=4.93×10-10)比CH3COOH弱,根据“越弱越水解,谁强呈谁性”,可知NH4NO2溶液为酸性,而NH4CN溶液为碱性。 2.近似处理方法 在弱电解质溶液电离的平衡体系中,数据的近似处理,使问题简化,容易得出结论,但要注意近似处理的条件范围。 例如:已知CH3COOH的电离平衡常数K=1.8×10-5,求0.1 mol·L-1的CH3COOH溶液中的c(H+),设电离度为α, c0 0 c-cαcαcα 经查α=0.0134,则1-α≈1(一般弱电解质的α都比较小、但在稀溶液中α会比较大) 同样可以推算pH=2的盐酸和醋酸的物质的量浓度分别为0.01 mol·L-1、5.56 mol·L-1,仅仅相差555倍,相同体积相同pH的HCl与CH3COOH溶液分别与足量的锌粒反应生成的H2相差555倍,让学生从感性认识上升到理性认识,理性认识更有说服力。 例如:(浙江高考2016年4月第30题节选) N2H4的水溶液呈弱碱性,室温下其电离常数K1≈1.0×10-6,则0.01 mol·L-1N2H4水溶液的pH等于________(忽略N2H4的二级电离和H2O的电离)。 分析NH3、N2H4、R-NH2的水溶液呈碱性的原因,氮原子上的孤电子对与水电离的氢离子形成配位键,电离出OH-。 1×10-4, 所以pH=10。 例如:求0.1 mol·L-1NH4Cl溶液中的c(H+)。 ≈7.5×10-7mol·L-1 例如:求CH3COOH和CH3COONa混合液为中性时,两者的浓度比。 分析:设CH3COOH和CH3COONa的浓度为c1、c2mol·L-1,c(H+)为xmol·L-1, c1c20 c1-xc2+xx 也就是当CH3COOH和CH3COONa混合液中,当两者浓度之比为1∶200时溶液接近中性,这对理解溶液的性质,量的关系有一定的化学意义。 所以CH3COOH与CH3COONa浓度比为1∶1时,溶液呈酸性,这是比较溶液离子浓度的前提。 3.抓大放小(抓主放次)的处理方法 抓大放小,分清主次的处理方法,可以快速比较溶液中粒子浓度的大小,快速近似地计算等。 例如:已知NaHSO3溶液呈现酸性,比较NaHSO3溶液中的粒子浓度大小。 ②方程式c(H2SO3)=c(OH-), 同样考虑水的电离③可得c(OH-)>c(H2SO3)。 所以离子浓度大小关系为 例如:N2H4易溶于水,是与氨相类似的弱碱,已知其常温下电离常数K1≈1.0×10-6,常温下,将0.2 mol·L-1N2H4·H2O与0.1 mol·L-1盐酸等体积混合(忽略体积变化),则此时溶液的pH等于___________(忽略N2H4的二级电离)。 分析:N2H4·H2O与盐酸反应后,N2H4·H2O与N2H5Cl的浓度均为0.05 mol·L-1,首先要判断该溶液是酸性还是碱性,酸性则以水解为主,而碱性则以电离为主,根据N2H4·H2O的K值与NH3·H2O的K值接近,可判断为碱性(NH3·H2O与NH4Cl为1∶1时,溶液为碱性迁移过来),则 0.05-x0.05+xx 所以pH=8。 以此类推,若HCN与NaCN 1∶1的溶液呈碱性,则以水解方程式近似计算。 1.微粒观、存在观 (浙江高考2017年4月第23题)25℃时,在含CH3COOH和CH3COO-的溶液中,CH3COOH和CH3COO-二者中各自所占的物质的量分数(α)随溶液pH变化的关系如图所示。下列说法不正确的是 ( ) A.在pH<4.76的溶液中,c(CH3COO-) B.在pH=7的溶液中,α(CH3COOH)=0,α(CH3COO-)=1.0 C.在pH>4.76的溶液中,c(CH3COO-)与c(OH-)之和可大于c(H+) D.在pH=4.76的溶液中加盐酸,α(CH3COOH)与α(CH3COO-)之和保持不变 点评:B项是错的,pH=7时,从图象上看,似乎α(CH3COOH)=0,α(CH3COO-)=1.0是对的,本题的考查学生的微粒观、存在观,尽管此时α(CH3COOH)很小,但不可能为0,高考第一次出现,有一定的隐蔽性。 2.守恒观 电解质溶液中存在电荷守恒、物料守恒、质子守恒等。 3.变化观、平衡移动观 量变引起质变,如CH3COOH与CH3COONa的两者量的比例变化导致溶液酸碱性的变化。多元弱酸的电离逐级减弱,如H2SO3的电离: 4.离子相互牵制观 同一离子同时牵制几个平衡,如在HF、CH3COOH的水解溶液中,c(H+)同时制约HF、CH3COOH、H2O的电离平衡。 溶液中c(H+)=c(F-)+c(CH3COO-)+c(OH-),溶液的氢离子的总浓度同时制约三个平衡,有 弱电解质电离的强弱,决定相应阳离子、酸根离子的水解程度,也影响多离子反应的反应顺序。 弱电解质的分步电离→水解程度大小→离子反应顺序,如: 碳酸电离: 碳酸钠水解: 向碳酸钠与碳酸氢钠混合液滴加盐酸的反应顺序: 理解反应先后的本质原因,掌握判断的方法。如在CH3COOH和HCl的混合溶液中加入NaOH溶液,HCl先反应,反应本质是H+与OH-的中和反应,若CH3COOH先与NaOH反应生成CH3COONa,HCl又会与CH3COONa反应生成CH3COOH。反应顺序、定量关系是高考考查主要思想之一。下列化学反应都要考虑顺序: ①CH3COOH、HCl(HX、HY)的混合液中滴加NaOH溶液 ②NaOH、Ca(OH)2混合溶液中通入CO2 ③Na2CO3、NaHCO3混合溶液中滴加盐酸 ④NH4Cl、AlCl3混合溶液中滴加NaOH溶液 ⑤HCl、MgCl2、AlCl3混合溶液中滴加NaOH溶液 ⑦NH4Fe(SO4)2、NH4Al(SO4)2溶液中分别滴入Ba(OH)2溶液 ⑧NaHCO3与Ca(OH)2溶液相互滴加 (浙江高考2013年第12题)25℃时,用浓度为0.100 0 mol·L-1的NaOH溶液滴定20.00 mL浓度均为0.100 0 mol·L-1的三种酸HX、HY、HZ,滴定曲线如图所示。下列说法正确的是 ( ) A.在相同温度下,同浓度的三种酸溶液的导电能力顺序:HZ B.根据滴定曲线,可得Ka(HY)≈10-5 C.将上述HX、HY溶液等体积混合后,用NaOH溶液滴定至HX恰好完全反应时:c(X-)>c(Y-)>c(OH-)>c(H+) 此题考查强弱酸的判断,pH的变化,离子浓度的变化,守恒思想的应用,K值的求算,c(H+)的表达式。此题渗透K值的相对处理、反应顺序、离子的相互牵制等学科思想。 浙江省金华市外国语学校)






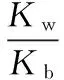





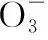

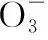

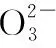
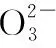
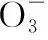
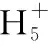

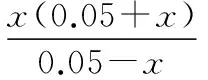
三、电解质溶液学科思想或观点


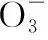

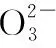



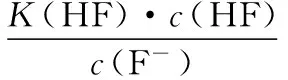

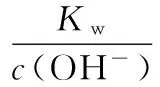
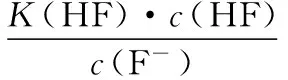
四、电解质溶液中的离子反应





五、典型试题解析