“御敌于国门之外”
——病毒入侵抑制剂的研究进展
姜世勃 苏 珊 夏 帅 邹 鹏 陆 路
(复旦大学基础医学院病原生物系,复旦大学医学分子病毒学教育部/卫计委重点实验室 上海 200032)

专家简介姜世勃,教授,博导,国家 “千人计划” 特聘专家,复旦大学病原微生物研究所所长。毕业于第一和第四军医大学并获得硕士和博士学位,1987—1990年在美国纽约洛克菲勒大学进修学习和博士后训练,1990—2010年在纽约血液中心LFK研究所先后担任助理研究员、副研究员、研究员和研究室主任。曾是武汉大学、复旦大学、广州第一军医大学、西安第四军医大学、中国军事医学科学院客座教授,中国科学院海外评审专家、清华大学高级访问学者、上海计划生育研究所特聘顾问、南方医科大学抗病毒中心荣誉主任和特聘教授。2010年10月入选国家 “千人计划” ,回国担任复旦大学上海医学院医学分子病毒学教育部/卫生部重点实验室教授。
从事抗病毒 (HIV、SARS-CoV、MERS-CoV、RSV、HPV、流感病毒、埃博拉病毒、寨卡病毒等) 药物及疫苗研究多年,是国际上最早参与研发预防HIV性传播“杀微生物剂”的研究人员之一。20世纪90年代初发现了第一个抗HIV的C-多肽,发明专利转让给美国Trimeris和罗氏制药公司,用于开发国际上第一个抗HIV多肽药物——恩夫韦肽 (Enfuvirtide,又名T20)。该发现开辟了研发病毒融合/入侵抑制剂和抗病毒多肽药物的全新领域。在此基础上,带领团队又先后发现了抗SARS-CoV、MERS-CoV和寨卡病毒的多肽,并研发出最为安全、有效的SARS和MERS候选亚单位疫苗。最近,又在中国成功开发上市一个可防控HPV感染、降低宫颈癌发生率的JB01生物蛋白,现已在全国500多家三甲医院使用,年销售量2~3亿元人民币。
已发表385篇SCI论文和117篇非SCI论文,累计影响因子1 881 (篇均4.9),其中包括Nature、NatMed、NatCommun、NatRevMicrobiol、Lancet、Cell、JExpMed、ProcNatlAcadSciUSA等,被引用11 000多次,h指数57。已申请美国专利32项 (授权21项) 和中国及PCT专利37项 (授权7项),作为PI获得美国NIH研究基金项目9项2 000多万美元、中国国家和省部级研究基金项目9项2 000多万元人民币,在30多个国家作学术报告200多场。
国际抗病毒研究学会、国际艾滋病学会、美国微生物学会、美洲华人生物科学学会会员,国际顶尖医学杂志TheLancet编辑顾问 (editorial consultant),PLoSOne科学编辑,EmergMicrobInfect、Retrovirology、PLoSOne、BiochimBiophysActa、MicrobInfect杂志编委,为60多家英文杂志 (如Science、SciTransMed、NatMed、Lancet等) 审稿,美国健康研究院 (NIH)、香港研究资助局 (RGC)、中国自然科学基金会 (NSFC)、加拿大健康研究院 (CIHR)、新加坡科学技术研究局 (A*STAR) 评审委员。
上海医学院创建90周年寄语先驱汤飞凡,后任林飞卿;勇者闻玉梅,灭毒为人民;主任袁正宏,带队向前进;分子病毒室,日渐更兴盛;本人受感召,归国为使命;入侵抑制剂,突破加创新;御敌国门外,抗击传染病。
“御敌于国门之外”
——病毒入侵抑制剂的研究进展
姜世勃△苏 珊 夏 帅 邹 鹏 陆 路
(复旦大学基础医学院病原生物系,复旦大学医学分子病毒学教育部/卫计委重点实验室 上海 200032)
25年前,我们在国际上开辟了研发人类免疫缺陷病毒(human immunodeficiency virus,HIV)融合/入侵抑制剂和抗HIV多肽药物的全新领域。近6年来,我们在HIV、中东呼吸综合征冠状病毒(Middle East respiratory syndrome coronavirus,MERS-CoV)、埃博拉病毒(Ebola virus,EBOV)和寨卡病毒(Zika virus,ZIKV)入侵抑制剂的研发工作中取得了一系列重要研究成果。本文概要性地综述了相关高致病性病毒入侵抑制剂的研究进展。
高致病性病毒; 病毒入侵抑制剂; 病毒灭活剂
病毒是一类只能在有机体活细胞内完成自身复制的病原微生物。由于病毒不具有完整的细胞结构,无法通过自体的分裂来完成自身增殖,所以其只能寄生在宿主细胞内利用宿主细胞的代谢系统来完成自身的扩增。所以病毒的完整生命周期包括进入宿主细胞并完成复制的整个过程,大致分为如下步骤:附着 → 入侵 → 脱壳 → 合成 → 组装 →释放。
现有的主要抗病毒药物作用在病毒生命周期的各个阶段。其中,入侵抑制剂作用在较早的病毒黏附及入侵阶段,也称为进入抑制剂(entry inhibitor)。病毒通过特异性结合靶细胞表面的受体附着到宿主细胞表面,然后通过受体介导的内吞或者膜融合途径进入靶细胞(图1)。相应的,入侵抑制剂主要分为黏附抑制剂(attachment inhibitors),受体/共受体拮抗剂(receptor/coreceptor antagonists),融合抑制剂(fusion inhibitors)和病毒灭活剂(virus inactivators),分别阻断病毒与宿主靶细胞的黏附,与受体/共受体的结合,与靶细胞膜融合,及在细胞外灭活病毒。病毒除了通过靶细胞膜进入靶细胞内复制,也能通过感染细胞传递到相邻的未感染细胞,该途径同样由病毒包膜蛋白介导,所以入侵抑制剂也能阻断这一传播途径,在这个方面相较于其他抗病毒药物有明显优势。入侵抑制剂包括多肽,抗体,修饰蛋白及化学小分子,各有其优势和缺点。

A:Virus enters the target cell by receptor-mediated endosomal membrane fusion;B:Virus enters target cell by receptor-mediated plasma membrane fusion.
图1病毒进入靶细胞过程
Fig1Entryprocessofavirus
与其他入侵抑制剂的作用机制不同,病毒灭活剂可直接作用于人体内游离的病毒颗粒,使病毒包膜蛋白发生构象变化,使得病毒丧失感染靶细胞的能力;或者直接破坏病毒膜的完整性,导致病毒基因组释放,失去活性。
由于病毒灭活剂能直接地灭活游离病毒颗粒,而其他入侵抑制剂能阻断病毒进入细胞,它们均能保护细胞不受病毒感染。其相较于其他必须进入宿主细胞内抑制病毒复制的抗病毒药物而言,能更好地保护宿主细胞的功能以及活性,避免病毒进入细胞后整合到人类基因组,并减少对细胞的毒性作用。所以,如果能够开发出抗病毒活性强,成药性好的病毒入侵抑制剂,将能够更有效地防控病毒对宿主细胞的感染,真正做到“拒敌于国门之外”。
人类免疫缺陷病毒(HIV)入侵抑制剂和灭活剂人类免疫缺陷病毒(human immunodeficiency virus,HIV)是包含两条相同正链RNA的逆转录病毒,通过其包膜蛋白介导的膜融合进入宿主细胞内。该过程中,HIV包膜蛋白亚单位gp120首先与靶细胞上的受体及共受体反应,导致 gp41亚单位暴露。暴露后的gp41 N末端的融合多肽(FP)插入靶细胞膜,其N端七重复螺旋序列(N-terminal heptad repeats,NHR)和C端七重复螺旋序列(C-terminal heptad repeats,CHR)相互反应,形成发夹样六聚体结构(six helix bundle,6-HB)[1],拉近病毒与靶细胞发生膜融合。HIV入侵抑制剂即作用在这个阶段,现在美国食品药品管理局(FDA)已批准上市的HIV入侵抑制剂包括融合抑制剂——恩夫韦肽(enfuvirtide,又叫T20)和CCR5拮抗剂——马拉维若(maroviroc)。其中,T20能与gp41的NHR区结合,阻断6-HB的形成,抑制HIV与靶细胞的膜融合进程(图2)。

Binding of the HIV-1 gp120 to the receptor and co-receptor triggers the exposure of gp41.An HIV-1 fusion inhibitor can binds to the exposed gp41 to block the 6-HB formation,thus inhibiting HIV-1 entry into the target cell.
图2HIV-1融合抑制剂作用机制
Fig2MechanismofactionofHIVfusioninhibitors
多肽类药物 1990年初,姜世勃及同事在国际上首次发现来源于HIV-1 gp41蛋白CHR结构域的多肽(C-多肽)-- SJ-2176能有效抑制HIV感染[2-3],其发明专利(USP5,444,044)转让给美国Trimeris药物公司,该公司与罗氏制药公司合作,开发出国际上第一个能抑制HIV进入靶细胞的多肽药物T20。该药物被誉为是艾滋病药物研究史上的一个里程碑,其出现开创了国际病毒入侵抑制剂和抗病毒多肽药物的新领域。T20在临床治疗上表现出了较好的效果,特别是对于逆转录酶抑制剂和蛋白酶抑制剂产生抗性的艾滋病患者,具有显著的疗效。但由于T20半衰期较短,活性较低,需每日皮下注射两次,导致注射局部反应重及费用高。而且,T20在临床使用久了以后易诱导HIV耐药毒株的产生。因此,对T20药物的改造及新型同类药物的设计成为该领域研究的主要方向。我们团队在该方面也做了大量的工作,发现了多种更高效和更长效的多肽类HIV入侵抑制剂。
首先,为了改造T20,使其活性提升,我们对T20的作用机制开展了更深入的研究。我们发现T20与大部分C多肽不同,它需要借助脂质结合结构域(lipid binding domain,LBD)与细胞膜作用后才能有效结合到gp41的NHR区,进而阻断6-HB形成和抑制病毒与细胞膜的融合[4]。而其他C-多肽(如C34)不含有LBD,但含有可与NHR上的口袋形成区(pocket forming domain,PFD)密切结合的口袋结合区(pocket binding domain,PBD),所以这些C-多肽可以直接与NHR结合形成更稳定的6-HB,更有效地阻止病毒6-HB的形成,从而拥有比T20更好的抑制活性[5]。因此,我们将注意力更加聚焦于包含有PBD的C-多肽的研究上。
基于C34序列,引入更多带电荷的氨基酸残基来稳定螺旋结构而设计出的西夫韦肽(Sifuvirtide)比T20具有更强的抗抗HIV活性,且对T20抗性株也有显著的抑制效果[6]。该药物目前已在国内通过了临床I期和II期试验。同时,我们还发现包含了C34上游(621-627:QIWNNMT)序列的CP621-652多肽拥有更好的抗HIV感染的活性[7]。进一步引入增加其α螺旋性的E-K盐桥突变后,得到的CP32M多肽具有低纳摩尔级别的抑制HIV融合和进入靶细胞的活性[8]。
进一步分析QIWNNMT序列与NHR的反应,何玉先等发现(626)MT(627)序列能形成钩状结构,将该M-T钩子加到C-多肽的N末端后,可有效地提高这些C-多肽的HIV抑制活性[9-10]。最近,我们设计了基于IDL序列的另一类钩状结构,将其加到C-多肽的C末端后也能显著提升C-多肽的抑制活性。同时将M-T钩子和IDL钩子分别加到一个C多肽N和C末端,可以更显著提升该C多肽的抗HIV-1活性,对一些HIV-1临床株的半数抑制浓度(IC50)能达到0.1纳摩尔[11]。
此外,我们还对多肽的设计模型进行了深入的研究,发现以往对于C-多肽上的点突变位点选择均是基于6-HB经典螺旋模型,但是该模型没有考虑氢键、盐桥和氨基酸侧链的作用,有一定的局限性。所以,我们利用已解析的多个6-HB晶体结构分析了CHR上每个残基对于结合NHR的作用,提出了NHR-CHR-NHR新模型,将参与螺旋模型形成的氨基酸残基从29%提高到76%,使设计突变的选择范围大大提高,同时基于新模型设计的C34突变体多肽也较C34有更好的抗HIV-1活性[12]。
同时,我们还发现,截至目前大部分C-多肽的设计均是基于CHR的天然序列,所以部分HIV感染者体内预先存在的靶向CHR的抗体将拮抗C-多肽的抗HIV-1活性。因此,我们基于人工多肽模板5HRu,结合MT序列设计了多肽AP1、AP2和AP3。其中AP3效果最好,较T20半衰期更长,且血清中预存的抗HIV-1抗体不但没有削弱其活性,反而增强了其抗病毒的效果[13]。我们的研究还证明将胆固醇分子连接到人工多肽的N-末端可明显提高该人工多肽的抗病毒活性[14]。
除了以上手段,还有研究者使用了非天然氨基酸[15-16]、酯化肽[14,17-18]以及氨基酸定点共价交联[19]等手段来提升C-多肽的性能(表1),并获得了多种高活性或具有显著优势的C-多肽抑制剂。
在联用策略方面,我们还发现虽然C-多肽均靶向gp41 NHR,但第一代融合抑制剂T20和第二代融合抑制剂T1144或者西夫韦肽联合使用时,均具有很好的协同作用效果,且对T20耐受株也有效。这一研究成果也为临床联合使用不同的HIV融合抑制剂提供了依据[20]。
除了C-多肽的研究,我们也开展了来源于gp41 NHR区的N-多肽的研究工作。目前,学界大多数研究都集中于来源于gp41 CHR区的C-多肽,因为NHR来源的序列疏水性强,在中性溶液中极易发生聚集沉降,大大影响了其抑制活性。我们利用T4 fibritin三聚域(Fd)构建了NHR三聚体,大大提高了N-多肽的水溶性和抗HIV-1活性[21],为设计基于N-多肽的抗HIV药物提供了新的思路。
小分子类药物 相较于多肽类药物,小分子药物成本低,且可以口服,因此也成为入侵抑制剂设计的重要方向之一。本团队在国际上首次发现了ADS-J1对HIV-1有低毫摩尔级别的抑制作用[22],并对其机制进行了深入的研究,发现其可阻断6-HB的形成和HIV-1包膜蛋白Env介导的膜融合,证明了研发小分子类入侵抑制剂的可能。

表1 多肽类HIV入侵抑制剂的修饰策略Tab 1 Strategies to optimize the peptide-based HIV entry inhibitors
本团队还利用在之前研究所发现的能特异性识别6-HB结构的单克隆抗体-NC-1,建立起了可高通量筛选具有阻断6-HB形成活性的HIV入侵抑制剂筛选模型,并利用该模型筛选了大量的小分子入侵抑制剂。其中包括NB-2和NB-64[23-24],它们可结合到NHR的疏水沟槽中,对各型HIV均有较好的抑制作用。进一步优化NB-64得到了A12,GLS-22,GLS-23,NB-206以及NB206的衍生物11b,11d,11a,121,12m,5f和5g[25-26]等,其中一些抗HIV-1活性得以显著提升,具有开发成为药物的潜力。并且,为了得到活性和耐受性都更好的药物,我们还设计了多肽与小分子化合物相结合的新型药物。我们将人工设计的四重复多肽-m4HR与小分子pssm结合,得到了具有低毫摩尔级别抗HIV-1活性的新型融合抑制剂[14],其在入侵抑制剂的设计和作用机制研究上具有重要意义。
HIV灭活剂 现有的抗HIV临床药物均是作用于HIV附着到靶细胞表面或者是进入HIV后各个阶段的,均不能在没有靶细胞存在的情况下,直接灭活游离HIV的病毒颗粒,使其失去感染活性。可溶性CD4(sCD4)在体外实验中显示在较高浓度的情况下,具有一定灭活HIV病毒的能力,但体内研究发现其在较低浓度下还会促进一些HIV-1亚型的感染,因此sCD4较难作为HIV灭活剂来进行开发。在仔细分析了sCD4的作用机制后,我们以创新的思路构建了一个新型的HIV灭活剂,将CD4的D1D2结构域和T1144多肽串联在一起,命名为2DLT[27]。D1D2结构域结合gp120上的CD4结构区后,T1144能紧接着结合到D1D2所诱导的gp41融合中间态上的NHR区,从而使HIV-1 Env发生不可逆转的构象变化,成为融合后构象,使HIV病毒颗粒丧失了感染力,并且还解除了sCD4促进HIV感染的作用(图3)。通过进一步的研究,我们还发现,2DLT不但单独使用就有较高的抑制活性,而且其与核苷类逆转录酶抑制剂以及非核苷类逆转录酶抑制剂联合使用还具有显著的协同效应[28],有潜力加入到“高效抗逆转录病毒疗法(HAART)”中,来提升各类药物的抗病毒活性及抗变异。我们最近的研究证明将C-多肽(如T20,T1144,或SFT)与作用于gp120的双特异性抗体复合物——4Dm2m 合用可大大提高4Dm2m对HIV-1的灭活作用[29]。

A:T1144 alone can bind to gp41 after gp120 interacts with the receptor and co-receptor,thus blocking the membrane fusion process;B:2D in 2DLT binds to HIV-1 gp120,triggering the exposure of gp41.T1144 in 2DLT then interacts with gp41,resulting in the inactivation of the virion.
图3HIV-1灭活剂2DLT作用机制示意图
Fig3MechanismofactionofHIVinactivator-2DLT
严重急性呼吸综合征冠状病毒(SARS-CoV)入侵抑制剂冠状病毒是一类有包膜的单股正链RNA病毒。其中,SARS-CoV(severe acute respiratory syndrome coronavirus)及中东呼吸综合征冠状病毒(Middle East respiratory syndrome coronavirus,MERS-CoV)是感染人类并对人高致病性的冠状病毒,对人类的生命健康带来了严重威胁。冠状病毒的感染机制与HIV-1类似,其包膜蛋白(S蛋白)在介导感染的过程发挥着重要作用[30-31]。近年来,本团队所研发的靶向于S蛋白的多肽和抗体可有效抑制病毒的进入,具有很好的抗病毒效果。
2002年,SARS-CoV于广州首次爆发,导致8 000多人的感染,并具有近10%的死亡率[31]。在SARS-CoV疫情的传播过程中,果子狸是其中间宿主,而菊头蝙蝠是其原始宿主。SARS-CoV可从果子狸等中间宿主直接传播到人类,但是否存在由蝙蝠直接传播到人类的可能还不是很清楚[32](图4)。在抗SARS-CoV的入侵抑制剂研究方面,本团队于2004年成功地分析出SARS-CoV S蛋白中七肽重复区域的具体特征,发现分别源自于HR1和HR2的多肽CP-1和NP-1,相互作用下可形成六螺旋结构,并且多肽CP-1可有效地抑制SARS-CoV的融合进入过程,具有很好的抗SARS-CoV活性[33]。在针对S蛋白抗体类入侵抑制剂的研发方面,也取得了显著的进展。我们发现源自于S蛋白受体结合域(receptor-binding domain,RBD)的重组蛋白,在动物体内可诱导产生高效价的中和抗体,我们从中分离出27株鼠源单克隆抗体,其中25株能识别SARS-CoV RBD中不同空间构型中和表位的单抗具有很好的广谱SARS-CoV中和活性[34]。同样,Dimitrov等与我们合作在抗体库中筛选出针对于SARS-CoV RBD的全人源单克隆抗体m396,具有高效并且广谱的中和活性[35]。这些单克隆抗体的发现进一步丰富了抗SARS-CoV 的入侵抑制剂种类[31]。
中东呼吸综合征冠状病毒(MERS-CoV)入侵抑制剂2012年,中东地区首次爆发了新型人感染冠状病毒MERS-CoV。流行病学表明,蝙蝠是其自然宿主,而单峰骆驼(dromedary)则可能是其中间宿主。目前已有直接证据证明MERS-CoV的“骆驼-人”的传播途径,但是否存在“蝙蝠-人”的直接传播途径,还有待进一步研究(图5)[32]。
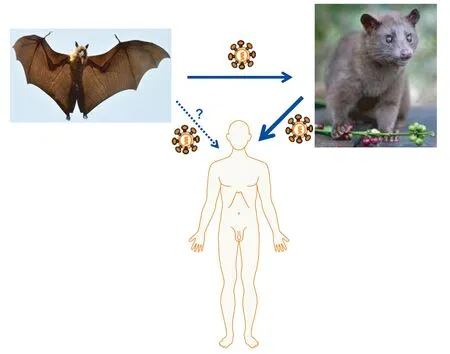
The horseshoe bat is the natural reservoir of SARS-CoV,while the palm civet is its intermediate reservoir.The civet-to-human transmission of SARS-CoV has been confirmed,but it is still unclear whether MERS-CoV can be transmitted directly from bat to human.
图4SARS-CoV传播途径
Fig4TransmissionpathwayofSARS-CoV

The fruit bat is the natural reservoir of MERS-CoV,while the dromedary camel is its intermediate reservoir.The camel-to-human transmission of MERS-CoV has been confirmed,but it is still unclear whether MERS-CoV can be transmitted directly from bat to human.
图5MERS-CoV传播途径
Fig5TransmissionpathwayofMERS-CoV
MERS-CoV疫情爆发后,本团队快速地建立起MERS-CoV假病毒系统和细胞-细胞融合系统,为后续的MERS-CoV入侵抑制剂的研发、活性评估及机制研究奠定了重要基础[36-37]。同时,我们成功地解析出MERS-CoV S2 的六螺旋结构,并根据晶体结构设计出抗MERS-CoV的多肽类入侵抑制剂HR2P,发现该多肽能非常有效地抑制MERS-CoV S蛋白介导的膜融合及假病毒和活病毒的感染。通过对HR2P序列的优化,获得优化多肽HR2P-M2,后者的水溶性、稳定性及抗病毒活性都有显著提高[36]。多肽HR2P-M2通过鼻道给药,在含有hDPP4基因的重组腺病毒Ad5构建的Ad5-hDPP4小鼠和hDPP4转基因(hDPP4-Tg)小鼠中均显示出非常好的保护效果[36,38-39]。另外,根据晶体结构提示,在其六螺旋的N端潜在一个疏水性口袋,针对该结构,在抗MERS-CoV多肽M0的N端添加“EAN”序列,可显著地提高M0多肽的抗病毒活性,也为针对于其他I型包膜病毒的多肽类入侵抑制剂的设计和优化提供了新思路[11]。同时我们还发现将MERS-CoV S蛋白中RBD的截断体(aa377-588)与IgG Fc fragment (S377-588-Fc)融合表达后,所获得的重组蛋白可有效地与受体DPP4结合,并具有竞争性抑制MERS-CoV进入靶细胞的效果,表明该重组蛋白可开发成为蛋白类MERS-CoV入侵抑制剂。另外,与SARS-CoV的RBD性质的类似[30-31,34-35],该重组蛋白含有关键中和位点,可在动物体内诱生大量高效价的中和抗体,可直接阻断MERS-CoV 的RBD与受体的结合,因此可开发成安全有效的抗MERS疫苗[40-41]。在可抑制MERS-CoV进入靶细胞的抗体研发方面,我们也取得了很大的进展。使用MERS-CoV 的RBD免疫小鼠获得一个鼠源单克隆中和抗体Mermab1,可有效地阻止MERS-CoV与受体的结合及MERS-CoV的入侵过程[42]。此外,我们与Dimitrov合作,利用其超大容量噬菌体全人源抗体库筛选出一系列针对MERS-CoV RBD的全人源抗体单克隆抗体,其中的m336具有超高效价的MERS-CoV中和活性,对MERS-CoV假病毒和活病毒半数中和浓度分别为 0.005和0.07 μg/mL[43],该抗体在兔子和hDPP4-Tg小鼠体内具有很好的保护效果[44-45]。另外,该抗体属于人的类胚系抗体(germline-like antibody),具有对人免疫原性极低的优点,因而,在防治MERS-CoV感染方面具有更好的应用前景[44,46]。
埃博拉病毒(EBOV)入侵抑制剂EBOV(Ebola Virus)属丝状病毒科,分为5个亚种,分别为扎伊尔型、苏丹型、本迪布焦型、科特迪瓦型及雷斯顿型[47]。EBOV是造成埃博拉病毒病(Ebola virus disease,EVD)的病原体,埃博拉病的患者通常死于严重的多器官衰竭以及系统性感染造成的休克[48]。
EBOV主要是通过与含有高浓度病毒的患者体液接触后发生传播[49]。EBOV可在 EVD 幸存者的精液中持续存活数月[50],表明EBOV可通过性传播[51]以及EVD生还者精液中长期存活的EBOV可引起新的EVD爆发。
截至目前,还没有针对EBOV的有效药物或者疫苗被批准上市。ZMapp是混合了几种针对EBOV包膜蛋白抗体的联合制剂[52]。 2014年,ZMapp虽然还处于动物试验阶段,但该抗体联合制剂在西非的EBOV爆发流行中被成功地用于少数几个EVD患者的治疗[53]。 2016年,ZMapp临床试验完成。虽然证明ZMapp 对于EVD的治疗有一些效果,但远未达到其预测的功效[54]。此外,Zmapp仅能中和扎伊尔型EBOV,对其他四型EBOV不能提供保护作用[55]。
本团队在以前的研究中发现酸酐化修饰蛋白对一些病毒,如HIV[56]、HPV[57]等具有很好的抑制作用。于是我们设计并表达了一系列酸酐化修饰蛋白,发现3-羟基苯二甲酸酐修饰的人血清白蛋白(HP-HSA)对表达扎伊尔型和苏丹型EBOV包膜蛋白的假病毒均具有较高的抑制活性,半数抑制浓度(IC50)达到了纳摩尔水平,甚至比EBOV中和抗体MIL77-2 (ZMapp的成分之一)活性更高[58]。更重要的是,HP-HSA在45 ℃储存8周后,依然保持良好的抗病毒活性。与抗体需要冷链运输及高生产费用相比,该酸酐化蛋白更适合在热带和亚热带的发展中国家(特别是EBOV流行地区)使用。我们发现HP-HSA与MIL77-2还具有协同作用的效果,使得该蛋白既能单使用,也可与其他抗EBOV的药物联合使用。此外,HP-HSA还可被开发成为阻断EBOV性传播的杀微生物剂,在生殖道局部使用防控EBOV的性传播。
寨卡病毒(ZIKV)入侵抑制剂ZIKV(Zika Virus)是一种蚊媒传播病毒,与登革病毒(Dengue Virus,DENV)、黄热病病毒(Yellow Fever Virus,YFV)和西尼罗病毒(West Nile Virus,WNV)同属于黄病毒科家族成员。2007年之前,ZIKV仅偶尔在亚洲和非洲的局部地区造成零星感染。2007年后,人感染ZIKV病例逐渐增多。本次ZIKV大爆发始于巴西,并迅速传播到美洲、非洲和亚洲的84个国家和地区[59]。ZIKV感染能损伤神经系统,引起包括小头症在内的严重的先天性脑发育障碍[60-62](图6A),并能导致吉兰-巴雷综合征(Guillain-Barré syndrome)[63-64]。研究还表明ZIKV感染能造成雄性生殖系统损伤[65-66]。
寨卡病毒为具有囊膜的单股正链RNA病毒,在ZIKV囊膜表面覆盖着介导病毒感染的E蛋白。我们对E蛋白的序列进行分析后,基于其颈部(stem)保守氨基酸序列设计了一条多肽—Z2。我们研究发现该多肽可与ZIKV的E蛋白结合,破坏病毒膜的完整性,导致病毒的基因组释出,从而灭活ZIKV病毒颗粒。在多种体外细胞模型及体内动物模型的实验中,Z2多肽均能有效地抑制ZIKV的感染。进一步研究发现Z2多肽具有穿透胎盘屏障的能力,不仅能够降低ZIKV感染的孕鼠血清中的病毒滴度,还能显著降低胎盘和胎鼠的病毒感染率,从而阻止ZIKV的垂直传播(图6B)。该多肽灭活剂对孕鼠及胎鼠均表现出良好的安全性,有望发展为可防治ZIKV感染的新型药物,尤其适用于孕妇等ZIKV感染的高危人群[67]。
经过与应天雷课题组合作研究,我们从超大容量噬菌体全人源抗体库成功地筛选到一系列可与ZIKV的E蛋白的DIII结构域(domain III)结合的全人源单克隆抗体。其中一株抗体m301能广泛地中和多种目前流行的ZIKV毒株,并与另一株抗体m302合用具有协同效应。表位作图和竞争性结合研究表明m301和m302结合于DIII结构域C-C’loop的相邻区域,该区域代表了一个最近鉴定的间歇性暴露的隐蔽表位(cryptic epitope)。此隐蔽表位可能通过一个称为病毒呼吸(viral breathing)的过程间歇性地暴露而被m301和m302抗体识别。这些人源单克隆抗体也都是类胚系抗体,与其相应的胚系免疫球蛋白重链可变区基因有98%~100%的同源性,其与体细胞超突变抗体(somatically hypermutated antibody)相比,显示更低的免疫原性和更好的成药性。因此,此项研究有助于我们理解ZIKV抗体的抗原表位和设计更有效的抗ZIKV疫苗和血清学诊断方法,并且这些抗ZIKV的全人源中和抗体还具有进一步研发为抗体治疗药物的潜力[68]。

A:Infection of ZIKV during pregnancy may result in congenital malformation of fetal brain and microcephaly;B:Peptide Z2 can inactivate ZIKV and reduce the virus load in maternal blood,and can also penetrate the placental barrier,thus significantly reducing the infection rate of placenta and fetus,and preventing the vertical transmission of ZIKV.
图6ZIKV入侵抑制剂和灭活剂
Fig6EntryinhibitorsandinactivatorsofZIKV
虽然已经确证ZIKV感染可引起包括小头症在内的胎儿先天性畸形和成人吉兰-巴雷综合征等疾病,但对ZIKV感染孕妇后导致先天性畸形的胎儿的预后及其成年后可能出现的后遗症知之甚少。许多ZIKV感染相关的小鼠模型虽已建立[69-70],但感染的胎鼠通常在出生之前或之后不久死亡[71-72],先天性感染的胎鼠难以成功出生并成年,限制了先天性ZIKV感染的成年后遗症的研究及防治该后遗症的药物及疫苗的筛选和评估。经过与张嘉漪课题组合作研究,我们成功地建立了一种小鼠先天性ZIKV感染新模型[73],通过羊膜腔内注射途径接种ZIKV,大量胎鼠顺利出生并成长至成年期。检测发现小鼠出生后ZIKV可在小鼠体内持续感染并复制,直到成长至青春期后,随着免疫系统成熟,病毒可被清除。感染小鼠与对照组相比,大脑体积显著减小,皮层变薄,视觉系统和小脑出现解剖缺陷以及颅内钙化,且先天性感染ZIKV的小鼠中出现后肢瘫痪和运动不协调。“旷场实验”、“悬尾实验”、“转棒实验”、“高架十字迷宫”、“步态分析”等行为学检测,表明先天性ZIKV感染的小鼠预后出现运动功能障碍以及视觉功能障碍等后遗症,重现了人先天性ZIKV感染的若干临床表现,有助于人先天性ZIKV感染的预后研究。此模型通过采用行为学分析的预后评估系统,可用于筛选和鉴定能修复神经损伤从而改善预后病症的候选药物和评估抗ZIKV治疗的预后效果。
展望病毒入侵抑制剂主要分为多肽类、抗体类、修饰蛋白类以及小分子类抗病毒药物及其候选。其中,本团队在HIV、SARS-CoV、MERS-CoV、EBOV以及ZIKV多肽类及修饰蛋白类入侵抑制剂研究领域处于国际领先水平。多肽类入侵抑制剂具有入侵抑制剂普遍具有的作用于病毒入侵的早期阶段,能有效保护靶细胞免受病毒伤害的优点。同时,由于其分子量较小,免疫原性较低,不易引发机体产生针对病毒入侵的抑制剂的抗体。但是,多肽类药物也有其相应的缺点。如20年前研发的第一个多肽抑制剂类抗HIV药物——T20具有抗病毒活性低[4],临床用量大,注射次数多等缺点。这些问题正在通过选取对膜蛋白亲和力更高的结构域[7],添加人工设计的钩状结构[9-11],设计酯化肽[14]等手段解决。另一问题是由于其分子量较小,导致其半衰期较短,临床使用时导致用药频率较高。研究人员采用在全人工设计的非天然序列中引入β氨基酸[16]或使用酸酐修饰C-多肽使其与人血清白蛋白发生快速和不可逆转的结合[74]等方法一定程度上延长了多肽类药物的半衰期,但长效多肽的研发仍然是未来研究需努力的方向之一。另外,由于RNA病毒基因组易发生突变,各病毒均有各种不同的亚型,不同区域的流行亚型也不尽相同,所以开发针对病毒在入侵过程中具有重要作用的保守位点(如6-HB)的广谱抗病毒药物也是未来抗病毒药物的发展重点之一。尤其是对于新发病毒(如MERS-CoV和ZIKV)来说,如果能提前开发出广谱抗冠状病毒和广谱抗黄病毒的药物,可在这些新发病毒疫情发生时,第一时间使用来挽救感染者的性命,大大节省国家的公共卫生投入。
修饰蛋白类药物作为局部使用药物可防控病毒的性传播,如酸酐修饰的牛血清白蛋白作为针对HPV的阴道用杀微生物剂,其有效性和安全性都在临床试验中得到了确认[75-76]。其中酸酐修饰的β乳球蛋白对HIV-1、HIV-2、HPV、HSV及EBOV也具有广谱的抑制效果[56-58,77]。修饰类蛋白局部用药剂型生产成本低、作用广谱、性质稳定、非常安全、使用方便,十分适合被开发成可防控上述病毒性传播的局部用药。
抗体类病毒入侵抑制剂多为针对病毒包膜蛋白特定位点的单克隆抗体,特别是全人源的类胚系抗体,具有抗病毒活性高和免疫原性低的优点。但是,抗体药物在病毒防治领域较难推广使用的重要原因之一是其制造成本太高。为解决这一问题,学界也进行了很多研究,包括开发分子量较小的新结构抗体,以及将抗体与多肽药物联合使用来降低抗体药物的使用量等手段。同时,抗体类入侵抑制剂针对的病毒表位单一,易出现病毒逃逸的情况。研究人员也因此提出联合使用多种单克隆抗体或构建双/三特异性抗体等来解决病毒逃逸的问题,但是这将更进一步增加用药成本。所以本团队提出联合使用抗体类和多肽类入侵抑制剂的策略,以期大大增加药物靶向的位点范围,减少耐药情况产生。
以上多肽类以及抗体类入侵抑制剂同样具有的一个问题是只能通过注射用药,相较于口服药,患者依从性较低。小分子类入侵抑制剂能有效解决这些问题。但目前小分子类入侵抑制剂的活性普遍较低,还不适合开发成药物。所以该类病毒入侵抑制剂的研究方向仍聚焦于如何有效提高其抗病毒活性。
病毒灭活剂能作用于患者体内的游离病毒,在药物利用率等方面具有明显优势。如能通过胎盘的ZIKV多肽灭活剂Z2不仅能用于治疗母体的感染,还能保护胎儿不受病毒感染。由于Z2多肽具有灭活游离病毒的功能,可以在病毒进入胎鼠脑部前将病毒灭活,因此可有效减低胎鼠脑部的病毒感染率,具有显著的优势[67]。此外,病毒灭活剂还可被发展成为清除HIV潜伏细胞的细胞杀灭剂,在艾滋病治愈药物的开发上具有潜力。例如,HIV潜伏库的清除一直是HIV治愈领域的一大研究重点,其中激活并杀死(shock and kill)的策略被认为是最有希望清除HIV潜伏库的方法之一[78]。HIV灭活剂就能运用到该策略上,直接灭活被激活的潜伏病毒,有效保护机体不受激活后产生的新病毒的影响,并且还能通过偶联毒素等策略设计成为有效地将被激活的、表面表达HIV-1 Env的潜伏细胞杀灭,从而将其清除。所以,设计出灭活效率高的病毒灭活剂是今后抗病毒治疗及治愈药物发展的一大方向。
致谢感谢闻玉梅院士、袁正宏教授及医学分子病毒学教育部/卫生部重点实验室其他同事的大力支持,感谢姜世勃/陆路课题组全体成员的贡献。
[1] CHAN DC,FASS D,BERGER JM,etal.Core structure of gp41 from the HIV envelope glycoprotein[J].Cell,1997,89(2):263-273.
[2] JIANG S,LIN K,STRICK N,etal.HIV-1 inhibition by a peptide[J].Nature,1993,365(6442):113.
[3] JIANG S,LIN K,STRICK N,etal. Inhibition of HIV-1 infection by a fusion domain binding peptide from the HIV-1 envelope glycoprotein GP41[J].BiochemBiophysResCommun,1993,195(2):533-538.
[4] LIU S,LU H,NIU J,etal.Different from the HIV fusion inhibitor C34,the anti-HIV drug Fuzeon (T-20) inhibits HIV-1 entry by targeting multiple sites in gp41 and gp120[J].JBiolChem,2005,280(12):11259-11273.
[5] LIU S,JING W,CHEUNG B,etal.HIV gp41 C-terminal heptad repeat contains multifunctional domains.Relation to mechanisms of action of anti-HIV peptides[J].JBiolChem,2007,282(13):9612-9620.
[6] HE Y,XIAO Y,SONG H,etal.Design and evaluation of sifuvirtide,a novel HIV-1 fusion inhibitor[J].JBiolChem,2008,283(17):11126-11134.
[7] HE Y,CHENG J,LI J,etal.Identification of a critical motif for the human immunodeficiency virus type 1 (HIV-1) gp41 core structure:implications for designing novel anti-HIV fusion inhibitors[J].JVirol,2008,82(13):6349-6358.
[8] HE Y,CHENG J,LU H,etal. Potent HIV fusion inhibitors against Enfuvirtide-resistant HIV-1 strains[J].ProcNatlAcadSciUSA,2008,105(42):16332-16337.
[9] CHONG H,YAO X,SUN J,etal.The M-T hook structure is critical for design of HIV-1 fusion inhibitors[J].JBiolChem,2012,287(41):34558-34568.
[10] CHONG H,QIU Z,SUN J,etal.Two M-T hook residues greatly improve the antiviral activity and resistance profile of the HIV-1 fusion inhibitor SC29EK[J].Retrovirology,2014,11:40.
[11] SU S,ZHU Y,YE S,etal.Creating an artificial tail anchor as a novel strategy to enhance the potency of peptide-based HIV fusion inhibitors[J].JVirol,2017,91(1):e01445-16.
[12] SU S,WANG Q,XU W,etal.A novel HIV-1 gp41 tripartite model for rational design of HIV-1 fusion inhibitors with improved antiviral activity[J].AIDS,2017,31(7):885-894.
[13] ZHU X,ZHU Y,YE S,etal.Improved pharmacological and structural properties of HIV fusion inhibitor AP3 over enfuvirtide:highlighting advantages of artificial peptide strategy[J].SciRep,2015,5:13028.
[14] WANG C,SHI W,CAI L,etal.Artificial peptides conjugated with cholesterol and pocket-specific small molecules potently inhibit infection by laboratory-adapted and primary HIV-1 isolates and enfuvirtide-resistant HIV-1 strains[J].JAntimicrobChemother,2014,69(6):1537-1545.
[15] WELCH BD,FRANCIS JN,REDMAN JS,etal.Design of a potent D-peptide HIV-1 entry inhibitor with a strong barrier to resistance[J].JVirol, 2010,84(21):11235-11244.
[16] STEPHENS OM,KIM S,WELCH BD,etal.Inhibiting HIV fusion with a beta-peptide foldamer[J].JAmChemSoc, 2005,127(38):13126-13127.
[17] ASHKENAZI A,VIARD M,UNGER L,etal. Sphingopeptides:dihydrosphingosine-based fusion inhibitors against wild-type and enfuvirtide-resistant HIV-1[J].FASEBJ,2012,26(11):4628-4636.
[18] DING X,ZHANG X,CHONG H,etal. Enfuvirtide (T20)-based lipopeptide is a potent HIV-1 cell fusion Inhibitor:implications for viral entry and inhibition[J].JVirol,2017,91(18):e00831-17.
[19] SIA SK,CARR PA,COCHRAN AG,etal.Short constrained peptides that inhibit HIV-1 entry[J].ProcNatlAcadSciUSA, 2002,99(23):14664-14669.
[20] PAN C,LU H,QI Z,etal.Synergistic efficacy of combination of enfuvirtide and sifuvirtide,the first- and next-generation HIV-fusion inhibitors[J].AIDS,2009,23(5):639-641.
[21] CHEN X,LU L,QI Z,etal. Novel recombinant engineered gp41 N-terminal heptad repeat trimers and their potential as anti-HIV-1 therapeutics or microbicides[J].JBiolChem,2010,285(33):25506-25515.
[22] JIANG S,LIN K,LU M.A conformation-specific monoclonal antibody reacting with fusion-active gp41 from the human immunodeficiency virus type 1 envelope glycoprotein[J].JVirol, 1998,72(12):10213-10217.
[23] LIU K,LU H,HOU L,etal.Design,synthesis,and biological evaluation of N-carboxyphenylpyrrole derivatives as potent HIV fusion inhibitors targeting gp41[J].JMedChem,2008,51(24):7843-7854.
[24] JIANG S,LU H,LIU S,etal.N-substituted pyrrole derivatives as novel human immunodeficiency virus type 1 entry inhibitors that interfere with the gp41 six-helix bundle formation and block virus fusion[J].AntimicrobAgentsChemother, 2004,48(11):4349-4359.
[25] KATRITZKY AR,TALA SR,Lu H,etal.Design,synthesis,and structure-activity relationship of a novel series of 2-aryl 5-(4-oxo-3-phenethyl-2-thioxothiazolidinylidenemethyl)furans as HIV-1 entry inhibitors[J].JMedChem,2009,52(23):7631-7639.
[26] JIANG S,TALA SR,LU H,etal.Design,synthesis,and biological activity of novel 5-((arylfuran/1H-pyrrol-2-yl)methylene)-2-thioxo-3-(3-(trifluoromethyl)phenyl)thi azolidin-4-ones as HIV-1 fusion inhibitors targeting gp41[J].JMedChem,2011,54(2):572-579.
[27] LU L,PAN C,LI Y,etal.A bivalent recombinant protein inactivates HIV-1 by targeting the gp41 prehairpin fusion intermediate induced by CD4 D1D2 domains[J].Retrovirology,2012,9:104.
[28] XU W,WANG Q,YU F,etal.Synergistic effect resulting from combinations of a bifunctional HIV-1 antagonist with antiretroviral drugs[J].JAcquirImmuneDeficSyndr,2014,67(1):1-6.
[29] QI Q,WANG Q,CHEN W,etal.HIV-1 gp41-targeting fusion inhibitory peptides enhance the gp120-targeting protein-mediated inactivation of HIV-1 virions[J].EmergMicrobesInfect,2017,6(6):e59.
[30] XIA S,LIU Q,WANG Q,etal.Middle East respiratory syndrome coronavirus (MERS-CoV) entry inhibitors targeting spike protein[J].VirusRes,2014,194:200-210.
[31] DU L,HE Y,ZHOU Y,etal.The spike protein of SARS-CoV--a target for vaccine and therapeutic development[J].NatRevMicrobiol,2009,7(3):226-236.
[32] 代嫣嫣,夏帅,王茜,等.人类高致病性冠状病毒SARS-CoV 和MERS-CoV 的流行与突变— 共性与个性特征的启示[J].生命科学,2016,28(3):357-366.
[33] LIU S,XIAO G,CHEN Y,etal.Interaction between heptad repeat 1 and 2 regions in spike protein of SARS-associated coronavirus:implications for virus fusogenic mechanism and identification of fusion inhibitors[J].Lancet,2004,363(9413):938-947.
[34] HE Y,LI J,LI W,etal.Cross-neutralization of human and palm civet severe acute respiratory syndrome coronaviruses by antibodies targeting the receptor-binding domain of spike protein[J].JImmunol,2006,176(10):6085-6092.
[35] ZHU Z,CHAKRABORTI S,HE Y,etal.Potent cross-reactive neutralization of SARS coronavirus isolates by human monoclonal antibodies[J].ProcNatlAcadSciUSA,2007,104(29):12123-12128.
[36] LU L,LIU Q,ZHU Y,etal.Structure-based discovery of Middle East respiratory syndrome coronavirus fusion inhibitor[J].NatCommun,2014,5:3067.
[37] ZHAO G,DU L,MA C,etal. A safe and convenient pseudovirus-based inhibition assay to detect neutralizing antibodies and screen for viral entry inhibitors against the novel human coronavirus MERS-CoV[J].VirolJ,2013,10:266.
[38] CHANNAPPANAVAR R,LU L,XIA S,etal.Protective effect of intranasal regimens containing peptidic Middle East respiratory syndrome coronavirus fusion inhibitor against MERS-CoV infection[J].JInfectDis,2015,212(12):1894-1903.
[39] TAO X,GARRON T,AGRAWAL AS,etal.Characterization and demonstration of the value of a lethal mouse model of Middle East respiratory syndrome coronavirus infection and disease[J].JVirol,2015,90(1):57-67.
[40] DU L,KOU Z,MA C,etal.A truncated receptor-binding domain of MERS-CoV spike protein potently inhibits MERS-CoV infection and induces strong neutralizing antibody responses:implication for developing therapeutics and vaccines[J].PLoSOne,2013,8(12):e81587.
[41] DU L,ZHAO G,KOU Z,etal.Identification of a receptor-binding domain in the S protein of the novel human coronavirus Middle East respiratory syndrome coronavirus as an essential target for vaccine development[J].JVirol, 2013,87(17):9939-9942.
[42] DU L,ZHAO G,YANG Y,etal. A conformation-dependent neutralizing monoclonal antibody specifically targeting receptor-binding domain in Middle East respiratory syndrome coronavirus spike protein[J].JVirol, 2014,88(12):7045-7053.
[43] YING T,DU L,JU TW,etal.Exceptionally potent neutralization of Middle East respiratory syndrome coronavirus by human monoclonal antibodies[J].JVirol,2014,88(14):7796-7805.
[44] HOUSER KV,GRETEBECK L,YING T,etal.Prophylaxis with a Middle East respiratory syndrome coronavirus (MERS-CoV)-specific human monoclonal antibody protects rabbits from MERS-CoV infection[J].JInfectDis,2016,213(10):1557-1561.
[45] AGRAWAL AS,YING T,TAO X,etal.Passive transfer of a germline-like neutralizing human monoclonal antibody protects transgenic mice against lethal middle east respiratory syndrome coronavirus infection[J].SciRep,2016,6:31629.
[46] YING T,PRABAKARAN P,DU L,etal.Junctional and allele-specific residues are critical for MERS-CoV neutralization by an exceptionally potent germline-like antibody[J].NatCommun,2015,6:8223.
[47] WEYER J,GROBBELAAR A,BLUMBERG L.Ebola virus disease:history,epidemiology and outbreaks[J].CurrInfectDisRep,2015,17(5):480.
[48] FELDMANN H,GEISBERT TW.Ebola haemorrhagic fever[J].Lancet,2011,377(9768):849-862.
[49] DE LA VEGA MA,CALEO G,AUDET J,etal.Ebola viral load at diagnosis associates with patient outcome and outbreak evolution[J].JClinInvest,2015,125(12):4421-4428.
[50] CROZIER I.Ebola virus RNA in the semen of male survivors of Ebola virus disease:The uncertain gravitas of a privileged persistence[J].JInfectDis,2016,214(10):1467-1469.
[51] MATE SE,KUGELMAN JR,NYENSWAH TG,etal.Molecular evidence of sexual transmission of Ebola virus[J].NEnglJMed,2015,373(25):2448-2454.
[52] QIU X,WONG G,AUDET J,etal. Reversion of advanced Ebola virus disease in nonhuman primates with ZMapp[J].Nature,2014,514(7520):47-53.
[53] LYON GM,MEHTA AK,VARKEY JB,etal.Clinical care of two patients with Ebola virus disease in the United States[J].NEnglJMed,2014,371(25):2402-2409.
[54] GROUP PIW,MULTI-NATIONAL PIIST,DAVEY RT,JR,etal.A randomized,controlled trial of ZMapp for Ebola virus infection[J].NEnglJMed,2016,375(15):1448-1456.
[55] FURUYAMA W,MARZI A,NANBO A,etal.Discovery of an antibody for pan-ebolavirus therapy[J].SciRep,2016,6:20514.
[56] LI L,HE L,TAN S,etal.3-hydroxyphthalic anhydride-modified chicken ovalbumin exhibits potent and broad anti-HIV-1 activity:a potential microbicide for preventing sexual transmission of HIV-1[J].AntimicrobAgentsChemother, 2010,54(5):1700-1711.
[57] LU L,YANG X,LI Y,etal.Chemically modified bovine beta-lactoglobulin inhibits human papillomavirus infection[J].MicrobesInfect, 2013,15(6-7):506-510.
[58] LI H,YU F,XIA S,etal.Chemically modified human serum albumin potently blocks entry of Ebola pseudoviruses and viruslike particles[J].AntimicrobAgentsChemother,2017,61(4):e02168-16.
[59] WHO.Zika virus and complications:2016 Public health emergency of international concern[R/OL].[2017-09-28]http://www.who.int/emergencies/zika-virus/en/.
[60] GARCEZ PP,LOIOLA EC,MADEIRO DA COSTA R,etal.Zika virus impairs growth in human neurospheres and brain organoids[J].Science,2016,352(6287):816-818.
[61] CALVET G,AGUIAR RS,MELO ASO,etal.Detection and sequencing of Zika virus from amniotic fluid of fetuses with microcephaly in Brazil:a case study[J].LancetInfectDis,2016,16(6):653-660.
[62] CUGOLA FR,FERNANDES IR,RUSSO FB,etal.The Brazilian Zika virus strain causes birth defects in experimental models[J].Nature,2016,534(7606):267-271.
[63] BRASIL P,SEQUEIRA PC,FREITAS AD,etal. Guillain-Barre syndrome associated with Zika virus infection[J].Lancet,2016,87(10026):1482.
[64] PARRA B,LIZARAZO J,JIMENEZ-ARANGO JA,etal. Guillain-Barre syndrome associated with Zika virus infection in Colombia[J].NEnglJMed,2016,375(16):1513-1523.
[65] MA W,LI S,MA S,etal.Zika virus causes testis damage and leads to male infertility in mice[J].Cell,2016,167(6):1511-1524.
[66] GOVERO J,ESAKKY P,SCHEAFFER SM,etal.Zika virus infection damages the testes in mice[J].Nature,2016,540(7633):438-442.
[67] YU Y,DENG YQ,ZOU P,etal.A peptide-based viral inactivator inhibits Zika virus infection in pregnant mice and fetuses[J].NatCommun,2017,8:15672.
[68] WU YL,LI S,DU LY,etal.Neutralization of Zika virus by germline-like human monoclonal antibodies targeting cryptic epitopes on envelope domain III[J].EmergMicrobesInfect,2017,Accepted.
[69] MOR F,COHEN IR.Pathogenicity of T cells responsive to diverse cryptic epitopes of myelin basic protein in the Lewis rat[J].JImmunol,1995,155(7):3693-3699.
[70] MORRISON TE,DIAMOND MS.Animal models of Zika virus infection,pathogenesis,and immunity[J].JVirol,2017,91(8):e00009-17.
[71] MINER JJ,CAO B,GOVERO J,etal.Zika virus infection during pregnancy in mice causes placental damage and fetal demise[J].Cell,2016,165(5):1081-1091.
[72] LI C,XU D,YE Q,etal. Zika virus disrupts neural progenitor development and leads to microcephaly in mice[J].CellStemCell, 2016,19(5):672.
[73] CUI L,ZOU P,CHEN E,etal. Visual and motor deficits in grown-up mice with congenital Zika virus infection[J].EBioMedicine,2017,20:193-201.
[74] XIE D,YAO C,WANG L,etal. An albumin-conjugated peptide exhibits potent anti-HIV activity and long in vivo half-life[J].AntimicrobAgentsChemother,2010,54(1):191-196.
[75] GUO X,QIU L,WANG Y,etal.A randomized open-label clinical trial of an anti-HPV biological dressing (JB01-BD) administered intravaginally to treat high-risk HPV infection[J].MicrobesInfect,2016,18(2):148-152.
[76] GUO X,QIU L,WANG Y,etal.Safety evaluation of chemically modified beta-lactoglobulin administered intravaginally[J].JMedVirol,2016,88(6):1098-1101.
[77] NEURATH AR,JIANG S,STRICK N,etal.Bovine beta-lactoglobulin modified by 3-hydroxyphthalic anhydride blocks the CD4 cell receptor for HIV[J].NatMed,1996,2(2):230-234.
[78] HAMER DH.Can HIV be Cured? Mechanisms of HIV persistence and strategies to combat it[J].CurrHIVRes,2004,2(2):99-111.
[79] NISHIKAWA H,OISHI S,FUJITA M,etal.Identification of minimal sequence for HIV-1 fusion inhibitors[J].BioorgMedChem,2008,16(20):9184-9187.
[80] JOHNSON LM,MORTENSON DE,YUN HG,etal.Enhancement of alpha-helix mimicry by an alpha/beta-peptide foldamer via incorporation of a dense ionic side-chain array[J].JAmChemSoc,2012,134(17):7317-7320.
Defeatingenemyoutsidetheborder-developmentofviralentryinhibitors
JIANG Shi-bo△, SU Shan, XIA Shuai, ZOU Peng, LU Lu
(MOE/MOHKeyLaboratoryofMedicalMolecularVirology,ShanghaiMedicalCollege,FudanUniversity,Shanghai200032,China)
About 25 years ago,we had pioneered the research fields of developing human immunodeficiency virus (HIV) fusion/entry inhibitors and anti-HIV peptide drugs.Over the past six years,we have gained some promising results in research and development of the HIV,Middle East respiratory syndrome coronavirus (MERS-COV),the Ebola virus (EBOV),and the Zika virus (ZIKV) entry inhibitors.This article provides an overview of the research progress of viral entry inhibitors against the related highly pathogenic viruses.
highly pathogenic viruses; virus entry inhibitors; virus inactivators
R511
A
10.3969/j.issn.1672-8467.2017.06.0014
国家自然科学基金 (81102476,81173098,81261120382,81361120378,81373456,81410308013,81590762,8161101485,81630090,81672019);国家重点研究计划“生物安全关键技术研发”重点项目 (2016YFC1201000,2016YFC1200400,2016YFC1202901)
△Corresponding author E-mail:shibojiang@fudan.edu.cn
*ThisworkwassupportedbytheNationalNaturalScienceFoundationofChina(81102476,81173098,81261120382,81361120378,81373456,81410308013,81590762,8161101485,81630090,81672019)andNationalKeyResearchProgramofChina-ResearchandDevelopmentofKeyTechnologiesforBiosafety(2016YFC1201000,2016YFC1200400,2016YFC1202901).
2017-09-30;编辑:张秀峰)

