视网膜神经信号的调制和视网膜疾病
杨雄里
(复旦大学脑科学研究院 上海 200032)

专家简介杨雄里,1941年出生,神经生物学家,生理学家,中国科学院院士(1991年当选),发展中国家科学院院士(2006年)。1958—1960年在上海第一医学院医疗系学习,1963年毕业于上海科技大学,1982年在日本获学术博士学位。现为复旦大学教授,脑科学协同创新中心主任,脑科学研究院学术委员会主任,《辞海》、《大辞海》副主编,ProgNeurobiol杂志国际顾问编委,国内外多所大学荣誉教授或客座教授。曾任中国科学院生物学部副主任(1991—1996年),中科院上海生理研究所所长(1988—1999年),中国生理学会理事长(1998—2002年),《生理学报》主编(1988—2002年),《中国神经科学杂志》主编(1996—2005年),973项目“脑功能和脑重大疾病的基础研究”首席科学家(1999—2004年),复旦大学神经生物学研究所所长(2000—2010年),脑科学研究院院长(2006—2009年),亚大地区生理学联合会第一副主席(FAOPS)(1994—1998年)、秘书长(2006—2011年)。第十、十一届全国政协委员。
在视网膜中信号传递处理及其机制研究方面取得了若干重要成果,已发表学术论文250余篇,专著、译著多册,曾获中科院自然科学一等奖(1989年),教育部自然科学一等奖(2006年),上海市自然科学一等奖(2006年),何梁何利科技进步奖(2001年),上海市科技精英(1991年),上海市科普教育创新杰出人物奖(2013年)等。
上海医学院创建90周年寄语在科学上树“会当凌绝顶”的决心,在育人中怀“甘为孺子牛”的精神,强而不骄,谦而不萎,益整旗鼓,再铸辉煌。
视网膜神经信号的调制和视网膜疾病
杨雄里△
(复旦大学脑科学研究院 上海 200032)
本文概述了作者所领导的团队近年来在视网膜研究方面的主要工作。在基础研究方面,集中介绍了褪黑素对视网膜神经元的神经调制作用;而在与临床相结合的研究方面,则涉及青光眼的发病机制,特别是Müller胶质化激活和ephrin/Eph信号系统的反向信号在视网膜神经节细胞凋亡中的作用。最后论及视网膜多巴胺在眼屈光系统发育及形觉剥夺性近视形成中的作用,以及多巴胺与屈光发育和近视形成的关系。
视网膜; 视网膜疾病; 神经信号
最近10年来(2007—2017年),我除了继续推进视网膜的基础研究之外,开始努力把研究和临床问题结合起来。基础和临床结合固然是当前生命科学的一个重要趋势,也反映了我自己强烈的心愿。在基础研究方面,我着重分析了褪黑激素(melatonin,MEL)、促醒素(orexin)对视网膜神经信号的调制;在与临床相结合方面,则致力于对青光眼、糖网病和近视眼的发病机制进行探索。本文将结合学科发展趋势从几个侧面介绍我的实验室的部分研究成果,作为向上医创建90周年庆典的汇报。
褪黑素(MEL)对视网膜信息的神经调制作用在脊椎动物中,MEL的合成主要发生在松果体和视网膜。其合成和释放显示明显的昼夜节律变化,夜间较高,白昼较低[1]。它参与了多种生理过程的调节,如睡眠、生殖、免疫和心血管反应等[2]。近年来,许多实验证据显示了MEL的神经调制作用[3]。在视网膜中,MEL主要在光感受器中合成,其释放受昼夜节律和光照的调制[3]。
我们第一个研究主题是,在外层视网膜MEL对视杆信号和视锥信号的传递进行调制的特点[4]。我们以硬骨鱼为实验动物,因为在鱼的外层视网膜,视杆和视锥两种信号向视网膜第二级神经元——水平细胞和双极细胞的传递基本是分开的,即视杆和视锥的信号分别传递至不同类型的水平细胞和双极细胞。应用细胞内记录技术,在分离的鲫鱼视网膜标本,我们观察到,生理浓度的MEL使视锥信号驱动的水平细胞(视锥水平细胞)去极化,并使其对光反应减小(图1A1),MEL的这种作用为MEL的受体MT1、MT2的竞争性拮抗剂luzindole(LUZ)所阻断。当GABA能、多巴胺能和甘氨酸能输入均用相应的拮抗剂所阻断后,MEL的这些作用依然存在,表明这是MEL对水平细胞的直接作用(图1A2)。相反,MEL使视杆信号驱动的水平细胞膜电位轻微超极化,使其光反应幅度有所增大。我们应用全细胞膜片钳记录技术记录了分离视锥水平细胞上的AMPA受体(谷氨酸受体亚型)介导的电流。实验进一步显示,MEL通过增加其效率(efficacy)和表观亲和力(apparent affinity)使AMPA电流增大。MEL的这一效应可以为LUZ所翻转,但使用MT2受体的特异性拮抗剂不能阻断MEL的作用,这提示MEL的作用是由MT1受体介导的(图1A3)。像MEL一样,鸟苷酸环化酶的抑制剂甲基兰(MB)也增大AMPA电流,而cGMP的胞内灌流压抑这些电流。进而,这种MEL的效应在胞内施加cGMP或用MB培养的视锥水平细胞不复存在。所有这些结果都提示,MEL的这一效应是由于MEL激活MT1受体,使胞内cGMP浓度降低而致。由此可对所观察到的现象作如下解释:视锥水平细胞表达的MT1受体的激活使AMPA受体更强被激活,使细胞膜电位随之更接近AMPA受体的翻转电位(0 mV),这样就使细胞的驱动力(driving force)减小,其结果是细胞光反应幅度下降。MEL对从视锥向水平细胞的谷氨酸能传递的这种调制,可能是这种细胞光反应昼夜节律变化的原因之一。
我们进一步在双极细胞对MEL的作用进行了研究[5]。如前所述,鱼的视杆和视锥信号向双极细胞的传递基本上是分离的,即传递至两类形态不同的细胞。有一类接受视锥信号的“给光型”(ON型)双极细胞,具有一个明显膨大的轴突终末,形态上很易识别,也易于进行膜片钳记录。我们首先用全细胞膜片钳技术对这种细胞进行了研究。在视网膜薄片标本上,MEL能诱导出一个持续的内向电流(图1B1)。实验表明,这是一个经MT2激活由cGMP依赖的阳离子通道介导的电流。与此相一致,MEL通过抑制磷酸二酯酶(PDE)的活性使胞内cGMP浓度增加;而当用cGMP作胞内灌流时,MEL不再能诱导任何电流。我们还测试了MEL对这种细胞的光反应的影响。为了避免来自光感受器和水平细胞的突触前作用,采用了Snellman和Nawy(2004)首先提出的模拟光[6],即视网膜铺片用饱和浓度的L-AP4(代谢型谷氨酸受体mGluR6的激动剂)作连续灌流来模拟“暗”,而在L-AP4连续灌流的过程中,短暂施加CPPG(mGluR6的拮抗剂)至细胞的树突,以此模拟光刺激。如图1B3 (左)所示,MEL使细胞对此模拟光的反应增大,而这种效应为cGMP依赖激酶所介导。进而,MEL增大暗视ERG b波的幅度(图1B4),这是一个可预测的结果,因为b波反映的是双极细胞的活动。MEL对接受视锥信号的双极细胞的作用则完全不同。虽然MEL使这些细胞胞内cGMP水平升高,但不能诱导电流。这些结果提示,夜间释放的MEL可能用于提高夜间双极细胞的对光反应灵敏度,从而使弱光引起的视杆信号超出背景噪音水平。以上的实验结果可归纳于图1C、D模式图。MEL增大由视杆至双极细胞的信号传递,却使视锥至水平细胞的信号传递下降。MEL这两种不同的作用分别由MT1和MT2介导,前者使胞内cGMP下降,而后者使之增高。
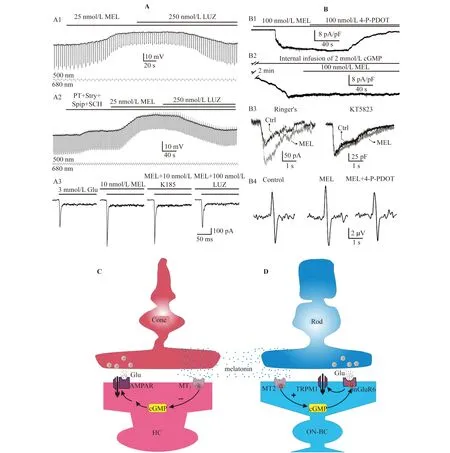
A:Melatonin modulates carp cone-driven horizontal cells (H1 cells).A1:Intracellular recording of a H1 cell from whole-mount carp retina.Melatonin (MEL) of 25 nmol/L depolarized the cell and reduced the amplitudes of the light responses.Co-application of the MT1/MT2receptor antagonist luzindole (LUZ) of 250 nmol/L blocked the melatonin effects.A2:When dopaminergic,GABAergic and glycinergic synaptic transmission was blocked by application of a mixture of spiperone (Spip),SCH 23390 (SCH),picrotoxin (PT) and strychnine (Stry),melatonin was still capable of depolarizing the cell and reducing the response amplitudes.A3:In an H1 cell,glutamate (3 mmol/L)-induced current was potentiated by 10 nmol/L melatonin,which was blocked by 100 nmol/L LUZ,but not by the MT2specific antagonist K185 of 100 nmol/L.B:Melatonin modulates carp rod-dominant bipolar cells (Rod-ON-BCs).B1:Melatonin of 100 nmol/L induced a sustained inward current from a Rod-ON-BC,which was blocked by the MT2receptor specific antagonist 4-P-PDOT of 100 nmol/L.B2:Internal infusion of 2 mmol/L cGMP induced a sustained inward current,and addition of 100 nmol/L melatonin failed to further induce any current.B3:Left,Response of a Rod-ON-BC to simulated light flash was potentiated by melatonin (100 nmol/L);Right,With internal infusion of the cGMP-dependent kinase antagonist KT5823 (10 μmol/L),melatonin of 100 nmol/L failed to potentiate the simulated light-induced response.B4:Melatonin (100 nmol/L) potentiated the scotopic b-wave,which was blocked by 100 nmol/L 4-P-PDOT.C and D:Schematic diagrams showing the signaling pathways of how melatonin modulates cone signal to the horizontal cell (C) and rod signal to the bipolar cell (D) in carp retina.In the horizontal cell (HC),melatonin decreases intracellular cGMP concentration by activating the MT1receptor,which may lead to a stronger activation of the AMPA receptor.In the rod-driven ON type bipolar cell (ON-BC),melatonin,through activating the MT2receptor,increases intracellular cGMP concentration,which potentiates the light response that is mediated by the transient receptor potential M1 (TRPM1) channel coupled to the mGluR6 receptor.Modified from Huangetal[3]of our own group.
图1褪黑素(MEL)以不同的方式调制外层视网膜中视锥和视杆信号
Fig1Melatonindifferentiallymodulatesconeandrodsignalsintheouterretina
我们的研究工作进而又拓展至MEL对大鼠视杆给光型双极细胞活动、神经节细胞甘氨酸电流的调制[7-9],从而对MEL在视网膜中的神经调制作用及其机制,形成了较全面的认识。应ProgRetinEyeRes杂志主编Osborne的邀请,我们撰写了长篇综述[3],可供有兴趣的读者参阅。
对青光眼和近视眼发病机制的研究
青光眼研究
高眼压引起Müller细胞的胶质化激活,导致神经节细胞的丢失 青光眼是一种重要的致盲性疾病,眼压过高引起神经节细胞凋亡的机制仍然是一个悬而未决的问题。在建立了慢性高眼压大鼠模型后,我们研究的第一个问题是,视网膜Müller细胞胶质化激活(gliosis)是否和神经节细胞的凋亡有关。胶质细胞的重激活见于几乎所有的中枢神经系统疾病[10],包括多种视网膜的疾患[11]。我们首先用免疫组化方法,在正常大鼠显示,内向整流钾通道(Kir 4.1)蛋白表达于Müller细胞;当处于高眼压时,Müller细胞表达GFAP增加,而表达的Kir 4.1 蛋白水平降低,相应的Kir 4.1电流也减小。我们对此现象提出了一个工作假设:在高眼压大鼠模型,胞外谷氨酸浓度增加,使代谢型谷氨酸受体(mGluR)中的一种亚型mGluR5过度激活,从而抑制Kir电流。这一工作假设已为实验所证实。在由正常视网膜分离的Müller细胞上,mGluR I的选择性激动剂DHPG压抑Kir电流,这种压抑作用能被MPEP(mGluR5的拮抗剂)所阻断。药理学实验进一步显示,介导DHPG效应的是:胞内钙依赖的PLC/IP3-rynordine/PKC信号通路,而cAMP-PKA通路并未参与其中。如果在正常大鼠玻璃体中注射DHPG会使Müller细胞产生类似于在慢性高眼压大鼠所见的变化,而DHPG所诱导的GFAP在Müller细胞上表达的增加能为Ba+所阻断,提示Kir通道参与这一效应。所有这些结果表明,高眼压所致胞外谷氨酸浓度的增高可使mGluR5过度激活,压抑Kir通道,从而使Müller细胞产生胶质化激活[12](参见图2模式图)。这意味着:如果以某种方式使青光眼情况下视网膜mGluR5的活性适当降低,从而减轻Müller细胞的再激活,有可能是防止神经节细胞丢失的一种有效途径。
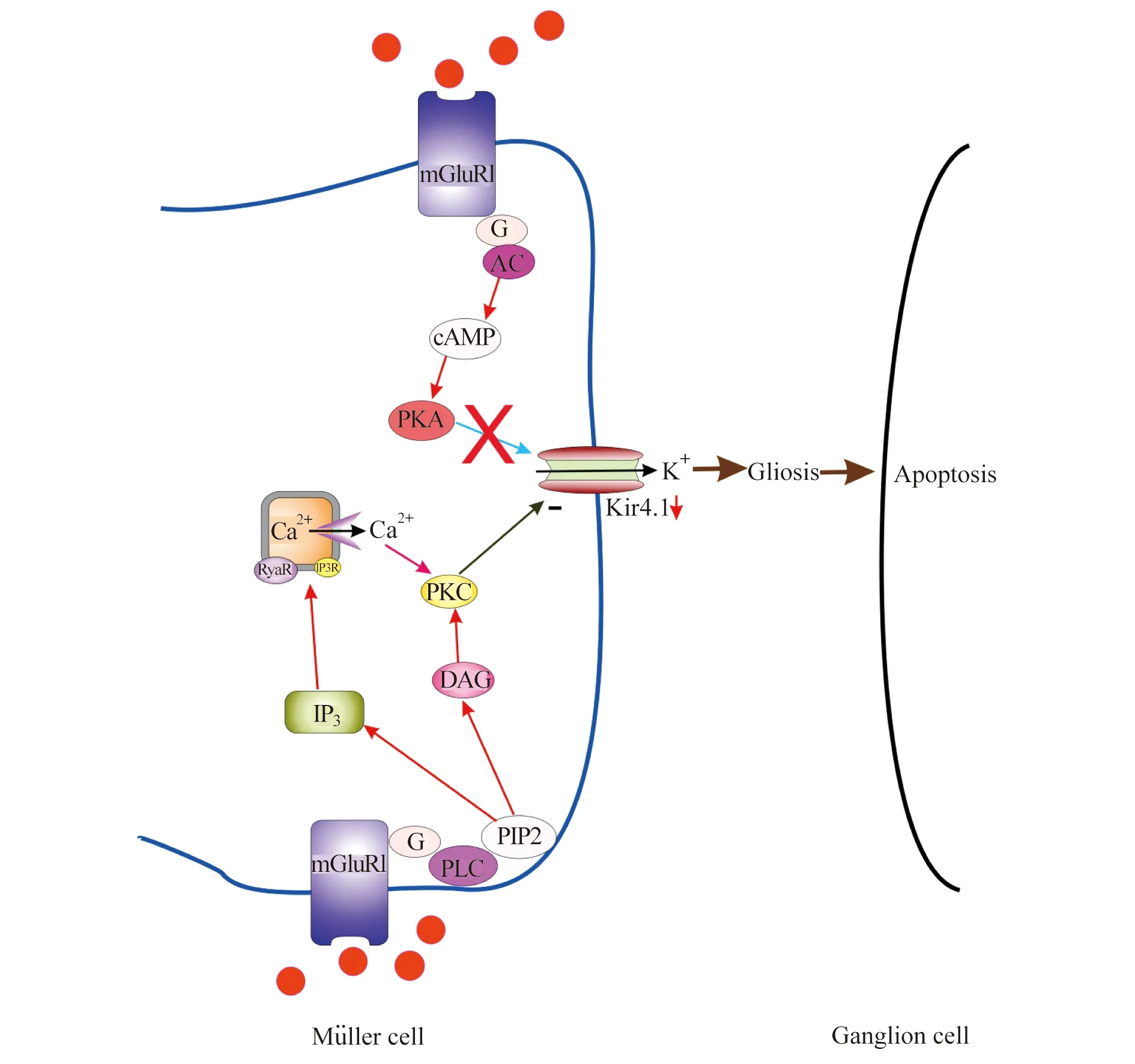
图2 高眼压情况下Müller细胞如何发生胶质化的模式图Fig 2 A schematic drawing showing how gliosis of Müller cells is caused under ocular hypertension
高眼压引起EphB/ephrin B反向信号的激活导致神经节细胞的凋亡 ephrin/Eph信号系统的特点是产生双向性信号,其正向信号作用于表达Eph (受体)的细胞,而反向信号作用于表达ephrin(配体)的细胞[13]。研究这一系统在高眼压所致神经节细胞死亡中的作用,是我们青光眼研究中的另一个主题[14]。首先,免疫组化实验显示,EphB1在Müller细胞表达,而ephrinB2除Müller细胞外,也在神经节细胞表达,EphB1和ephrinB因此在神经节细胞组成了EphB/ephrinB反向信号系统。在慢性高眼压大鼠,EphB1和ephrinB2表达显著增高,反向信号激活,伴有磷酸化(p)-src激酶、AMPA受体GluA2亚基和pGluA2蛋白水平的增高。在正常视网膜,将EphB2-Fc(EphB2的激动剂)作玻璃体内注射,其TUNEL正信号增加,免疫共沉淀测试表明在ephrinB2、p-src和GluA2之间存在直接的相互作用。此外,在慢性高眼压大鼠,视网膜细胞表面的GluA2蛋白的表达降低。这种GluA2的胞吞(endocytosis)能为手术前玻璃体内注射PP2(src家族酪氨酸激酶的抑制剂)所阻断。在正常大鼠玻璃体内注射EphB2-Fc,上述蛋白水平发生与慢性高眼压大鼠上观察到的相似的变化,这些变化均能为手术前注射PP2所阻遏。膜片钳实验进一步显示,在获PP2注射的大鼠,神经节细胞的由 AMPA受体介导的兴奋性突触后电流(EPSC)的电流-电压关系具有更强的内向整流特性。进而,在获EphB2注射的大鼠或慢性高眼压大鼠,若手术前注射PP2或Naspm(钙通透的无GluA2亚基AMPA受体的抑制剂),则神经节细胞的凋亡大幅降低。从这些结果可以得出推论:EphB2/ephrinB2反向信号的激活所引起的GluA2 trafficking的升高,是引起慢性高眼压大鼠神经节细胞凋亡的原因之一。这些成果归纳于图3的模式图。
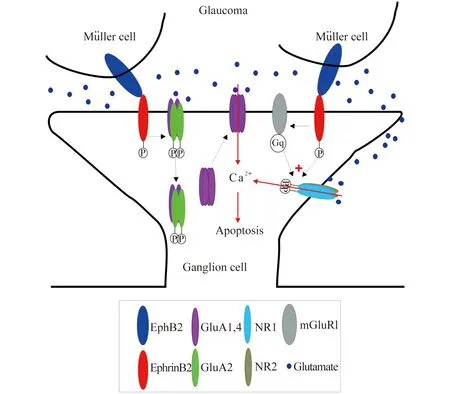
图3高眼压情况下EphB/ephrinB反向信号的激活
如何导致视网膜神经节细胞的凋亡
Fig3AschematicdrawingshowinghowtheactivationofEphB/ephrinBreversesignalingleadstoapoptosisofretinalganglioncellsunderocularhypertension
近视眼研究 主要围绕多巴胺(dopamine,DA)在眼的屈光发育和近视形成中的作用这样一个中心问题展开研究。
按目前主流的观点,在近视形成的过程中DA是一个起关键作用的重要信号分子[15],其在视网膜中的浓度在近视时降低,提示视网膜中DA 能无长突细胞结构和功能的改变。近年来由于遗传操作较易进行,小鼠已成为近视研究的一种重要的动物模型。我们在参加有关近视研究的973项目时,作为研究工作的一项重要基础,首先需要确定在形觉剥夺导致近视(FDM)形成的CB57小鼠模型视网膜DA浓度是否以及如何发生变化的[16]。
在成功建立的C57BL/6小鼠FDM模型上(在形觉剥夺4周内,眼的屈光度发生 5.0 D的变化),用HPLC技术测定了视网膜DA的浓度。出乎意料,在形觉剥夺4周所造成的近视眼上获得的数据,与同一动物对照组之间差异并无统计学意义。不仅如此,DA的代谢产物DOPAC的含量,不管在视网膜中还是玻璃体中,与对照组差异均无统计学意义。反映胞外DA水平的多巴胺转运体的表达也未发生变化。与这些现象相一致,形态学研究表明,视网膜中唯一产生DA的无长突细胞的数量和它们的突起所占据的平均面积,乃至酪氨酸羟化酶(DA的合成酶)的表达,均未发生改变。所有这些结果都清楚表明,C57BL/6小鼠当形成FDM时,其视网膜的DA系统基本不受影响;在这种小鼠,视网膜DA水平与FDM的发展并无关联。
对DA在近视的作用持有传统观点的研究者对我们的这一结果提出了强烈的质疑,这充分反映在当论文投寄InvestigativeOphthalmologyandVisualScience杂志后评审专家表示的意见中。他们的总体观点是:这项结果强烈地挑战有关DA在屈光发育过程中作用的现代观点,即研究结果必须是无可挑剔的。他们对结果提出了长达数十页的问题和质疑。为了回答这些质疑,我们又补充了许多实验结果,数易其稿,从送审日算起,历经一年半之久才正式发表。
那么,DA在屈光发育中究竟起什么作用呢?我们接着采用6-羟多巴胺(6-OHDA)人为地使视网膜DA水平降低,考察对屈光发育的影响。6-OHDA是一种神经毒性物质,特异地损毁多巴胺能细胞,从而使DA水平降低。当玻璃体内注射6-OHDA的剂量为6.25 μg和12.5 μg时,视网膜DA和酪氨酸羟化酶水平显著降低。但ERG a波 和b波幅度并不受到影响,这表明在这两个浓度6-OHDA注射时,所产生的效应主要由于6-OHDA对DA能神经元特异作用所致。在正常视觉环境中,6-OHDA以剂量依赖的方式诱导近视性屈光偏移。特别值得注意的是,形觉剥夺在6-OHDA注射的眼能诱导程度更深的近视性屈光偏移,但却并不引起DA的进一步下降。光学参数测定显示,尽管6-OHDA注射和形觉剥夺均引起近视性屈光变化,但原因是不同的:在前者是由于眼轴变短,而角膜曲率变得更大,在后者的情况下,则是眼轴增长,角膜曲率不变[17]。
综合以上结果,可以作出如下的推论:在C57BL/6小鼠,对于屈光调节存在两种不同的机制,一种依赖于DA,另一种不依赖于DA,这两种机制以不同的方式运转(图4)。这个推论是否能拓展至人类,尚需进一步实验的验证。但是这两种机制的存在,显然有助于机体能按照各种不同的环境,以不同的机制来调节屈光系统的发育。另一方面,这两种机制同时存在的可能性提示我们,在考虑如何防止近视的发生以及矫正近视时采取何种措施,一定要十分谨慎,不能只考虑存在多巴胺依赖性一种机制。
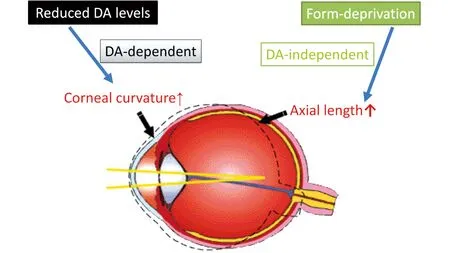
图4 参与大鼠眼球屈光发育和形觉剥夺近视形成的两种机制:多巴胺(DA)依赖及DA非依赖的Fig 4 A schematic drawing showing that both dopamine-dependent and dopamine-independent mechanisms,underlying myopic refractive shifts,coexist in mouse retina
致谢本文是我的实验室近十年部分工作的小结。这些工作中有许多是我的同事钟咏梅、王中峰、翁史均、苗艳颖领导的研究小组完成的,他们和众多学生的贡献构成了这篇文章的主体。藉此机会,谨对所有参与研究的人员表达作者深切的谢意。我们的研究多年来得到科技部、教育部、基金委、上海市科委的多项基金资助,关于这些基金的具体信息均在原始论文发表的杂志上清楚地标明,限于篇幅,不再详述。
为节省篇幅,本栏列出的文献仅为与本文有关的主要文献,详细的参考文献请参阅本人相关论文所引述之引文目录。
[1] TOSINI G,POZDEYEV N,SAKAMOTO K,etal.The circadian clock system in the mammalian retina[J].Bioessays,2008,30(7):624-633.
[2] DUBOCOVICH ML,DELAGRANGE P,KRAUSE DN,etal.International Union of Basic and Clinical Pharmacology.LXXV.Nomenclature,classification,and pharmacology of G protein-coupled melatonin receptors[J].PharmacolRev,2010,62(3):343-380.
[3] HUANG H,WANG Z,WENG SJ,etal.Neuromodulatory role of melatonin in retinal information processing[J].ProgRetinEyeRes,2013,32:64-87.
[4] HUANG H,LEE SC,YANG XL.Modulation by melatonin of glutamatergic synaptic transmission in the carp retina[J].JPhysiol,2005,569(Pt 3):857-871.
[5] PING Y,HUANG H,ZHANG XJ,etal.Melatonin potentiates rod signals to ON type bipolar cells in fish retina[J].JPhysiol,2008,586(Pt 11):2683-2694.
[6] SNELLMAN J,NAWY S.cGMP-dependent kinase regulates response sensitivity of the mouse on bipolar cell[J].JNeurosci,2004,24(29):6621-6628.
[7] YANG XF,MIAO Y,PING Y,etal.Melatonin inhibits tetraethylammonium-sensitive potassium channels of rod ON type bipolar cells via MT2 receptors in rat retina[J].Neuroscience,2011,173:19-29.
[8] ZHAO WJ,ZHANG M,MIAO Y,etal.Melatonin potentiates glycine currents through a PLC/PKC signalling pathway in rat retinal ganglion cells[J].JPhysiol,2010,588(Pt 14):2605-2619.
[9] JI M,ZHAO WJ,DONG LD,etal.RGS2 and RGS4 modulate melatonin-induced potentiation of glycine currents in rat retinal ganglion cells[J].BrainRes,2011,1411:1-8.
[10] SOFRONIEW MV.Ractive astrocytes in neural repair and protection[J].Neuroscientist,2005,11(5):400-407.
[11] BRINGMANN A,IANDIEV I,PANNICKE T,etal.Cellular signaling and factors involved in Muller cell gliosis:neuroprotective and detrimental effects[J].ProgRetinEyeRes,2009,28(6):423-451.
[12] JI M,MIAO Y,DONG LD,etal.Group I mGluR-mediated inhibition of Kir channels contributes to retinal Muller cell gliosis in a rat chronic ocular hypertension model[J].JNeurosci,2012,32(37):12744-12755.
[13] PASQUALE EB.Eph-ephrin bidirectional signaling in physiology and disease[J].Cell,2008,133(1):38-52.
[14] DONG LD,GAO F,WANG XH,etal.GluA2 trafficking is involved in apoptosis of retinal ganglion cells induced by activation of EphB/EphrinB reverse signaling in a rat chronic ocular hypertension model[J].JNeurosci,2015,35(13):5409-5421.
[15] FELDKAEMPER M,SCHAEFFEL F.An updated view on the role of dopamine in myopia[J].ExpEyeRes,2013,114:106-119.
[16] WU XH,LI YY,ZHANG PP,etal.Unaltered retinal dopamine levels in a C57BL/6 mouse model of form-deprivation myopia[J].InvestOphthalmolVisSci,2015,56(2):967-977.
[17] WU XH,QIAN KW,XU GZ,etal.The Role of Retinal Dopamine in C57BL/6 Mouse Refractive Development as Revealed by Intravitreal Administration of 6-Hydroxydopamine[J].InvestOphthalmolVisSci,2016,57(13):5393-5404.
Modulationofretinalinformationandretinaldiseases
YANG Xiong-li△
(InstitutesofBrainScience,FudanUniversity,Shanghai200032,China)
In this article a general account of the major results in retina research obtained by my team in the past ten years is provided.The basic research of my team is exemplified by the study of neuromodulatory action of melatonin on retinal neurons.This is followed by a brief description of our endeavor in exploring the pathogenesis of glaucoma,focusing on the involvement of Müller cell gliosis a nd reverse signaling of the ephrin/Eph signaling system in apoptosis of retinal ganglion cells.Finally,our recent studies,concerning roles retinal dopamine (DA) plays in refractive development and form-deprivation myopia (FDM) are presented.Our results strongly suggest that a DA-independent mechanism may work together with a DA-dependent mechanism,mediating refractive development and FDM formation.
retina; retinal diseases; neural signal
R774
A
10.3969/j.issn.1672-8467.2017.06.001
△Corresponding author E-mail:xlyang@fudan.edu.cn
2017-09-26;编辑:张秀峰)

