用模块化思维破解制备类实验装置
山西 刘 伟 河北 孙红霞
用模块化思维破解制备类实验装置

以陌生物质制备为背景的实验题,一直是高考考查的重点,而有气体参与的制备实验又是此类试题中最耀眼的明星题型。由于这类实验涉及的物质多、装置多、反应多,令广大考生望而生畏,本文重点解决有气体参与的制备类实验的通法、通解,旨在减轻师生的备考负担。
一、树立模块化思维
1.思考程序模块化
物质是化学实验的核心,所以首先要分析在给定条件下反应后有哪些物质存在,然后就可以结合实验目的自行设计所需实验装置或分析命题人提供的实验装置的作用,有些装置几乎在所有制备实验中都会出现,我们称之为“常规装置”,还有一些装置是出于某些特殊目的而设置,我们称之为“个性装置”,具体思维程序见下图:

2.实验装置模块化
设计或分析有气体参与的实验装置时,可参照如下模块辅助我们思考。
气体制备实验自左至右可能涉及的模块:气体发生装置→除杂装置→干燥装置→收集装置→(尾气处理装置)
有气体参与的制备实验自左至右可能涉及的模块:气体发生装置→除杂装置→干燥装置→目标产物制备装置→(防干扰装置)→(除杂装置)→(收集装置)→(防干扰装置)→(尾气处理装置)
需要注意的是,干燥装置本质上属于除杂装置,由于此装置在制备实验中非常重要和普遍,故单独作为一个模块列出。
上述所列装置,括号中的装置为个性装置,要根据具体的题目作出选择,如某些成分从右侧进入目标产物制备装置与装置中的物质发生反应,则需要在目标产物制备装置的右侧设置防干扰装置;如目标产物制备装置中生成的是气体或易挥发的物质,就要设置收集装置;如尾气有毒、有害或易燃、易爆就要设置尾气处理装置。
3.实验中的潜规则
潜规则1:在有气体参与的制备实验中,如果题中涉及的是中学常见气体,且题目中没有明确指出用哪种方法制取,要结合题中装置,优先选用课本上提供的制备方法。
附:常见气体的制备方法。


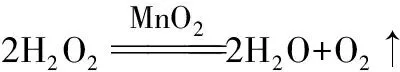








潜规则2:制备类实验对除杂问题要求比较严格,气体进入目标产物制备装置前,那些与反应无关的气体一般都要除掉。
二、各模块装置详解
1.气体发生装置
(1)“固(或液)+液”不加热装置

装置①反应液一次性通过长颈漏斗加入,不能对反应进行有效控制;装置②可通过夹紧夹子,使反应停止,打开夹子使反应又进行,使反应得到控制;装置③和④可通过分液漏斗控制反应液的滴加速度,从而控制反应速率;装置⑤夹紧夹子或将干燥管提起脱离反应液,从而控制反应进行。
(2)“固(或液)+液”加热装置


装置①为中学课本上提供的“固(或液)+液”加热装置,根据反应的需要,可开发出后面5种常用的改良装置。
装置②可通过分液漏斗滴加反应液,从而控制反应速率;装置③可通过温度计,控制反应温度,减少副反应的发生;装置④采用水浴(或油浴)加热,使反应装置受热均匀,便于控制温度;装置⑤用导气管g将分液漏斗上口和圆底烧瓶相连,使分液漏斗内压强和圆底烧瓶内压强相等,便于液体顺利滴下;装置⑥常用于有机物的制备,使用恒压滴液漏斗,便于液体顺利滴下,使用球形冷凝管,可使易挥发的有机物冷凝回流,提高反应物的利用率。
(3)“固+固”加热装置

如装置①所示,绝大多数情况下,“固+固”加热装置的试管口要略向下倾斜,防止固体中存在的水分(受热形成水蒸气)或反应生成的水蒸气在试管口冷凝为液态水,倒流回到试管底部,使试管炸裂。但少数固体在加热过程中会熔化为液体,这种情况下就需要试管口略向上倾斜了,如装置②所示。
2.除杂装置

装置①被称为“洗气瓶”,“洗气瓶”盛放的是溶液或液体除杂试剂,气体的进入方向为“长导气管一端进气,短导气管一端出气”,除杂试剂不能影响预保留的气体,如除去氢气中的氯化氢气体可选择NaOH溶液,除去氯气中的氯化氢气体可选用饱和食盐水,除去二氧化碳中的氯化氢可选择饱和碳酸氢钠溶液,除去乙烯中的CO2和SO2可选用NaOH溶液。
装置②干燥管和装置③U形管中盛放的都是固体除杂试剂,当气体杂质与固体除杂试剂常温下能反应时,可选用此类装置。
装置④玻璃管中盛放的也是固体除杂试剂,当气体杂质与固体除杂试剂需要在加热条件下才能反应时,可选用此装置。如除去氮气中的氧气可选用铜粉。
3.干燥装置

用干燥剂除去少量水分的方法叫干燥,常用的干燥剂有三类:酸性干燥剂、中性干燥剂、碱性干燥剂。
酸性干燥剂浓硫酸可干燥N2、O2、H2、CO、CO2、SO2等常见气体,不能干燥NH3以及还原性气体H2S、HI、HBr等。
中性干燥剂无水CaCl2可干燥绝大多数气体,但不能干燥NH3。
碱性干燥剂碱石灰能干燥N2、O2、H2、NH3等气体。
干燥剂浓硫酸常用装置①盛放,无水CaCl2、碱石灰常用装置②或装置③盛放。
4.目标产物制备装置
根据反应物的状态以及反应条件的不同,选择不同类型的装置。

装置①常用于气体和固体加热反应,装置②常用于气体和溶液反应。
5.收集装置
(1)常见排空气收集装置

装置①是经典向下排空气法收集气体的装置,用来收集密度比空气小的气体,装置②是经典向上排空气法收集气体的装置,用来收集密度比空气大的气体,装置③和装置④既可收集密度比空气大的气体也可收集密度比空气小的气体,从a口或c口进气可收集密度比空气大的气体,从b口或d口进气可收集密度比空气小的气体(判断秘诀:把收集装置想象成限制气体自由的集中营,从哪个导气管口进入收集装置后,气体聚集在该导气管出口附近,就是正确的进气方向。)
(2)常见的排液收集装置

难溶于水且与水不发生反应的气体,都可用上图三个装置排水收集。若收集易溶于水或能与水反应的气体,我们可以把水换成其他的液体,如可用排植物油收集氨气,可用排饱和食盐水收集氯气等。
(3)特殊物质的收集装置

若某产物在反应温度下是气体,但离开目标产物制备装置后,温度降低该物质变成固态物质,为了防止固态物质堵塞导气管,发生危险,连接目标产物制备装置和收集装置的导气管往往很粗,如装置①所示。
若某产物在反应温度下是气体,而降温后易转化为液体或固体物质,可给收集装置增加冷凝装置,使气体及时冷凝为液体或固体,减少挥发,便于收集。如装置①中盛有冷水的烧杯和装置②中盛有冰水的水槽。
6.尾气处理装置
有毒、有害的气体(如氯气、氯化氢、二氧化硫等)或易燃、易爆的气体需要设置尾气处理装置。
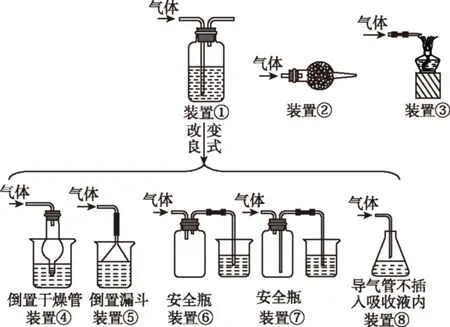
装置①若盛有碱液(如NaOH溶液)可吸收氯气、氯化氢、二氧化硫等。
装置②若盛有碱石灰也可吸收氯气、氯化氢、二氧化硫等。
装置③是典型的“引燃法”处理尾气,可处理H2、CO等易燃、易爆的气体。
若气体在吸收液中溶解度较大,则可能会导致装置中压强迅速降低,可使用装置④→装置⑧所示装置,预防倒吸事故的发生。
7.防干扰装置
有些制备实验,空气中的某些成分(如水蒸气、CO2、O2等)可能会与目标产物制备装置中的物质发生反应或者制备实验中用到了可燃性气体,而可燃性气体与空气混合加热会发生爆炸,在目标产物制备装置发生反应前,要先通入一段时间的气体,排尽装置中的空气。

