如何促进反应原理核心概念的形成
王福成
“化学反应限度”是中学化学的一个教学难点。国内外的研究表明,学生对化学反应限度的认识一直存在较多误区。例如,学生把可逆反应达到化学反应限度时的化学平衡与日常生活中的平衡等同起来,认为所谓的平衡就是指静止的、不变的状态[1],而非动态平衡。学生不是把平衡混合物看作一个整体,而是认为化学平衡的两边各自独立进行,在逆反应开始之前,反应先往正方向进行且达到完全,接着反应又朝着逆方向进行,如此反复交替,如同钟摆运动[2][3]。
新课标中明确要求应设计实验证明某些化学反应的可逆性,而教师在处理方法上多以问题引导,直指问题核心—理解化学平衡的建立过程与本质特征,缺乏实验根基。从教学目标来看,如果简单地将“化学反应限度”内容定位于“通过实验认识化学反应的限度”,就会失去一次帮助学生建构化学反应原理核心概念的契机。
一、核心概念分析及教学目标确定
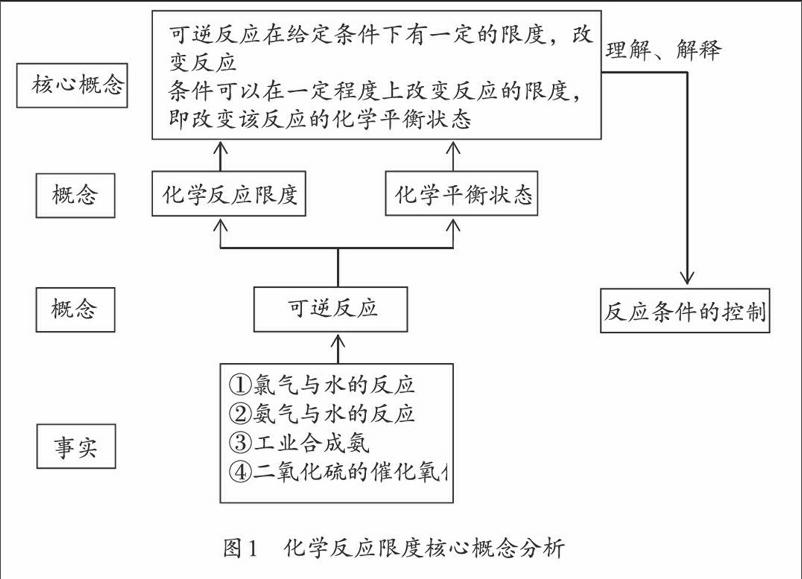
“化学反应限度”属于化学热力学研究的范畴,是中学化学的重要概念之一。它是中学化学涉及的溶解平衡、电离平衡和水解平衡等知识的核心,对学生研究物质在水溶液中的行为起着极其重要的指导作用。“化学反应限度”是理解化学反应的一个重要维度,是建立“平衡观”的起点,是选修“化学反应原理”的必要基础。
热力学认为,与一切自然过程一样,一定条件下进行的化学反应受到来自能量和熵的两个方向的推动:一方面倾向于达到能量的最低状态,另一方面又力求实现熵的最大状态。两种推动的效果正好相反,而又同时存在。“相同条件”“同时进行”和“自发地趋向于平衡”,是一切可逆反应的共同特征。当可逆反应达到平衡状态时,基本特征是体系中的所有组分的浓度不再继续随时间而改变。由于反应物和生成物共存,到达平衡状态时正逆反应不会停止,其实质是动态平衡,宏观表现为正逆反應速率相等。此时,可逆反应在该条件下达到最大程度,即反应限度。当条件改变时,这种动态平衡就会被破坏,直至达到新的平衡,反应限度也随之改变。因此,本节课的核心概念为可逆反应在给定条件下有一定的限度,改变反应条件可以在一定程度上改变反应限度,即改变该反应的化学平衡状态。因此,通过调控反应条件,可使反应更好地符合人们预期的结果(见图1)。
基于以上分析,本节课的教学重点和难点为:理解可逆反应的特征;认识化学平衡状态的特征和实质。
二、挖掘实验教学功能,促进核心概念形成
1.科学史话激疑,引入可逆反应概念
傅鹰先生说过:“化学可以给人以知识,化学史更可以给人以智慧。”用化学史料创设问题情境,可以充分反映人们在认识自然界过程中的科学态度和科学思想,有利于学生学到形成和运用知识的科学方法,养成严谨求实的科学态度。
例如,钢铁生产是17世纪从英国开始的第一次产业革命的两大支柱之一。但炼制1t生铁所需焦炭的实际用量,远高于按照化学反应方程式计算所需的量,且从高炉顶端出来的气体中总含有没被充分利用的CO气体。起初,炼铁工程师认为是CO与铁矿石接触不够充分之故,于是设法增加高炉的高度。然而令人吃惊的是,高炉增高后,高炉尾气中CO的比例竟然没有改变。这时教师就可以提问学生:你能揭开炼铁工程师的困惑吗?
2.自主实验探究,建构可逆反应概念
教师要善于发现和提出有探究价值的化学问题,引导学生依据探究目的,设计并优化实验方案,完成实验操作,对观察记录的实验信息(证据)进行加工并获得结论,培养学生敢于质疑和批判的创新精神。
【问题1】将0.01mol/L的FeCl3溶液与0.01mol/L的KI溶液混合,会发生怎样的反应?说出你的依据。
【设计说明】调研发现,学生尚未形成认识化学反应的一般思路,即性质决定反应,反应是性质的体现。他们虽然形成了认识物质性质的三个视角—氧化还原、类别和元素周期律(表),但不会自觉地将三者有机结合,为此,教师设计了问题1。Fe3+具有较强的氧化性,I-还原性如何?根据元素周期律,碘元素的非金属性较弱,推知碘单质的氧化性较弱,则I-还原性较强,因此,Fe3+和I-之间可能会发生氧化还原反应。
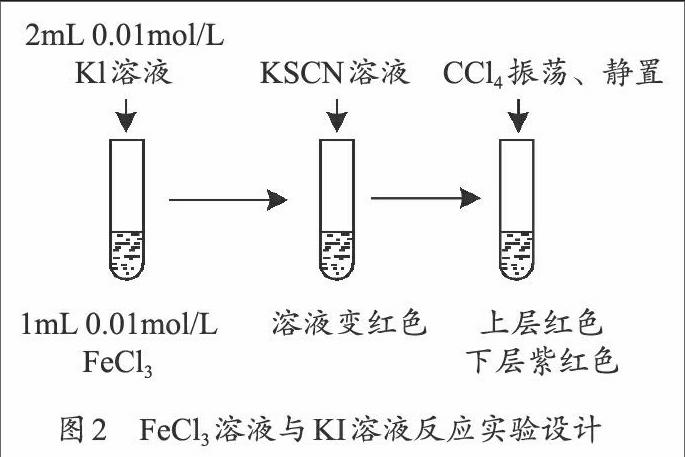
【学生活动1】设计实验证明反应:2Fe3++2I-→2Fe2++I2
试剂:0.01mol/L的KI溶液、0.01mol/L的FeCl3溶液、0.1mol/L的KSCN溶液和CCl4。
【设计说明】用氯化铁与碘化钾证明化学反应有一定限度,一些教师提出还可用“CCl4—K4Fe(CN)6法”“淀粉—KSCN法”[4]。
实验设计见图2。
【问题2】你认为可能是哪些原因,使Fe3+不能全部消耗?
【设计说明】将少量FeCl3溶液与过量KI溶液混合后,Fe3+仍然有剩余,说明正向反应没有完全进行到底,即反应有一定限度吗?不能。Fe3+不能全部消耗,可能存在以下三个原因:从体系内考虑,还原性强的Fe2+可能会被氧化性较弱的I2氧化;氧化还原型离子反应普遍比复分解型反应速率慢;从环境因素看,可能是空气中的氧气将Fe2+氧化。
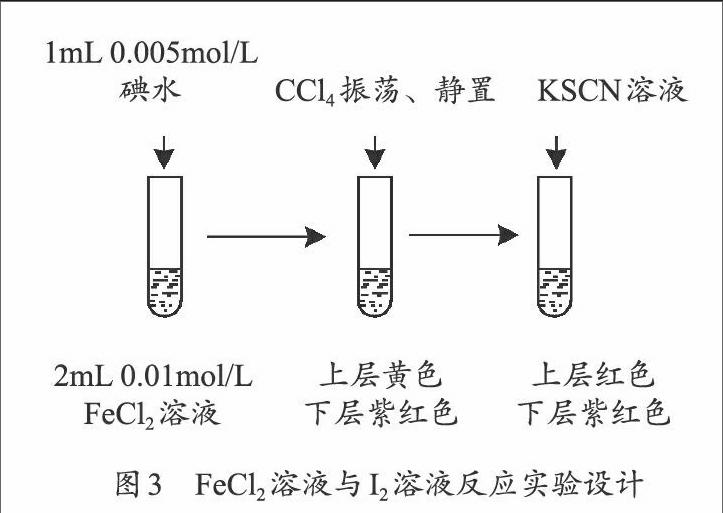
【学生活动2】设计实验证明反应:2Fe2++I2 →2Fe3++2I-
试剂:0.005mol/L碘水、0.01mol/L FeCl2溶液、0.1mol/LKSCN溶液和CCl4。
【设计说明】Fe3+与I-反应速率慢,是一个不可忽略的因素,需要在相同条件下证明逆反应的存在,实验设计见图3。
基于以上实验事实得出结论:相同条件下,反应2Fe3++2I-2Fe2++I2是可逆的。
3.深挖实验素材,建构反应限度概念
基于实验信息(证据)进行分析推理,认识化学现象与数学模型之间的联系,由宏观到微观,由微观再走向宏观,是促进学生形成科学概念的重要手段。
【学生活动3】若在t1时刻溶液颜色不再变化,请学生在图4中画出I2浓度随时间变化的曲线。endprint
【问题3】从t1时刻开始,反应“停止”了吗?为什么?
【设计说明】引导学生由定性到定量认识化学平衡状态的基本特征,是反应物和生产物浓度不再改变;之所以反应没有“停止”,是由于反应物和生成物微粒共存于同一体系,微粒间的相互作用仍然存在。
【学生活动4】判断图4中A、B、C、D四点用Fe3+表示的正逆反应速率大小,在图5中画出v(Fe3+)—t曲线。
【设计说明】认识到化学平衡的实质是动态平衡,宏观表现为正逆反应速率相等。A点时正反应c(Fe3+)最大,正反应速率最大;逆反应生成的c(Fe3+)是0,逆反应速率为0。B点时正反应消耗的c(Fe3+)减小,正反应速率减小;逆反应生成的c(Fe3+)增大,逆反应速率增大,v正(Fe3+)>v逆(Fe3+),因此仍然表现为c(Fe3+)减小。从C点到D点,正反应消耗的c(Fe3+)与逆反应生成的c(Fe3+)相等,v正(Fe3+)=v逆(Fe3+),表现为c(Fe3+)不再发生变化。这时教师要总结化学平衡状态和化学反应限度及其特征。
4.完善实验探究,形成核心概念
无论是对学生还是科学家,科学活动和科学思维的目的都是为了理解世界,通过实验探究,可以使学生体会完整的科学探究过程,优化实验教学设计,建构合理的知识结构,从而有利于形成核心概念。例如,如果向图2实验中继续加入0.1mol/L的KI溶液,振荡,上层红色变浅,由此你会得出什么结论?你怎样认识可逆反应、化学平衡和化学反应限度间的关系?
通过演示实验,学生可以认识到可逆反应在一定条件下建立的化学平衡状态是可以改变的,从而形成本节课的核心概念:可逆反应在给定条件下有一定的限度,改变反应条件可以在一定程度上改变反应限度,即改变该反应的化学平衡状态。
三、反思
核心概念的形成需要大量的实证,运用分类与比较、宏观与微观、定性与定量相结合等化学思想方法,抽象概括出事物的关键特征。在教学过程中,实证越丰富,关键特征越明显,越有利于核心概念的理解。化学实验是获得实证的常用方式,学生需要根据实验目的设计实验,通过观察并记录实验数据获得实证。实践表明,深入挖掘实验教学功能,有助于促进核心概念的形成,提高学生的学科素养。
参考文献:
[1]Maskill,R.,Cachapuz,A.F.C.,Learning about the Chemistry Topic of Equilibrium[C].The Use of Word Association Tests to Detect Developing Conceptualizations. International Journal of Science Education,1989,11(1).
[2]Vanessa Barker.Beyond Appearances:StudentsMisconceptions about Basic Chemical Ideas[R].A Report Prepared for the Royal Society of Chemistry.
[3]Bergquist,W.,Heikkinen,H.,StudentsIdeasregarding Chemical Equilibrium[J]. Journal of Chemical Education,1990,67(12).
[4]朱正德.氯化鐵溶液与碘化钾溶液反应限度实验的设计[J].化学教学,2012(4).
责任编辑:孙建辉endprint

