Yarrowia lipolytica H222(pox1-6缺陷)利用苹果渣酶解液与葡萄糖发酵合成微生物油脂的对比研究
刘 梁,尤毅娜,孟永宏
(陕西师范大学 食品工程与营养科学学院,西安 710119)
YarrowialipolyticaH222(pox1-6缺陷)利用苹果渣酶解液与葡萄糖发酵合成微生物油脂的对比研究
刘 梁,尤毅娜,孟永宏
(陕西师范大学 食品工程与营养科学学院,西安 710119)
分别以苹果渣酶解液和葡萄糖作为发酵培养基的碳源,以YarrowialipolyticaH222(pox1-6 缺陷)为实验菌株合成微生物油脂。分析比较发酵液中细胞干重、总油脂含量、总油脂产量及脂肪酸组成。结果表明:以苹果渣酶解液为碳源的发酵液中细胞干重、总油脂含量、总油脂产量、脂滴大小均较以葡萄糖为碳源的发酵液有显著增高;当发酵至3 d时,80 g/L总糖含量的苹果渣酶解液为碳源的发酵液中总油脂产量达到最高(0.088 mg/mL),明显高于以葡萄糖为碳源的发酵液中总油脂产量,并且不同碳源的发酵液中主要脂肪酸组成和含量也存在明显差异。因此,苹果渣酶解液更有利于YarrowialipoliticaH222(pox1-6缺陷)产生油脂。
苹果渣酶解液;葡萄糖;微生物油脂;脂肪酸
当前世界正面临着严重的化石能源危机,生物质能源已受到越来越多国家的关注,但其面临着原料缺口大、成本高、供给季节性强等难题[1]。近年来,微生物油脂以其原料供应足、生产强度大、胞内含油量高及可缓解环境压力等优势[2],成为了生物质能源领域研究的热点之一,同时也为油脂资源的获得提供了一条新的途径[3-4]。
苹果作为世界四大水果之一,全球种植面积约500万hm2,我国产销量均居世界第一位[5]。苹果渣是苹果加工业的副产物,主要由果核、果皮及残余果肉等组成,约占鲜果质量的25%[6],每生产1 t苹果浓缩汁就会产生0.8 t湿苹果渣废料,每年仅陕西省就产生百万吨以上的苹果湿渣[7]。苹果干渣中含有约42%的糖类物质,此外还含有木质素、纤维素、糠醛等其他化学物质[8-9],是一种可被再利用的副产物[10-11]。
本文对苹果渣发酵合成微生物油脂的可行性进行初步分析,并对苹果渣酶解液和葡萄糖利用YarrowialipolyticaH222(pox1-6缺陷)发酵合成微生物油脂、菌体生长、细胞油脂积累、脂肪酸组成进行了研究与分析,为苹果渣发酵生产可再生能源提供理论基础和新的思路。
1 材料与方法
1.1 实验材料
1.1.1 原料与试剂
苹果渣:陕西咸阳阿果安娜果汁有限公司提供,粉碎过筛至20目备用;纤维素酶CTec、HTec2:诺维信公司提供;碳十三酸标准品:Sigma公司;柠檬酸、硫酸铵、甲醇、氢氧化钾、正己烷,均为分析纯;蛋白胨、酵母浸粉、琼脂,均为生物试剂。
1.1.2 仪器与设备
755B紫外可见分光光度计,AUY220分析天平,DZKW-4电热恒温水浴锅,WGL-125B烘箱,THZ-C恒温振荡器,Shimadzu GC-2014C气相色谱仪。
1.2 实验方法
1.2.1 苹果渣预处理及酶解[12]
准确称取苹果渣10.0 g,使用2 mol/L的氢氧化钠调节过氧化氢的pH至11.5。在苹果渣含量为10%的条件下用4.5%的过氧化氢溶液进行预处理(pH 11.5,50℃培养箱,2 h)。预处理结束后煮沸5 min 终止反应,过滤收集苹果渣,用蒸馏水冲洗使pH至中性,置于45℃的烘箱中烘干。
准确称取5.0 g预处理后的苹果渣于250 mL锥形瓶中,加入pH 4.8、0.05 mol/L柠檬酸缓冲溶液和纤维素酶CTec和HTec2,苹果渣中二者的加入量分别为7.4 FPU/g和0.37 FPU/g,使固形物含量为40 g/L,酶终质量浓度为44 μL/g(以苹果渣质量计),充分摇匀后放入恒温摇床中,150 r/min 50℃ 温浴72 h。酶解结束后,沸水浴中煮沸5 min终止酶解反应,过滤收集滤液。旋转蒸发浓缩滤液,用DNS法测定总糖含量。
1.2.2 发酵条件
1.2.2.1 菌种
YarrowialipolyticaH222[13](德国德累斯顿工业大学Matthäus Falk教授馈赠)是一种pox1-6缺陷工程菌株,可积累油脂。敲除pox1-6基因,阻断了油脂中脂肪酸的β氧化,阻止了油脂降解中的第一步,促使油脂积累。
1.2.2.2 培养基
种子培养基(YPD):蛋白胨2%、酵母浸粉1%、葡萄糖2%。制备固体培养基时,添加琼脂1.5%~1.8%。
葡萄糖发酵培养基:葡萄糖40 g/L、(NH4)2SO42.5 g/L、酵母浸粉1.7 g/L。
苹果渣酶解液发酵培养基:将葡萄糖发酵培养基中的40、60、80 g/L葡萄糖转化为苹果渣酶解液中总糖含量,(NH4)2SO4、酵母浸粉添加量相同。
1.2.2.3 培养方法
种子培养:从YPD固体菌种活化平板上挑单菌落接至2 mL YPD种子培养基中, 30℃、160 r/min培养24 h。
发酵培养:分别配制不同碳源糖质量浓度(40、60、80 g/L)的发酵培养基,其他组分质量浓度不变,121℃灭菌20 min。发酵时采用1%接种量,30℃、160 r/min培养6 d。
1.2.3 细胞干重的测定
将发酵液转移至50 mL灭菌离心管中,4℃ 5 000 r/min 离心5 min,并收集菌体。用预冷的无菌水清洗菌体,重复3次。105℃ 干燥至恒重。
1.2.4 脂肪酸组成的测定
采用GB 5413.27—2010 甲酯化法,并参照文献[14]进行样品处理。取发酵1、2、3、4、5、6 d的发酵液1 mL于厌氧管(16 mm×125 mm)中,加入1.0 mL C13∶0(0.5 mg/1.0 mL)作为内标;加入5.3 mL甲醇、0.7 mL氢氧化钾(10 mol/L);85℃水浴15 min进行预处理,冷却试管;加入0.58 mL浓硫酸使脂肪酸甲酯化;旋涡振荡试管,85℃水浴15 min,冷却试管;加入2.0 mL蒸馏水、2.0 mL正己烷溶解,振荡试管5 min, 4 000 r/min离心7.5 min。
样品处理完成后,将顶部正己烷层包裹的样品转入气相进样瓶。GC-2014C气相色谱仪配DB-WAX毛细管柱,进样量1 μL,140℃保持5 min,4℃/min升温到240℃保持20 min,进行脂肪酸组成的测定,计算总油脂含量、总油脂产量。
1.2.5 透射电子显微镜分析
取材:取发酵3 d、80 g/L糖含量的发酵液 1 mL 离心(10 000 r/min,1 min),弃滤液。固定:加入0.5 mL固定液(4%戊二醛),静置24 h(4℃),用0.1 mol/L磷酸盐缓冲液漂洗2次(5 min/次),1%锇酸与0.2 mol/L磷酸盐缓冲液(1∶1)固定(1~2 h),0.1 mol/L磷酸盐缓冲液漂洗2次(5 min/次)。脱水:用50%、70%、80%、90%、95%梯度乙醇各洗1次。浸透及包埋:无水乙醇漂洗3次(5 min/次),丙酮漂洗3次(5 min/次),用包埋剂(环氧树脂)丙酮混合液(1∶1)33℃恒温培养箱中处理样品1 h;纯包埋剂恒温处理1 h(60℃),45℃再处理30 min。用新配包埋剂放胶囊或模板内包埋标本。聚合:35℃过夜,60℃,24~48 h。将包埋好的样品用超薄切片机进行切片,厚度70~80 nm。染色:铅铀染色,最后在JEM-1230透射电子显微镜下观察图片。
2 结果与分析
2.1 不同碳源对细胞干重的影响(见图1)
由图1a可知,以葡萄糖为碳源的发酵液在发酵1~4 d细胞干重呈持续上升的趋势,发酵4 d时细胞干重基本趋近,约为0.093 3 mg/mL,从发酵5 d后细胞干重逐渐下降。由图1b可知,以苹果渣酶解液为碳源的发酵液发酵1~4 d细胞干重持续上升,从发酵4 d后细胞干重基本趋于稳定。对比可知,以苹果渣酶解液为碳源的发酵液中细胞干重明显大于以葡萄糖为碳源的发酵液中细胞干重。因此,苹果渣酶解液中含有能够被YarrowialipolyticaH222利用的碳水化合物,而且碳水化合物营养丰富,非常适宜YarrowialipolyticaH222的生长繁殖。

图1不同碳源对细胞干重的影响(a.葡萄糖;b.苹果渣酶解液,下同。)
2.2 不同碳源对细胞内总油脂含量的影响(见图2)
由图2a可知,以葡萄糖为碳源的发酵液发酵1 d 时,40、60、80 g/L的糖含量对应总油脂含量分别为3.17%、1.90%、2.41%;发酵2~6 d,总油脂含量逐渐减少直至稳定,原因可能是发酵1 d后,培养基中的营养成分逐渐被菌体消耗至不平衡甚至消耗完。由图2b可知,以苹果渣酶解液为碳源的发酵液发酵3 d时,40、60、80 g/L糖含量对应的总油脂含量最高,分别为44.48%、34.05%、41.25%;发酵 3 d 后,总油脂含量有升有降。以苹果渣酶解液为碳源的发酵液中,总油脂含量明显高于以葡萄糖为碳源的发酵液中总油脂含量。因此,以苹果渣酶解液为碳源的发酵液更适合YarrowialipolyticaH222的生长、繁殖和生产油脂。
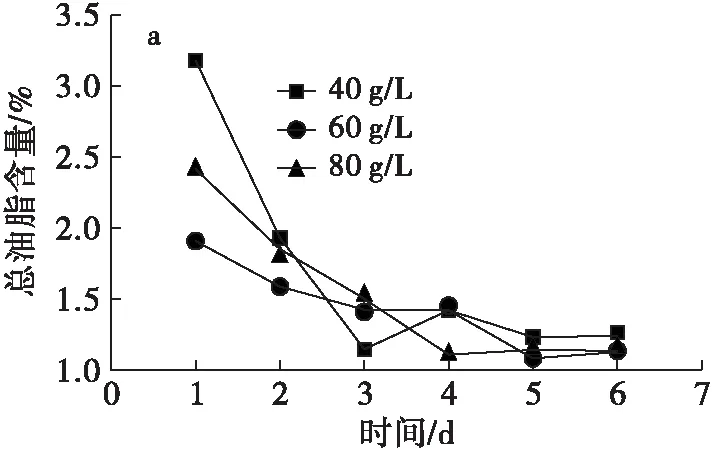
图2不同碳源对细胞内总油脂含量的影响
2.3 不同碳源对细胞内总油脂产量的影响(见图3)
由图3可知,以葡萄糖为碳源的发酵液中总油脂产量有升有降,以苹果渣酶解液为碳源的发酵液中,发酵1~3 d总油脂产量均呈逐渐上升的趋势,从发酵4 d开始,总油脂产量有升有降。原因可能是发酵后期,碳氮比例不合适导致营养失衡,从而使得发酵3 d后的总油脂产量升降不连续。发酵3 d时,以苹果渣酶解液为碳源的发酵液中,40、60、80 g/L总糖含量对应的总油脂产量分别为0.077、0.071、0.088 mg/mL。综合考虑,发酵可选取80 g/L总糖含量和发酵时间3 d。对比可看出,以苹果渣酶解液为碳源的发酵液中总油脂产量远远大于以葡萄糖为碳源的发酵液中总油脂产量。
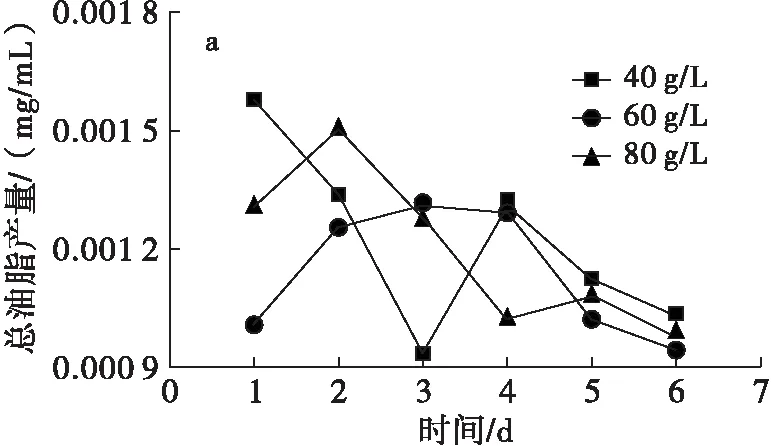
图3不同碳源对细胞内总油脂产量的影响
2.4 不同碳源对油脂中脂肪酸组成的影响
依据发酵时间对细胞干重和总油脂产量的影响结果,选择发酵1 d和3 d发酵液对比分析不同碳源对油脂中脂肪酸组成的影响,结果如图4所示。

图4不同碳源对油脂中脂肪酸组成的影响
由图4可知,YarrowialipolyticaH222利用葡萄糖发酵所产油脂的脂肪酸组成主要以C18和C20系为主[15],发酵1 d C18∶2含量达到最高,为46.96%;发酵3 d C18∶1 含量达到最高,为53.67%。利用苹果渣酶解液发酵所产油脂的脂肪酸组成主要以C16、C18和C20系为主,发酵1 d C20∶0含量达到最高,为44.29%;发酵3 d C18∶0 含量达到最高,为45.70%。因此,不同的发酵时间、不同碳源的发酵液中油脂中主要脂肪酸组成不同,其含量也存在明显差异。
2.5 不同碳源对细胞内脂滴大小的影响(见图5)
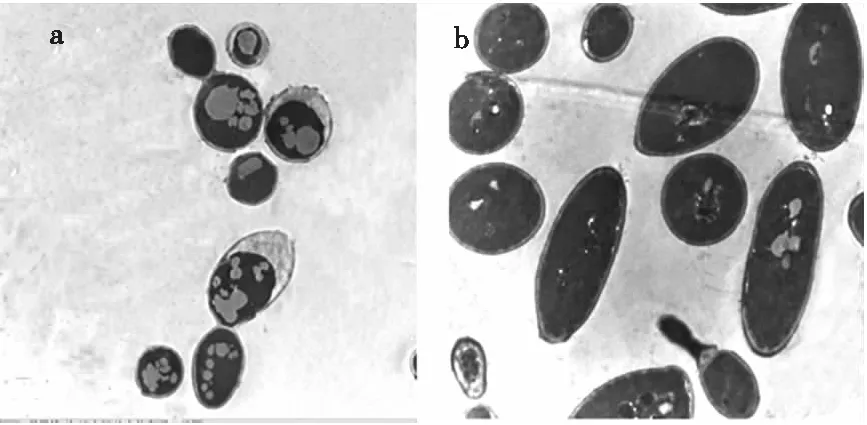
图5 细胞内脂滴的透射电镜图
由图5可知,以苹果渣酶解液为碳源的发酵液中脂滴明显大于以葡萄糖为碳源的发酵液中的脂滴。
3 结 论
通过YarrowialipolyticaH222(pox1-6缺陷)对苹果渣酶解液与葡萄糖发酵合成微生物油脂的对比研究发现,以苹果渣酶解液为碳源的发酵液中细胞干重、总油脂含量、总油脂产量均显著增高,细胞内脂滴也明显增大。说明苹果渣酶解液是一种优异的发酵碳源,可以进一步用于生产可再生能源。但是本研究的酵母油脂含量偏低,今后可以通过优化培养基、探索不同的接种量、探索最佳发酵条件、补充发酵等手段进一步提高油脂含量和油脂产量,提高研究结果的实用性。
[1] XUE F Y, MIAO J X, ZHANG X, et al. Studies on lipid production byRhodotorulaglutinisfermentation using monosodium glutamate wastewater as culture medium[J]. Bioresour Technol, 2008, 99:5923-5927.
[2] NICOLL R W, LAMERS A, LUBITZ W D, et al. Evaluation of algal biomass and biodiesel co-products for bioenergy applications[J]. J Biobased Mat Bioenergy, 2014, 8(4):429-436.
[3] 李为民,郑晓林,徐春明,等. 固体碱法制备生物柴油及其性能[J]. 化工学报,2005,56(4):711-716.
[4] 姚亚光,纪威,符太君,等. 基于酸催化的餐饮业废弃油脂与醇类酯化反应试验研究[J].中国农业大学学报,2006,11(3):113-116.
[5] 张欣. 苹果产业价值链价值增值研究[D]. 陕西 杨凌:西北农林科技大学, 2013.
[6] VENDRUSCOLO F, ALBUQUERQUE P M, STREIT F, et al. Apple pomace: a versatile substrate for biotechnological applications[J]. Crit Rev Biotechnol,2008,28(1):1-12.
[7] 李睿,陈雪峰,麻佩佩. 苹果渣膳食纤维超声波辅助脱色的工艺参数研究[J].食品工业,2013,34(3):128-131.
[8] 张玉臻,林学政,刘宏. 苹果渣皮固态发酵的研究[J]. 食品与发酵工业,1996(3):29-32.
[9] 李彩凤,杨福有. 苹果渣的营养成分及利用[J]. 饲料博览,2001,1(2):19-20.
[10] GIVENS D I. The nutritritive evaluation of apple pomace for ruminant[J]. Anim Feed Sci Technol,1987,16(14):311-315.
[11] 孟桂元, 孙方, 周静,等. 大麻种子含油量及油脂脂肪酸组成分析[J]. 中国油脂, 2017, 42(3):140-143.
[12] 尤毅娜, 邓红, 孟永宏,等. 碱性双氧水预处理对苹果渣化学组分和酶解得率的影响[J].中国农业科学, 2016, 49(8):1559-1566.
[13] BLAZECK J, HILL A, LIU L Q, et al. HarnessingYarrowialipolyticalipogenesis to create a platform for lipid and biofuel production[J]. Nat Commun, 2014, 5(1):149-168.
[14] LI Y, ZHAO Z, BAI F. High-density cultivation of oleaginous yeastRhodosporidiumtoruloidesY4 in fed-batch culture[J]. Enzyme Microb Technol, 2007, 41(3): 312-317.
[15] 王冬梅, 郭书贤, 梁跃辉,等. 酵母菌发酵啤酒生产废水产微生物油脂和菌体蛋白的研究[J]. 中国油脂, 2017, 42(4):108-112.
ComparisonofoilproductionfromenzymatichydrolysateofapplepomaceandglucosebyYarrowialipolyticaH222(pox1-6-)
LIU Liang, YOU Yina, MENG Yonghong
(College of Food Engineering and Nutritional Science, Shannxi Normal University, Xi’an 710119, China)
Microbial oil was synthesized using enzymatic hydrolysate of apple pomace and glucose as carbon source of fermentation medium andYarrowialipolyticaH222(pox1-6-)as experimental strain. The dry cell weight, total oil content, total oil productivity and fatty acid composition in fermentation broth were mainly compared and analyzed. The results showed that when the carbon source was enzymatic hydrolysate of apple pomace, the dry cell weight, total oil content, total oil productivity and oil droplet increased significantly. When fermentation time was 3 d, the total oil content was the highest(0.088 mg/mL) using enzymatic hydrolysate of apple pomace with 80 g/L of total sugar content as carbon source, which was far greater than that of glucose. And the fatty acid composition and content of fermentation broth had obvious differences using different carbon sources. Therefore, using enzymatic hydrolysate of apple pomace as carbon source was more beneficial forYarrowialipolyticaH222(pox1-6-)to synthesize microbial oil.
enzymatic hydrolysate of apple pomace; glucose; microbial oil; fatty acid
TQ644;X792
A
1003-7969(2017)11-0089-05
2017-03-16;
2017-08-24
刘 梁(1993),女,硕士研究生,研究方向为食品工程(E-mail)766088184@qq.com。
孟永宏,副教授,硕士生导师(E-mail)mengyonghong@snnu.edu.cn。

