白细胞介素-8基因在鼻息肉组织中的表达及对鼻黏膜上皮细胞凋亡的影响
郑慧媛 马新春 石 磊 李建民
(青海大学附属医院耳鼻喉科,青海 西宁 810001)
白细胞介素-8基因在鼻息肉组织中的表达及对鼻黏膜上皮细胞凋亡的影响
郑慧媛 马新春 石 磊 李建民
(青海大学附属医院耳鼻喉科,青海 西宁 810001)
目的探讨白细胞介素(IL)-8基因在鼻息肉组织中的表达及对鼻黏膜上皮细胞凋亡的影响。方法Western印迹检测IL-8在鼻息肉组织及下鼻甲组织中的表达;从鼻息肉组织中分离培养人鼻黏膜上皮细胞(HNEC),将IL-8小干扰RNA(IL-8-siRNA)和阴性对照(siRNA-NC)转染细胞,以空脂质体转染的细胞作为对照组,Western印迹检测转染效果;各组转染细胞培养48 h后,流式细胞仪检测细胞的凋亡情况,Western印迹检测酶切caspase3蛋白表达。结果IL-8在鼻息肉组织中的表达显著高于下鼻甲组织(Plt;0.01);siRNA-NC组与对照组差异无统计学意义(Pgt;0.05),IL-8-siRNA组显著低于对照组(Plt;0.01);siRNA-NC组细胞凋亡率及酶切caspase3蛋白表达与对照组比较差异无统计学意义(Pgt;0.05),IL-8-siRNA组均显著高于对照组(Plt;0.01)。结论IL-8在鼻息肉组织中高表达,沉默IL-8的表达能通过上调酶切caspase3蛋白表达促进HNEC凋亡。
白细胞介素-8基因;鼻息肉;鼻黏膜上皮细胞;凋亡
目前鼻息肉发病原因及机制尚不清楚〔1〕。近年来研究发现多种细胞因子参与了鼻息肉的发生发展〔2〕。白细胞介素(IL)-8是一种多源性细胞因子,在炎症和肿瘤中可激活血管内皮细胞及白细胞。IL-8的激活可促进血管内皮细胞的增殖、抑制细胞的凋亡〔1〕。IL-8基因在鼻息肉形成中的作用目前研究尚不清楚。本研究旨在探讨IL-8在鼻息肉组织中的表达及其对鼻黏膜上皮细胞凋亡的影响及机制。
1 材料与方法
1.1一般材料 收集青海大学附属医院2014年6月至2015年7月手术切除后存档的慢性鼻窦炎鼻息肉组织石蜡包埋标本40例,其中男27例,女13例,年龄20~71岁,中位年龄45.1岁。患者均为首次鼻息肉摘除术,且在术前2 w未使用多抗组胺类药物、糖皮质激素。对照组选择同时期在我院进行鼻中隔矫正术患者的下鼻甲组织,其中男16例,女12例,年龄21~51岁,中位年龄34.2岁。所有样品采集均经过患者及家属的知情同意。试剂和仪器:胰蛋白酶购自美国Sigma;DMEM/F12细胞培养基、磷酸盐缓冲液(PBS)购自美国Invitrogen Gibco;BCA蛋白浓度测定试剂盒购自上海碧云天;IL-8、酶切caspase3单克隆抗体及辣根过氧化物标记的二抗均购于美国 Abcam;细胞凋亡试剂盒购自ACTGene公司;酶标仪购自Thermo Labsystems公司;流式细胞仪购自美国BD;CO2细胞培养箱购自美国SIM公司。
1.2方法
1.2.1IL-8在鼻息肉组织中的表达检测 将鼻息肉组织及下鼻甲组织放入研钵研磨成粉末后,加入适量的裂解液置于冰上反应30 min,4℃,12 000 r/min离心20 min,收集上清。按照BCA试剂盒操作说明检测提取的蛋白浓度。充分混匀蛋白样品与上样缓冲液,100℃变性5 min,将变性蛋白加入到制好的十二烷基硫酸钠-聚丙烯酰胺(SDS-PAGE)凝胶,每孔加入25 μl,电泳结束后取出凝胶,4℃转膜1.5 h,5%的脱脂奶粉封闭聚偏氟乙烯(PVDF)膜2 h,以IL-8单克隆抗体作为一抗(1∶1 000稀释),4℃孵育过夜,Tris盐酸缓冲液(TBST)洗膜后加入辣根过氧化物酶标记的羊抗鼠IgG(1∶1 000稀释),37℃孵育2 h。TBST清洗后加入增强化学发光法(ECL)发光剂显影,自动凝胶成像系统采集图像。以甘油醛-3-磷酸脱氢酶(GAPDH)作为内参,分析蛋白表达水平。
1.2.2人鼻黏膜上皮细胞(HNEC)的分离培养 取鼻息肉组织,用4℃的PBS多次冲洗后,加入0.25%的胰酶消化16~18 h,制成细胞悬液。锥虫蓝染色法确定细胞的活性后,将细胞悬液稀释为每升含有108个细胞,置于37℃,5% CO2的培养箱中培养1 h,去除成纤维细胞,转移细胞至6孔细胞培养板中(已加入盖玻片),加入含有5 mg/L转铁蛋白、5 mg/L胰岛素、10 μg/L霍乱霉素、0.36 mg/L氢化可的松、100 μg/L维生素A酸,20 μg/L三碘甲状腺氨酸、25 μg/L表皮生长因子、3.75 mg/L内皮细胞生长因子的DMEM/F12培养基,隔天换液1次,进行无血清原代培养4~5 d。细胞融合度达到80%以上进行消化传代。
1.2.3细胞转染 取生长至对数期的HNEC,调整细胞浓度为106个/ml,接种于6孔细胞培养板中。每孔加2 ml细胞悬浮液,培养24 h。将对照组(空脂质体转染组)、siRNA-NC(转染100 nmol/L的阳性siRNA)、IL-8-siRNA(转染100 nmol/L的IL-8-siRNA)转染到细胞内,室温放置15 min后,取500 μl转染复合物加入到细胞中,置于37℃,5% CO2的培养箱中培养6 h,更换细胞培养液继续培养。
1.2.4细胞凋亡检测 取转染后的上述3组细胞,以3×104个/ml接种于96孔细胞培养板中,取1 ml细胞悬液转移至离心管中,4℃,1 000 r/min离心8 min,弃上清,加入提前预冷的PBS 3次洗涤细胞后,在细胞沉淀中加入200 μl缓冲液,加入 PI和 Annexin-V各5 μl,充分混匀后放置避光条件下反应20 min,加400 μl缓冲液,流式细胞仪检测细胞凋亡率。
1.2.5Western印迹检测酶切caspase3蛋白表达 取转染后培养48 h的1.2.3中的3组细胞,适量的Trizol置于冰上裂解反应30 min后,4℃,12 000 r/min离心15 min,吸取蛋白上清液,BCA试剂盒检测提取的蛋白浓度。按照1.2.1检测酶切caspase3蛋白表达。
1.3统计学方法 应用SPSS21.0软件进行单因素方差分析、t检验。
2 结 果
2.1IL-8在鼻息肉组织中的表达 IL-8在鼻息肉组织中的表达(0.468±0.035)显著高于下鼻甲组织(0.162±0.023,Plt;0.01)。见图1。
2.2IL-8在转染后细胞中的表达 siRNA-NC组细胞中IL-8蛋白表达(0.606±0.035)与对照组(0.611±0.039)差异无统计学意义(Pgt;0.05),IL-8-siRNA组(0.224±0.023)显著低于对照组(Plt;0.01)。见图2。
2.3IL-8对HNEC凋亡的影响 siRNA-NC组细胞凋亡率〔(2.28±0.92)%〕及酶切caspase3蛋白表达(0.092±0.009)与对照组〔(2.23±0.77)%,0.108±0.010〕比较差异不显著(Pgt;0.05),IL-8-siRNA组细胞凋亡率〔(15.12±1.43)%〕及酶切caspase3蛋白表达(0.311±0.029)显著高于对照组(Plt;0.01),见图3。

图1 IL-8在鼻息肉组织及下鼻甲组织中的表达

图2 转染后各组细胞中 IL-8蛋白表达水平
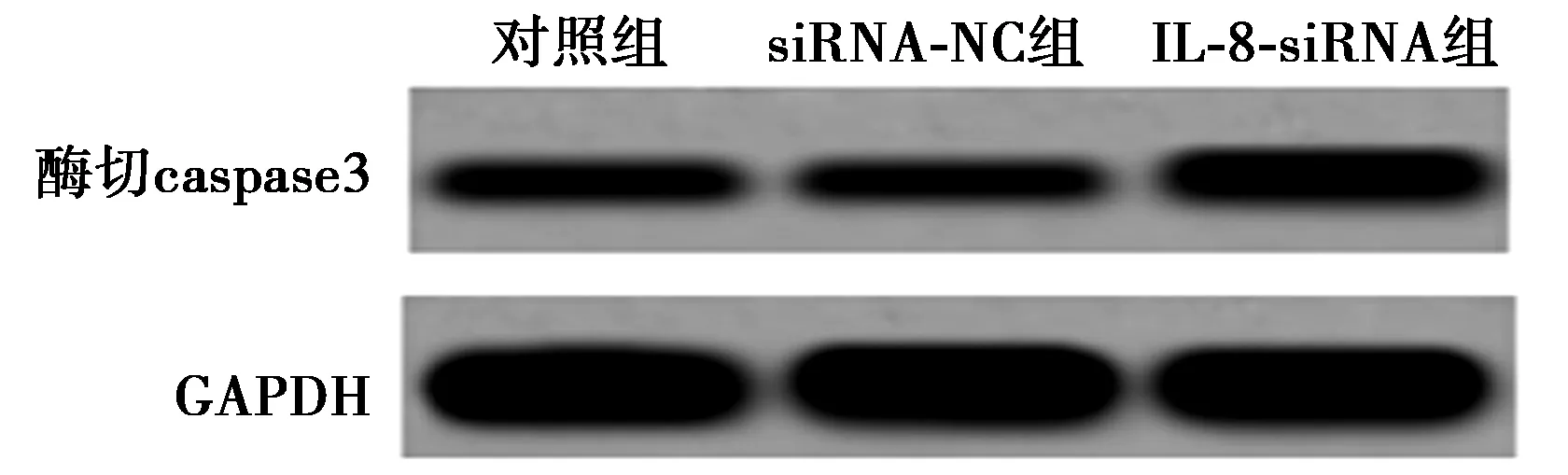
图3 IL-8对HNEC凋亡的影响
3 讨 论
鼻息肉的发病机制目前尚不清楚,手术治疗效果虽然有所提高,但病人术后仍有复发。目前研究认为鼻息肉的形成是由多种因素共同参与的慢性炎症〔2〕。且有研究显示,多种细胞因子影响了鼻息肉的发生及病理过程〔3〕。IL-8是一种炎性细胞因子,可诱导嗜酸性粒细胞、单核细胞、中性粒细胞迁移到炎症或感染部位,在损伤、感染患者的血清中可发现IL-8的高表达〔4〕。研究显示,在鼻息肉匀浆组织中检测到IL-8的表达水平显著高于对照组,在慢性鼻窦炎患者的窦黏膜也可检测IL-8的高表达〔5〕。本研究中也检测IL-8在鼻息肉组织中的高表达,其结果与前人的研究一致。RNA干扰是由双链DNA引起的一种序列特异性的基因沉默,作为下调基因的工具已被广泛用于基因功能的研究及疾病的治疗〔6〕。本研究结果显示,沉默IL-8的表达能促进HNEC的凋亡及酶切caspase3蛋白的表达。细胞凋亡是细胞在受到各种刺激因素后所发生的程序性死亡过程,其过程受到多种基因的调控。其中以caspase家族及Bcl-2家族为主。caspase3位于caspase所介导的蛋白酶级联反应的下游,通常以非活化的酶原形式在细胞质中存在,其激活后可降解多种蛋白质底物,从而诱导细胞的凋亡〔7〕。本研究结果说明沉默IL-8的表达通过上调酶切caspase3蛋白的表达诱导HNEC的凋亡。
1Visciano C,Liotti F,Prevete N,etal.Mast cells induce epithelial-to-mesenchymal transition and stem cell features in human thyroid cancer cells through an IL-8-Akt-Slug pathway〔J〕.Oncogene,2015;34(40):5175-86.
2王成硕,娄鸿飞,孟一帆,等.组织普酸粒细胞增多对慢性鼻-鼻窦炎伴鼻息肉复义的预测价值研究〔J〕.中华耳鼻咽喉头颅外科杂志,2016;51(4):268-72.
3Wang LF,Chien CY,Tai CF,etal.Vitamin D decreases the secretion of eotaxin and RANTES in nasal polyp fibroblasts derived from Taiwanese patients with chronic rhinosinusitis with nasal polyps〔J〕.Kaohs J Med Sci,2015;31(2):63-9.
4Beigelman A,Isaacson-Schmid M,Sajol G,etal.Randomized trial to evaluate azithromycin′s effects on serum and upper airway IL-8 levels and recurrent wheezing in infants with respiratory syncytial virus bronchiolitis〔J〕.J Allergy Clin Immunol,2015;135(5):1171-8.
5Okano M,Fujiwara T,Kariya S,etal.Regulatory effect of TLR3 signaling on staphylococcal enterotoxin-induced IL-5,IL-13,IL-17A and IFN-γ production in chronic rhinosinusitis with nasal polyps〔J〕.Allergol Int,2016;65(1):96-102.
6王 婷,高玉珍,沈明志,等.条件性 RNA 干扰技术研究进展〔J〕.现代生物医学进展,2015;15(3):547-50.
7林 欢,冷吉燕,于 静,等.蓝莓花色苷对人脐静脉内皮细胞凋亡调控基因 Bax,Caspase-3 表达的影响〔J〕.中国老年学杂志,2015;35(15):4157-8.
〔2017-04-15修回〕
(编辑 袁左鸣/滕欣航)
R765.2
A
1005-9202(2017)22-5564-03;
10.3969/j.issn.1005-9202.2017.22.034
郑慧媛(1975-),女,硕士,主治医师,主要从事鼻腔鼻窦肿瘤研究。

