HLA-F在ICP患者胎盘组织中的表达及意义
杨丽娟 葛静 潘华 张晶
·论著·
HLA-F在ICP患者胎盘组织中的表达及意义
杨丽娟 葛静 潘华 张晶
目的探讨妊娠期肝内胆汁淤积症(ICP)患者胎盘组织中人类白细胞抗原F(HLA-F)的表达变化及意义。方法选取2013年1月至2015年7月产科确诊的ICP患者65例(ICP组)、40例健康妊娠女性(健康组),采用Western blot检验技术检测2组胎盘组织中HLA-F蛋白的表达水平,并将ICP组根据病情进行亚组分析。结果ICP组患者的胎盘组织中HLA-F蛋白表达灰度值(0.729±0.164)显著的低于健康组,差异有统计学意义(Plt;0.05);ICP组患者的血清TBA、ALT、AST水平均高于健康组,差异均有统计学意义(Plt;0.05);ICP重度组患者的胎盘组织中HLA-F蛋白表达灰度值显著的低于ICP轻度组,差异有统计学意义(Plt;0.05);ICP重度组患者的血清TBA、ALT、AST水平均高于ICP轻度组,差异均具有统计学意义(Plt;0.05);ICP组患者的胎盘组织中HLA-F蛋白表达灰度值与血清TBA、ALT、AST水平均呈现出显著的负相关关系(Plt;0.05)。结论ICP患者胎盘组织的HLA-F蛋白表达水平明显降低,并且与患者的病情、血清TBA、ALT、AST水平密切相关性。
妊娠;肝内胆汁淤积症;胎盘组织;人类白细胞抗原F
妊娠期肝内胆汁淤积症(intrahepatic cholestasis of pregnancy ,ICP)是临床上较为常见的妊娠期合并症,相关研究显示ICP的发病率可达0.006%以上,且近年来呈现出一定的上升趋势[1,2]。有研究显示,母体与胎儿的免疫耐受的平衡对于降低妊娠期合并症的发生具有重要的意义,免疫平衡的紊乱可以促进ICP的发生发展[2]。人类白细胞抗原F(human leukocyte antigen F,HLA-F)是重要的免疫调节分化因子,可以通过影响到T淋巴细胞的分化及免疫因子的释放,进而稳定胎儿及母体之间的免疫耐受[3,4]。本研究探讨ICP患者胎盘组织中HLA-F蛋白的表达变化,揭示HLA-F与ICP发生发展的关系。
1 资料与方法
1.1 一般资料 选取2013年1月至2015年7月我院产科确诊的ICP患者65例(ICP组)、40例健康妊娠女性(健康组)。ICP组:年龄22~35岁,平均年龄(27.4±3.5)岁;孕周34~39周,平均(36.5±1.9)周;孕次1~3次,平均(1.3±0.7)次;孕晚期体重指数(BMI)(27.6±2.0)kg/m2;ICP轻度39例,ICP重度26例。健康组:年龄22~36岁,平均年龄(27.1±3.3)岁;孕周36~41周,平均(37.9±1.5)周;孕次1~3次,平均(1.5±0.7)次;孕晚期BMI(27.9±1.9)kg/m2。2组产妇年龄、孕次、孕晚期BMI差异无统计学意义(Pgt;0.05),具有可比性。
1.2 纳入与排除标准
1.2.1 纳入标准:①ICP的诊断及分度标准参考中华医学会妇产科学分会2011年提出的诊断标准[5];②ICP妊娠女性表现为中晚期出现皮肤瘙痒、伴或不伴有黄疸;③实验室检查:ICP患者的血清总胆汁酸(TBA)gt;10 μmol/L,可伴有AST、ALT水平升高;④本研究获得研究对象的知情同意及医院医学伦理委员会的批准。
1.2.2 排除标准:①双胎妊娠女性;②合并病毒性肝炎、酒精性肝炎、药物性肝炎及其他类型肝疾病的患者;③伴有免疫系统疾病的患者;④合并妊娠高血压、妊娠糖尿病、胎膜早破等并发症的女性。
1.3 Western blot检验方法 冰上分离出胎盘组织,置于预冷的研钵中液氮研磨至粉末状。冰上静置1 h,4℃ 14 000 r/min离心30 min,去沉淀组织留上清。考马斯亮蓝显色法测定蛋白浓度,分装。-70℃冻存。按总蛋白80 μg计算上样体积,4∶1的比例加上样缓冲液,每条泳道加20 μl样品缓冲液,于60 V电压下跑胶,脱脂蛋白封闭2 h,羊抗HLA-F抗体(1∶200),2 h 后加入二抗。Image proplus 4.01版本的专业图像分析软件进行图像分析。
1.4 观察指标 检测各组妊娠女性妊娠晚期血清总胆汁酸(TBA)、丙氨酸氨基转移酶(ALT)、天门冬氨酸氨基转移酶(AST)。清晨采集空腹静脉血,按照10 000 r/min的离心速度进行离心分离血清,-20℃保存待测,采集标本后1周内检测TBA、ALT、AST,采用瑞士罗氏全自动生化分析仪E170模块进行检测,检测试剂盒购自上海泰康生物科技有限公司。具体检测方法参照试剂盒说明书,试剂盒内配有质控血清或质控标准品,所有操作严格按照操作说明完成。
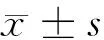
2 结果
2.1 ICP组和健康组的胎盘组织中HLA-F蛋白表达水平比较 ICP组患者的胎盘组织中HLA-F蛋白表达灰度值显著低于健康组,差异均有统计学意义(Plt;0.05);ICP组患者的血清TBA、ALT、AST水平均高于健康组,差异均有统计学意义(Plt;0.05)。见表1,图1。
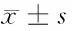
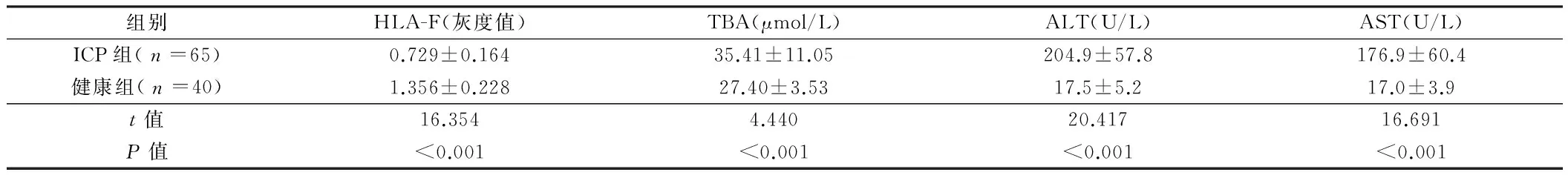
组别HLA-F(灰度值)TBA(μmol/L)ALT(U/L)AST(U/L)ICP组(n=65)0.729±0.16435.41±11.05204.9±57.8176.9±60.4健康组(n=40)1.356±0.22827.40±3.5317.5±5.217.0±3.9t值16.3544.44020.41716.691P值lt;0.001lt;0.001lt;0.001lt;0.001
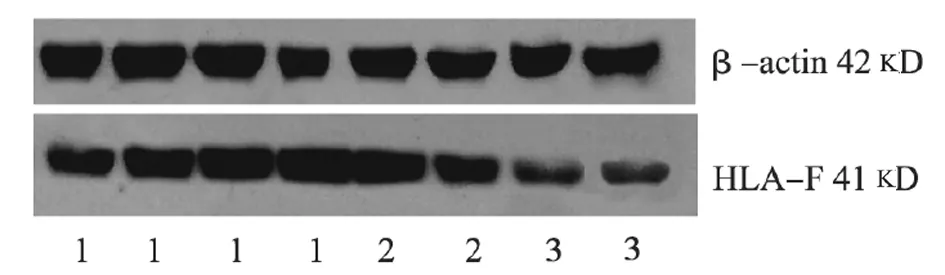
图1 Western blot检测图
2.2 不同病情的ICP组胎盘组织中HLA-F蛋白表达水平比较 ICP重度组患者的胎盘组织中HLA-F蛋白表达灰度值显著低于ICP轻度组,差异均有统计学意义(Plt;0.05);ICP重度组患者的血清TBA、ALT、AST水平均高于ICP轻度组,差异均有统计学意义(Plt;0.05)。见表2,图1。
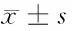

病情HLA-F(灰度值)TBA(μmol/L)ALT(U/L)AST(U/L)ICP轻度(n=39)0.822±0.15732.64±7.33139.7±51.698.3±39.7ICP重度(n=26)0.584±0.13940.62±10.76289.6±55.3268.4±52.1t值6.2623.56111.15016.852P值lt;0.01lt;0.01lt;0.01lt;0.01
2.3 ICP组胎盘组织中HLA-F蛋白表达水平与血清TBA、ALT、AST的相关性分析 ICP组患者的胎盘组织中HLA-F蛋白表达灰度值与血清TBA、ALT、AST水平均呈现出显著的负相关关系(Plt;0.05)。见表3。

表3 相关性分析
3 讨论
遗传易感因素、基础性肝功能异常及免疫耐受的打破等,均可以促进ICP的发生发展,特别是在年龄介于25~30岁的初产妇中,ICP的发病率可较普通人群上升3~4倍[6,7]。临床上ICP容易导致胎儿宫内窘迫、新生儿窒息、脑瘫等风险,导致胎儿的存活率,治疗花费大。而通过对于ICP发病过程中相关机制的研究,可以了解ICP的发病机制、ICP的综合性的临床治疗提供理论基础。
HLA-F编码的蛋白主要为人类组织相容性抗原,从而介导免疫系统反应、免疫应答及免疫损伤。HLA-F结构上包含了多个重复的巯基结构,通过非化学键的结合作用,进而促进HLA-F本身与调节性T淋巴细胞及B细胞膜表面的结合,影响体液免疫及细胞免疫应答。胎盘组织中的HLA-F蛋白的表达,可以影响到胎盘血管的重塑、胎盘滋养细胞的侵袭等生理过程,抑制胎盘母体面及胎儿面的免疫排斥[8,9];低水平的HLA-F失去了其对于滋养细胞抑制性受体a及胎盘血管内皮细胞受体的保护作用,导致相关抗原容易受到自身免疫分子的攻击,导致肝胆管及肝脏组织细胞的损伤,促进了ICP的发生发展[10,11]。相关研究证实了HLA在ICP患者中的异常表达,认为低表达水平的HLA可以促进ICP的发生发展[12],但相关研究的样本量较少,且缺乏对于HLA-F与ICP病情严重程度关系的研究。
TBA、ALT、AST是评估ICP病情的重要指标,ICP患者血清中的ALT、AST等均明显上升,高于正常对照人群,提示了ICP患者的肝功能的损伤和胆汁淤积的病理状态。病例组患者胎盘组织中的HLA-F表达浓度明显下降,对于对照组,表明HLA-F可能参与到了ICP的发生发展过程中。HLA-F的下降失去了其对于稳定胎盘母体胎儿免疫耐受的能力,导致胆管、肝脏实质性组织细胞容易受到自身免疫复合物沉淀的影响,从而促进了ICP的发生发展。Zhang等[13,14]通过回顾性分析了82例样本量的ICP临床资料,发现在相关病例组患者的胎盘组织中,HLA-F的表达可较正常对照下降25%左右,这与本研究的结论较为一致。而通过对于不同病情的ICP患者的临床分析后发现,HLA-F的表达与ICP的病情严重程度的关系较为明显,在病情越为严重的ICP患者胎盘组织中,HLA-F的表达浓度可进一步下降,其中重度ICP患者胎盘组织中的灰度值仅为(0.584±0.139),下降较为明显。但需要注意的是, Zhang等[13]的研究中并未发现不同病情的ICP与HLA-F的关系,这与本研究的结论存在一定的差别,考虑到检测方法的差别、临床资料的收集偏移等,均可能导致了统计结论的差异。相关关系分析也可以发现,HLA-F蛋白表达灰度值与血清TBA、ALT、AST水平均呈现出显著的负相关关系,进一步提示HLA-F与ICP的密切关系。
综上所述,在ICP患者胎盘组织中HLA-F的表达明显下降,且HLA-F下降程度越明显,ICP的病情越为严重。本研究的局限性在于:(1)缺乏对于HLA-F与ICP治疗结局的关系研究;(2)胎盘组织中的HLA-F定性研究不足。
1 曹卫平,陈廷美,毛雨,等.功能性T细胞亚群与妊娠期肝内胆汁淤积症关系的研究进展.中国妇幼保健,2013,42:6079-6080.
2 何毛毛,王晓东.妊娠期肝内胆汁淤积症胎儿宫内缺氧机制的研究进展.中华妇幼临床医学杂志(电子版),2011,25:60-63.
3 胡海军,李佳平.妊娠期肝内胆汁淤积症在细胞分子水平上的认识进展.川北医学院学报,2015,24:128-131.
4 李明,吴晶,邢爱耘.人类白细胞抗原F在妊娠期肝内胆汁淤积症患者胎盘中的表达及意义.实用妇产科杂志,2015,22:545-549.
5 孔艳,孔祥.妊娠期肝内胆汁淤积症免疫因素的研究进展.中华妇幼临床医学杂志(电子版),2015,32:798-800.
6 刘金涛.血清总胆汁酸检测在妊娠期肝内胆汁淤积症中的临床应用价值.检验医学,2015,24:541-544.
7 Sanhal CY,Kara O,Yucel A.Can fetal left ventricular modified myocardial performance index predict adverse perinatal outcomes in intrahepatic cholestasis of pregnancy?J Matern Fetal Neonatal Med,2016,25:1-6.
8 Hubschmann AG,Orzechowski KM,Berghella V.Severe first trimester recurrent intrahepatic cholestasis of pregnancy:a case report and literature review.AJP Rep,2016,6:38-41.
9 Mella MT,Kohari K,Jones R,et al.Mitochondrial gene expression profiles are associated with intrahepatic cholestasis of pregnancy.Placenta,2016,32:90-92.
10 Zhang X,Ling YU,Ding Y.Human leukocyte antigen G and miR-148a are associated with the pathogenesis of intrahepatic cholestasis of pregnancy.Therapeutic Medicine,2014,24:56-58.
11 王萍萍,王增芳,王增艳,等.细胞因子网络失衡与妊娠期肝内胆汁淤积症.中国临床研究,2012,32:1125-1126.
12 伍思玲,邵勇,何芳.妊娠期肝内胆汁淤积症对母儿的影响及其机制.国际妇产科学杂志,2014,25:154-157.
13 Zhang YH,Pan YD,Lin CD,et al.Bile acids evoke placental inflammation by activating Gpbar1/NF-κB pathway in intrahepatic cholestasis of pregnancy.Journal of Molecular Cell Biology,2016,25:98-101.
14 吴瑛婷,张军,陈慧芬.原发性胆汁性肝硬化合并妊娠的研究进展.诊断学理论与实践,2015,25:573-576.
ExpressionandsignificanceofHLA-FinplacentaofpatientswithICP
YANGLijuan,GEJing,PANHua,etal.
DepartmentofObstetrics,HospitalforMaternalandChildHealthofHunanProvince,Changsha410008,China
ObjectiveTo investigate the expression and significance of human leukocyte antigen F (HLA-F) in placenta of patients with intrahepatic cholestasis of pregnancy (ICP).MethodsSixty-five patients with ICP who were diagnosed and treated in our hospital from January 2013 to July 2015 were enrolled as ICP group,and 40 healthy pregnant women were enrolled as control group.The expression level of HLA-F protein in placenta tissues were detected by Western Blot,moreover the ICP group was redivided into subgroups according to pathogenetic condition.ResultsThe expression gray value (0.729±0.164) of HLA-F protein in placenta tissues of patients in ICP group was significantly lower than that (1.356±0.228) in control group (Plt;0.05). The serum levels of TBA,ALT and AST in ICP group were significantly higher than those in control group (Plt;0.05). The expression gray value [(0.584±0.139)μmol/L]of HLA-F protein in placenta tissues in severe ICP group was significantly lower than that [(0.822±0.157)μmol/L]in mild ICP group (Plt;0.05), however, the serum levels of TBA,ALT and AST in severe ICP group were significantly higher than those in mild ICP group (Plt;0.05).Moreover the expression gray value of HLA-F protein in placenta tissues of patients in ICP group was negatively correlated to the serum levels of TBA,ALT and AST (Plt;0.05).ConclusionThe expression levels of HLA-F protein in placenta tissues of patients with ICP are significantly decreased,moreover,which are closely correlated with patient's condition and the serum levels of TBA,ALT and AST.
pregnancy; intrahepatic cholestasis; placental tissue; human leukocyte antigen F
10.3969/j.issn.1002-7386.2017.23.004
410008 长沙市,湖南省妇幼保健院产科
R 714.2
A
1002-7386(2017)23-3539-03
2017-05-18)
——以咸阳市屯庄水库为例

