大鼠蛛网膜下腔出血后血清lincRNA-p21的变化水平研究
郭丹 宋锦宁 尹倩雯
(西安交通大学医学院第一附属医院:1神经外科, 2检验科, 陕西 西安 710061)
·论著·
大鼠蛛网膜下腔出血后血清lincRNA-p21的变化水平研究
郭丹1宋锦宁1*尹倩雯2
(西安交通大学医学院第一附属医院:1神经外科,2检验科, 陕西 西安 710061)
目的动态监测血清基因间长链非编码RNA-p21 (lincRNA-p21)表达水平与急性蛛网膜下腔出血(SAH)的相关性,从而为临床早期诊断SAH提供可靠的实验依据。方法将105只SD雄性大鼠随机分为SAH手术组(63只)、假手术组(21只)和正常对照组(21只),采用颈内动脉穿刺法制作SAH模型,实时荧光定量聚合酶链式反应法(RT-PCR)检测血清中lincRNA-p21水平,于预定时间进行神经行为学评估和干湿重法测定脑组织含水量。结果相对于正常对照组,急性SAH组在2~18 h lincRNA-p21表达呈下降趋势(P<0.05),18~48 h呈急剧上升趋势后恢复至正常水平(P<0.05),而0~2 h、48~72 h和假手术组相对于正常对照组差异无统计学意义(P>0.05)。对神经行为学评分、脑组织含水量与lincRNA-p21表达相关性分析结果显示神经行为学(P=0.924)和脑组织含水量(P=0.224)均与lincRNA-p21表达无相关性。结论血清lincRNA-p21的表达水平可以作为急性蛛网膜下腔出血潜在的生物学诊断标志和治疗靶点,但不能作为病情严重程度指标。
蛛网膜下腔出血; 基因间长链非编码RNA-p21; 血清
蛛网膜下腔出血(subarachnoid hemorrhage, SAH)是指各种病因导致的脑底或脑及脊髓表面血管发生病变而突然破裂,血液直接进入蛛网膜下腔的统称,是一类非常严重的脑卒中亚型,主要发病年龄在50~60岁人群[1],具有很高的发病率和死亡率。早期预测诊断可以提高SAH患者的生存率并能够改善长期预后,目前主要依赖影像学技术,尚无有效预测SAH的血液生化检测指标,因为血液生化检查的快速方便费用低的优势,临床上迫切需要寻找能够早期诊断SAH并有较高敏感性及特异性的新的生物标志物作为辅助诊断技术,提高SAH诊断的准确性。
长链非编码RNA (long non-coding RNA, lncRNA)和基因间长链非编码RNA (long intergenic non-coding RNAs, lincRNAs)是近年来被发现的。WU等[2]发现lincRNA-p21参与血管系统和神经系统疾病过程,参与血管内膜增生,平滑肌细胞增殖和凋亡等过程。SAH后p53在缺氧等多种因素作用下被激活,诱导内皮细胞凋亡[3],促进靶基因p53上调的凋亡调节物(p53 upregulated modulator of apoptosis, PUMA)的表达诱导内皮细胞凋亡并产生血管痉挛[4]。Huarte等[5]首先发现并报道了一种与p53表达关系最为密切的lncRNA、lincRNA-p21、p53可直接结合于lincRNA-p21的上游调控区并正调控其转录水平。由此我们设想lincRNA-p21可能也参与了SAH疾病的发生发展过程,并且lncRNA可以形成相对稳定的二级结构可以在体液(如血液、尿液)中被监测到,因此本研究主要通过检测血清中lincRNA-p21的表达水平来探讨与急性蛛网膜下腔出血之间的临床意义。
材料与方法
一、实验动物及分组
健康成年雄性SD大鼠105只,质量在280~330 g之间,由西安交通大学医学院实验动物中心提供,标准环境下饲养,24 h昼夜循环光照,术前术后自由摄食饮水。本实验动物伦理已经过西安交通大学医学部生物伦理委员会批准。实验动物随机分组,SAH组63只,假手术组21只,正常对照组21只。
二、主要试剂和仪器
无水乙醇、氯仿、异丙醇、焦碳酸二乙酯 (diethylpyrocarbonate, DEPC)处理的水、RNAiso Plus (TaKaRa, 日本)试剂盒、PrimeScript RT reagent Kit with gDNA Eraser (TaKaRa, 日本) 试剂盒、SYBR Premix Ex TaqTM II (TaKaRa, 日本)试剂盒、甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase, GAPDH)〔GAPDH(内参照物):上游引物GGGAAATTCAACGGCACAGT;下游引物:AGATGGTGATGGGCTTCCC,华大基因;特异性lincRNA-p21:上游引物CCTGTCCACTCGCTTTC;下游引物GGAACTGGAGACGGAATGTC,华大基因〕。
三、主要仪器
低温离心机、实时定量聚合酶链反应扩增仪、UV-Vis Spectrophotometer。
四、模型制作
SAH模型组采用PRUNELL等[6]文献中的方法,暴露右侧颈总动脉分叉处,分离颈外动脉然后用血管夹阻断血流,从颈总动脉分叉处插入3-0单股尼龙线进入颈内动脉长度约18~20 mm时感觉有阻力再进入约3 mm刺穿大脑前动脉和中动脉,停留15 s左右拔出,关闭缝合。假手术组除了不刺破血管外,其余操作均与SAH模型组相同。SAH组和假手术组的每只大鼠按照实验安排,均于术后的不同时间段经左心室灌注生理盐水及40 g/L多聚甲醛后取脑,观察脑组织大体标本的变化。
五、实验方法
1.实验分组、取血:模型制作成功后,按照表1设置的时间段随机分组,然后开胸心脏取血。
表1 105只SD雄性大鼠心脏取血时间分组
Tab 1 Different groups of 105 SD male rats according to the time of taking blood from heart
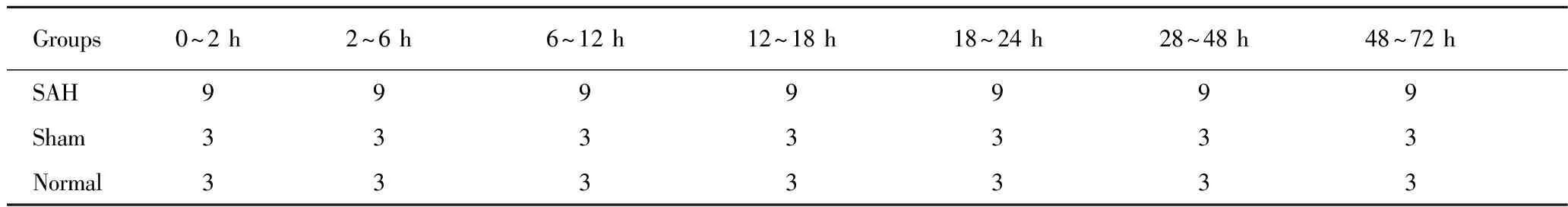
Groups0~2h2~6h6~12h12~18h18~24h28~48h48~72h SAH9999999 Sham3333333 Normal3333333
2.提取血清:采集完血液室温静置30 min后放入4 ℃冰箱静置冷藏过夜,随后室温下3000 r/min离心15 min,将上层血清转移至1.5 mL的EP管内,-20 ℃冰箱保存备用。
3.血清总RNA提取:按照RNAiso Plus试剂盒的说明操作。
4.去除基因组DNA:将总RNA反转录为cDNA,按照PrimeScript RT reagent Kit with gDNA Eraser试剂盒说明操作。
5.lincRNA-p21荧光定量检测:按照TaKaRa Ex Taq HS试剂盒说明操作。分三步法扩增反应,预变性:95 ℃ 30 s,1个循环;PCR反应:95 ℃ 5 s,60 ℃ 30 s,40个循环;溶解:95 ℃ 15 s,60 ℃ 30 s,95 ℃ 15 s,1个循环。以GAPDH为内参,采用比较阈值法,目的基因的量=2-ΔΔCt计算实验组与对照组lincRNA-p21的表达差异。
六、大鼠神经行为评分
根据Loeffler的五分制评分法[7]对各组大鼠进行神经行为学评分:当抓大鼠背部能正常运动且在5 s内翻身,评分5分;5 s内能翻身,但是自主运动减少,评分4分;3分为>5 s翻身;2分为不能翻身;1分无自主运动。因SAH模型完成后的2 h内大多数大鼠麻醉未清醒,故0~2 h时间段未进行神经行为评分。
七、脑含水量的检测
按照实验安排的不同时间段,术后深度麻醉后迅速开颅取脑,取其中一半脑组织用电子分析天平称取湿重,然后置于60 ℃恒温干燥箱内,烘烤至恒重(两次重量差≤0.2 mg),称取干重。脑组织含水量按以下公式计算:脑组织含水量=(湿重-干重)/湿重×100%。
八、统计学分析

结 果
一、脑组织大体标本
假手术组脑大体形态未见异常(图1B),SAH大鼠模型取材后可见脑组织均有不同程度的水肿,脑底Willis环附近有明显的出血灶(图1A)。
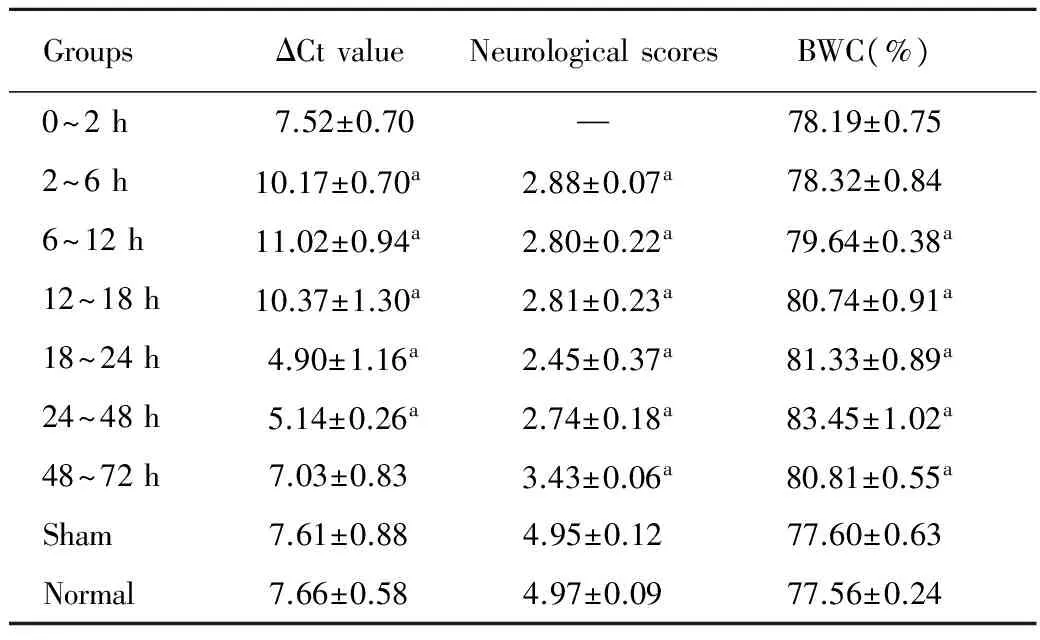
二、各组大鼠lincRNA-p21 实时荧光定量PCR结果、神经行为学评分和脑组织含水量的比较
结果显示相对正常对照组,lincRNA-p21的表达0~2 h无变化,从2 h开始下降持续至18 h,从18 h后表达急剧升更高,随后逐渐下降,在48 h趋于正常对照组水平持续到72 h,而假手术组的改变无统计学意义(图2)。
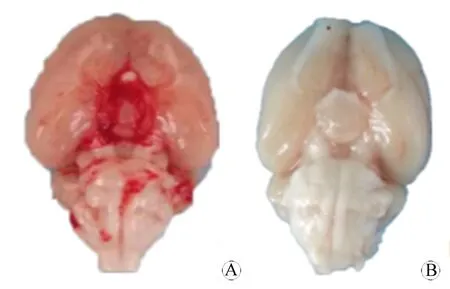
图1 SAH模型组(A)和假手术组(B)大鼠脑大体标本形态
Fig 1 General morphological changes of the brain after SAH in SAH group and sham group
A:Brain general specimen in SAH group; B:Brain general specimen in sham group.
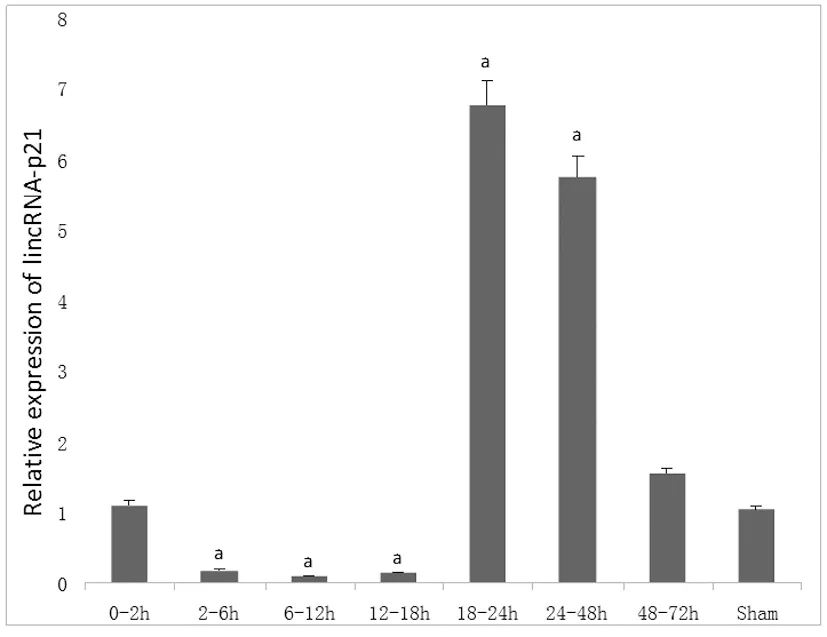
图2 实时PCR法检测在不同时间点lincRNA-p21的相对表达量与正常对照组比较
Fig 2 Comparison of the relative expression of lincRNA-p21 at different time points between experimental group and sham group detected by RT-PCR
aP<0.05,vssham group.
检验各组正态性和方差齐性显示lincRNA-p21ΔCt值、神经行为学评分和脑组织含水量比较均符合正态性和方差齐性(P=0.515、0.392和0.282)。LSD-t检验说明相对于正常对照组,2~6、6~18、18~24和24~48 h时间段ΔCt值表达差异均有统计学意义(P<0.05),假手术组和正常对照组之间无显著差异(P>0.05,表2);SAH模型组的动物在建模后均出现不同程度的嗜睡、意识模糊、活动饮食减少等症状,神经行为学评分显示从2 h开始到72 h的评分相对于正常对照组均有显著下降(P<0.05);各组脑组织含水量的比较发现6~12、12~18、18~24、24~48、48~72 h时间段含水量相对正常对照组均显著升高(P<0.05),且脑组织含水量在24~48 h时间段的表达最高(图2)。对神经行为学和脑组织含水量与lincRNA-p21ΔCt值之间进行相关性分析,结果显示神经行为学(r=0.15,P=0.924)和脑组织含水量(r=0.31,P=0.224)与lincRNA-p21ΔCt值之间均无直接关系。
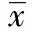
GroupsΔCtvalueNeurologicalscoresBWC(%) 0~2h7.52±0.70—78.19±0.75 2~6h10.17±0.70a2.88±0.07a78.32±0.84 6~12h11.02±0.94a2.80±0.22a79.64±0.38a 12~18h10.37±1.30a2.81±0.23a80.74±0.91a 18~24h4.90±1.16a2.45±0.37a81.33±0.89a 24~48h5.14±0.26a2.74±0.18a83.45±1.02a 48~72h7.03±0.833.43±0.06a80.81±0.55a Sham7.61±0.884.95±0.1277.60±0.63 Normal7.66±0.584.97±0.0977.56±0.24
aP<0.05,vssham group and normal control group.
讨 论
蛛网膜下腔出血后病理生理过程为血脑屏障破坏、血管痉挛、微血栓形成和血管自动调节受损等表现[8]。本项研究是首次发现大鼠蛛网膜下腔出血后血清中能够检测到lincRNA-p21的表达,并且lincRNA-p21表达的变化与SAH后不同时间点相关,但是与大鼠神经行为学评分和脑组织含水量并无直接的关系,表明血清lincRNA-p21可能作为急性SAH潜在的生物学诊断标志和治疗靶点,但与病情的严重程度并不相关。
lincRNA-p21最早是在2010年被发现的,作为转录因子p53下游的一个靶基因,其转录受到p53的正性调控。进一步的机制研究表明,lincRNA-p21的1-778nt区域可直接结合于核内不均一核糖核蛋白成员hn RNP-K,进而作为p53的辅助因子调控下游基因的转录[9]。也有研究报道了lincRNA-p21可以与下游靶基因的mRNA结合以调控转录[10]。之前对lincRNA-p21在血管系统疾病的研究主要集中在血管内皮细胞和平滑肌细胞,可以在体内外抑制血管平滑肌细胞增殖并诱导凋亡[11],与心血管系统有着密切的关系[12]。当发生脑缺血后[13],脑血管内皮细胞的的lncRNA表达谱出现不同程度的上调或下调,脑出血后脑组织的lncRNA表达谱出现也出现改变。Yan等[3]的研究结果显示,在大鼠SAH后24 h,海马的小血管内皮细胞中p53表达显著增加,DNA断裂的原位末端标记法(TUNEL)染色发现有大量内皮细胞凋亡,同时伴随有严重的血脑屏障损伤和脑水肿;当抑制p53的表达后内皮细胞的凋亡明显减轻,脑水肿缓解。Cahill等[4]研究表明在大鼠SAH后,皮质及海马内神经元的p53被活化且参与了神经元的凋亡,这可能与以后神经后遗症相关,而抑制p53活性可使脑内神经元的凋亡显著减少、死亡率的下降和神经学评分的好转。本项研究结果显示lincRNA-p21的表达与SAH相关,说明lincRNA-p21可能也参与了SAH疾病发生发展过程,具体机制有待进一步研究。
本实验应用实时荧光定量PCR方法检测结果显示正常情况下大鼠的血清中有一定lincRNA-p21的表达,并且它的表达量相对稳定。随着SAH发生后时间的推移,lincRNA-p21的表达出现先下降后上升最后恢复至正常对照组的水平,可以看出随着出血时间的变化,lincRNA-p21的表达也相应出现显著改变。据此,我们可以认为lincRNA-p21在急性蛛网膜下腔出血后的2~48 h内可以作为潜在诊断标志和治疗靶点,并且可以根据lincRNA-p21表达量初步判断出血的时间,但是并不能作为病情严重程度的指标,为临床治疗提供一定的证据,做到早发现早治疗,改善疾病的预后,提高患者生存质量,减轻家庭及社会负担。
总而言之,本项研究的结果表明lincRNA-p21可以在急性蛛网膜下腔出血后的2~48 h内作为潜在的生物学标志,并有机会成为潜在的治疗靶点。但是我们对于lncRNA的认识还远远不够,机制方面也不够明确,但是我们相信lncRNA会在未来的医学研究中发挥着重要的作用,lncRNA作为疾病的生物学标志和治疗靶点有望应用于临床。
1DE ROOIJ N K, LINN F H, VAN DER PLAS J A, et al. Incidence of subarachnoid haemorrhage:a systematic review with emphasis on region, age, gender and time trends [J]. J Neurol Neurosurg Psychiatry, 2007, 78(12):1365-1372.
2WU G, CAI J, HAN Y, et al. LincRNA-p21 regulates neointima formation, vascular smooth muscle cell proliferation, apoptosis, and atherosclerosis by enhancing p53 activity [J]. Circulation, 2014, 130(17):1452-1465.
3YAN J, CHEN C, HU Q, et al. The role of p53 in brain edema after 24 h of experimental subarachnoid hemorrhage in a rat model [J]. Exp Neurol, 2008, 214(2):37-46.
4CAHILL J, CALVERT J W, MAREANTONIO S, et al. p53 may play an orchestrating role in apoptotic cell death after experimental subarachnoid hemorrhage [J]. Neurosurgery, 2007, 60(3):531-545.
5HUARTE M, GUTTMAN M, FELDSER D, et al. A large intergenic noncoding RNA induced by p53 mediates global gene repression in the p53 response [J]. Cell, 2010, 142(3):409-419.
6PRUNELL G F, MATHIESEN T, DIEMER N H, et al. Experimental subarachnoid hemorrhage:subarachnoid blood volume, mortality rate, neuronal death, cerebral blood flow, and perfusion pressure in three different rat models [J]. Neurosurgery, 2003, 52(1):165-176.
7KUO L E, ABE K, ZUKOWSKA Z. Stress, NPY and vascular remodeling:implication for stress-related diseases [J]. Peptides, 2007, 28(2):435-440.
8金林, 郝璞珩, 王植海, 等. 早期足量自由基清除剂对颅内破裂动脉瘤的影响 [J]. 中华神经外科疾病研究杂志, 2012, 11(3):208-210.
9TAKEMURA G, FUJIWARA H. Doxorubicin-induced cardiomyopathy from the cardiotoxic mechanisms to management [J]. Prog Cardiovasc Dis, 2007, 49(5):330-352.
10OHNO T, GORDON D, SAN H, et al. Gene therapy for vascular smooth muscle cell proliferation after arterial injury [J]. Science, 1994, 265(5173):781-784.
11SAKAGUCHI K, HERRERA J E, SAITO S, et al. DNA damage activates p53 through a phosphorylation-acetylation cascade [J]. Genes Dev, 1998, 12(18):2831-2841.
12WU G Z, ZENG C Y. LincRNA-P21 feedback enhances P53 activity via interaction with MDM2 function in vascular smooth muscle cells proliferation dominantly neointimal hyperplasia of atherosclerosis [J]. Heart, 2013, 99( Suppl 3):A7-A8.
13DHARAP A, NAKKA V P, VEMUGANTI R, et al. Effect of focal ischemia on long noncoding RNAs [J]. Stroke, 2012, 43(10):2800-2802.
ChangesofserumlevelsoflincRNA-p21inratsaftersubarachnoidhemorrhage
GUODan1,SONGJinning1,YINQianwen2
1DepartmentofNeurosurgery;2DepartmentofClinicalLaboratory,TheFirstAffiliatedHospital,MedicalSchoolofXi'anJiaotongUniversity,Xi'an710061, China
ObjectiveDynamic monitoring of the correlation between the expression of serum long intergenic non-coding RNA-p21 (lincRNA-p21) and acute subarachnoid hemorrhage (SAH) was performed to provide a reliable laboratory basis for early clinical diagnosis of SAH.MethodsTotally 105 adult male SD rats were randomly divided into SAH group (63 cases), sham group (21 cases) and normal control group (21 cases). SAH was induced via intracranial endovascular perforation, and the levels of lincRNA-p21 in serum were measured by real-time polymerase chain reaction (RT-PCR). The neurological assessment and wet weight of brain tissue were measured in each group for a predetermined period of time.ResultsCompared with normal control group, the expression of lincRNA-p21 in SAH group was decreased at 2~18 h (P<0.05), and showed a trend of rising sharply at 18 h and then it returned to normal level at 48 h (P<0.05). But there was no significant difference between 0~2 h, 48~72 h, sham group and normal control group (P>0.05). The correlation between neurobiological behavior, brain tissue water content and lincRNA-p21 expression showed no correlation between neurobehavioral (P=0.924) and brain tissue water content (P=0.224).ConclusionThe expression level of serum lincRNA-p21 can be used as a potential biomarker and therapeutic target for acute subarachnoid hemorrhage, but can not be used as a severity index.
Subarachnoid hemorrhage; Long intergenic non-coding RNA-p21; Serum
1671-2897(2017)16-412-05
R 651
A
国家自然科学基金资助项目(30471774);陕西省自然科学基金资助项目(2003C1-16)
郭丹,硕士研究生,E-mail:danguo525@126.com
*通讯作者: 宋锦宁,主任医师,博士生导师,E-mail:jinningsong@126.com
2017-06-02;
2017-07-18)

