川芎嗪通过下调JNK磷酸化抑制PM2.5诱导的血管平滑肌细胞增殖
万 强,杨玉萍,杨 雪,陈洪涛,万蝉俊,徐 驲
(江西中医药大学附属医院1.心血管病科,2.肺病科,江西南昌 330006)
·论 著·
川芎嗪通过下调JNK磷酸化抑制PM2.5诱导的血管平滑肌细胞增殖
万 强1,杨玉萍2,杨 雪1,陈洪涛1,万蝉俊1,徐 驲1
(江西中医药大学附属医院1.心血管病科,2.肺病科,江西南昌 330006)
目的探讨川芎嗪(TMP)对PM2.5诱导的大鼠血管平滑肌细胞(VSMC)增殖的影响及作用机制。方法以PM2.520,200和400 mg·L-1染毒培养VSMC 24 h,MTT法检测VSMC存活,ELISA法检测细胞黏附分子1(VCAM-1)含量,放射免疫分析(RIA)法和硝酸还原酶法分别检测内皮素1(ET-1)和一氧化氮(NO)含量,Western蛋白印迹法检测VSMC中成纤维细胞生长因子受体1(FGFR-1)蛋白表达。分别加入TMP 20,200和2000 mg·L-1及JNK抑制剂SP600125 10 μmol·L-1检测TMP对PM2.5的干预作用及机制。结果与正常对照组比较,PM2.5200和400 mg·L-1处理组A570nm显著升高,VCAM-1和ET-1分泌增加,NO分泌降低,p-JNK及FGFR-1蛋白表达显著增加(P<0.01);PM2.520 mg·L-1处理组上述指标无显著变化。与PM2.5200 mg·L-1处理组比较,PM2.5200 mg·L-1+TMP 200和2000 mg·L-1预处理组A570nm显著降低,VCAM-1及ET-1分泌降低,NO分泌增加,p-JNK和FGFR-1蛋白表达显著降低(P<0.01);PM2.5200 mg·L-1+TMP 20 mg·L-1预处理组无显著变化。与PM2.5200 mg·L-1+TMP 2000 mg·L-1预处理组比较,PM2.5200 mg·L-1+TMP 2000 mg·L-1+SP600125 10 μmol·L-1抑制剂组可进一步增强TMP对上述指标的影响(P<0.05,P<0.01)。结论TMP可能通过下调JNK磷酸化,并调节VSMC内FGFR-1蛋白表达及VCAM-1,ET-1和NO含量,抑制PM2.5诱导的VSMC增殖。
PM2.5;川芎嗪;c-Jun氨基端激酶;血管平滑肌细胞
研究表明,空气动力学直径<2.5 μm的悬浮细颗粒物(fine particulate matter,PM2.5)可负载铅、镉和砷等重金属有毒有害物质及硫化盐、甲醛等化学物质,可诱发呼吸系统和心血管系统疾病(cardiovascular disease,CVD)的发生,空气污染已纳入我国CVD危险因素范畴[1]。动脉粥样硬化(atherosclerosis,AS)是CVD重要病理基础,长期吸入PM2.5可通过促炎、诱导氧化应激损伤、增加血管内皮细胞损伤等导致AS的发生[2],但其机制尚未完全明确。血管平滑肌细胞(vascular smooth muscle cells,VSMC)是血管壁的重要成分,可调节血管的收缩及舒张功能,其异常增殖导致的血管腔狭窄和痉挛是促进AS发生的重要病理基础[3]。c-Jun氨基端激酶(c-Jun N-terminal kinase,JNK)是丝裂原活化蛋白激酶超家族成员之一,可被多种因素激活,与CVD有密切联系,且对于细胞的增殖、分化和凋亡等起关键调控作用。JNK磷酸化的激活,可通过增加成纤维细胞生长因子受体1(fibroblast growth factor receptor-1,FGFR-1)蛋白表达、减少气体信号传递分子一氧化氮(nitric oxide,NO)含量、诱导VSMC增殖及促进炎症因子浸润等而致AS形成[4]。川芎嗪(tetramethylpyrazine,TMP)是从中药川芎中分离提纯得到的一种生物碱,临床上广泛用于治疗CVD。研究表明,TMP可通过调节脂质代谢、减轻氧化应激损伤、减少血管内皮细胞凋亡和抗炎等途径发挥抗AS作用[5-7],但TMP抗AS作用机制未完全阐明。本研究观察PM2.5对大鼠VSMC增殖的影响,用TMP和JNK信号通路阻滞剂SP600125干预,探讨TMP对PM2.5影响VSMC增殖的干预作用及可能机制。
1 材料与方法
1.1 动物、药品、试剂和仪器
5周龄雄性SD大鼠,体质量90~110 g,购自南昌大学医学部实验动物中心,动物许可证号:SYXK(赣)2010-0002。
盐酸TMP注射液(哈尔滨三联药业有限公司,批号2016020198);四甲偶氮唑蓝(methyl thiazolyltetrazolium,MTT)和二甲亚砜(dimethylsulphoxide,DMSO)(美国Sigma公司);DMEM培养基和胎牛血清(fetal bovine serum,FBS)(美国 Gibco公司);兔抗小鼠FGFR-1单抗、兔抗小鼠JNK单抗、兔抗小鼠p-JNK单抗、兔抗小鼠β肌动蛋白单抗和HRP标记山羊抗兔IgG二抗(美国Cell Signal Technology公司);JNK抑制剂SP600125(美国Tocris Bioscience公司);β肌动蛋白免疫组化试剂盒(美国Santa Cruz公司);细胞黏附分子1(vascular cell adhesion molecule-1,VCAM-1)试剂盒(美国eBioscience公司);内皮素1(endothelin-1,ET-1)放射免疫分析试剂盒(北京北方生物技术研究所);NO试剂盒(南京建成生物工程研究所)。
MiniVol型便携式PM2.5采样器和ST16R型低温高速离心机(美国Airmetrics公司);MK3型酶标仪和3111型恒温细胞培养箱(美国Thermo公司);石英纤维滤膜(美国Whatman公司);IX71型荧光倒置显微镜(日本Olympus公司);165-1801型电泳仪(美国Bio-Rad公司)。
1.2 VSMC原代培养和鉴定
以1 mL戊巴比妥钠(1.0 g·L-1)ip麻醉SD大鼠,无菌条件下完整分离主动脉,剥离血管内、外膜后剪成1 mm×1 mm碎片,加入含20%FBS的DMEM培养基在含5%CO2的37℃恒温培养箱内,以组织贴块法培养VSMC,待细胞80%~90%融合后进行传代,相差显微镜观察细胞形态,β肌动蛋白免疫组化染色鉴定。细胞胞浆呈细颗粒状棕黄色沉淀,均匀分布,判定为VSMC细胞。取4~8代对数生长期的VSMC进行实验。
1.3 PM2.5的采集和制备
参照南昌市环保局发布的空气质量预报,选择2016年1~3月空气质量等级为重度污染及以上的天气,PM2.5采样器置于交通主干道旁距离地面约50 m高的采样点,以5 L·min-1流量进行24 h连续采样,共3 d。将载有采样颗粒物的石英纤维滤膜剪成1 cm×3 cm大小浸于去离子水,超声振荡30 min×3次洗脱采样颗粒物,用6层无菌纱布过滤振荡液,4℃以4472×g离心20 min分离提取物,真空冷冻并干燥成干粉。加灭菌PBS缓冲液配制质量浓度为20,200和400 mg·L-1的PM2.5混悬液。
1.4 VSMC分组和处理
VSMC按照处理分为正常对照组、PM2.520,200和400 mg·L-1处理组(作用24 h)[8]、TMP 20,200和2000 mg·L-1预处理组(TMP预处理1 h[9]后,加 PM2.520,200和 400 mg·L-1染毒 24 h)、PM2.5200 mg·L-1+TMP 2000 mg·L-1+SP600125 10 μmol·L-1抑制剂组(TMP 2000 mg·L-1预处理VSMC 1 h+JNK 抑制剂 SP600125 10 μmol·L-1处理30 min[10]+PM2.5200 mg·L-1作用VSMC 24 h)。
1.5 MTT法检测VSMC存活
VSMC以每孔1×104接种于96孔板,每组设6个复孔,24 h后弃原培养基,加入PM2.5混悬液。PM2.5染毒后加入20 μL MTT 5 g·L-1,37℃,5%CO2恒温培养箱培养4 h,弃上清后加DMSO 150 μL低速振荡10 min,酶标仪检测570 nm波长处各孔吸光度(A570nm)。
1.6 VSMC中VCAM-1,ET-1和NO含量的测定
VSMC以1×108接种于培养皿。酶联免疫吸附法(enzyme-linked immunosorbent assay,ELISA)检测细胞培养液上清VCAM-1含量;收集VSMC并以PBS为匀浆介质破碎细胞取上清,放射免疫分析(radioimmunoassay,RIA)法检测ET-1含量;硝酸还原酶法检测NO含量,具体操作步骤参照试剂盒说明书进行。
1.7 Western蛋白印迹法检测VSMC中p-JNK和FGFR-1蛋白表达
提取VSMC总蛋白,定量后煮沸5 min进行SDS聚丙烯酰胺凝胶电泳,蛋白转印至PVDF膜,以5%脱脂牛奶封闭2 h,TBST冲洗;加一抗(1∶1000稀释)于4℃过夜,TBST冲洗;加二抗(1∶2000稀释)37℃孵育1 h,化学发光试剂曝光。Quantity One软件采集p-JNK,FGFR-1及β肌动蛋白条带积分吸光度值,以p-JNK和FGFR-1与β肌动蛋白积分吸光度比值表示蛋白表达水平。
1.8 统计学处理
2 结果
2.1 PM2.5对VSMC存活的影响
MTT结果显示(图1),与正常对照组比较,PM2.5200和400 mg·L-1处理组A570nm显著升高(P<0.01),PM2.520 mg·L-1处理组A570nm无明显变化。提示PM2.5200和400 mg·L-1可显著诱导VSMC增殖。
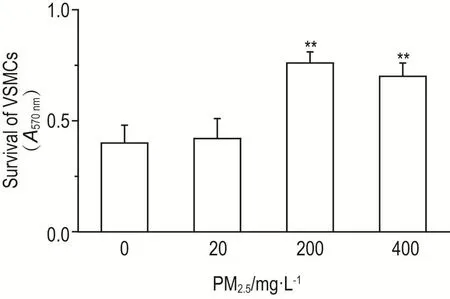
Fig.1 Effect of PM2.5on survival of vascular smooth muscle cells(VSMCs)of rats by MTT.VSMCs were treated with PM2.5for 24 h.±s,n=3.**P<0.01,compared with normal control(0)group.
2.2 PM2.5对VSMC分泌VCAM-1,ET-1和NO的影响
结果显示,与正常对照组比较,PM2.5200和400 mg·L-1处理组VCAM-1和ET-1分泌增加(P<0.01),NO分泌减少(P<0.01);PM2.520 mg·L-1处理组无显著变化。提示PM2.5200和400 mg·L-1可诱导VSMC中VCAM-1和ET-1分泌增加,NO分泌减少(表1)。

Tab.1 Effect of PM2.5on vascular cell adhesion molecule-1(VCAM-1),endothelin-1(ET-1)and nitric oxide(NO)levels of VSMCs in rats
2.3 PM2.5对VSMC中p-JNK和FGFR-1蛋白表达水平的影响
Western蛋白印迹结果(图2)显示,与正常对照组比较,PM2.5200和400 mg·L-1处理组p-JNK和FGFR-1蛋白水平显著增加(P<0.01),PM2.520 mg·L-1处理组无显著变化。因为PM2.5200 mg·L-1对VSMC增殖及VCAM-1,ET-1和NO分泌的影响最显著,后期TMP干预实验中PM2.5剂量均选为200 mg·L-1。
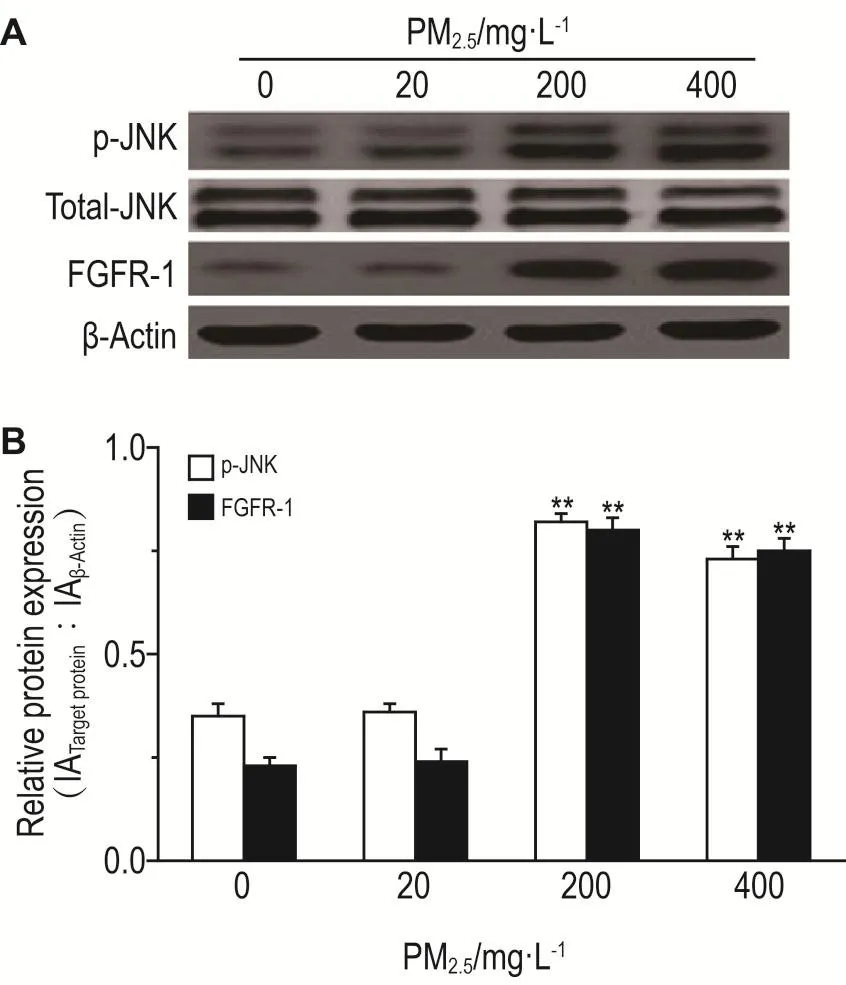
Fig.2 Effect of PM2.5on protein levels of p-JNK and fibroblast growth factor receptor-1(FGFR-1)of VSMCs in rats by Western blotting.See Fig.1 for the cell treatment.B was the semiquantitative result of A.IA:integrated absorbance.±s,n=3.**P<0.01,compared with normal control(0)group.
2.4 TMP对PM2.5诱导VSMC增殖的干预作用
MTT结果(图3)显示,与正常对照组比,PM2.5200 mg·L-1处理组A570nm显著升高(P<0.01);与PM2.5200 mg·L-1处理组比较,PM2.5200 mg·L-1+TMP 200和2000 mg·L-1预处理组A570nm显著降低(P<0.01),PM2.5200 mg·L-1+TMP 20 mg·L-1预处理组无显著变化,提示TMP 200和2000 mg·L-1可抑制PM2.5诱导的VSMC增殖;与PM2.5200 mg·L-1+TMP 2000 mg·L-1预处理组比较,PM2.5200 mg·L-1+TMP 2000 mg·L-1+SP600125 10 μmol·L-1组A570nm显著降低(P<0.05),提示JNK抑制剂SP600125进一步抑制PM2.5诱导的VSMC增殖。
2.5 TMP对PM2.5诱导VSMC分泌VCAM-1,ET-1和NO的干预作用
与正常对照组比,PM2.5200 mg·L-1处理组VCAM-1和ET-1含量升高,NO含量显著降低(P<0.05,P<0.01);与PM2.5200 mg·L-1处理组比较,PM2.5200 mg·L-1+TMP 200和2000 mg·L-1预处理组VCAM-1和ET-1含量显著降低(P<0.01),PM2.5200 mg·L-1+TMP 20 mg·L-1预处理组无显著变化,提示TMP可减少PM2.5诱导VCAM-1和ET-1的分泌量,并增加NO的分泌量;与PM2.5200 mg·L-1+TMP 2000 mg·L-1预处理组比较,PM2.5200 mg·L-1+TMP 2000 mg · L-1+SP600125 10 μmol· L-1组VCAM-1(P<0.01)和ET-1(P<0.05)的分泌量进一步减少,并且NO的分泌进一步增加(P<0.05)(表2)。

Fig.3 Effect of tetramethylpyrazine(TMP)or SP600125 on survival of PM2.5-induced VSMCs of rats by MTT.VSMCs were pre-treated with TMP 20,200 and 2000 mg·L-1for 1 h,or TMP 2000 mg·L-1for 1 h+SP600125 20 μmol·L-1for 30 min,and followed by PM2.5200 mg·L-1treatment for 24 h,respectively.±s,n=3.**P<0.01,compared with normal control group;##P<0.01,compared with PM2.5group.ΔP<0.05,compared with PM2.5+TMP 2000 mg·L-1group.
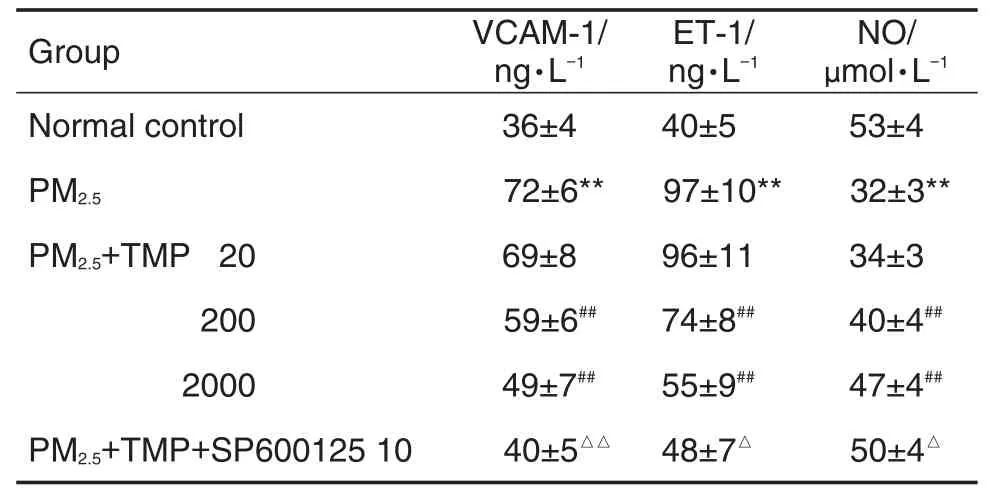
Tab.2 Effect of tetramethylpyrazine(TMP)or SP600125 on VCAM-1,ET-1 and NO levels in PM2.5-induced VSMCs of rats
2.6 TMP对PM2.5诱导VSMC表达p-JNK和FGFR-1的干预作用
Western蛋白印迹结果(图4)显示,与正常对照组比较,PM2.5200 mg·L-1处理组p-JNK和FGFR-1蛋白水平升高(P<0.01);与PM2.5200 mg·L-1处理组比较,PM2.5200 mg·L-1+TMP 200和2000 mg·L-1预处理组p-JNK和FGFR-1蛋白水平降低(P<0.01),PM2.5200 mg·L-1+TMP 20 mg·L-1预处理组无显著变化,提示TMP 200和2000 mg·L-1可减少PM2.5诱导的p-JNK和FGFR-1蛋白表达;与PM2.5200 mg·L-1+TMP 2000 mg·L-1预处理组比较,PM2.5200 mg·L-1+TMP 2000 mg·L-1+SP600125 10 μmol·L-1组p-JNK(P<0.05)和FGFR-1蛋白表达进一步减少(P<0.01)。

Fig.4 Effect of TMP and SP600125 on protein levels of p-JNK and FGFR-1 in PM2.5-induced VSMCs of rats by Western blotting.See Fig.3 for the cell treatment.B was the semiquantitatine result of A.±s,n=3.**P<0.01,compared with normal control group;##P<0.01,compared with PM2.5group;△△P<0.01,compared with PM2.5+TMP 2000 mg·L-1group.
3 讨论
本研究结果发现,PM2.5染毒可显著诱导VSMC增殖,增加VSMC内FGFR-1蛋白表达,诱导VSMC VCAM-1和ET-1分泌增多及NO分泌减少,同时PM2.5可激活丝裂原活化蛋白激酶家族中的JNK,使其磷酸化水平升高。TMP可抑制PM2.5诱导的VSMC增殖,减少VSMC内FGFR-1蛋白表达,减少VSMC分泌VCAM-1和ET-1,并增加NO的分泌,同时TMP可抑制JNK,使其磷酸化水平降低。
VSMC作为构成血管壁组织结构的主要细胞成分,可维持血管张力的功能,其过度增殖是促进AS及多种血管疾病发生、发展的共同病理基础。在正常血管中,VSMC表现为收缩表型,嵌入在细胞外基质组成的支架中,并呈现出极低的增殖率。当血管受到生长因子、趋化因子和损伤等因素刺激后,中膜VSMC表型将转变为合成或(和)分泌型,VSMC迁移至血管内膜并在内膜中快速增殖[11]。本研究结果发现,PM2.5染毒可显著诱导VSMC增殖,提示PM2.5可作为细胞应激因素,参与VSMC的增殖过程。VCAM-1可促进单核细胞黏附于血管内皮细胞并进入炎症部位,释放细胞活性物质,引起VSMC增殖[12]。本研究结果发现,PM2.5可使VSMC分泌VCAM-1增加,提示PM2.5诱导VSMC增殖与VCAM-1分泌增加有关。血管内皮舒张因子NO具有保护血管内膜、抗血小板黏附和抑制VSMC增殖的作用[13]。ET-1是一种内源性长效收缩血管调节因子,具有较强的促进VSMC有丝分裂、增殖的作用[14]。NO与ET-1二者平衡紊乱参与了VSMC增殖过程。本研究结果发现,PM2.5可使VSMC分泌ET-1含量升高,NO含量降低,提示PM2.5诱导VSMC增殖与ET-1分泌增加、NO分泌减少有关。FGFR-1是碱性成纤维细胞生长因子(basic fibroblast growth factor,bFGF)发挥促增殖作用的主要受体,与bFGF亲和力最高,也是重要的VSMC增殖促进因子,其表达水平与VSMC增殖程度正相关[15]。本研究结果发现,PM2.5可使FGFR-1蛋白的表达显著增加,提示PM2.5诱导VSMC增殖与FGFR-1蛋白表达增加有关。本研究与前期在体水平研究报道高浓度PM2.5吸入可引起小鼠VSMC增殖结果一致[16],为进一步研究抑制PM2.5诱导VSMC增殖药物的作用机制提供了实验依据。
VSMC的增殖过程是在外界各种因素剌激作用下细胞外传导信号通过细胞内信号传导系统到达细胞核内,诱导与VSMC增殖相关的蛋白表达改变,启动细胞周期,从而导致VSMC分裂和增殖[17]。因此,阻断促细胞分裂、增殖信号的传导,并降低增殖相关蛋白的表达是减少VSMC增殖的关键策略。本研究结果发现,TMP可抑制PM2.5诱导的VSMC增殖,减少VSMC内FGFR-1蛋白表达,减少VSMC分泌VCAM-1和ET-1,并增加NO的分泌,同时TMP可抑制JNK,使其磷酸化水平降低,提示TMP抑制VSMC增殖的作用与调节VSMC内FGFR-1蛋白、分泌VCAM-1,ET-1及NO含量等途径有关。为了进一步检测TMP的干预机制,本研究观察JNK抑制剂SP600125联合TMP共同预处理VSMC与TMP单独预处理VSMC对PM2.5诱导VSMC增殖干预作用的区别。结果显示,与TMP预处理组比较,TMP联合SP600125可进一步抑制PM2.5诱导的VSMC增殖,减少VSMC内FGFR-1蛋白表达,减少VSMC分泌VCAM-1和ET-1含量,并增加NO的分泌,同时降低JNK磷酸化水平。JNK是相对分子质量分别为46×103和54×103的蛋白,进化上属于保守型丝氨酸或(和)苏氨酸蛋白激酶,可以被紫外线照射、活性氧等环境因素和热休克、脂多糖、肿瘤坏死因子、缺血/再灌注损伤等细胞应激所激活,参与调节细胞生长、分化、增殖、凋亡和存活、炎症反应等多种病理生理过程[4]。本研究结果提示,TMP可能通过下调JNK磷酸化,并调节VSMC内FGFR-1蛋白、分泌VCAM-1,ET-1和NO含量等途径抑制PM2.5诱导的VSMC增殖。本研究可为TMP临床治疗PM2.5所致的心血管疾病提供实验依据。促进VSMC增殖的细胞内信号转导机制非常复杂,JNK信号转导途径的激活可能是其机制之一,但不足以完全阐明VSMC增殖现象。本研究局限性在于只检测了JNK通路,关于PM2.5诱导VSMC增殖机制以及TMP对此过程的干预作用及机制和临床应用仍需进一步研究。
[1]Li Y,Ma Z,Zheng C,Shang Y.Ambient temperature enhanced acute cardiovascular-respiratory mortality effects of PM2.5in Beijing,China[J].Int J Biometeorol,2015,59(12):1761-1770.
[2]Dorans KS,Wilker EH,Li W,Rice MB,Ljungman PL,Schwartz J,et al.Residential proximity to major roads,exposure to fine particulate matter,and coronary artery calcium:the Framingham Heart Study[J].Arterioscler Thromb Vasc Biol,2016,36(8):1679-1685.
[3]Hou J,Xue X,Li J.Vasostatin-2 inhibits cell proliferation and adhesion in vascular smooth muscle cells,which are associated with the progression of atherosclerosis[J].Biochem Biophys Res Commun,2016,469(4):948-953.
[4] Sozen E,Karademir B,Yazgan B,Bozaykut P,Ozer NK.Potential role of proteasome on c-jun related signaling in hypercholesterolemia induced atherosclerosis[J].Redox Biol,2014,2:732-738.
[5] Li WM,Liu HT,Li XY,Wu JY,Xu G,Teng YZ,et al.The effect of tetramethylpyrazine on hydrogen peroxide-induced oxidative damage in human umbilical vein endothelial cells[J].Basic Clin Pharmacol Toxicol,2010,106(1):45-52.
[6]Li XY,He JL,Liu HT,Li WM,Yu C.Tetramethylpyrazine suppresses interleukin-8 expression in LPS-stimulated human umbilical vein endothelial cell by blocking ERK,p38 and nulear factor-kappaB signaling pathways[J].J Ethnopharmacol,2009,125(1):83-89.
[7]Wu X,Zhang F,Xiong X,Lu C,Lian N,Lu Y,et al.Tetramethylpyrazine reduces inflammation in liver fibrosis and inhibits inflammatory cytokine expression in hepatic stellate cells by modulating NLRP3 inflammasome pathway[J].IUBMB Life,2015,67(4):312-321.
[8]Li T,Song T,Ni L,Yang G,Song X,Wu L,et al.The p-ERK-p-c-Jun-cyclinD1 pathway is involved in proliferation of smooth muscle cells after exposure to cigarette smoke extract[J].Biochem Biophys Res Commun,2014,453(3):316-320.
[9]Hua JY,He YZ,Jiang XH,Ye W,Yang MY.Effect of tetramethylpyrazine on the proliferation and collagen synthesis of vascular smooth muscle cells[J].Chin J Integrated Tradit West Med(中国中西医结合杂志),2013,33(9):1226-1231.
[10]Du CQ,Liu XW,Zeng GZ,Jin HF,Tang LJ.Inhibition of farnesyl pyrophosphate synthase attenuates angiotensinⅡ-induced fibrotic responses in vascular smooth muscle cells[J].Int J Mol Med,2015,35(6):1767-1772.
[11] ChistiakovDA, OrekhovAN, BobryshevYV.Vascular smooth muscle cell in atherosclerosis[J].Acta Physiol(Oxf),2015,214(1):33-50.
[12] Lee HM,Kim HJ,Won KJ,Choi WS,Park SH,Song H,et al.Soluble form of vascular cell adhesion molecule 1 induces migration and proliferation of vascular smooth muscle cells[J].J Vasc Res,2008,45(3):259-268.
[13]Wong JC,Fiscus RR.Protein kinase G activity prevents pathological-level nitric oxide-induced apoptosis and promotes DNA synthesis/cell proliferation in vascular smooth muscle cells[J].Cardiovasc Pathol,2010,19(6):e221-e231.
[14] Gomez SY,Levesque LO,Li Y,Anand-Srivastava MB.Role of epidermal growth factor receptor transactivation in endothelin-1-induced enhanced expression of Gi protein and proliferation in A10 vascular smooth muscle cells[J].Can J Physiol Pharmacol,2013,91(3):221-227.
[15]Guizoni DM,Dorighello GG,Oliveira HC,Delbin MA,Krieger MH,Davel AP.Aerobic exercise training protects against endothelial dysfunction by increasing nitric oxide and hydrogen peroxide production in LDL receptor-deficient mice[J].J Transl Med,2016,14(1):213.
[16]Floyd HS,Chen LC,Vallanat B,Dreher K.Fine ambient air particulate matter exposure induces molecularalterations associated with vascular disease progression within plaques of atherosclerotic susceptible mice[J].Inhal Toxicol,2009,21(5):394-403.
[17]Kim EJ,Choi YK,Han YH,Kim HJ,Lee IK,Lee MO.RORalpha suppresses proliferation of vascular smooth muscle cells through activation of AMP-activated protein kinase [J].Int J Cardiol,2014,175(3):515-521.
2016-11-11 接受日期:2017-07-20)
(本文编辑:贺云霞)
Tetramethylpyrazine inhibits PM2.5-induced vascular smooth muscle cell proliferation by down-regulating JNK phosphorylation
WAN Qiang1,YANG Yu-ping2,YANG Xue1,CHEN Hong-tao1,WAN Chan-jun1,XU Ri1
(1.Department of Medical Cardiology,2.Department of Respiratory Medicine,Affiliated Hospital of Jiangxi University of Traditional Chinese Medicine,Nanchang 330006,China)
OBJECTIVETo investigate the inhibitory effect and the possible mechanism of tetramethylpyrazine(TMP)in preventing vascular smooth muscle cells(VSMCs)proliferation induced by fine particulate matter(PM2.5).METHODSPM2.520,200 and 400 mg·L-1was added to VSMCs for 24 h,the survival of VSMCs was measured by MTT assay,the protein levels of p-c-Jun N-terminal kinase(JNK)and fibroblast growth factor receptor-1(FGFR-1)in the VSMCs were detected by Western blotting,while the levels of vascular cell adhesion molecule-1(VCAM-1),endothelin-1(ET-1)and nitric oxide(NO)in the VSMCs were analyzed by ELISA,radioimmunoassay and nitrate reductase method,respectively.TMP 20,200 and 2000 mg·L-1or a specific inhibitor of JNK SP600125 10 μmol·L-1was added into the VSMCs to observe the effect of TMP.RESULTS Compared with the normal control group,PM2.5200 and 400 mg·L-1significantly increased theA570nmvaule,the protein levels of p-JNK and FGFR-1,the levels of VCAM-1 and ET-1,but decreased the level of NO(P<0.01),while there were no significant changes in PM2.520 mg·L-1group.Compared with the PM2.5200 mg·L-1group,TMP 200 and 2000 mg·L-1pre-treatment markedly decreased the A570nmvaule,the protein levels of p-JNK and FGFR-1,the levels of VCAM-1 and ET-1,but increased the level of NO(P<0.01),while there were no significant changes in TMP 20 mg·L-1pre-treated group.Moreover,the effects of TMP were significantly enhanced by the co-incubation of TMP 2000 mg·L-1with SP600125 10 μmol·L-1,compared to the TMP 2000 mg·L-1pre-treated group(P<0.05,P<0.01).CONCLUSION TMP displays a significant inhibitory effect against VSMC proliferation induced by PM2.5.The mechanism may be related to the inhibition of JNK phosphorylation,and the regulation of FGFR-1 protein expression and VCAM-1,ET-1 and NO levels.
PM2.5;tetramethylpyrazine;JNK;vascular smooth muscle cells
The project supported by National Natural Science Foundation of China(81660770);Natural Science Foundation of Jiangxi Province(2016BAB215256);and Science and Technology Planning Project of Health and Family Planning Commission of Jiangxi Province(20171105)
WAN Qiang,E-mail:wanqiang109559140@163.com
R972.6
A
1000-3002-(2017)07-0707-07
10.3867/j.issn.1000-3002.2017.07.002
国家自然科学基金(81660770);江西省自然科学基金(20161BAB215256);江西省卫生计生委科技计划(20171105)
万 强,男,博士,主治医师,从事心血管疾病的临床与实验研究。
万 强,E-mail:wanqiang109559140@163.com

