基于高效液相色谱-串级质谱法研究肝微粒体中T-2毒素代谢的种属差异性
林妮妮,郭 磊,陈 佳,谢剑炜
(军事医学科学院毒物药物研究所毒物分析实验室,抗毒药物与毒理学国家重点实验室,北京 100850)
基于高效液相色谱-串级质谱法研究肝微粒体中T-2毒素代谢的种属差异性
林妮妮,郭 磊,陈 佳,谢剑炜
(军事医学科学院毒物药物研究所毒物分析实验室,抗毒药物与毒理学国家重点实验室,北京 100850)
目的比较T-2毒素在不同种属动物肝微粒体中代谢的差异性。方法将T-2毒素与小鼠、大鼠、比格犬、猴和人肝微粒体37℃孵育不同时间,孵育液经蛋白沉淀后采用高效液相色谱-质谱法检测,比较T-2毒素在不同种属动物中代谢动力学参数及代谢产物生成量的差异。结果T-2毒素在人肝微粒体中半衰期(t1/2)<1 mim,在小鼠和猴肝微粒体中为2~4 min,在比格犬肝微粒体中为13 min,在大鼠肝微粒体中为39 min。5种动物对T-2毒素的肝清除能力可分为3组,即人、比格犬和大鼠为1组;猴和小鼠各为1组。其中小鼠组对T-2毒素的肝清除率是人、比格犬和大鼠组的3~4倍。不同种属的肝微粒体对T-2毒素的亲和力存在显著差异,其中T-2毒素在小鼠肝微粒体中的亲和力最高,其余依次为人、比格犬、大鼠和猴。酶的转化速率以在猴肝微粒体中最大,大鼠和比格犬中略小,而人和小鼠肝微粒体中酶转化速率仅为猴肝微粒体中转化速率的1/106。T-2毒素在猴肝微粒体中主要代谢产物为3′-OH-T-2和新茄病镰刀菌烯醇,在人和大鼠肝微粒体中为T-2三醇和HT-2毒素,在比格犬肝微粒体中以HT-2毒素和3′-OH-T-2毒素为主,在小鼠中则以T-2三醇和3′-OH-T-2毒素为主。T-2毒素在小鼠、大鼠、比格犬和人肝微粒体中主要以水解代谢转化为主,而在猴肝微粒体中则以羟基化代谢为主。结论T-2毒素的代谢参数、代谢产物及其生成量、代谢途径均存在种属差异性。
T-2毒素;种属差异;肝微粒体;液质联用法
近年来,毒理学研究中体外测试方法发展迅速。尽管体外测试尚不能完全代替动物试验,但在毒性筛选以及作用机制等研究方面具有很大的优势和发展前景。药物或毒物的动物种属差异性研究是体外测试关注的重点之一,可为动物的毒理学数据外推至人体以及动物模型提供重要数据支持。
T-2毒素属于单端孢霉烯族类毒素中的A类毒素,是该类毒素中毒性最强的真菌毒素,并且极易污染农作物,其中玉米、燕麦、小麦和大麦等粮食作物受污染最为严重,带来一系列食品安全问题。世界粮农组织和世界卫生组织把T-2毒素列为自然界存在的最危险的食品污染源[1]。欧盟食品科学委员会在2001年颁布了一项临时标准,限制每日T-2毒素与HT-2毒素之和的允许限量为0.06 μg·kg-1。已有研究表明,T-2毒素结构中,环氧环和双键是其毒性作用的关键基团,环氧环打开或双键还原均可使T-2毒素毒性下降[2]。T-2毒素代谢产物与原型具有相同的母核结构,大多数代谢产物仍然保留环氧环和双键,与原型具有相似的毒性。因此,T-2毒素代谢产物的毒性亦是人们关注的重点。本研究在建立高效液相色谱-质谱联用分析方法的基础上,研究T-2毒素在体内主要毒性靶器官肝微粒体中的代谢动力学、代谢产物和代谢途径等的种属差异性,为合理选择毒理学动物研究模型提供依据。
1 材料与方法
1.1 试剂和仪器
玉米赤霉酮(zearalanone,ZAN)、新茄病镰刀菌烯醇(neosolaniol,NEO)、3′-羟基-T-2 毒素(3′-OH-T-2 toxin)、T-2 三醇(T-2 triol,TRIOL)、HT-2毒素、T-2毒素和乙酰化T-2毒素(acetyl T-2 toxin)标准品及甲醇和乙腈(色谱纯)购自美国Sigma Aldrich公司;还原型辅酶Ⅱ四钠盐(NADPHNa4)购自瑞士Roche公司;甲酸铵和乙酸铵购自美国Fisher公司;小鼠、大鼠、比格犬、猴和人肝微粒体(蛋白质浓度20 g·L-1)均购自于北京汇智泰康医药技术有限公司;实验用水为Milli-Q超纯水购自美国Millipore公司。Agilent 1200型高效液相色谱仪、6430型三重四极杆质谱仪和XDB-C18反相色谱柱(50 mm×4.6 mm,ID1.8 μm)(Agilent公司,美国);RVC 2-33 CD plus型冷阱-隔膜泵-离心蒸发浓缩仪(Christ公司,德国);HW.SY11-K2型电热恒温水浴锅(北京长风仪器公司);PL203型电子天平(Mettler Toledo公司,德国);Eppendorf Centrifuge 5418型高速离心机(Eppendorf公司,德国)。
1.2 液相色谱-质谱条件
液相色谱条件:A相为5 mmol·L-1乙酸铵水溶液,B相为5 mmol·L-1乙酸铵甲醇溶液。梯度条件为:0~0.5 min,65%B;0.5~3.5 min,65%B~100%B;3.5~6.0 min,100%B;6.0~6.1 min,100%B~65%B;6.1~7.0min,65%B。柱温40℃,流速0.5mL·min-1,进样5 μL。
质谱条件:离子源,电喷雾离子源;模式,正离子模式;检测方式,多反应监测(multiple reaction monitoring,MRM)模式;雾化气35 psi,干燥气8 L·min-1,源温350℃。6种分析物及内标的定量离子对及质谱参数见表1。
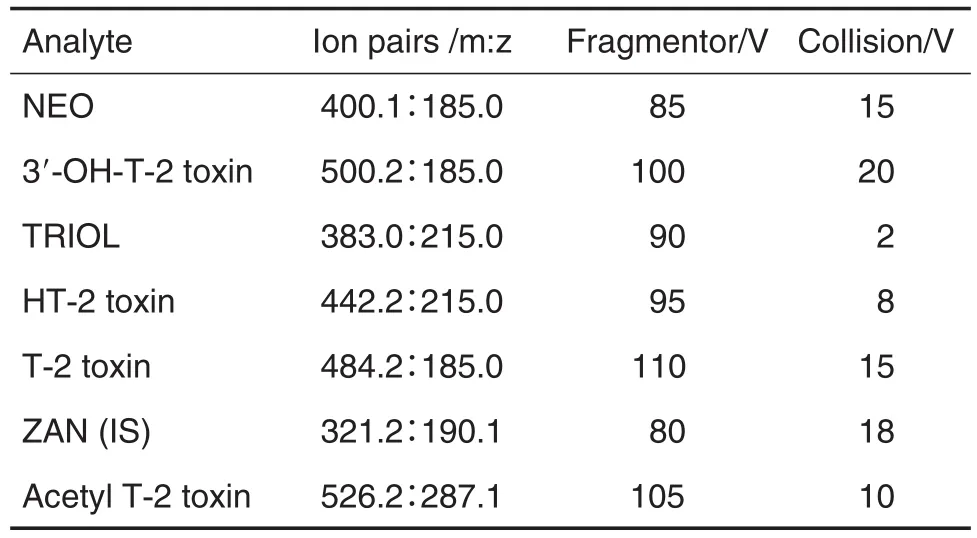
Tab.1 Mass spectrometry(MS)parameters of 6 analytes and internal standard(lS)
1.3 不同种属动物肝微体中T-2毒素代谢产物生成量的比较
固定 T-2 毒 素 浓度 为 20 μmol·L-1,孵 育120 min,其余按1.2方法操作,考察不同种属动物中代谢产物的生成量。
1.4 不同种属动物肝微粒体中T-2毒素的代谢
配制浓度为20 mmol·L-1的T-2毒素乙腈溶液(-20℃可稳定储存3个月),以PBS溶液稀释至0.1,0.5,1,10,20,50,100,200和1000 μmol·L-1。冰浴条件下,分别取上述溶液100 μL,加入蛋白质终浓度为0.5 g·L-1的肝微粒体80 μL中,37℃预孵育5 min后加入NADPHNa4(10 mmol·L-1)溶液20 μL,再于37℃孵育一定时间,然后加入200 μL终止液(V甲醇∶V乙腈=3∶1,含内标ZAN)终止反应,涡旋2 min,以14 243×g离心10 min,取上清液进样,LC-MS/MS分析。每个时间点平行制备3份样品。另外,分别取上述溶液100 μL,首先加入终止液,再加入肝微粒体80 μL。以PBS液代替NADPHNa4溶液,其余同上述操作,作为肝微粒体失活对照。按失活对照方法,采用不同浓度的T-2毒素进行同法操作,进行方法学验证。
依据测得的半衰期(t1/2),小鼠、大鼠、比格犬、猴和人肝微粒体孵育时间分别为20,30,20,5和2 min。
1.5 数据处理与分析
以T-2毒素在0时的浓度为100%,其他时间点的浓度与0时浓度比较得到T-2毒素的剩余百分比。将各时间点的剩余百分比的自然对数与对应的孵育时间作图,经直线回归求得斜率-k,由式①求得T-2毒素微粒体代谢的t1/2(min),应用Well Stirred模型[3]式②和式③对微粒体实验的相关数据进行外推可得到T-2毒素在小鼠、大鼠、比格犬、猴和人肝中的固有清除率Clint(mL·min-1·kg-1)和肝清除率Clh(mL·min-1·kg-1),其中相关的理化参数经验值见表2[3-5]。应用SigmaPlot(10.0)软件拟合得到米氏常数(Km)和酶转化数(Vmax)值[6]。

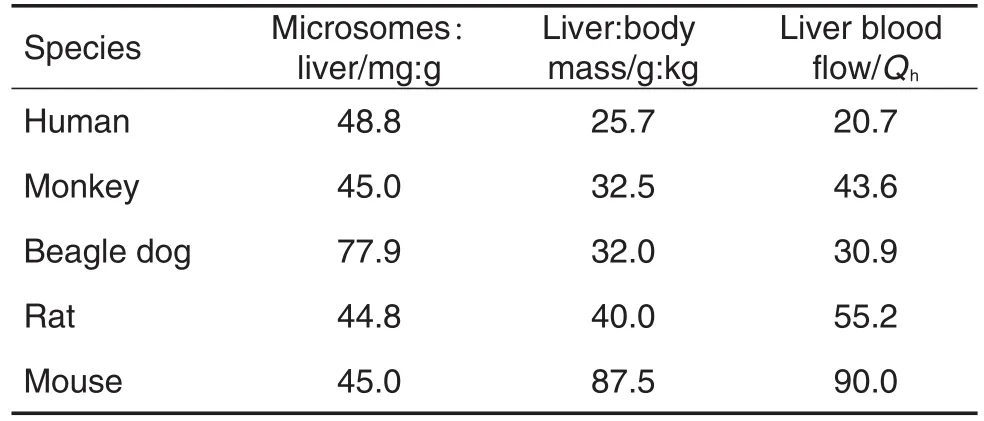
Tab.2 Physiological parameters used for calculation on Clintand Clhin liver microsomes
2 结果
2.1 分析方法验证
研究表明,分析物在不同种属肝微粒体中的基质效应无明显差异(图略)。因此,本研究采用SD大鼠肝微粒体绘制校正工作曲线。通过对10份不同批次的大鼠肝微粒体平行测定,结果表明其对分析物无明显干扰(图1)。
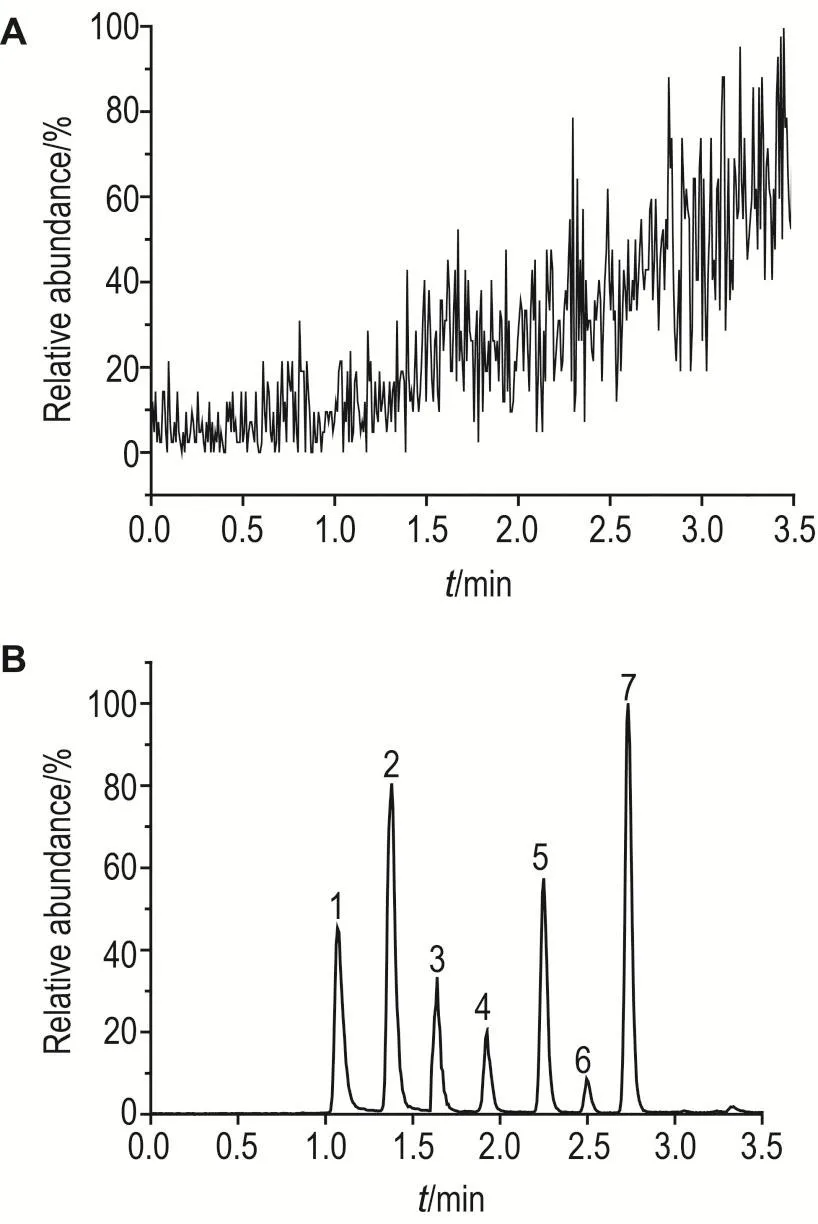
Fig.1 Multiple reaction monitoring(MRM)chromatograms of incubating samples of blank liver microsomes(A)and liver microsomes mixed standards(B).The chromatograms were attained under the following conditions:water with 5 mmol·L-1ammonium acetate(mobile phase A)and methanol with 5 mmol·L-1(mobile phase B)in the gradient of 0-0.5 min,65%B;0.5-3.5 min,65%B-100%B;3.5-6.0 min,100%B;6.0-6.1 min,100%B-65%B;6.1-7.0 min,65%B.Column temperature was 40℃,and MS model was MRM.1:NEO;2:3′-OH-T-2 toxin;3:TRIOL;4:HT-2 toxin;5:T-2 toxin;6:ZAN;7:acetyl T-2 toxin.
各分析物在0.005~20 mmol·L-1的浓度范围内具有良好的线性关系,其R2>0.990,检出限为0.001~0.02 mmol·L-1,回收率为82.2%~119.1%。提示本方法快速且灵敏,可应用于T-2毒素及其代谢物的检测。
2.2 T-2毒素在不同种属动物肝微粒体中的代谢差异
2.2.1 T-2毒素的代谢产物
将T-2毒素在不同种属动物肝微粒体中进行孵育,采用液相色谱-质谱进行产物鉴定和产物生成量的测定,结果如表3所示。
2.2.2 T-2毒素的代谢动力学参数
图2系半对数作图法计算消除速率所得。以不同时间T-2毒素剩余浓度百分比的对数与孵育时间作图法计算消除速率。T-2毒素在不同种属动物肝微粒体中呈线性消除,由此得到T-2毒素的消除参数(表4)。
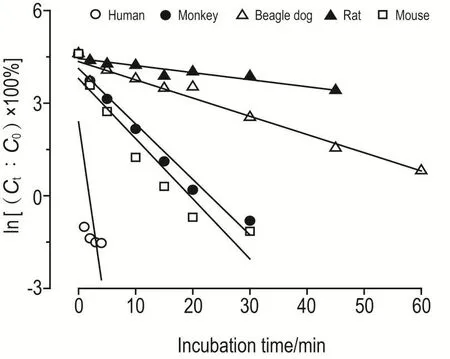
Fig.2 Semi-logarithm plot of remaining percentage of T-2 toxin-incubation time in liver microsomes of mice,rats,Beagle dogs,monkeys and humans.Semilog plot for the estimates of elimination rate constants.The semilog plots were conventionally used to convert the exponential decay to the linear first order process facilitating the k determination.Ctwas the concentration of T-2 toxin at time t,C0was the initial incubation concentration.

Tab.3 Results of T-2 toxin biotransformaton in liver microsomes of mice,rats,Beagle dogs,monkeys and humans
3 讨论
T-2毒素在各种属动物肝微粒体中孵育120 min后,均检测不到其原型,表明其已完全代谢,同时均可检测到包含3′-OH-T-2毒素、HT-2毒素、NEO和TRIOL等在内的多种代谢产物,但其生成量依种属不同而呈现出较大差异。在比格犬肝微粒体中,T-2毒素转化生成上述4种代谢物的比例高达89.1%,在其他种属肝微粒体中其转化比例均较低,在小鼠肝微粒体中的转化比例最低,为38.9%。通过分析3′-OH-T-2毒素、HT-2毒素、NEO和TRIOL等4种主要代谢产物之间的含量可知,该4种代谢产物在比格犬肝微粒体中的转化生成量相近,在猴肝微粒体中主要代谢产物为3′-OHT-2毒素和NEO,而在人和大鼠肝微粒体中主要代谢产物为TRIOL和HT-2毒素,表现出显著的种属差异性。
本研究结果表明,T-2毒素在人肝微粒体中迅速代谢,1 min内呈线性消除。小鼠和猴肝微粒体中T-2毒素代谢也较快,t1/2在2~4 min之间。在比格犬肝微粒体中的t1/2为13 min,而大鼠肝微粒体中T-2毒素代谢最慢,t1/2为39 min。T-2毒素在不同种属肝微粒体中代谢速率顺序为大鼠<比格犬<猴和小鼠<人。
在研究的5种动物中,人肝微粒体中T-2毒素的固有清除率(Clint)最高,但外推获得的肝清除率(Clh)最低,说明虽然人肝微粒体对T-2毒素的清除较快,但T-2毒素在其中的驻留时间长,表明其对人肝损伤时间最久。综合肝中血流(Qh)等参数,也可辅证T-2毒素在人肝中的清除率较低这一结果。其他4种动物肝微粒体中,小鼠中T-2毒素的t1/2较短,但Clint较高,外推的Clh也最大,说明小鼠肝对T-2毒素消除较快。依据Clh的大小,可以将5种动物对T-2毒素的肝清除能力分为3组,即人、比格犬和大鼠为1组;猴和小鼠各为1组。其中小鼠对T-2毒素的肝清除率是人、比格犬和大鼠的3~4倍。
Km是酶的特征性参数,1/Km近似表示酶与底物的亲和力大小,1/Km越大,亲和力越大。Vmax为酶的转化速率,Vmax越大,单位时间内对某种底物转化效率越高。本研究结果表明,不同种属的肝微粒体对T-2毒素的亲和力存在显著差异,T-2毒素在小鼠肝微粒体中的亲和力最高,其余依次为人、比格犬、大鼠和猴,表明在小鼠和人肝微粒体中不需要很高的底物浓度便可达到最大反应速度。酶的转化速率以在猴肝微粒体中为最大,大鼠和比格犬肝微粒体中略小,而人和小鼠肝微粒体中Vmax与猴肝微粒体中Vmax存在数量级上的差异,仅为猴的1/106。
一般将动物实验结果外推至人,必须考虑不同药物或毒物在人和动物之间种属及性别差异性的表现形式及可能存在的规律[7]。通常种属差异可分为2类:一是某种动物出现的生理作用或毒性在其他动物不出现,即质的种属差异,这种差异一般是由于代谢酶的有无而引起的;二是不同动物之间药物作用的持续时间或强度不同,即量的种属差异[8]。综合上述实验结果推测,T-2毒素在不同种属动物肝微粒体中的主要代谢途径及产物生成量虽呈现一定的差异性,但其主要代谢途径均涉及水解和羟基化(图3,以人肝微粒中代谢为例)。通过产物分析鉴定可知,T-2毒素在小鼠、大鼠、比格犬和人肝微粒体中主要以水解代谢转化为主,由于这些水解代谢产物的毒性均较低[9-10],故该途径可使T-2毒素减毒;而在猴肝微粒体中则以毒性较高的羟基化产物3′-OH-T-2毒素为主,呈现出一定的增毒作用[11]。对引起这种代谢差异性的原因,本研究依据T-2毒素的酶解实验结果[10,12]推测,不同种属动物中含有的羧酸酯酶量及其活性的差别可能是其主要原因。
综上所述,本研究通过建立的高灵敏度肝微粒体中T-2毒素及其代谢物的高效液相色谱-串联质谱分析方法,比较研究了T-2毒素在不同种属动物肝微粒体中的Ⅰ相代谢性质。结果表明,不同动物种属间呈现种属差异性,在小鼠、大鼠、比格犬和人肝微粒体中以水解转化减毒途径为主,而在猴肝微粒体中以羟基化的增毒代谢途径为主。T-2毒素在大鼠肝微粒体中的各代谢参数与人的较为接近,为动物实验结果外推至人提供了有益的参考数据。
Fig.3 Major metabolic pathways of T-2 toxin.HLM:human liver microsomes,A:NEO;B:HT-2 toxin;C:T-2 triol;D:T-2 tetraol;E:T-2 toxin;F:3′-OH-T-2 toxin;G:3′-OH-HT-2 toxin;H:3′-OH-T-2 triol.
[1] Wang MH,Li LM,Ding XL.Research advances on T-2 toxin[J].Chin J Anim Nutr(动物营养学报),2011,23(1):20-24.
[2]Peng SQ,Dong JY,Yang JS.Studies on relationship between toxicity of trichothecene toxin T-2 and its structure[J].Chin J Prev Med(中华预防医学杂志),1996,30(3):141-143.
[3]Obach RS.Prediction of human clearance of twentynine drugs from hepatic microsomal intrinsic clearance data:An examination ofin vitrohalf-life approach and nonspecific binding to microsomes[J].DrugMetab Dispos,1999,27(11):1350-1359.
[4]Davies B,Morris T.Physiological parameters in laboratory animals and humans[J].Pharm Res,1993,10(7):1093-1095.
[5]Zhou JJ.Effects of metabolism and interaction on efficacy and/or safety-in vitrostudies(天然产物/中药的代谢相互作用与药效和安全的体外研究)[D].Shanghai:Fudan University(复旦大学),2010.
[6] Zhang DL,Zhu MS.Griffith Humphreys W.Drug Metabolism in Drug Design and Development[M].Hoboken,New Jersey:John Wiley&Sons,Inc.2008:424-430.
[7]Li JT.Clinical Pharmacology(临床药理学)[M].2nd ed.Beijing:People′s Medical Publishing House,2001:78-79.
[8]Liu CX.Drug Evaluation(药物评价学)[M].Beijing:Chemical Industry Press ,2006:145-149.
[9] Swanson SP,Rood HD Jr,Behrens JC,Sanders PE.Preparation and characterization of the deepoxy trichothecenes:deepoxy HT-2,deepoxy T-2 triol,deepoxy T-2 tetraol,deepoxy 15-monoacetoxyscirpenol,and deepoxy scirpentriol[J].Appl Environ Microbiol,1987,53(12):2821-2826.
[10] Königs M, Mulac D, Schwerdt G, Gekle M,Humpf HU.Metabolism and cytotoxic effects of T-2 toxin and its metabolites on human cells in primary culture[J].Toxicology,2009,258(2-3):106-115.
[11] Knupp CA,Swanson SP,Buck WB.Comparativein vitrometabolism of T-2 toxin by hepatic microsomes prepared from phenobarbital-induced or control rats,mice,rabbits and chickens[J].Food Chem Toxicol,1987,25(11):859-865.
[12] Lin NN,Chen J,Xu B,Wei X,Guo L,Xie JW.The roles of carboxylesterase and CYP isozymes on thein vitrometabolism of T-2 toxin[J].Mil Med Res,2015,2:13.
2016-12-09 接受日期:2017-07-06)
(本文编辑:齐春会)
Species difference of T-2 toxin metabolism in liver microsomes by high performance liquid chromatography-tandem mass spectrometry
LIN Ni-ni,GUO Lei,CHEN Jia,XIE Jian-wei
(Laboratory of Toxicant Analysis,Institute of Pharmacology and Toxicology,Academy of Military Medical Sciences,State Key Laboratory of Toxicology and Medical Countermeasures,Beijing 100850,China)
OBJECTlVETo compare the species difference of T-2 toxin metabolism in liver microsomes of different animals.METHODST-2 toxin was incubated with liver microsomes from mice,rats,Beagle dogs,monkeys and humans,respectively,at 37℃for some time.Then,the incubation liquid was detected by high liquid chromatography-mass spectrometry method after albumen precipitation.RESULTSThe half-life(t1/2)of T-2 toxin was less than 1 min,2-4 min in mouse and monkey liver microsomes,13 min in dog liver microsomes,and 39 min in rat liver microsomes.The hepatic clearance(Clh)of T-2 toxin was divided into three groups among the five species of animals:humans,dogs and rats were in one group,monkeys a second group,and mice in another group.The Clhof mouse group was 3-4 times that of the human,dog and rat group.The affinity to T-2 toxin was different between the liver microsomes of these five species.The affinity of mouse liver microsomes was the strongest,followed by that of humans,dogs,rats and monkeys.The enzyme transfer rate of T-2 toxin was the highest in monkey liver microsomes followed by that of rats and dogs.It was one million times higher in monkey liver microsomes than in human and mouse liver microsomes.The major metabolites were 3′-hydroxyl-T-2 toxin and neosolaniol.T-2 triol and HT-2 toxins were the major metabolites in human and rat liver microsomes.HT-2 toxin and 3′-OH-T-2 toxin were the dominating metabolites in dog liver microsomes and T-2 triol and 3′-OH-T-2 toxin in mouse liver microsomes.T-2 toxin metabolited by hydrolysis effect in mouse,rat,dog and human liver microsomes,but through hydroxylation in monkey liver microsomes.CONCLUSlONThere are species differences in metabolic parameters,metabolites,amounts of metabolites,metabolic pathways of T-2 toxin in mouse,rat,dog,monkey and human liver microsomes.
T-2 toxin;species difference;liver microsomes;high performance liquid chromatographytandem mass spectrometry
The project supported by National"Twelfth Five-Year"Plan for Science&Technology(2011BAK10B07);and National Science and Technology Major Project of China(2012ZX09301003-001-010)
XIE Jian-wei,E-mail:xiejw@bmi.ac.cn
A
1000-3002-(2017)07-0754-06
DOl:10.3867/j.issn.1000-3002.2017.07.008
“十二五”国家科技支撑计划(2011BAK10B07);国家科技重大专项(2012ZX09301003-001-010)
林妮妮,博士,助理研究员,主要从事毒素代谢研究。
谢剑炜,E-mail:xiejw@bmi.ac.cn

