艰难梭菌毒素C蛋白的克隆表达和抗体制备
王建霞*,王宏伟*,杨锡琴,黄 忱,罗 芸,金大智,冯晓燕,张贺秋
(1.河北大学生命科学学院,河北保定 071000;2.军事医学科学院基础医学研究所,北京 100850;3.浙江省疾病预防控制中心,浙江杭州 310051)
艰难梭菌毒素C蛋白的克隆表达和抗体制备
王建霞1,2*,王宏伟1*,杨锡琴2,黄 忱3,罗 芸3,金大智3,冯晓燕2,张贺秋2
(1.河北大学生命科学学院,河北保定 071000;2.军事医学科学院基础医学研究所,北京 100850;3.浙江省疾病预防控制中心,浙江杭州 310051)
目的克隆艰难梭菌毒素C(tcdC)基因并构建TcdC蛋白的原核表达载体,制备多克隆抗体。方法从艰难梭菌标准株(ATCC43255)基因组DNA中扩增获得tcdC基因的部分片段,连接到原核表达载体并转化到大肠杆菌中,诱导表达GST-TcdC/L和IL1-TcdC/L融合蛋白,前者用作免疫抗原,后者用作检测抗原。采用SDS-PAGE法鉴定融合蛋白的表达,并通过Ni柱纯化IL1-TcdC/L融合蛋白,Q柱纯化GST-TcdC/L融合蛋白。将纯化的GST-TcdC/L融合蛋白于兔背部皮内多点注射,每只1 mg,4周1次,共3次。最后1次免疫后2周,采血分离血清。用IL1-TcdC/L蛋白包被酶联板,采用ELISA法检测多抗血清效价;Western蛋白印迹法检测多抗特异性。结果SDS-PAGE结果表明,所表达的2个融合蛋白与预期分子质量一致。ELISA结果显示,制备的TcdC多克隆抗体效价>1∶6.4×104。Western蛋白印迹实验显示,制备的TcdC/L多克隆抗体能特异性识别艰难梭菌中的TcdC蛋白。结论成功克隆了艰难梭菌tcdC/L基因并进行了原核表达,成功制备了其多克隆抗体,为后续研究tcdC基因在艰难梭菌致病过程中的作用及机制奠定了基础。
艰难梭菌;毒素C蛋白;多克隆抗体
艰难梭菌(Clostridium difficile,CD)是革兰阳性芽孢杆菌,1935年Hall和 O'Toole[1]首次从新生儿粪便中分离。该菌一般寄生在人肠道内,无荚膜,对环境抵抗力较弱,对氧极度敏感,是人类肠道感染的主要致病菌之一。CD感染是由产毒型CD在肠道过度增殖并大量释放毒素引起的一系列感染性疾病[2]。
CD引起的临床疾病与其携带的致病基因座(pathogenicity locus,PaLoc)相关。强毒力株的毒素分泌量与PaLoc中毒素A(toxin A,tcdA)和tcdB基因转录和(或)表达水平具有相关性[3],但PaLoc中其他基因,尤其是tcdC基因在毒素表达调控方面的作用机制尚不明确,存在较大争议。因此,为了进一步确定tcdC基因是否在调控tcdA和tcdB基因表达方面发挥作用,就要首先了解TcdC蛋白的生物学功能,但目前尚无针对TcdC的商品化抗体。为满足实验需求,本研究克隆tcdC基因的部分片段,然后将其连接至表达载体构建原核表达系统,并获得纯度较高的TcdC融合蛋白,免疫制备相应的多克隆抗体,为后续tcdC基因功能及作用机制的研究奠定基础。
1 材料与方法
1.1 试剂和仪器
原核表达质粒pBVGST和pBVIL1及大肠杆菌DH5α和HB101为本课题组构建;CD(ATCC43255)菌株由浙江省疾病预防控制中心提供;限制性内切酶XhoⅠ,XbaⅠ以及T4 DNA连接酶由大连宝生物工程有限公司生产;2×Power Taq PCR MasterMix、质粒提取试剂盒及胶回收试剂盒均购自北京百泰克生物技术有限公司;引物合成及序列测定由北京中美泰和生物技术有限公司完成;IPTG、弗氏佐剂购自美国Sigma公司;辣根过氧化物酶(HRP)标记的山羊抗兔IgG抗体(二抗)购自北京中杉金桥生物技术公司;PVDF膜购自美国Millipore公司;Super-ECL Plus超敏发光液购自北京普利莱基因技术有限公司。PCR扩增仪(S1000 TM thermal cycler)、UV凝胶成像分析仪(Gel Doc XR+)购自美国Bio-rad公司;电泳仪(DYY-6 C型)购自北京六一仪器厂;离心机(LEGEND MICRO17)和温箱(培养箱)(HERACELL 240i)购自美国Thermo公司;自动化酶联免疫分析仪(SM-3)购自北京天石天力医疗器械有限公司。
1.2 tcdC基因克隆和质粒构建
利用生物信息学软件BIOSUN对TcdC蛋白的氨基酸序列的B细胞表位分布进行分析。根据已报道的CD(ATCC43255)菌株的基因组序列,设计tcdC基因的引物,从基因组DNA中扩增获得相应目的基因,命名为tcdC/L。引物序列如下:上游引物tcdC/L,5′-GCCTCGAGTGTTCTGAAGACCATGAGGAGGTC-3′;下 游 引 物tcdC/L,5′-GCTCTAGAATTAATTTTCTCCACAGCGATGCCTGG-3′。以提取的CD基因组DNA为模板,利用上述引物扩增获得目的基因,PCR反应条件为94℃预变性5 min;94℃变性30 s,58℃退火30 s,72℃延伸40 s,进行30个循环;结束后72℃终延伸10 min。将纯化后的PCR产物分别连接入pBVGST和pBVIL1载体,构建表达质粒pBVGST-TcdC/L和pBVIL1-TcdC/L并进行测序,将含有测序正确目的基因的大肠杆菌菌株进行42℃诱导表达,SDS-PAGE电泳鉴定GSTTcdC/L和IL1-TcdC/L融合蛋白的表达。
1.3 TcdC融合蛋白纯化和鉴定
GST-TcdC/L蛋白的纯化:将测序正确的菌落诱导,离心收集并超声破碎(冰浴)菌体,用溶解液〔Tris-EDTA(TE)缓冲液25 mmol·L-1、1%β-巯基乙醇和脲8 mol·L-1,pH 8.5〕溶解包涵体,收集样品进行Ni柱纯化。上样结束后分别用含咪唑25和250 mmol·L-1的洗脱缓冲液洗脱并收集目的蛋白,SDS-PAGE电泳鉴定纯化后的蛋白。
IL1-TcdC/L蛋白的纯化:收集的菌体超声裂解后,提取的包涵体用TE缓冲液溶解,样品进行Q柱纯化。上样结束后,用含梯度NaCl的TE缓冲液进行洗脱,收集各洗脱液。将上样前样品、穿过液、梯度NaCl洗脱液进行SDS-PAGE电泳鉴定。取G50柱100 mL柱体,G50平衡液平衡约3个柱体积,根据上述电泳结果将收集纯化的目的蛋白过柱,收集第一个洗脱峰即为脱盐的目的蛋白,将收集的目的蛋白用Tris-HCl缓冲液(pH 8.5)5倍体积透析48 h后进行SDS-PAGE电泳鉴定。
1.4 多克隆抗体制备及效价测定
为了排除空载体上融合蛋白的影响,本实验表达了GST-TcdC/L和IL1-TcdC/L 2个融合蛋白,其中GST-TcdC/L蛋白为免疫抗原,用于制备多抗,IL1-TcdC/L蛋白为检测抗原,用于抗体效价测定。取纯化后的GST-TcdC/L抗原免疫新西兰大白兔。初次免疫前取血作为阴性对照,取抗原(1 g·L-1)与完全弗氏佐剂按1∶1的比例混匀乳化,于兔背部皮内多点注射,每只注射GST-TcdC/L融合蛋白1 mg;4周后,取抗原与不完全弗氏佐剂混匀乳化后进行第2次免疫。再于4周后,进行第3次加强免疫。第3次免疫2周后耳缘静脉取血,分离血清,测定抗体效价。若效价≥1∶10 000则隔天进行心脏取血,离心分离血清,分装后置于-20℃保存。
ELISA法检测多抗血清的效价。取兔血清,首次稀释500倍,采用倍比稀释法进行稀释,阴性血清作为对照,加入到包被有IL1-TcdC/L检测抗原(2.5 mg·L-1)的包被板中,37℃孵育30 min后洗板拍干;加入HRP标记的山羊抗兔IgG二抗(1∶10000),37℃孵育20 min后洗板拍干;加入A和B显色液,37℃避光10 min后加入终止液,在450 nm波长处测定吸光度(A450nm)值。
利用Montege®Antibody purification pRosop®-G试剂盒纯化抗体,SDS-PAGE电泳检测纯化的抗体,并用分光光度计检测抗体的蛋白含量。
1.5 Western蛋白印迹法检测抗体特异性
将免疫用抗原和检测用抗原进行常规SDSPAGE电泳分离;电泳完毕后转到PVDF膜上,转膜条件为4℃,200 mA电转1 h;取出PVDF膜,用含5%脱脂奶粉的TBST室温封闭1 h;加入制备的多克隆抗体(1∶3000稀释),4℃孵育过夜;TBST洗膜后,加入HRP标记的山羊抗兔IgG(1∶2000稀释),室温孵育1 h;TBST洗膜后,化学发光显色(ECL)并拍照,鉴定抗原抗体的反应。
取CD(ATCC43255)菌株,加入裂解液,冰上裂解20 min,然后4℃,3000×g离心20 min,收集上清即为全蛋白。将全蛋白经SDS-PAGE电泳分离,封闭后用多克隆抗体(1∶200稀释)4℃孵育过夜;洗膜,加入HRP标记的山羊抗兔IgG(1∶1000稀释),室温孵育1 h;洗膜后化学发光显色(ECL)并拍照,鉴定制备的抗体是否可检测到菌中的TcdC蛋白。
2 结果
2.1 抗原区段的选择
本研究利用BIOSUN生物信息学软件分析TcdC蛋白B细胞表位分布情况,发现该结构域(30~50 aa)为高疏水性区域,与文献[9]报道的其结构中含有跨膜结构域(30~50 aa)一致,抗原性较弱;而50~232 aa区域亲水性较强,为优势表位抗原区段(图1)。因此,选取峰值较高的表位区域即TcdC蛋白的50~232 aa抗原区段(TcdC/L)进行克隆表达。

Fig.1 BlOSUN software analysis of toxin C(TcdC)protein epitope in pathogenicity locus of Clostridium difficile(CD).Above the blue line for hydrophilic protein fragments,while hydrophobic fragments under the blue line.
2.2 目的基因的获取
以CD(ATCC43255)基因组DNA为模板,采用tcdC基因引物进行PCR扩增,琼脂糖电泳鉴定。结果显示,获得了相应长度目的基因条带,基因长度约为549 bp(图2)。
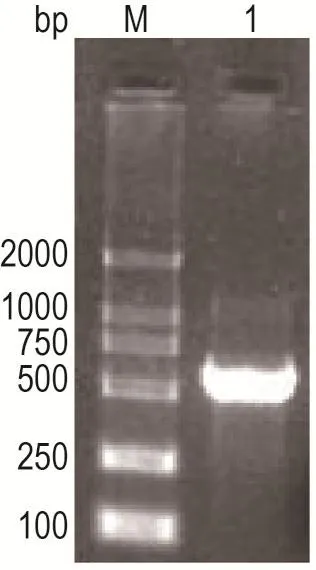
Fig.2 Electrophoretic profile of PCR product of tcdC gene.The tcdC/L gene was amplified using tcdC/L primers from the chromosomal DNA of CD.The PCR product was separated on 2%gel electrophoresis.M:DNA molecular mass marker;lane 1:amplified product of tcdC/L gene(549 bp).
2.3 抗原表达与纯化
将tcdC抗原基因连接至表达载体,选取测序正确的重组表达质粒转化于大肠杆菌诱导表达,收集菌体,并进行SDS-PAGE电泳鉴定。结果显示,GST-TcdC/L和IL1-TcdC/L融合蛋白均获得了表达,经过柱纯化后获得纯化融合蛋白,其中GSTTcdC/L约为45 ku,IL1-TcdC/L约为39 ku(图3)。
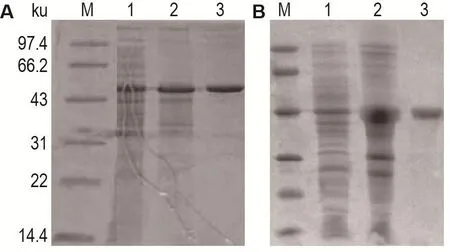
Fig.3 SDS-PAGE analysis of expressed GST-TcdC/L(A)and lL1-TcdC/L(B)fusion proteins.Recombinant proteins were separated on 15%SDS-PAGE gel and stained with Coomassie blue.A:the bands show GST-TcdC/L protein was approximately 45 ku.Lane 1:pBVGST-TcdC/L was inducted at 42℃;lane 2:the lysate supernatant;lane 3:purified GST-TcdC/L protein;M:protein molecular mass marker.B:the bands show IL1-TcdC/L protein was approximately.Lane 1:pBVIL1-TcdC/L was inducted at 42℃;lane 2:the lysate supernatant;lane 3:purified IL1-TcdC/L protein.
2.4 多克隆抗体的效价测定及纯化
用GST-TcdC/L免疫家兔,在最后1次免疫2周后耳缘静脉取血,分离出血清进行抗体效价测定。用IL1-TcdC/L抗原包被酶联板,间接ELISA法检测抗体效价,抗体血清首次稀释500倍,然后采用倍比稀释法进行稀释。以免疫前的阴性血清作为对照。结果显示,抗体效价>1∶6.4×104(图4),可用于后续实验研究。
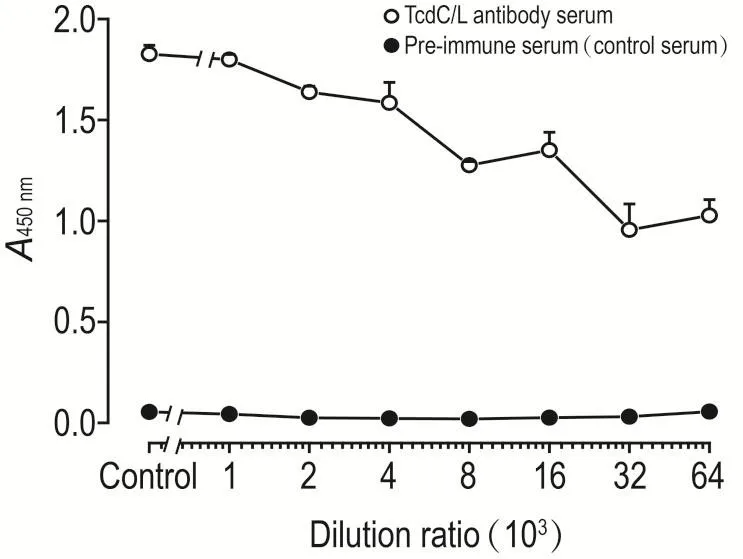
Fig.4 Titer determination of rabbit antiserum against GST-TcdC/L was used as an fusion protein.Purified GST-TcdC/L fusion protein was used as an antigen to immunize rabbits.The rabbit antiserum was harvested two weeks after the third booster immunizations.Indirect ELISA assay demonstrated that the titer of the antiserum was above 1∶6.4 ×104.
利用Montege®Antibody purification pRosop®-G试剂盒进行纯化得到纯化后多克隆抗体,多克隆抗体主要抗体形式为IgG,基本结构是由4条多肽链(二硫键连接的2条重链和2条轻链)组成的糖基化蛋白[4],经过变性处理后,二硫键打开,IgG解离成重链(50 ku)和轻链(25 ku),纯化结果如图5。紫外分光光度法检测TcdC/L多克隆抗体浓度为4 g·L-1。
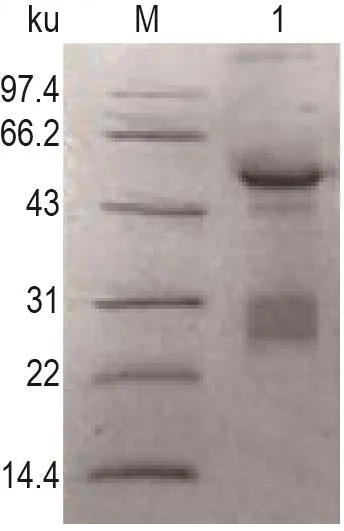
Fig.5 SDS-PAGE analysis of purified anti-TcdC/L polyclonal antibody.See Fig.4 for the preparation of antiserum.The antibody was purified by Montege® Antibody Purification pRosop®-G Kit.Lane 1:purified anti-TcdC/L polyclonal antibody.
2.5 TcdC/L多克隆抗体特异性检测和鉴定
利用制备得到的多克隆抗体对抗原及CD(ATCC43255)菌株进行Western蛋白印迹检测,以过量蛋白封闭掉的抗体作为阴性对照。图6A和B结果显示,制备的多克隆抗体可与免疫抗原在相对分子质量约45 ku处出现明显的杂交条带,也可与检测抗原IL1-TcdC/L反应并在39 ku处产生杂交条带,而阴性对照组中条带消失,说明制备的抗体可特异性识别TcdC蛋白区段抗原,是针对TcdC抗原区段的特异性抗体。

Fig.6 Specificity and determination of TcdC/L polyconal antibody by Western blotting.A:purified TcdC/L polyconal antibody that recognized GST-TcdC/L and IL1-TcdC/L proteins;lanes 1 and 3:IL1-TcdC/L;lanes 2 and 4:GST-TcdC/L;lanes 1 and 2:unblocked by antigen;lanes 3 and 4:blocked by antigen.B:determination of TcdC/L polyclonal antibody by recognizing TcdC protein from CD.Lane 1:unblocked by antigen;lane 2:blocked by antigen.
对CD菌体进行检测(图6C)发现,在相对分子质量约25.5 ku处可见明显特异性条带,而阴性对照组中条带消失,说明制备的抗体识别CD中的天然全长TcdC蛋白,可用于后续实验研究。
3 讨论
CD是人与动物伪膜性肠炎及抗生素相关性腹泻的主要病原菌。CD感染已成为基础研究、公共卫生和临床治疗等多个领域广为关注的问题[5]。产毒型CD含有1个约19.6 kb的PaLoc基因座,含有tcdA,tcdB,tcdC,tcdE和tcdR5个开放式阅读框及cdu-2和cdd-3等插入序列。tcdA和tcdB基因编码毒素A和B,毒素A为肠毒素,毒素B为细胞毒素[6]。tcdE基因位于tcdA和tcdB基因之间,tcdE基因编码膜孔蛋白(holin)协助CD毒素分泌至外环境[7]。
tcdC基因编码的蛋白TcdC由232 aa组成,相对分子质量约为25.5 ku。Govind等[8]发现,大部分TcdC蛋白存在于细胞质膜中。van Leeuwen等[9]采用生物信息学方法,发现TcdC蛋白结构包括跨膜结构域(30~50 aa)、二聚体结构域(90~130 aa)和可结合寡核苷酸的C端。目前传统观点认为tcdB基因编码一种反ε因子,反ε因子和ε因子及其他一些未知转录因子通过一种复杂的方式对tcdA和tcdB基因的表达进行调控[10]。但也有一些研究结果得出不同结论,Cartman等[11]选取tcdC基因缺失18 bp片段的CD(R20291)与携带有完整tcdC基因的CD(630)为对照,发现2株菌之间产毒量差异不显著。Vohra 等[12]在分析 CD(VPI10463)和 CD(630)的PaLoc中各基因的转录水平时发现,tcdC基因转录水平升高的同时,tcdA和tcdAB毒素基因的转录水平和产毒量也随之升高。由此可知,对于tcdC基因的功能及其在致病过程中所起的作用仍不明确,并存在较大的争议,需要进行更加细致地探索研究,为CD感染的控制提供更加有效的基础支撑。
为了更加深入地研究tcdC基因及其蛋白在毒素调节方面的作用,首先要了解TcdC蛋白在CD中的表达特征,因此需要制备能高效识别该蛋白的抗体。本研究将tcdC基因中编码50~232 aa区段的151~699 bp基因片段克隆至原核表达载体,转化到大肠杆菌中,分别诱导表达了GST-TcdC/L蛋白和IL1-TcdC/L蛋白。然后以纯化的GST-TcdC/L蛋白作为抗原免疫制备了多克隆抗体。用IL1-TcdC/L蛋白包被酶联板,ELISA方法检测制备的多克隆抗体,其效价>1∶6.4×104。Western蛋白印迹结果显示,制备的TcdC/L多克隆抗体可与免疫抗原GSTTcdC/L和检测抗原IL1-TcdC/L发生特异性结合并产生杂交条带。该多克隆抗体能够特异性识别CD中的TcdC蛋白,为后续研究TcdC蛋白在CD中的表达、定位分布及其对TcdA和TcdB表达调节的作用机制奠定了基础。
[1] Hall IC,O′Toole E.Intestinal flora in new-born infants:With a description of a new pathogenic anaerobe,Bacillus difficilis[J].Am J Dis Child,1935,49(2):390-402.
[2] Curry SR,Marsh JW,Muto CA,O'Leary MM,Pasculle AW,Harrison LH.TcdC genotypes associated with severe TcdC truncation in an epidemic clone and other strains ofClostridium difficile[J].J Clin Microbiol,2007,45(1):215-221.
[3] Kociolek LK,Gerding DN.Clinical utility of laboratory detection ofClostridium difficilestrain BI/NAP1/027[J].J Clin Microbiol,2016,54(1):19-24.
[4] Yang ZY.Cloning,prokaryotic expression of goat PTHrP,and its antibody preparation(山羊PTHrP基因的克隆、原核表达和多克隆抗体制备)[D].Xi′an:Northwest A&F University(西北农林科技大学),2010.
[5]Sattar A,Thommes P,Payne L,Warn P,Vickers RJ.SMT19969 forClostridium difficileinfection(CDI):in vivoefficacy compared with fidaxomicin and vancomycin in the hamster model of CDI[J].J Antimicrob Chemother,2015,70(6):1757-1762.
[6] Chen YB,Gu SL,Wei ZQ,Shen P,Kong HS,Yang Q,et al.Molecular epidemiology ofClostridium difficilein a tertiary hospital of China[J].J Med Microbiol,2014,63(Pt 4):562-569.
[7] Cao B,Li XP,Cheng Y.Clostridium difficilevirulence factors inducing anti-infection response and its gene functions[J].Immunol J(免疫学杂志),2013,29(4):357-360.
[8] Govind R,Dupuy B.Secretion ofClostridium difficiletoxins A and B requires the holin-like protein TcdE[J].PLoS Pathog,2012,8(6):e1002727.
[9] van Leeuwen HC,Bakker D,Steindel P,Kuijper EJ,Corver J.Clostridium difficileTcdC protein binds four-stranded G-quadruplex structures[J].Nucleic Acids Res,2013,41(4):2382-2393.
[10] Mani N,Dupuy B.Regulation of toxin synthesis inClostridium difficileby an alternative RNA polymerase sigma factor[J].Proc Natl Acad Sci USA,2001,98(10):5844-5849.
[11] Cartman ST,Kelly ML,Heeg D,Heap JT,Minton NP.Precise manipulation of theClostridium difficilechromosome reveals a lack of association between the tcdC genotype and toxin production[J].Appl Environ Microbiol,2012,78(13):4683-4690.
[12] Vohra P,Poxton IR.Comparison of toxin and spore production in clinically relevant strains ofClostridium difficile[J].Microbiology,2011,157(Pt 5):1343-1353.
*Co-first author.
2017-02-03 接受日期:2017-07-12)
(本文编辑:齐春会)
Cloning and expression of toxin C gene of Clostridium difficile and its polyclonal antibody preparation
WANG Jian-xia1,2*,WANG Hong-wei1*,YANG xi-qin2,HUANG Chen3,LUO Yun3,JIN Da-zhi3,FENG Xiao-yan2,ZHANG He-qiu2
(1.College of Life Sciences,Hebei University,Baoding 071000,China;2.Institute of Basic Medical Sciences,Academy of Military Medical Sciences,Beijing 100850,China;3.Zhejiang Provincial Center for Disease Control and Prevention,Hangzhou 310051,China)
OBJECTlVETo clone and express toxin C(tcdC)gene pathogenicity locus ofClostridium difficile(CD),and prepare the polyclonal antibody against TcdC protein.METHODSThetcdCgene was amplified from CD(ATCC43255)strain genome DNA and inserted into prokaryotic expression vectors.The correct recombinant plasmids were transformed intoE.coliwhich was induced to express the GSTTcdC/L and IL1-TcdC/L fusion protein.Meanwhile,the fusion proteins were respectively purified through Ni-NTA agarose affinity chromatography and Q-Sepharose Fast Flow.The purified GST-TcdC/L fusion protein was used as an antigen to inoculate rabbits to produce antiserum.Two weeks after the final immunization,the rabbits were sacrificed and serum was collected.The titer of the serum was determined by ELISA and the reactivity of the polyclonal antibody was identified by Western blotting.RESULTSThe SDS-PAGE result showed that GST-TcdC/L and IL1-TcdC/L fusion proteins were expressed at the size of 45 ku and 39 ku.The titer of TcdC/L polyclonal antibody was over 1∶6.4×104.Western blotting detection demonstrated that the TcdC/L polyclonal antibody recognized the TcdC protein in CD(ATCC43255).CONCLUSlONThe tcdC/L gene is cloned and the polyclonal antibody against TcdC/L is prepared,which will contribute to studing the function and mechanism of tcdC gene in pathogenicity locus.
Clostridium difficile;toxin C proteins;polyclonal antibody
The project supported by National Natural Science Foundation of China(81471998);Science and Technology Medicine and Healthcare of Zhejiang Province(WKJ-ZJ-1507);and Post-graduate′s Innovation Fund Project of Hebei University(X2016072)
FENG Xiao-yan,Tel:(010)66931397,E-mail:xyfeng2002@126.com;JIN Da-zhi,Tel:(0571)87115299,E-mail:dzjin@cdc.zj.cn
R967
A
1000-3002-(2017)07-0760-06
DOl:10.3867/j.issn.1000-3002.2017.07.009
国家自然科学基金(81471998);国家卫生和计划生育委员会科学研究基金-浙江省医药卫生重大科技计划(WKJ-ZJ-1507);河北大学研究生创新项目(X2016072)
王建霞,女,硕士研究生,主要从事生物疾病诊断研究;王宏伟,女,教授,主要从事水生生物疾病诊断研究。
冯晓燕,E-mail:xyfeng2002@126.com,Tel:(010)66931397;金大智,E-mail:dzjin@cdc.zj.cn,Tel:(0571)87115299
*共同第一作者。

