基于核心素养观念下对数图像题的突破策略研究
□刘树领 周建国
(山东省北镇中学,山东滨州256600;邹平县第一中学,山东邹平256200)
基于核心素养观念下对数图像题的突破策略研究
□刘树领 周建国
(山东省北镇中学,山东滨州256600;邹平县第一中学,山东邹平256200)
因图像题较好地体现出化学核心素养体系的考查,使得对数图像题逐渐成为命题的热点及主流题型。通过分析与研究发现,知识考查的落脚点主要集中在电解质溶液理论的基本知识及实际应用知识,进而找出对数图像题解答的关键在于横坐标为0点或问题点的探析上,由此提出了在夯实电解质溶液理论知识的前提下,运用学科观念、思维解答对数图像题的有效策略。
核心素养;对数图像题;学科观念;突破策略
在立德树人、突出核心素养考查的命题指导思想下,图像成为命题的新载体,其目的就是在考查基本知识及灵活运用的基础上,来渗透模型认知、证据推理、宏观辨识、微观探析、变化观念、平衡思想、社会责任等化学核心素养知识。化学上为了简便表示溶液的酸碱性从而引入了pH,因而出现了较多与pH有关的对数图像题,并衍生出了许多pOH、pKa、pKw、pKsp等对数图像题。
一、常见对数图像题的类型
(一)电离平衡(或水解平衡)对数图
溶液多为电解质溶液,因而溶液中就常存在电离平衡、水解平衡等多种平衡体系。为了考查其平衡移动方向及其影响因素、粒子浓度大小关系等知识,同时凸显宏微结合、变化与平衡、证据推理及模型认知等学科素养,因而出现电离(或水解)图像问题。
例125℃时,相同体积和pH的NaX、NaY、NaZ三种盐溶液,分别加水稀释,溶液pH的变化与所加水的体积关系如图1所示。下列说法正确的是( )

图1
A.在上述三种盐原溶液中,水的电离度大小是NaX>NaY>NaZ
B.在等物质的量浓度的NaX、NaY、NaZ混合液中,离子浓度的大小关系是c(Z-)>c(Y-)>c(X-)
C.在上述NaX和NaY的混合液中存在c(HX)/c(X-)=c(HY)/c(Y-)
D.在0.2 mol·L-1NaX溶液中加入等体积0.1 mol·L-1的盐酸,所得混合液中存在c(H+)+c(HX)=c(OH-)+c(Cl-)
评析:以盐类水解为知识考查背景而设计的图像题,突出对曲线变化原因分析及控制变量对比思想的灵活应用。解题的关键是曲线起点(横坐标为0)相同、稀释相同倍数时pH的变化量不同。具体过程:“稀释相同倍数的盐类溶液时,其pH变化越大则意味着该盐的水解程度就越小,其相对应的酸性就越强”[1],得出酸根离子水解程度大小顺序是Z->Y->X-,酸的强弱顺序是HX>HY>HZ。等物质的量浓度的NaX、NaY、NaZ混合液中,存在离子浓度的大小关系是c(Z-)<c(Y-)<c(X-),故A、B错误;等浓度NaX和NaY的混合液中存在c(HX)/c(X-)<c(HY)/c(Y-),故C错误;在0.2 mol·L-1NaX溶液中加入等体积0.1 mol·L-1的盐酸后,所得溶液是等物质的量浓度的NaX、NaCl、HX,根据电荷守恒得c(H+)+c(Na+)=c(OH-)+c(Cl-)+c(X-),物料守恒得c(Na+)=c(HX)+c(X-)=2c(Cl-),可得c(H+)+c(HX)=c(OH-)+c(Cl-),故D正确。
(二)酸碱中和滴定对数图
中和滴定是高中化学最重要的定量实验之一,因而对中和滴定曲线的考查较多,涉及的知识点考查较多,设问方式较多,并把数形结合思想、宏微结合、变化与平衡思想等素养体现的淋漓尽致。
1.一元酸与一元碱之间的滴定
例2(2016年天津卷) 室温下,用相同浓度的NaOH溶液,分别滴定浓度均为0.1mol·L-1的三种酸(HA、HB和HD)溶液,滴定的曲线如图2所示,下列判断错误的是( )
A.三种酸的电离常数关系:KHA>KHB>KHD
B.滴定至P点时,溶液中:c(B-)>c(Na+)>c(HB)>c(H+)>c(OH-)
C.pH=7时,三种溶液中:c(A-)=c(B-)=c(D-)
D.当中和百分数达100%时,将三种溶液混合后:c(HA)+c(HB)+c(HD)=c(OH-)-c(H+)
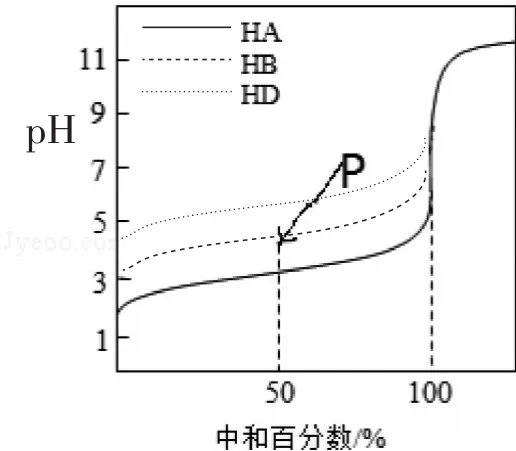
图2
评析:三条曲线是三种酸单独与等浓度氢氧化钠反应而产生的,组合在一起就是考查对比数据处理能力、视图分析能力及提取信息与灵活应用能力。解题的关键是曲线的起点(横坐标为0)、图中标记的P点及横坐标标出的中和百分之五十(即反应只进行了一半)、百分之百(恰好完全反应)时对应的特殊点。由浓度均为0.1mol·L-1的三种酸(HA、HB和HD)溶液滴定的三条变化曲线的起点(也可根据分别中和百分之五十或百分之百时对应的pH大小判断)可知,其酸性HA、HB、HD都是弱酸,且酸性依次减弱,故三种酸的电离常数关系存在KHA>KHB>KHD,所以A正确;滴定至P点时恰好HB反应了一半,即溶液中存在等浓度的HB与NaB,结合P点对应的溶液呈酸性,HB电离程度大于NaB水解程度,所以B正确;pH=7时,即意味着三种酸(HA、HB和HD)溶液中消耗氢氧化钠溶液的体积依次减少,故钠离子浓度不同,进而依据电荷守恒可知C错;当中和百分数达100%时,将三种溶液混合后含等浓度的NaA、NaB、NaD三种溶质,均水解呈碱性,其物料守恒式为 c(Na+)=c(HA)+c(HB)+c(HD)+c(A-)+c(B-)+c(D-)、电荷守恒式为 c(A-)+c(B-)+c(D-)+c(OH-)=c(Na+)+c(H+),进而得 c(HA)+c(HB)+c(HD)=c(OH-)-c(H+),所以D正确。
2.多元酸(或碱)与强碱(或强酸)的滴定
例3(2017全国理综I)常温下将NaOH溶液滴加到己二酸(H2X)溶液中,混合溶液的pH与离子浓度变化的关系图3所示。下列叙述错误的是( )
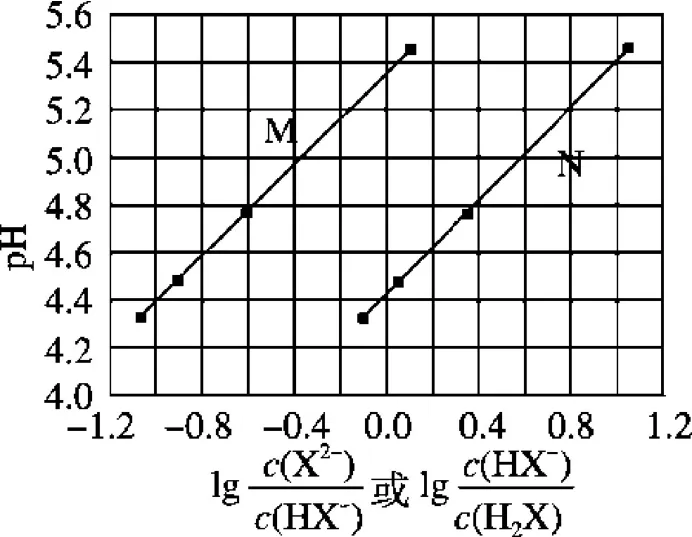
图3
A.Ka2(H2X)的数量级为10-6
C.NaHX溶液中c(H+)>c(OH-)
D.当混合溶液呈中性时,c(Na+)>c(HX-)>c(X2-)>c(OH-)=c(H+)
评析:这是一个二元酸被滴定的反应图像,图像中的两个直线就证明了反应过程存在反应先后顺序,两条直线有对应部分的横轴处于相同状态,说明反应又是一个连续的过程。突破关键是依据二元弱酸分步电离常数表达式,进行对数处理即可明确M、N两线的含义,再抓住横坐标为0分析即可。H2X⇌H++HX-、HX-⇌H++X2-,则Ka1=然后取对数可得不妨设当均为0时,即横坐标0时Ka1=c1(H+)≈10-4.4、Ka2=c2(H+)≈10-5.4,故曲线N代表第一步电离,曲线M代表第二步电离,故A、B项正确。同时由等量Na2X、NaHX溶液呈酸性知NaHX溶液一定呈酸性,故C正确;要使溶液显中性必然有大于 1,即c(HX-)<c(X2-),故D错误。
(三)盐溶液与强酸(或酸与盐混合)反应对数图
盐(或酸与盐混合)溶液与强酸反应实质上仍是酸碱中和滴定,仅是酸碱中和滴定的变式而已。
例 420℃时,向 20 mL 0.1 mol·L-1的Na2CO3溶液中逐滴加入0.1 mol·L-1盐酸(忽略H2CO3的分解和CO2的挥发),溶液pH随盐酸加入的体积变化曲线如图4。下列说法正确的是( )
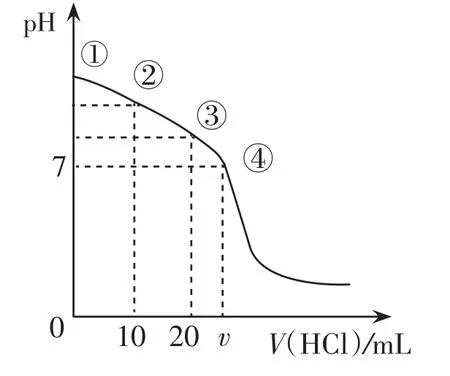
图4
A.点 ① 所 示 溶 液 中 :c(CO32-)>c(HCO3-)>c(OH-)>c(H+)
B.点②所示溶液中:c(CO32-)>c(Cl-)>c(HCO3-)>c(OH-)
C.点③所示溶液中:c(OH-)-c(H+)=c(H2CO3)-c(CO32-)
D.点④所示溶液中:c(Cl-)=2c(H2CO3)+c(HCO3-)
评析:本图像是多元弱酸盐与酸的反应,属于中和反应滴定的变式。解答的关键是依据离子反应的本质,分析多元弱酸离子(或混合溶液)与酸反应的先后顺序,然后再结合图像中提供的特殊点横坐标为0、10、20对应的溶液成分来分析。Na2CO3溶液中逐滴加入0.1= mol·L-1盐酸时发生两=个过程,即 CO32-+H+HCO3-、HCO3-+H+H2CO3。具体解答过程:点①所示溶液是碳酸钠溶液,根据盐类水解规律可得c(CO32-)>c(OH-)>c(HCO3-)>c(H+),故A错;点②所示溶液恰好等到等浓度的碳酸钠、碳酸氢钠、氯化钠溶液,由于碳酸根离子水解程度大于碳酸氢根离子,故 c(HCO3-)>c(Cl-)>c(CO32-)>c(OH-),故B错;点③所示溶液恰好是碳酸氢钠,其质子守恒式为 c(CO32-)+c(OH-)=c(H2CO3)+c(H+),故C正确;点④所示溶液为中性知含有碳酸氢钠、碳酸及氯化钠,根据电荷守恒2c(CO32-)+c(HCO3-)+c(OH-)+c(Cl-)=c(Na+)+c(H+)及物料守恒 2c(CO32-)+2c(H2CO3)+2c(HCO3-)=c(Na+)可得 2 c(H2CO3)+c(HCO3-)=c(Cl-),所以D正确。
(四)沉淀溶解平衡对数图
沉淀溶解平衡是电解质溶液净化除杂、沉淀转化等方面最常用的理论或方法之一。能较好地体现化学科学精神与社会责任、变化与平衡思想。
例5某温度下,向10 mL 0.1 mol·L-1CuCl2溶液中滴加0.1 mol·L-1的Na2S溶液,滴加过程中溶液中-lgc(Cu2+)与Na2S溶液体积(V)的关系如图5所示,下列有关说法正确的是( )
已知:lg2=0.3,Ksp(ZnS)=3×10-25mol2·L-2。
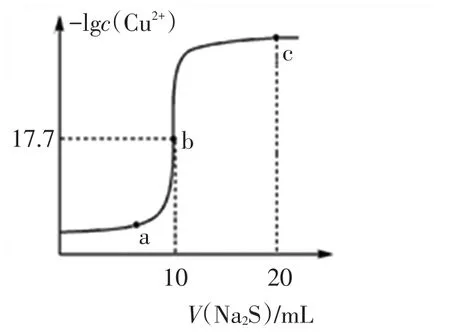
图5
A.a、b、c三点中,水的电离程度最大的为b点
B.Na2S溶液中:c(S2-)+c(HS-)+c(H2S)=2c(Na+)
C.该温度下Ksp(CuS)=4×10-36mol2·L-2
D.向100 mL Zn2+、Cu2+浓度均为10-5mol·L-1的混合溶液中逐滴加入10-4mol·L-1的Na2S溶液,Zn2+先沉淀
评析:本图像尽管是溶液中-lgc(Cu2+)随Na2S溶液体积(V)变化关系图,其实质上仍是除原点部分之外硫化铜的沉淀溶解平衡问题,目的是考查对沉淀溶解平衡曲线的深度理解,即曲线起点(横坐标为0)表示的0.1 mol·L-1CuCl2溶液,没有沉淀溶解平衡存在,但在曲线上的a、b、c等点存在沉淀溶解平衡。b点是CuCl2与Na2S溶液恰好完全反应的点,溶质是氯化钠,对水的电离没有作用,水的电离程度最小的为b点,而a、c两点对应的溶液中依次含有CuCl2、Na2S,而CuCl2、Na2S均能水解促进水电离,故A错误;根据物料守恒Na2S溶液中:2c(S2-)+2c(HS-)+2c(H2S)=c(Na+),故 B 错误;b点是CuCl2与Na2S溶液恰好完全反应的点,由CuS(s)⇌Cu2+(aq)+S2-(aq)知c(Cu2+)=c(S2-),再根据b点数据c(Cu2+)=2×10-18mol-1可推知该温度下Ksp(CuS)=4×10-36mol2·L-2,故C正确;Ksp(ZnS)=3×10-25mol2·L-2大于 Ksp(CuS)知CuS更难溶,所以向100 mL Zn2+、Cu2+浓度均为10-5mol·L-1的混合溶液中逐滴加入10-4mol·L-1的Na2S溶液,Cu2+先沉淀,故D错误。
二、突破策略
从上述例题中不难发现,突出数形结合来解答化学问题的命题思想,突出了定性与定量分析相结合、实证与逻辑推理及模型认知相结合的学科特点,其考查的知识点既有对强弱电解质、电离平衡、水的电离、pH、离子反应、盐类水解等基本概念或理论知识的考查,又有对图形等所给的相关信息提取、分析解决问题的综合运用能力及表达能力的考查。
(一)熟练掌握电解质溶液理论知识
电解质溶液理论主要包含电离平衡、水解平衡以及沉淀溶解平衡三部分,都是动态平衡,均遵循平衡移动原理。从形式上讲尽管三个平衡的研究对象不同,电离平衡、水解平衡以及沉淀溶解平衡分别研究可溶性弱电解质、可溶性且含弱离子的盐、难溶电解质,但它们之间存在内在的逻辑联系[2],如电离平衡与盐类水解平衡是一个相反的过程,等浓度下弱酸或弱碱的电离程度越小,则其对应盐的水解程度越大。沉淀溶解平衡则是在溶液达到饱和时存在的一种平衡状态,一般是研究难溶电解质,并因其电离出的离子浓度较小而忽略离子的水解影响,而电离平衡、盐类水解平衡一般是研究未达到饱和状态下存在的平衡关系,因而其加水稀释或增加溶质浓度均出现正向移动的结果,但其电离(或水解)程度相应地变大或变小。
(二)善于从化学学科素养角度认识图像问题
图像既有对宏观物质性质的反映,也有对微观反应过程的体现,因而分析图像时可以运用数形结合进行定量分析、微宏结合思想探析物质的性质、转化与守恒思想来建立量的关系。通过上述实例不难发现隐含着核心化学观念有:(1)微粒观:①微粒来源:其来源可能是外加物质、物质转化、物质的电离等。②存在形式:环境性质如何?存在形态是分子、原子还是离子?③微粒性质:如溶解性、酸碱性等。④微粒行为:如外观现象是沉淀生成、弱电解质生成?行为类型是氧化还原反应还是非氧化还原反应?是可逆过程还是非可逆过程?(2)守恒观:守恒观是基于元素观和转化观规律的升华和演变。元素有不同的存在形态,在转化过程中也以不同形态存在,但转化过程却表现为物料守恒、电荷守恒、质子守恒等多种形式。(3)平衡观:涉及电离平衡、难溶物沉淀平衡、水解平衡等类型。平衡定性分析涉及反应、条件、方向和结果四个方面的建模。具体而言:找微粒、建平衡,看条件、判移动,比结果。平衡量化思维需比较Qc与K的相对大小,判断平衡移动的方向及建立途径[3]。
(三)针对性训练提高解题能力
千懂万懂不如一试就懂。只有通过适量的有针对性地强化训练,才能真切感悟到基本理论的奇妙、灵活,才能自我归纳总结出切实有效的解题方法或技巧。如由上述几例,我们可总结出对数图像题的解题步骤,即宏观上由大到小依次看图,即首先看两轴表示的物理量,然后再看曲线总体变化趋势,再看曲线中的特殊点,即起点(尤其是横坐标为0时)、拐点、标记的问题点。其次是联想规律:强弱电解质的电离特点、电离平衡规律(或盐类水解规律)、沉淀溶解平衡规律及有关计算的格式。第三是结合题中信息及相关问题要求进行针对性地给予解答。对于出现多条变化曲线的图像时,则常考虑运用控制变量思想来分析比较找出一个自变量进行分析。对于出现有关计算时,则常采用以平衡常数为中心的三段式列式计算。
总之,对数图像题并不高深,它仅是基于客观事实的符号体现而已,只要我们善于从横坐标为0思考问题、善于运用学科观念来统领问题分析,总结出必要的解题步骤,就一定可使图像题迎刃而解。
[1]周建国,刘树领.高考新宠——三大平衡常数[J].化学教学,2010(3):63.
[2]刘树领.电解质溶液教学中常见疑难点的探究[J].化学教学,2013(6):74.
[3]夏时君,周小凡.化学图像信息解读的层次与方法[J].化学教育,2016(11):83.
*本文系滨州市教育科学“十三五”规划课题《基于学生核心素养培养下的化学教学设计研究》〔编号:BJK13517-23〕研究成果之一。

