胭脂萝卜天竺葵素抑制人胃癌细胞迁移与侵袭
,, ,
(长江师范学院生命科学与技术学院,重庆 408100)
胭脂萝卜天竺葵素抑制人胃癌细胞迁移与侵袭
梁姗,蒋子川,冯均,龚郭超
(长江师范学院生命科学与技术学院,重庆 408100)
主要探讨胭脂萝卜天竺葵素对人胃癌细胞(MKN45)迁移侵袭能力的影响及机制。采用不同浓度的天竺葵素处理MKN45细胞,用MTT法、流式细胞术、细胞划痕实验和TranswellTM小室实验分别检测细胞增殖、周期、迁移和侵袭能力变化,并用蛋白印迹法检测细胞黏附蛋白E-cadherin和N-cadherin的表达。结果表明,6 μg/mL天竺葵素能显著抑制细胞的增殖,迁移和侵袭,并使细胞阻滞在S期。天竺葵素抑制细胞迁移和侵袭的机制可能是促进E-cadherin蛋白的表达和抑制N-cadherin蛋白的表达。
天竺葵素,胭脂萝卜,胃癌,迁移和侵袭
胃癌是全球常见的恶性肿瘤,全球每年新发胃癌病例近100万,约40%发生在中国,每年因胃癌死亡的人数约80万,中国约占35%[1]。胃癌主要起源于胃粘膜上皮细胞,胃癌细胞具有很强的迁移侵袭能力,抑制胃癌细胞的迁移与侵袭是抑制胃癌转移及进行药物靶向治疗的关键。花青素(Anthocyanin)又名花色苷,主要糖苷形式存在,是一类广泛存在于植物中的黄酮类化合物。迄今为止,人类发现的天然花青素单体约有20种,其中6种单体较为常见,分别为矢车菊素(cyanidin)、天竺葵素(pelargonidin)、飞燕草素(delphindin)、芍药素素(peonidin)、牵牛花素(petunidin)和锦葵花素(malvidin),各单体的抗氧化、抗炎功能一直是主要的研究热点[2]。近年来发现,花青素还具有一定的抗肿瘤活性,且每种花青素单体的活性有一定差异[3-5]。蓝莓天竺葵素能通过抑制肺癌细胞内磷脂酰肌醇3-激酶(PI3K/Akt)来抑制人基质金属蛋白酶(MMP-2、MMP-9)的表达,从而抑制癌细胞的侵袭[6-7]。红心萝卜天竺葵素对乳腺癌耐药蛋白(BCRP)具有高亲和力,表现出BCRP抑制剂特性[8]。葡萄天竺葵素对胃癌细胞AGS、结肠癌细胞HCT-116、肺癌细胞NCIH460和乳腺癌细胞MCF-7以及非小细胞肺癌HC1299均有一定抑制作用[8-11]。蓝莓天竺葵素能提高肝癌细胞HepG2和结肠癌细胞LS174T的抗氧化能力[12]。
胭脂萝卜(Carmine radish)产于重庆涪陵,为十字花科萝卜属一年生草本植物,叶柄、表皮和肉质均呈紫红色,较易种植,适宜加工,多用于制备食用红色素。前期我们通过液相色谱分析发现胭脂萝卜红色素主要成分为天竺葵素,占其总含量的95%。目前胭脂萝卜天竺葵素的生物活性尚未见报道。本研究主要探讨胭脂萝卜天竺葵素对人胃癌MKN45细胞迁移侵袭的影响及作用机制,明确其是否像其它类型花青素一样具有一定的抗肿瘤活性。
1 材料和方法
1.1材料与仪器
天竺葵素分离自胭脂萝卜 纯度>95%,长江师范学院天然产物研究实验室;MKN45细胞为人胃癌细胞株 美国ATCC细胞库;二甲基亚砜(dimethyl sulfoxide,DMSO)、胰蛋白酶(≥180 U)、牛血清蛋白(bovine serum albumin,BSA)、RNA酶(≥250 U) Sigma公司;ECL显影液 Millipore公司;蛋白Marker、磷酸盐缓冲液(phosphate buffer saline,PBS) TaKaRa公司;PVDF膜、Tris-HCl(pH6.8、8.8)、十二烷基硫酸钠(sodium dodecyl sulfate,SDS)溶液、ACR(丙烯酸脂共聚物)溶液、荧光定量PCR试剂、结晶紫 Bio-Rad公司;RPMI1640培养基;磺化丙啶 Hyclone公司;RNA提取及反转录试剂盒 TaKaRa公司;MTT试剂盒(C0009)、兔抗E-cadherin(380654)及N-cadherin抗体(380671)、兔抗GAPDH(380626)、辣根过氧化物酶(Horseradish Peroxidase,HRP)标记的山羊抗兔二抗(511201) 正能生物公司;其他化学试剂均为国产分析纯。
Optima MAX-XP冷冻超速离心机 德国Beckman公司;FACSCalibur流式细胞分析仪 美国BD公司;GelDoc XR+凝胶成像系统、PowerPac Basic 1645070电泳仪、Trans-Blot SD半干转仪、CFX96荧光定量PCR仪 美国Bio-Rad公司;HERAcell 2401二氧化碳细胞培养箱 美国Thermo公司;TS100相差倒置显微镜 日本Nikon公司;HR40-IIA2生物安全柜 中国海尔公司;UPT超纯水制造机 中国优普公司。
1.2实验方法
1.2.1 细胞培养 人胃癌MKN45细胞采用含有20%胎牛血清的RPMI1640培养基培养。培养皿中细胞覆盖率达到80%~90%时进行传代,把原有培养基吸掉,用0.25%胰蛋白酶消化5 min,细胞都变圆后加入等体积的含血清的培养基终止消化,用移液枪吹打细胞,让细胞悬浮起来,把细胞吸到15 mL的离心管中,1000 r/min离心5 min,按1∶3传代,置于37 ℃、5% CO2培养箱中培养48 h后继续传代。
1.2.2 MTT法检测细胞增殖 根据碧云天公司细胞增殖及细胞毒性检测试剂盒(C0009)说明书进行操作:在96孔板中,每孔加入100 μL 2000个MKN45细胞,于37 ℃、5% CO2细胞培养箱中孵育24 h。对照组加入0.1% DMSO,实验组用不同浓度的天竺葵素(2、4、6、8 μg/mL),分别处理细胞24、48、72 h后,每孔加入10 μL MTT溶液(5 mg/mL),在细胞培养箱内孵育4 h。每孔加入100 μL Formanzan溶解液使外源性MTT还原为水不溶性的紫色结晶。在细胞培养箱中继续孵育4 h左右至紫色结晶全部溶解。用酶标仪在570 nm测定吸光度(A值),实验重复3次,每次设3个平行样。
1.2.3 细胞迁移划痕实验 将MKN45细胞以5×105个/mL密度接种于6孔板,培养至100%覆盖率时,去除培养液,沿6孔板中间划痕,PBS清洗2次后,加入含2、4、6、8 μg/mL天竺葵素的培养基,对照组加入含0.1% DMSO的培养基,培养24、48 h后,任取5个视野,20倍显微镜下拍照并计数越过划痕的细胞数目,实验重复3次,每次设3个平行样。
1.2.4 细胞侵袭小室实验 在24孔板中加入含20%小牛血清的RPMI-1640培养基,将TranswellTM小室置于24孔板中,取5×104个 MKN45细胞分别用含0.1% DMSO及2、4、6、8 μg/mL天竺葵素的培养基培养于小室内。24 h后,吸去小室内培养基,PBS清洗1次后,甲醇固定小室15 min,0.1%结晶紫染色小室内外部15 min,PBS清洗2次后,用棉签擦掉小室内部,20倍显微镜下随机挑选5个视野拍照小室外部,最后计数细胞个数,统计处理组细胞数与对照细胞数的倍数,实验重复3次,每次设3个平行样[5]。
1.2.5 Real-time PCR法检测不同浓度处理组细胞E-cadherin和N-cadherin的mRNA表达 6孔板细胞长至覆盖率为80%~90%时,用0.1% DMSO及2、4、6、8 μg/mL天竺葵素处理细胞24 h后,吸去培养基,PBS清洗一次,胰蛋白酶消化并收集各组细胞[10]。用TaKaRa公司试剂盒提取细胞总RNA,再采用TaKaRa公司反转录试剂盒方法将RNA转录为cDNA。GAPDH上游引物为5′-TGGACTCCACG ACGTACTCA-3′,下游引物为5′-AATCCCATCAC CATCTTCCA-3′;E-cadherin上游引物为5′-ATTCTGATTCTGCTGCTCTTG-3′,下游引物为5′-AGTAGTCATAGTCCTGGTCTT-3′;N-cadherin上游引物为5′-TGGGAAATGGAAACTTGATGGC-3′,下游引物为5′-TGGAAAGCTTCTCACGGCAT-3′。用CFX96和Fast EvaGreen Supermix进行实时定量检测,反应体系为10 μL:Supermix 5 μL,10 μmol/L上游引物0.5 μL,10 μmol/L下游引物0.5 μL,稀释的cDNA 4 μL,用二步PCR法检测目的基因表达,基因表达量计算采用ΔΔCt法,实验重复3次,每次设3个平行样。
1.2.6 蛋白印迹法(Western blot)检测细胞中E-cadherin和N-cadherin蛋白表达 在6孔板中,至细胞长至覆盖率为80%~90%时,用0.1% DMSO及2、4、6、8 μg/mL天竺葵素处理细胞24 h后,吸去培养基,PBS清洗一次,胰蛋白酶消化并收集各组细胞。用EBC250裂解细胞,595 nm波长测量蛋白含量,95 ℃变性5 min。将50 μg蛋白样品进行SDS-PAGE电泳,200 V恒压电泳至溴酚蓝刚好至凝胶底部,取出凝胶100 V转膜1.5 h。将PVDF膜分别放入兔抗E-cadhein抗体(1∶1000)、兔抗N-cadhein抗体(1∶1000)、兔抗GAPDH抗体(1∶2000),室温孵育2~3 h;TBST洗涤3次,每次10 min,将PVDF膜放入HRP标记的山羊抗兔二抗,室温孵育1 h后TBST洗涤3次,每次10 min。将ECL溶液Ⅰ和Ⅱ等体积混合后,均匀滴加在PVDF膜,将膜放置在凝胶成像仪中进行曝光,选取合适信号强度的照片分析。
1.2.7 流式细胞术分析细胞周期 经过0.1% DMSO和0.6 μg/mL天竺葵素处理24 h的细胞用胰蛋白酶消化[14],收集细胞,用预冷的PBS清洗1次,加入70%乙醇冰上固定30 min后,用500 μL PI染液(包含50 μg/mL磺化丙啶及100 μg/mL RNA酶),37 ℃染色30 min。分析时总共收集20000个细胞进行细胞周期分析,收集完成后,用流式细胞仪(BD FACSCalibur)软件分析细胞周期。
1.3统计学处理
实验重复3次,所有实验数据以“平均数±标准差”表示,应用SPASS 22.0统计软件对资料进行分析,两组均数间比较采用方差分析,p<0.05表示差异有统计学意义。
2 结果与分析
2.1天竺葵素抑制MKN45细胞增殖
由MTT结果显示(表1),2 μg/mL天竺葵素对MKN45细胞增殖无显著影响,随着天竺葵素浓度从4 μg/mL上升至8 μg/mL,MKN45细胞增殖受到显著抑制(p<0.05),6 μg/mL与8 μg/mL天竺葵素对细胞增殖的影响差异不显著,说明6 μg mL天竺葵素对细胞增殖有较显著的抑制效果。
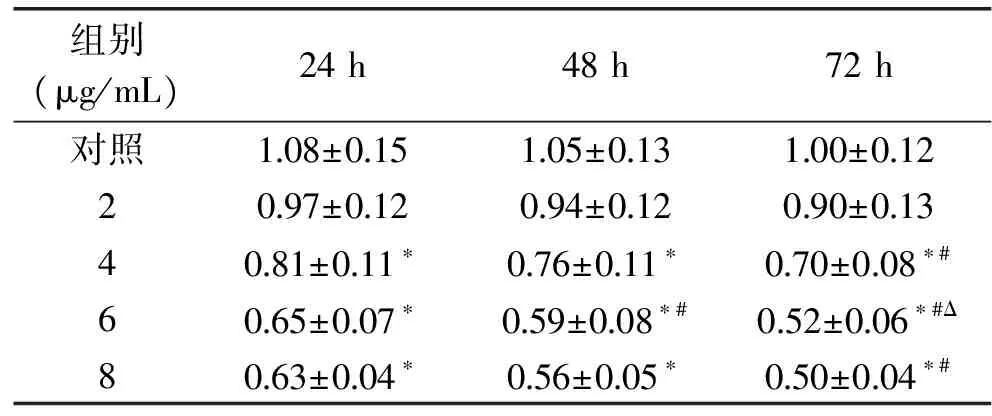
表1 天竺葵素对MKN45细胞增殖的影响
注:*表示与对照组相比p<0.05;#表示与24 h同剂量组相比p<0.05;Δ表示与48 h同剂量组相比p<0.05。
2.2天竺葵素抑制MKN45细胞迁移
细胞划痕实验结果显示(表2),在24 h与48 h时,与对照组相比,4、6、8 μg/mL天竺葵素的处理组随着浓度增大,细胞迁移能力逐渐下降(p<0.05),且6 μg/mL与8 μg/mL处理组之间差异不显著,说明6 μg/mL天竺葵素即能显著抑制MKN45细胞迁移能力(p<0.05),2 μg/mL天竺葵素对细胞迁移能力抑制不显著。

表2 天竺葵素对MKN45细胞迁移的影响
注:*表示与对照组相比p<0.05;#表示与处理组0 h相比p<0.05;Δ表示与处理组24 h相比p<0.05。
2.3天竺葵素抑制MKN45细胞侵袭
TranswellTM小室侵袭实验结果显示(图1),24 h后,与对照组相比,2、4、6、8 μg/mL处理组细胞在侵袭小室中残留的细胞更少,说明天竺葵素抑制了细胞的侵袭。经统计(图2),2 μg/mL处理组与对照组差异不显著,4、6、8 μg/mL的天竺葵素均显著抑制了细胞的侵袭(p<0.05),6 μg/mL与8 μg/mL处理组的抑制能力差异不显著,说明6 μg/mL天竺葵素对细胞侵袭已有较显著的抑制效果。
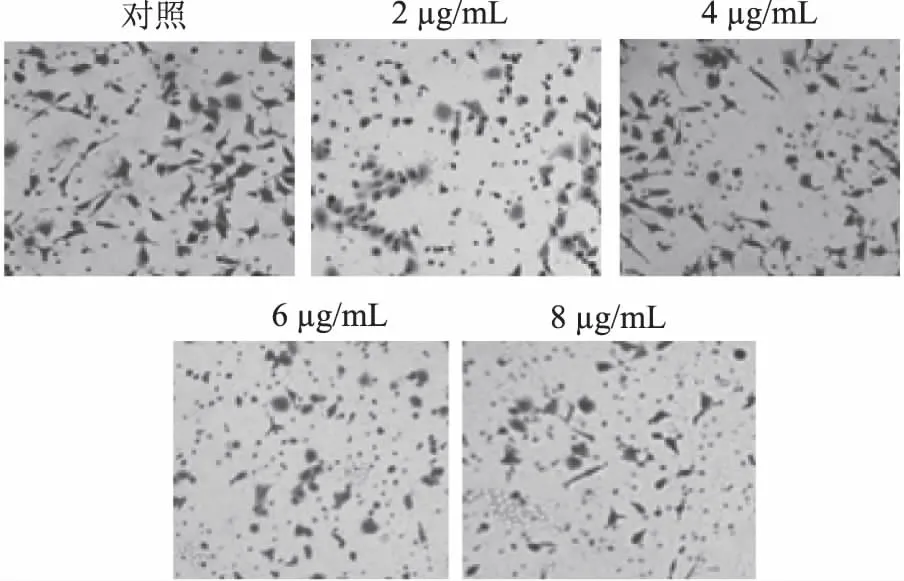
图1 天竺葵素对MKN45细胞侵袭能力的影响
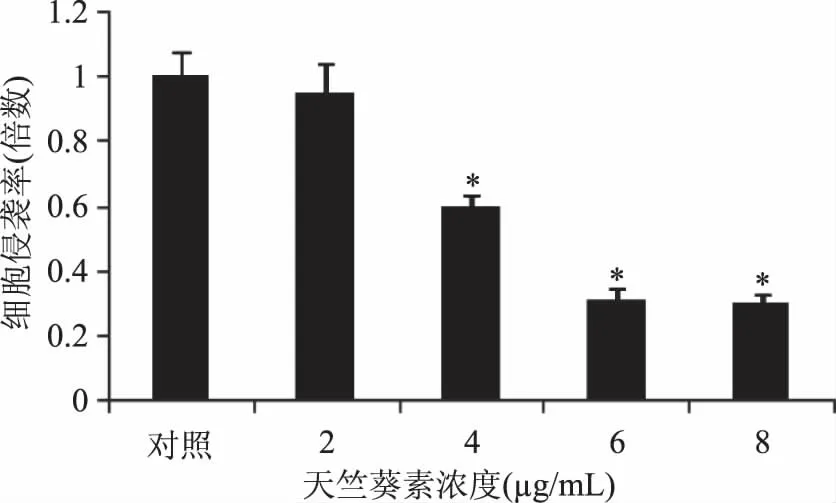
图2 天竺葵素对MKN45细胞侵袭的统计分析
2.4天竺葵素对N-cadherin和E-cadherin表达的影响
N-cadherin与E-cadherin蛋白是钙依赖性的跨膜蛋白,分布于上皮细胞,主要参与细胞与细胞间黏附,在维持细胞的极性和完整性等方面起重要的作用[13-14]。癌细胞的迁移侵袭通常伴随着细胞间粘附下降。本研究通过蛋白印迹分析和荧光定量PCR(图3和表3),发现与对照组相比,以不同浓度天竺葵素处理24 h后,2 μg/mL天竺葵素处理组的N-cadherin和E-cadherin蛋白和mRNA表达水平与对照组相比表达无显著差异;4、6、8 μg/mL天竺葵素处理组与对照组相比其E-cadherin蛋白和mRNA的表达水平均下调、N-cadherin蛋白和mRNA的表达平均上调(p<0.05),6 μg/mL与8 μg/mL处理组结果不显著,说明6 μg/mL能显著抑制E-cadherin、N-cadherin蛋白和mRNA的表达(p<0.05),提示天竺葵素抑制MKN45的迁移和侵袭与N-cadherin和E-cadherin表达密切相关。
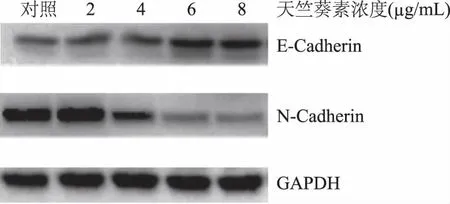
图3 天竺葵素对N-cadherin和E-cadherin蛋白表达的影响

表3 天竺葵素对N-cadherin和E-cadherin mRNA表达的影响(倍数±s)
注:*表示与对照组相比p<0.05;#表示与2 μg/mL剂量组比p<0.05;Δ表示与4 μg/mL剂量组比p<0.05。
2.5流式细胞术分析细胞周期
为进一步研究天竺葵素影响细胞迁移和侵袭与细胞周期是否相关,采用流式细胞术分析天竺葵素对MKN45细胞周期变化。由图4可见,经24 h处理后,6 μg/mL天竺葵素对细胞G0期无影响,说明细胞并未凋亡,而G1期显著上升(p<0.05),S期显著下降(p<0.05),G2期显著下降(p<0.05)。说明天竺葵素对细胞造成S期阻滞,抑制了细胞的增殖,与MTT结果相符。
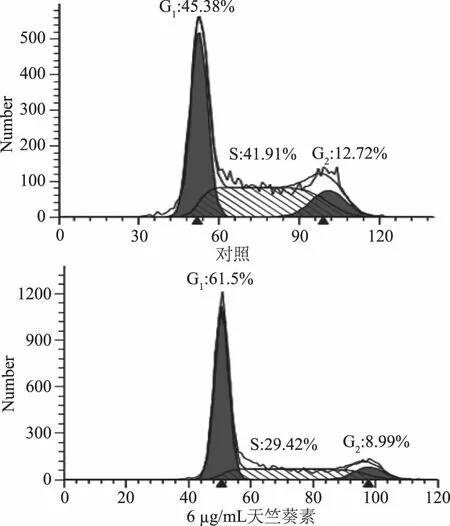
图4 天竺葵素对MKN45细胞周期的影响
3 结论
通过MTT实验和流式细胞术分析周期分析发现,6 μg/mL天竺葵素能使细胞增殖阻滞在S期从而抑制细胞增殖。通过细胞侵袭及划痕实验发现,6 μg/mL天竺葵素能显著抑制细胞的迁移和侵袭,进一步通过荧光定量PCR以及蛋白印迹实验表明,其对细胞迁移和侵袭的机制可能是在蛋白和基因水平上抑制N-cadherin以及上调N-cadherin表达。钙粘蛋白(Cadherin)是一种同亲型结合的细胞粘着糖蛋白,对胚胎发育的细胞识别、迁移和组织分化以及成体组织器官构成具有重要作用。E-cadherin表达的缺失以及N-cadherin表达的增强降低了细胞间的黏附强度,导致细胞活动性增加,促进肿瘤细胞的迁移和侵袭,免疫组化结果表示胃癌侵润样本的E-cadherin表达通常下调、N-cadherin表达为上调[15-16],对胃癌细胞株SCG-7901、MKN28的研究中也得出相同结果[17-18]。天竺葵素是否能抑制胃癌转移,与E-cadherin和N-cadherin在肿瘤样本的表达是否相关,还需进一步采用体内小鼠模型验证。
研究发现胭脂萝卜天竺葵素能抑制胃癌细胞的迁移、侵袭、增殖,但不影响细胞凋亡,补充了天竺葵素抗肿瘤作用的可能机制。
[1]左婷婷,郑荣寿,曾红梅,等.中国胃癌流行病学现状[J]. 中国肿瘤临床,2017,44(1):52-59.
[2]陈小捷,阴文娅.植物中花青素提取方法探究[J].食品工业科技,2013,34(2):395-399.
[3]Murthy K N C,Sultanpur C M,Rao R M,et a1.Natural molecules as tumourinhibitors:Promises and prospects[J].Journal of Herbal Medicine,2014,4(4):175-187.
[4]许胜,屈达才,黄慧明,等.花色素及其花色苷单体抗肿瘤活性研究进展[J].食品工业科技,2016,37(14):379-384.
[5]Novotny J A,Clevidence B A,Kurilich A C. Anthocyanin kinetics are dependent on anthocyanin structure[J]. British Journal of Nutrition,2012,107(4):504-509.
[6]Huang Huipei,Shih Y W,Chang Y C,et al. Chemoinhibitory effect of mulberry anthocyanins on melanoma metastasis involved in the Ras/PI3K pathway[J]. Journal of Agricultural and Food Chemistry,2008,56(19):9286-9293.
[7]Shin D Y,LU Jingnan,Kim G Y,et al. Anti-invasive activities of anthocyanins through modulation of tight junctions and suppression of matrix metalloproteinase activities in HCT-116 human colon carcinoma cells[J]. Oncology Reports,2011,25(2):567-572.
[8]Wang L S,Sun X D,Cao Y,et al. Antioxidant and pro-oxidant properties of acylated pelargonidin derivatives extracted from red radish[J]. Food & Chemical Toxicology,2010,48(10):2712-2718.
[9]Kausar H,Jeyabalan J,Aqil F,et al. Berry anthocyanidins synergistically suppress growth and invasive potential of human non-small-cell lung cancer cells.[J]. Cancer Letters,2012,325(1):54-62.
[10]Yun J W,Lee W S,Kim M J,et al. Characterization of a profile of the anthocyanins isolated from Vitis coignetiae Pulliat and their antiinvasive activity on HT-29 human colon cancer cells[J]. Food and Chemical Toxicology,2010,48(3):903-909.
[11]Zhang Y. Human tumor cell growth inhibition by nontoxic anthocyanidins,the pigments in fruits and vegetables.[J]. Life Sciences,2005,76(76):1465-1472.
[12]Kamenickova A,Anzenbacherova E,Pavek P,et al. Pelargonidin activates the AhR and induces CYP1A1 in primary human hepatocytes and human cancer cell lines HepG2 and LS174T[J]. Toxicology Letters,2013,218(3):253-259.
[13]Ferraz M A,Zabaglia L M,Pereira W N,et al. Downregulated Expression of E-cadherin and TP53 in Patients with Gastric Diseases:The Involvement of H. pylori Infection and Its Virulence Markers[J]. Journal of Gastrointestinal Cancer,2016,47(1):20-26.
[14]Rai H C,Ahmed J. A Role of N-Cadherin in Tumor Progression and Prognosis of Epitheliual Malignancy[J]. 2016,3(1):2393-2915.
[15]卢昕,孟庆彬,邵永胜. CDH17对胃癌细胞侵袭性的影响及其机制[J]. 中国普通外科杂志,2015,24(10):1406-1410.
[16]汤光华. 胃癌中Slug和E-cadherin表达及其临床意义[J]. 武汉大学学报,2015,36(4):536-540.
[17]Xia R,Jin F Y,Lu K,et al. SUZ12 promotes gastric cancer cell proliferation and metastasis by regulating KLF2 and E-cadherin[J]. Tumor Biology,2015,36(7):5341-5351.
[18]Jiang S B,He X J,Xia Y J,et al. MicroRNA-145-5p inhibits gastric cancer invasiveness through targeting N-cadherin and ZEB2 to suppress epithelial-mesenchymal transition[J]. Oncotargets & Therapy,2016,9:2305-2315.
Pelargoniumfromcarmineradishinhibitsmigrationandinvasionofhumangastriccancer
LIANGShan,JIANGZi-chuan,FENGJun,GONGGuo-chao
(Life Science and Technology Institute,Yangtze Normal University,Chongqing 408100,China)
The mechanisms of carmine radish pelargonium inhabited gastric cancer cells(MKN45)migration and invasion was investigated in the study. After different concentrations of pelargonium treatment,MTT assay,flow cytometry(FCM),cell wound healing and TranswellTMassay were used to detect the cell proliferation,cell cycle,cell migration and invasion ability. Protein expression of E-cadherin and N-cadherin were measured with western blot. The results showed 6 μg/mL pelargonium inhibited MKN45 cell proliferation,migration and invasion remarkable,induced cell S phase arrest. E-cadherin upregulation and N-cadherin downregulation might be the major mechanisms of pelargonium inhibited cell migration and invasion.
pelargonium;carmine radish;gastric cancer;migration and invasion
2017-04-05
梁姗(1982-),女,博士,讲师,研究方向:天然产物分离及活性研究,E-mail:vmm420@hotmail.com。
重庆市教委科研基金(KJ1601207);长江师范学院校级科研项目(2015KYQD01)。
TS255.1
A
1002-0306(2017)22-0001-05
10.13386/j.issn1002-0306.2017.22.001

