朱顶红中黄烷类化学成分的研究
辛国松,李 鑫,薛沁冰,魏 驰,朱洪剑,厉增毅,赵 贺,季宇彬
(1. 哈尔滨商业大学 生命科学与环境科学研究中心,哈尔滨 150076;2. 国家教育部抗肿瘤天然药物工程研究中心,哈尔滨 150076)
朱顶红中黄烷类化学成分的研究
辛国松1,2,李 鑫1,2,薛沁冰1,2,魏 驰1,朱洪剑1,厉增毅1,赵 贺1,季宇彬1,2
(1. 哈尔滨商业大学 生命科学与环境科学研究中心,哈尔滨 150076;2. 国家教育部抗肿瘤天然药物工程研究中心,哈尔滨 150076)
对朱顶红进行成分的粗提取,经分离纯化获得单体化合物,进行Hepg-2细胞的活性试验.用回流法对朱顶红中有效成分进行粗提,分别用石油醚、二氯甲烷、乙酸乙酯、正丁醇萃取,通过HPLC法获得二氯甲烷部分的单体化合物.最终制得化合物1为4'-羟基-7,3'-二甲氧基黄烷(4'-dihydroxy-7,3'-methoxy-flavan);化合物2为7,4'二羟基-3'-甲氧基黄烷(7,4'-dihydroxy-3'-methoxy-flavan).朱顶红中的化学成分对肿瘤细胞Hepg-2细胞具有抑制作用.
分离纯化;HPLC;抑制作用;单体化合物;肿瘤细胞
朱顶红(Hippeastrum vittatum)是单子叶亚纲石蒜科(Amaryllidaceae)植物,为朱顶红属所有种类总称,原产于墨西哥加勒比海以及阿根廷的北部[1].朱顶红花形优美、色泽艳丽.朱顶红除了具有观赏价值外也兼具有药用价值[2].通过查阅文献了解到,朱顶红中各成分含量丰富并具有多种药理活性,具有抗菌,抗氧化,抗肿瘤,促透等功效[3].本课题通过粗提朱顶红中各化学成分后萃取粗分.通过查阅文献了解到朱顶红二氯甲烷提取部分活性较好[4-5].继续对二氯甲烷提取部分分离纯化得到单体化合物[6-7].
1 实验仪器与药品
旋转蒸发仪(EYELA N-1100,东京理化器械株式会社)、型电子分析天平(BS110S,北京塞多利斯天平有限公司)、循环水式多用真空泵(郑州长城科工贸有限公司)、倒置显微镜(CKX-41-32,日本OLYMPUS公司);无水乙醇(分析纯,批号:20121008)二氯甲烷(分析纯,批号:20140516)甲醇(分析纯,批号:20140708)石油醚(分析纯,批号:20130423)乙酸乙酯(分析纯,批号:20131014)正丁醇(分析纯,批号:20130301).
2 实验方法
2.1朱顶红的粗提
取朱顶红干燥叶片用70%乙醇以固液比1∶12回流提取,旋蒸除去试剂得总浸膏,依次用石油醚、二氯甲烷、乙酸乙酯、正丁醇各萃取三次得粗提产物[8].
2.2朱顶红二氯甲烷部分的分离纯化及结构鉴定
2.2.1 二氯甲烷部分的粗分
硅胶柱分离取二氯甲烷部位浸膏作为拌样硅胶置于合适研钵中,将样品溶于二氯甲烷中,将拌有样品的硅胶放入通风厨中直至拌样硅胶呈细沙状,在拌样硅胶柱面上加一层脱脂棉,再向其加入流动相梯度洗脱.将梯度洗脱的馏分以半个保留体积570 mL为一馏分收集,薄层层析随时跟踪检测.再将安瓿瓶中的样品分别用少量二氯甲烷、甲醇溶解后薄层层析检测,将Rf值等同的流分收集在一个安瓿瓶中.
2.2.2 HPLC法对样品进行纯度分析
分析型色谱柱:Eclipse XDB-C18(4.6 mm×150 mm,5 μm);柱温:30 ℃;检测波长210 nm;流速:0.8 mL/min;流动相:甲醇-水(梯度洗脱),进样量:20 μL;进样方式为自动进样.合并ODS色谱柱洗脱部分,经TLC薄层色谱分析,将已纯化的样品进行纯度分析.将样品用甲醇溶解,采用0.45 μm的为空滤膜过滤到自动进样瓶中,以甲醇-水为流动相梯度洗脱,进行高效液相色谱分析并通过光谱学分析和文献对照对结构进行鉴定.
2.2.3 HPLC法对样品进行单体制备
制备型色谱柱:Eclipse XDB-C18(10 mm×250 mm,5 μm);柱温:30 ℃;检测波长210 nm;流速:2.0 mL/min;流动相:甲醇-水(比例选用分析色谱仪分析的峰型较好的达到基线分离的比例);进样量100 μL;手动进样,手动收集.
2.2.4 纯度测定和结构分析
按制备液相的色谱条件,分别将上述得到的化合物溶液注入分析型HPLC中检测.最后对单体化合物结构进行分析.
3 实验结果
3.1朱顶红的粗提
浓缩回收试剂得石油醚部分84.9 g、二氯甲烷部分17 g、乙酸乙酯部分23.8 g、正丁醇部分140.4 g.
3.2朱顶红二氯甲烷部分的分离纯化及结构鉴定
3.2.1 二氯甲烷部分的粗分
硅胶柱分离硅胶吸附色谱法中采用二氯甲烷-甲醇洗脱体系,比例依次为200∶0、200∶1、100∶1、80∶1、60∶1、50∶1、40∶1、30∶1、20∶1、15∶1、10∶1、8∶1、6∶1、5∶1、4∶1、3∶1、2∶1、1∶1,最后选用0∶100进行冲柱,总共收集到324个馏分,经TLC检测相同Rf值得合瓶后得到14个馏分.
3.2.2 HPLC法对样品进行纯度分析
对已纯化的样品进行纯度分析,根据样品中各组分的峰面积及分离程度,分析的到三个分离较好的样品.色谱条件为起始流动相甲醇∶水(40∶60)至35 min甲醇∶水(20∶80)至40min甲醇水(40∶60)梯度洗脱,运行时间45 min.三个样品的分析结果如图1~3所示.

图1 样品1分析液相图

图2 样品2分析液相图

图3 样品3分析液相图
3.2.3 HPLC法对样品进行单体制备
从样品1中分离出3个化合物,化合物A(25.6 mg)、化合物B(12.3 mg)、化合物C(4.9 mg),从样品2中分离出4个化合物,化合物D(6.6 mg)、化合物E(4.5 mg)、化合物F(8.6 mg)、化合物G(10.9 mg),从样品3中分离出1个化合物,化合物H(12.7 mg).制备液相色谱图如图4~6所示.

图4 样品1制备液相色谱图

图5 样品2制备液相色谱图

图6 样品3制备液相色谱图
3.2.4 纯度测定和结构分析
按制备液相的色谱条件,分别将上述得到的8个化合物溶液注入分析型HPLC中检测,其中有3个组分为单一色谱峰图.其他组分为单一峰但是峰型不好或有杂峰,显然不是单体化合物,且样品纯度不足80%.色谱图如图7、8、9所示.

图7 化合物Ⅰ的分析液相图

图8 化合物Ⅱ的分析液相图

图9 化合物Ⅲ的分析液相图
3.2.5 分离纯化结果
利用光谱学分析对化合物的结构进行解析,化合物1:黄色棒状结晶(CH3OH).紫外254 nm下有暗斑.1H NMR谱中,δH6.89(d,J = 8.2 Hz,1H),6.83(m,2H),6.77 (d,J=8.1 Hz,1H),6.27 (dd,J=8.1,1.7 Hz,1H),6.19 (s,1H)推测为苯环上的氢信号;δH4.88(d,J=9.2 Hz,1H)推测为羟基上的氢;δH3.75 (s,3H)推测为甲氧基上面的氢;δH3.38 (s,3H)推测为甲氧基上面的氢;δH2.78 (m,1H),2.57 (m,1H),2.37 (s,1H),2.03 (d,J=13.3 Hz,1H)推测为饱和碳上的氢.13C NMR (151 MHz,DMSO)谱中,δC156.84推测为二氢苯并哌喃与甲氧基相连的碳;δC155.75推测为二氢苯并哌喃上苯环与氧相连的碳;δC147.52推测为苯环上与甲氧基相连的碳;δC146.76推测为苯环上与羟基相连的碳;δC134.71推测为苯环上与二氢苯并哌喃相连的碳;130.22推测为二氢苯并哌喃上苯环的碳;δC117.25推测为苯环上的碳;δC113.81推测为苯环上与环氧六环上共同的碳;δC112.59,112.41推测为苯环上的碳;δC108.33,103.12推测为二氢苯并哌喃上苯环的碳;δC76.97推测为二氢苯并哌喃上与苯环相连的碳;δC56.05,56.05推测为甲氧基上的碳;δC29.80推测为二氢苯并哌喃上的碳;δC24.07推测二氢苯并哌喃的碳.鉴定该化合物为4'-羟基-7,3'-二甲氧基黄烷(4'-dihydroxy-7,3'-methoxy-flavan),分子式为C17H18O4,分子质量为286.12,结构式见图10,1H-NMR见图11,13C-NMR见图12.

图10 化合物1结构图

图11 化合物1的碳谱图
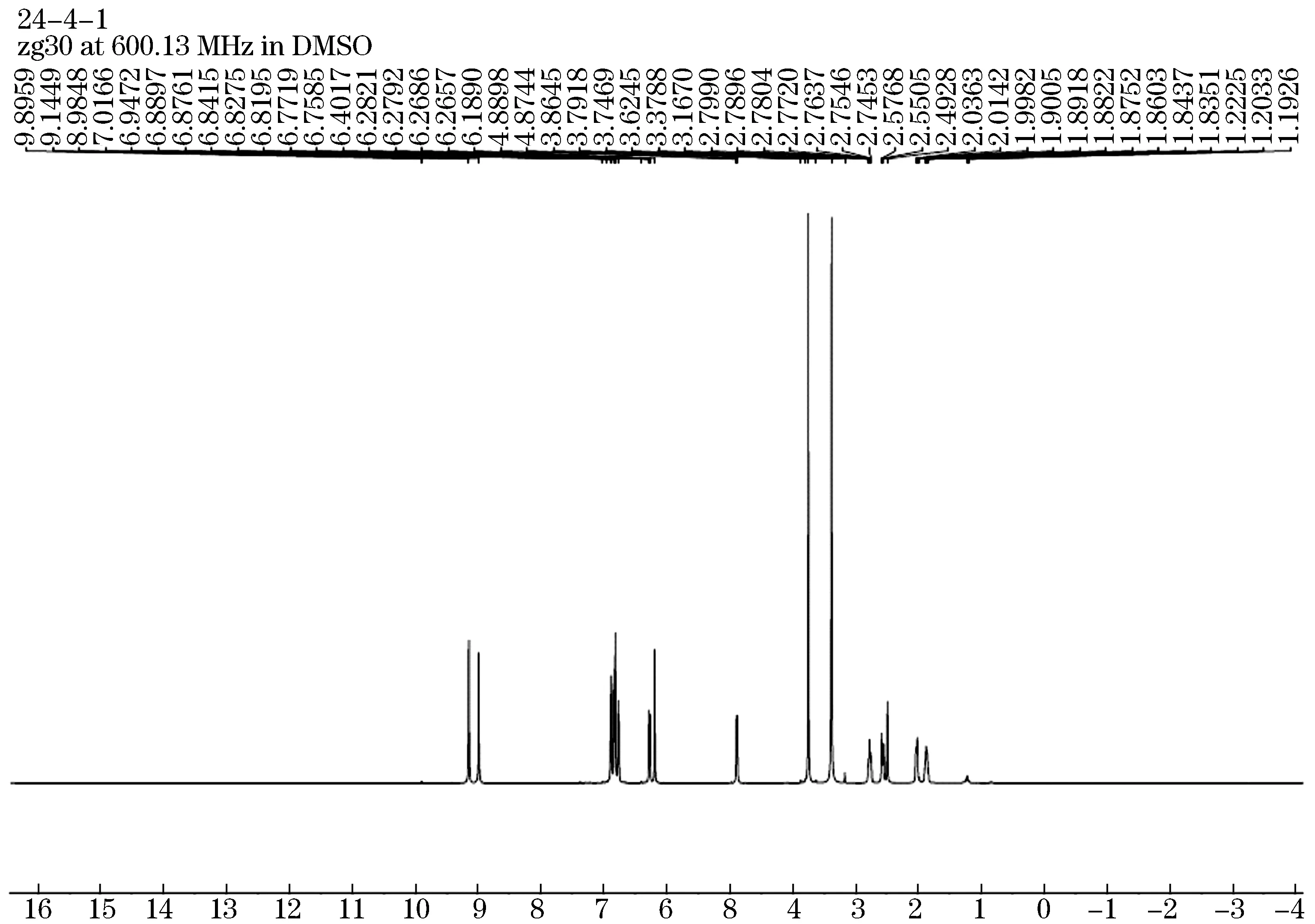
图12 化合物1的氢谱图
化合物2:透明油状物(CH3OH).紫外254 nm下有暗斑.1H NMR 中,δH6.98 (s,1H),6.92(t,J=8.7 Hz,2H),6.81(d,J=8.4 Hz,1H),6.26(dd,J=8.2,2.1 Hz,1H),6.18(d,J=2.1 Hz,1H)推测为苯环上氢;δH4.93(dd,J=9.9,,1.3 Hz,1H)推测羟基氢.δH3.74(d,J=4.7 Hz,3H)推测甲氧基氢.δH2.88(m,1H),2.79(m,1H),2.05(m,1H),1.91(m,1H)推测为饱和碳上氢.13C NMR(151 MHz, DMSO)谱中,δC157.68推测为二氢苯并哌喃与氧相连的碳;δC155.76推测为二氢苯并哌喃上与羟基相连的碳;δC148.68推测为苯环上与甲氧基相连的碳;δC149.03推测为苯环上与羟基相连的碳;δC134.63推测为苯环上与二氢苯并哌喃相连的碳;δC130.11推测为二氢苯并哌喃上苯环的碳;δC118.69推测为苯环上上的碳;δC111.99推测为苯环上与环氧六环上共同的碳;δC111.89,110.39推测为苯环上的碳;δC108.69推测为二氢苯并哌喃上苯环的碳;δC103.30推测为二氢苯并哌喃上苯环的碳;δC77.16推测为二氢苯并哌喃上与苯环相连的碳;δC55.92,55.85推测为甲氧基上的碳;δC29.90推测为二氢苯并哌喃上的碳;δC24.262推测为二氢苯并哌喃的碳.鉴定该化合物为7,4'-二羟基-3'-甲氧基黄烷(7,4'-dihydroxy-3'-methoxy-flavan),分子式为C16H16O4,分子质量为272.10,结构式见图13,1H-NMR见图14,13C-NMR见图15.
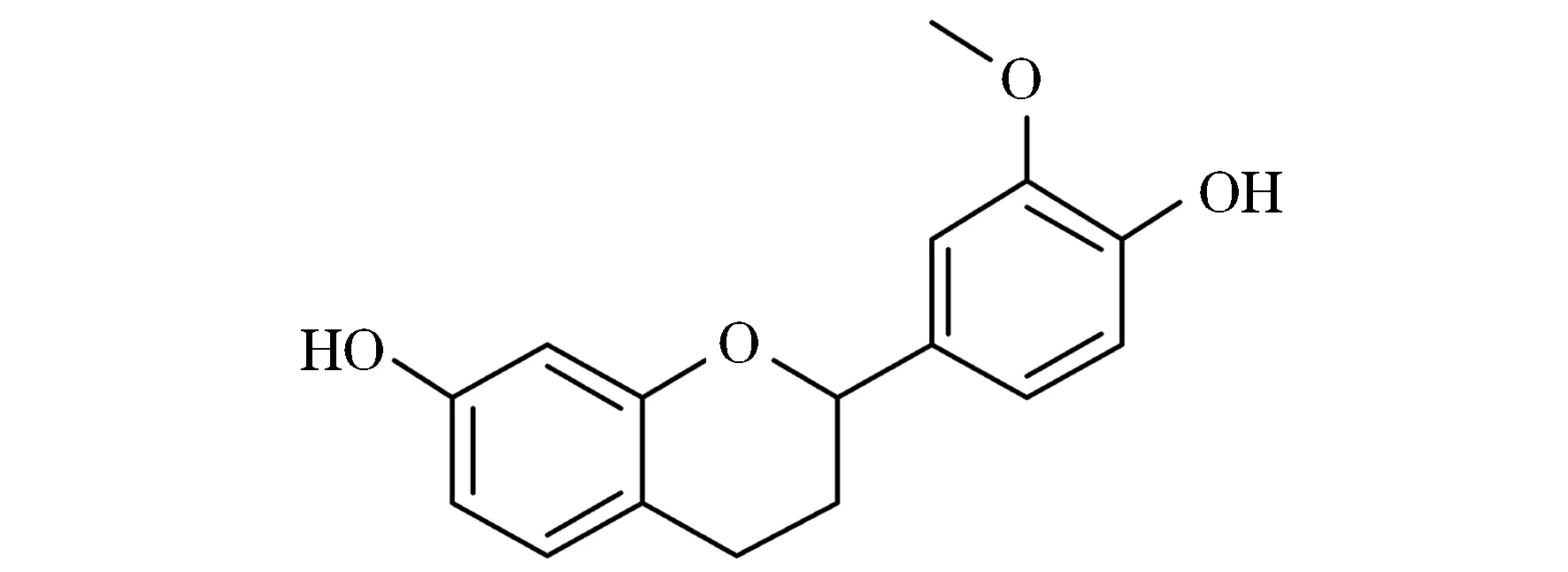
图13 化合物2结构图

图14 化合物2的碳谱图

图15 化合物2的氢谱图
化合物3:绿色油状物(CH3OH).紫外254 nm下有暗斑.1H NMR谱中含有氢信号δH7.43(t,J=7.9 Hz,1H),7.27(m,2H),7.16(d,J=8.3 Hz,1H),3.33(s,5H),2.50(dt,J=3.3,1.7 Hz,1H),1.62(s,3H),1.23(s,1H),0.85(t,J=6.9 Hz,1H).13C NMR(151 MHz,DMSO)谱中,δC150.24,150.19,148.14,148.09,147.97,130.63,128.64,126.32,120.30,120.27,119.85,119.83推测表明至少含有有两个苯环.其中δC120.30,120.27推测表明含有苯环的对位取代的羟基,δC128.64推测表明连有双键或甲基.通过以上数据推测化合物结构中至少有两个对羟基取代的苯环,一个连在双键或芳环上的甲基,有可能是二聚体,可能为黄酮类化合物.1H-NMR见图16,13C-NMR见图17.

图16 化合物3 的碳谱图

图17 化合物3的氢谱图
以上数据结合相关文献[9]确定了其中的2个化合物的结构[10],分别为4'-羟基-7,3'-二甲氧基黄烷(4'-dihydroxy-7,3'-methoxy-flavan),7,4'二羟基-3'-甲氧基黄烷(7,4'-dihydroxy-3'-methoxy-flavan).
[1] 马 慧, 王 琪,袁燕波, 等. 朱顶红属植物资源及园林应用[J]. 林业研究, 2012, 25(4): 28-33.
[2] 于 波. 广州地区朱顶红冬季盆栽主要园艺性状调查[J]. 中国农学通报, 2014, 30(10): 276-282.
[3] 宋德芳, 石子琪, 辛贵忠, 等. 石蒜科生物碱的药理作用研究进展[J]. 中国新药杂志, 2013, 22 (13): 1519-1524.
[4] 徐宏峰, 王富乾, 张 耕. 朱顶红鳞茎生物碱类成分及抗肿瘤活性研究[J]. 中国药学杂志, 2014, 49(22): 1989-1992.
[5] 李 健,于 淼, 高世勇, 等.石蒜科植物中生物碱的药理作用研究[J].哈尔滨商业大学学报:自然科学版, 2014, 30(2): 168-171.
[6] HA I J, LEE M Y, KWON Y K,etal. Metabolite profiling to discriminate different species and genus from thistles in Korea using liquid chromatography with quadrupole time-of-flight mass spectrometry [J]. Journal of Separation Science. 2015, 38, 502-510.
[7] KARADENIZ H, GULMEZ B, SAHINCI F,etal. Disposable electrochemical biosensor for the detectionof the interaction between DNA and lycorine based on guanine and adenine signals [J]. Journal of Pharmaceutical & Biomedical Analysis, 2013, 33(2): 295-302.
[8] LONG Z, GUO Z M, XUE X Y,etal. L.Selective separation and purification of highly polar basic compounds using a silica-based exchange stationary phase [J]. Analytica Chimica Acta, 2013, 804: 304-312.
[9] GARO E, MAILLARD M, ANTUS S,etal. Five flavans from mariscus psilostachys[J]. Phytochemistry, 1999, 43(43): 1265-1269.
[10] 李叶丹,孙晓波,季宇彬,等.雪胆属植物的研究[J].哈尔滨商业大学学报:自然科学版,2016,32(6):649-654.
StudyonflavanechemicalcompositionofHippeastrumVittatum
XIN Guo-song1,2, LI Xin1,2, XUE Qin-bing1,2, WEI Chi1, ZHU Hong-jian1, LI Zeng-yi1, ZHAO He1, JI Yu-bin1,2
(1. Life Science and Environmental Science Research Center,Harbin University of Commerce, Harbin 150076, China; 2. National Ministry of Education Anti-tumor Natural Drug Engineering Research Center, Harbin 150076, China)
Preextraction of Hippeastrum Vittatum was performed to obtained monomeric compounds by separation and purification, and then the activity test for Hepg-2 cells was conducted. The reflux method was used to coarse extract active ingredient in Hippeastrum Vittatum. The extraction solvents are petroleum ether, methylene dichloride, ethyl acetate and n-butanol. HPLC method was applied to obtaine parts of monomeric compounds of dichloromethane. We obtained the No.1 compound 4'-dihydroxy-7,3'-methoxy-flavan and the No.2 compound 7,4'-dihydroxy-3'-methoxy-flavan finally. The chemical components in Hippeastrum Vittatum had inhibiting effects for cancer cells of Hepg-2.
separation and purification; HPLC; inhibiting effects; monomericcompounds; cancer cells
2016-10-10.
哈尔滨市应用技术研究与开发项目(2016RQQXJ124,2016RAXXJ064);黑龙江省教育厅高校创新人才项目(UNPYSCT-2016181)
辛国松(1984-),男,博士,助理研究员,研究方向:中药药理学.
R284
A
1672-0946(2017)05-0513-06

