PCR-RFLP法对蛇胆川贝散中川贝母的鉴别研究
朱林,蒲婧哲,张亚中,,程旺兴,金斌
·药物与临床·
PCR-RFLP法对蛇胆川贝散中川贝母的鉴别研究
朱林1,蒲婧哲2,张亚中1,2,程旺兴1,金斌2
目的:研究聚合酶链式反应-限制性内切酶长度多态性方法(PCR-RFLP法)对蛇胆川贝散(胶囊)中川贝母鉴定的可行性。方法本实验选取8个厂家的蛇胆川贝散(胶囊)作为研究对象,对模板DNA的预处理方法进行考察,通过PCR-RFLP法对提取的DNA进行扩增和酶切。结果自提样本中只有川贝母自提样本的PCR产物可被酶切,8个厂家成药样本的PCR产物均不能被Sma I酶切。结论PCR-RFLP法对蛇胆川贝散(胶囊)中川贝母的鉴别具有很高的灵敏度和准确度,对市场上成药中川贝母的真伪鉴别提供了较好的依据。
蛇胆川贝散; 川贝母; PCR-RFLP法; 鉴别; 可行性
蛇胆川贝散(胶囊)处方均由蛇胆汁和川贝母二味药材组成,制法为川贝母粉碎成细粉,与蛇胆汁按6∶1的比例混匀,干燥,粉碎。具有祛风止咳,除痰散结的功效,适用于风热咳嗽,痰多气喘,胸闷,咳痰不爽或久咳不止等症[1]。由于川贝母市场价格较高,且贝母属的一些贝母与川贝母形态相似、价格较低,因此市售川贝母替代使用现象严重[2],常见替代品有以下几种:浙贝母、湖北贝母、伊犁贝母、新疆贝母、平贝母等。目前,川贝母常用的鉴别方法以性状鉴别和色谱鉴别为主,但由于贝母属的一些贝母与川贝母化学成分较为相似,因此常用的鉴别方法都存在一定的局限性[3-13]。尤其当川贝母以原料药投入至成药中,鉴别难度加大。近年来,学者们对聚合酶链式反应-限制性内切酶长度多态性方法(以下简称PCR-RFLP法)的研究突飞猛进,并广泛应用到医药学领域,提供了一种新的分析方法[14-18]。《中国药典》2010年版一部增补本中新增了川贝母PCR-RFLP法鉴别,该方法从DNA角度对贝母进行分析鉴别,具有灵敏度高和准确度高的特点[19]。但目前本方法仅限于药材鉴定,本研究将此方法应用到蛇胆川贝散(胶囊)的成药当中,以考察成药中川贝母的真伪情况。本次研究选取8个厂家的四十余批蛇胆川贝散(胶囊)作为实验样本,同时模拟生产工艺,自提样本。通过此方法的研究,首次将PCR-RFLP法应用到成药中,为完善成药中的川贝母真伪鉴定方法提供科学依据。
1 材料与方法
1.1 仪器 PCR仪(ABI),凝胶成像系统(美国Bio-Rad公司),电泳仪(美国Bio-Rad公司),分析天平(MettlerAB135-S),纯水仪(Millipore公司),全自动凝胶成像系统(Syngene Gene Genius),球磨仪(M400,Retsch)。
1.2 试剂 新型植物基因组DNA提取试剂盒(DP320)(天根生化科技(北京)有限公司),川贝母-R、川贝母- F引物(华大基因),TaKaRa EX Taq酶(RR01AM;TaKaRa),Sma I限制性内切酶(1085A;TaKaRa),核酸染料Genegreen(天根),琼脂糖(西班牙Biowest公司)。
2 方法
2.1 样本
2.1.1 实验中所用成药来源 本实验所用的样本,来自于8个厂家生产的蛇胆川贝散(胶囊)成药。阳性对照选取川贝母中的暗紫贝母(批号121000-201007)。见表1。

表1 样本信息及来源
2.1.2 自提样本 本实验模拟蛇胆川贝散(胶囊)的生产工艺,分别取川贝母、平贝母、浙贝母、伊贝母、湖北贝母的对照药材与蛇胆汁按蛇胆川贝散(胶囊)组成比例(6∶1)混合,混匀后在80 ℃烘箱中烘30 min,作为自提样本。见表2。
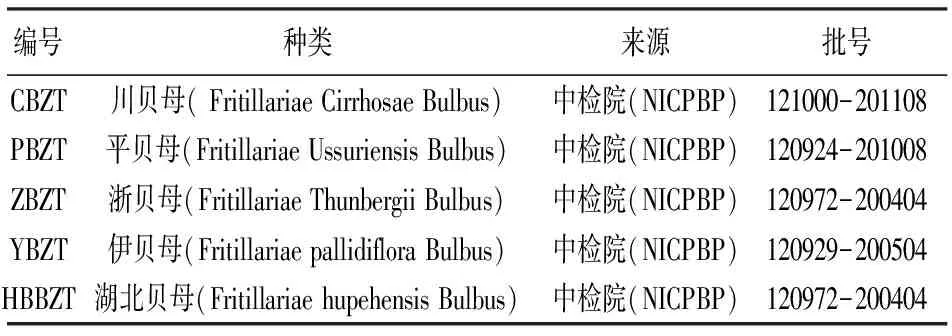
表2 自提样本中贝母信息
2.2 模板DNA预处理方法考察 方法一:将自提样本及成药加50%乙醇超声10 min,离心,弃去上清液,沉淀分别加水30 mL,混匀,离心3次,弃去水液,将沉淀置80℃烘箱中烘30min,取出,研细,即得。方法二:取自提样本及成药粉末,研细,即得。经考察,方法一与方法二结果一致,不经预处理结果无干扰,故样本直接进行DNA提取。成药经不同预处理方法的PCR结果,见图1。
1:DNA分子标记(DNA molecular marker)(100bp、250bp、500bp); 2: 阴性; 3~4: 阳性对照;5: Z1(方法一); 6: Z2(方法一); 7: Z3(方法一); 8: Z4(方法一); 9: Z1(方法二); 10: Z2(方法二); 11: Z3(方法二); 12: Z4(方法二);
图1 成药预处理方法考察PCR扩增凝胶成像图
2.3 DNA提取 取粉末20 mg,按照新型植物基因组DNA提取试剂盒(DP320)(天根生化科技(北京)有限公司)说明书进行操作,得供试品溶液,置零下20℃冰箱备用。另取川贝母阳性对照20 mg,精密称定,同法制成阳性对照模板DNA溶液。
3 PCR反应条件
本实验设计了2个不同的PCR反应体系进行条件优化:
体系一:总体积为30 μL,反应体系包括10×PCR缓冲液3 μL,dNTP(10 mmol/L)0.4 μL,二氯化镁(25 mmol/L)2 μL,鉴别引物(30 μmol/L)各0.5 μL,DNA聚合酶(5 U/μL)0.2 μL,DNA模板2 μL,灭菌超纯水21.4 μL;体系二:总体积为30 μL,反应体系包括10×PCR缓冲液3 μL,dNTP(10mmol/L)0.4 μL,二氯化镁(25 mmol/L)2 μL,鉴别引物(30 μmol/L)各0.3 μL,DNA聚合酶(5 U/μL)0.2 μL,DNA模板2 μL,灭菌超纯水21.8 μL。对2种体系进行比较,使用反应体系一的扩增结果较好,故本次实验选择体系一作为PCR反应体系。循环次数的考察:本实验对循环次数设计了4个不同的梯度进行比较,以优化扩增程序,次数为25次、30次、35次、40次。结果循环次数为30次的扩增效果最佳,故本次实验选择30次为循环次数。退火温度的考察:本实验对退火温度设计了5个不同的梯度进行比较,以优化扩增程序,温度为55 ℃,58 ℃,60 ℃,62 ℃,65 ℃。结果退火温度为62 ℃的条带最清晰,故本次实验选择62 ℃为退火温度。
3.1 鉴别引物 上游:5’-CGTAACAAGGTTTCCGTAGGTGAA-3’;下游:5’-GCTACGTTCTTCATCGAT-3’。
3.2 酶切反应体系 取PCR反应液,在200 μL离心管中进行,反应总体系为20 μL,反应体系包括10×酶切缓冲液2 μL,PCR反应液6 μL,Sma I(10 U/μL)0.5 μL,BSA 2 μL,灭菌超纯水9.5 μL。酶切反应参数:30℃,2 h。
3.3 琼脂糖凝胶电泳及凝胶成像 使用1.5%琼脂糖凝胶进行电泳,电压150 V,约30 min,电泳结束后,取凝胶片在凝胶成像仪上检视。
4 结果
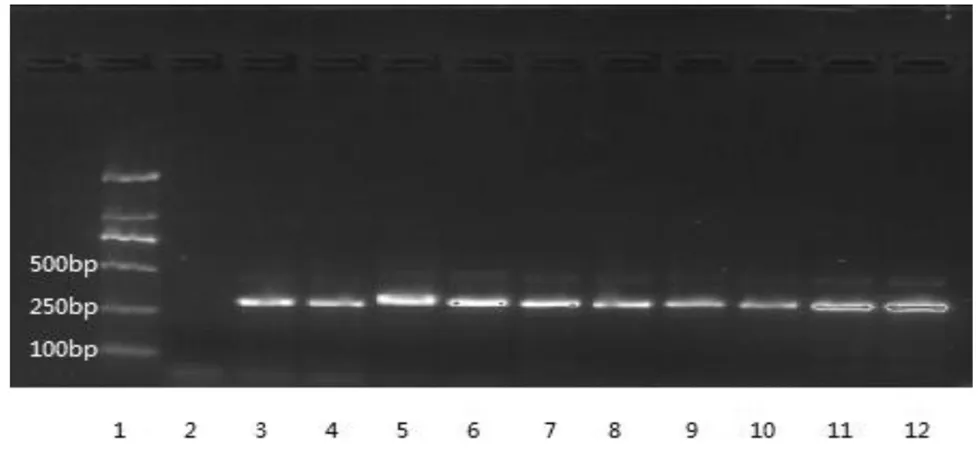
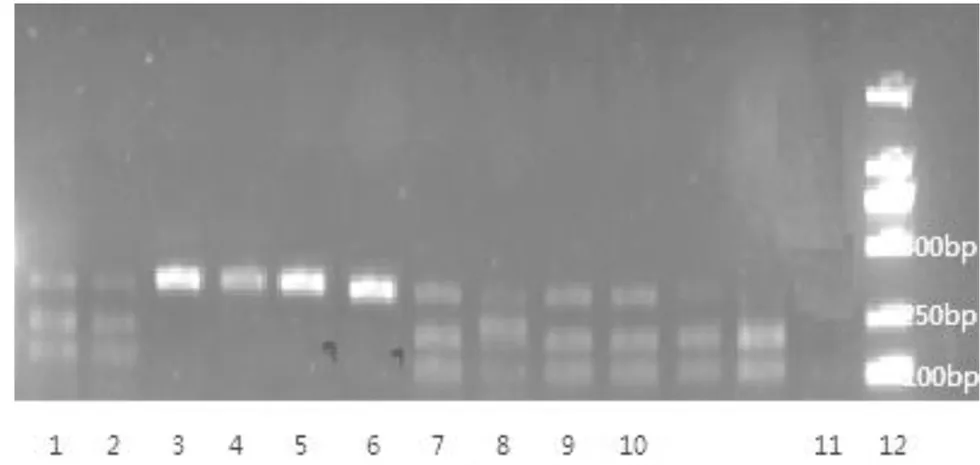
4.1 PCR-RFLP法实验结果 在自提样本中,只有川贝母的自提样本PCR产物能够被限制性内切酶Sma I切成2个片段,大小在100~250 bp,其它贝母自提样本,均不能被Sma I酶切。见图2自提样本PCR-RFLP凝胶成像结果图;8个厂家成药样本的PCR产物均不能被Sma I酶切,见图3成药PCR-RFLP凝胶成像结果图。
1-2:川贝母阳性对照;3:PBZT;4:ZBZT;5:HBZI;6:YBZT;7:青贝;8:松贝;9:太白贝母;10:瓦布贝母;11:阴性;12:DNA分子标记(100bp、250bp、500bp)
图2 自提样本PCR-RFLP结果图

1-2:川贝母阳性对照;3:Z1;4:Z2;5:Z3;6:Z4;7:Z5;8:Z6;9:Z7;10:Z8;11:阴性;12:DNA分子标记(100bp、250bp、500bp)
图3 成药PCR-RFLP结果图
4.2 方法检出限考察 本研究为考察成药中川贝母的检出限,选取国药集团冯了性(佛山)药业的蛇胆川贝散为样本,分别按照5%,25%,50%,75%,100%比例掺入川贝母阳性对照(批号121000-201007),制备检出限实验样本。检出限样本信息,见表3。每份取20 mg,按照上述PCR-RFLP法进行检测,结果表明:当成药中含有川贝母的限度为5 %时,此方法即可适用,PCR-RFLP法检出限结果,见图4。

表3 检出限样本的信息

2-3:J1;4-5:J2;6-7:J3;8-9:J4;10-11:J5;12:DNA分子标记(100bp,250bp,500bp)
图4 方法检出限PCR-RFLP结果图
5 讨论
成药中鉴定川贝母的真伪问题一直是一个难点。由于蛇胆川贝散(胶囊)成分仅为川贝母与蛇胆汁,且蛇胆汁所占比例较小,故干扰较小,且川贝母为原粉入药。这也是我们能够把PCR-RFLP法应用到此成药的前提条件。
通过8个厂家的蛇胆川贝散(胶囊)和4批自提样品,研究PCR-RFLP法对成药中川贝母鉴别的可行性,结果发现8个厂家蛇胆川贝散(胶囊)的PCR产物均不能被Sma I酶切,只有川贝母自提样本有酶切条带。厂家生产的蛇胆川贝散(胶囊)中存在使用贝母属其它贝母替代川贝母投料使用的可能性。本实验对两种反应体系进行了考察,对循环次数和退火温度进行了梯度实验,根据实验结果最终确定本实验的反应体条件。
虽然PCR-RFLP法对于川贝母的药材的鉴别已经有不少研究[20-26],但缺少对成药中川贝母掺伪的鉴别,这也增加了本研究的难度。经过实验的探索与研究,得出了PCR-RFLP法对成药中川贝母掺伪的鉴别有着很高的准确度和灵敏度,为PCR-RFLP法的完善和优化作出一定的理论依据,尤其对市售蛇胆川贝散(胶囊)及其他成药中川贝母掺伪的鉴别提供理论依据,对市售含川贝母药品的质量有着强有力的督促。
[1] 国家药典委员会.中华人民共和国药典(一部)[S].北京:化学工业出版社,2015:1487.
[2] 赵高琼,任波,董小萍.川贝母研究现状[J].中药与临床,2012,3(6):59-64.
[3] 任立波.川贝母及常见伪品的鉴别[J].内蒙古中医药,2012,31(16):49.
[4] 吴小婷.川贝母的真伪鉴别[J].海峡药学,2014,173(6):39-41.
[5] 倪进利.川贝母真伪的鉴别[J].中国中医药现代远程教育,2013,15(10):93-94.
[6] 张迎春,王燕华.川贝母真伪鉴别[J].辽宁中医药大学学报,2011,13(11):220-221.
[7] 丁丽娟.川贝母及其常见伪品鉴别[J].成都中医药大学学报,2009,32(2):83-84.
[8] 刘志梅,赵华,明延波.川贝母及其伪品小东贝母的鉴别[J].中国当代医药,2013,20(8):70-71.
[9] 杨复森,武卫红,王宁.基于AOTF-近红外光谱技术的川贝母药材即时快速鉴别研究[J].中成药,2013,35(1):135-140.
[10] 任立波.川贝母及常见伪品的鉴别[J].内蒙古中医药,2012,31(16):49.
[11] BAOZHONG DUAN.Identification and Quantitative Analysis of Nucleosides and Nucleobases in Aqueous Extracts of D. Don. Using HPLC-DAD and HPLC-ESI- MS[J]. Analytical Letters, 2011, 44(15): 2491-2502.
[12] 刘薇,张文娟,程显隆,等.中药川贝母质量控制方法研究[J].亚太传统医药,2015,11(2):41-46.
[13] 王曙,徐小平,谭昌勇,等.川贝母与其它贝母的薄层色谱鉴别[J].华西药学杂志,2002,17(3):219-221.
[14] 朱田田,晋玲,张裴斯,等.麻花秦艽ISSR-PCR反应体系的建立与优化[J].中国实验方剂学杂志,2015,21(6):74-78.
[15] 龚美蓉,陈凤丽,曹晨,等.实时荧光定量PCR技术及其在中医药研究中的应用[J].中国实验方剂学杂志,2014,20(22):238-241.
[16] 周雨晴,杜沛霖,傅鹏,等.青天葵ISSR-PCR体系优化及引物筛选[J].中国实验方剂学杂志,2014,20(21):95-99.
[17] 周涛,吴钰,金艳蕾,等.头花蓼重复片段多态性分析-多聚酶链式反应体系建立与正交优化[J].中国实验方剂学杂志,2010,16(6):50-53.
[18] 糜亚男,张水寒,蔡媛,等.杜仲SSR-PCR反应体系的优化[J].中国实验方剂学杂志,2015,21(2):1-6.
[19] 国家药典委员会.中华人民共和国药典(第一增补本)[S].北京:化学工业出版社,2010:83.
[20] 徐传林,李会军,李萍,等.川贝母药材分子鉴定方法研究[J].中国药科大学学报,2010,41(3):226-230.
[21] WAND WZ,LI O,Ding JY,et al.Simultaneous identification of Bulbus Fritillariae cirrhosae using PCR-RFLP analysis[J].Phytomedicine,2007,14(9):628-632.
[22] 谭莹,张丽华,李明成,等.中药材川贝母DNA指纹鉴定研究[J].中国药学杂志,2011,46(1):14-16.
[23] 张文娟,尚柯,魏锋,等.聚合酶链式反应-限制性片段长度多态性方法对太白贝母鉴别检验的适用性探讨[J].中国现代中药,2015,17(9):905-910.
[24] 罗达龙,黄林杰,黄琳.实时荧光定量PCR对川贝母的鉴别应用[J].中国药师,2016,19(6):1068-1070.
[25] 俞超,梁孝祺,陈金金,等.DNA条形码技术鉴定贝母属植物[J].中草药,2014,45(11):1613-1619.
[26] 罗焜,马培,姚辉,等.基于ITS2序列鉴定川贝母及其混伪品基原植物[J].世界科学技术-中医药现代化,2012,14(1):1153-1158.
安徽省科技攻关计划项目(1501041174)
1.安徽中医药大学 研究生院,安徽 合肥 230031;2.安徽省食品药品检验研究院 中药室,安徽 合肥 230051
朱林(1993-),男,在读研究生。
程旺兴(1971-),男,教授,博士,E-mail:chengwangxing@gmail.com。
10.14126/j.cnki.1008-7044.2017.06.038
R 282.5
A
1008-7044(2017)06-0719-04
2017-05-17)

