脂多糖诱导帕金森病大鼠模型及行为学评估
卞育婕 王莹雪 崔逸爽 周国龙 张宇新 魏子峰 王 茜
华北理工大学 河北唐山 063000
脂多糖诱导帕金森病大鼠模型及行为学评估
卞育婕 王莹雪 崔逸爽 周国龙 张宇新 魏子峰 王 茜
华北理工大学 河北唐山 063000
①目的 应用脂多糖(Lipopoly saccharide,LPS)建立帕金森病大鼠模型并对其进行行为学评估。②方法 雄性SD大鼠60只,随机分为观察组(40只)和对照组(20只)。应用立体定位技术向观察组大鼠右侧脑室内注入LPS(5μg/μL, 注射速度为1μL/min,20分钟注完)制成大鼠模型,应用转棒法和旋转法对大鼠运动协调行为进行评估,观察LPS诱发的大鼠行为学变化。向对照组大鼠右侧脑室注射生理盐水20μL,注射速度为1μL/min,20分钟注完。③结果 LPS造模后,40只大鼠中有31只(78%)在转棒实验中在棒时间显著缩短;有35只(88%)在旋转实验中出现向注射侧的旋转行为,同时伴有运动迟缓、肌肉强直、活动量减少等症状,提示帕金森大鼠模型复制成功。④结论 采用LPS成功建立帕金森病大鼠模型,为进一步研究帕金森病发病机制提供了新的实验方向;行为学检测也为帕金森病动物模型的评价提供了新的实验依据。
帕金森病 大鼠 动物模型 行为学评估
帕金森病(Parkinson's disease,PD)是一种多发于中老年人的神经系统退行性疾病,以大脑黑质处多巴胺神经元(Dopamine,DA)渐进性退化为主要特征,患者多伴有静止性震颤、肌肉强直、运动迟缓、面部表情呆板、步态异常等运动症状及抑郁、便秘、睡眠障碍等非运动症状,多在60岁以后发病,目前全球老年人中发病率高达1.7%,因此受到广泛关注[1]。PD发病机制尚未明确,建立成功的PD动物模型对研究、治疗PD至关重要。近年来PD动物模型研究发展迅速,国内外专家学者分别建立鱼藤酮模型、1-甲基-4-苯基1,2,3,6-四氢吡啶(1-Methyl-4-phenyl-1,2,3,6-tetrahydropyridine,MPTP)模型、6-羟基多巴胺(6-hydroxydopamine,6-OHDA)模型等多种模型[2],近期有研究发现利用LPS的炎症机制诱导SD大鼠建立动物PD模型具有较高成功率[3],但国内对此模型的研究并不多见。因此,本文用LPS诱导SD大鼠建立PD模型,通过实验前后大鼠的行为学变化评估模型构建是否成功,以期为PD发病机制和治疗的研究提供理论基础。
1 材料与方法
1.1实验动物和材料 健康雄性SD大鼠60只,体质量190~250g,购自北京维通利华实验动物技术有限公司,动物证号:SCXX(京)2013-2014;均自由进食饮水,室温(23℃~25℃),单笼喂养,自然光照,于华北理工大学动物实验中心适应性饲养1周。
水合氯醛、LPS、阿朴吗啡(apomorphine,APO)均购于美国Sigma公司,大鼠脑立体定位仪购于安徽正华生物仪器有限公司。
1.2SD大鼠PD模型制作 随机选择40只大鼠为观察组,20只为对照组,术前禁食水12小时。观察组给予6%水合氯醛(360mg/kg)腹腔注射,生理盐水新鲜配制5μg/μL的LPS溶液,根据包新民的大鼠脑立体定位图谱侧脑室注射,即于前囟后0.8mm正中线右旁开1.3mm,硬膜下3.5mm,将LPS溶液注入右侧脑室,注射速度为1μL/min,20分钟注完,以1mm/min的速度退针,以防LPS沿针道反流溢出,留针15分钟抽针缝合[4]。对照组向右侧脑室注射生理盐水20μL,注射速度为1μL/min,20分钟注完,留针15分钟后抽针缝合。
1.3行为学检测
1.3.1转棒法检测 术后1周开始,将大鼠置于正在运转的转棒仪上(恒定转速24r/min),开始计时。记录大鼠在转棒上停留的时间和2分钟内掉落的次数,以此表示其运动协调能力。每只大鼠测定3次,每次间隔30分钟,取平均值[5],连续检测6周。
1.3.2旋转法检测 术后1周开始,转棒实验结束6小时后,腹腔注射APO(0.5mg/kg)以诱发大鼠旋转行为,注射药物5分钟后,记录大鼠的旋转方向及30分钟内的旋转圈数[6],连续检测6周。平均向注射侧(右侧)[5]旋转速度≥7r/min为建立成功的PD模型大鼠。

2 结果
2.1一般观察 所有大鼠均成功完成脑立体定向手术,观察组死亡1只,对照组无死亡。观察组部分大鼠于术后1周后逐渐出现运动迟缓、肌肉强直、活动量减少等症状,对照组动物未见明显异常。
2.2行为学评估
2.2.1转棒实验结果 对照组大鼠在棒时间无明显变化,观察组大鼠与对照组比较,出现明显的四肢无力的现象,在棒时间也明显缩短(t=123.6,P<0.05)。并且随着术后时间的延长,观察组大鼠在棒时间逐渐缩短,行为障碍愈加明显,见表1。
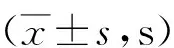
表1 术后实验组模型大鼠在棒时间
2.2.2旋转实验结果 观察组大鼠在腹腔注射APO后开始出现旋转,术后2周仅有2只大鼠出现向注射侧(右侧)旋转行为;随着时间的延长,观察组大鼠出现向右侧旋转行为逐渐增多,旋转时多以右后肢为支点,向右侧弯曲身体,原地转动,部分大鼠出现翻转;且大鼠旋转速度也逐渐增快。术后6周,出现旋转的大鼠数量及旋转速度相对稳定,其中35只大鼠恒定向注射侧(右侧)旋转,PD大鼠模型制备成功。对照组大鼠均未出现旋转行为,见表2。

表2 观察组大鼠术后APO诱导旋转行为
3 讨论
PD是一种最为常见的运动功能障碍疾病,患者主要以静止性震颤、运动迟缓、肌肉强直、姿势和步态障碍为主要表现,大量临床研究证实基底节功能障碍导致了以上症状的发生。目前临床PD的诊断主要依靠病史、临床表现及体征,辅助检查并无太大提示性意义。治疗主要以药物治疗为主,DA替代治疗是目前应用最为广泛的一种方式,同时脑深部电刺激、毁损术治疗近年来也取得一定疗效。但以上治疗措施仅能发挥改善疾病症状的作用,均不能延缓或阻止PD的进展。探寻PD的发病机制及根治措施,一直是国内外学者研究的热点。
大量研究表明氧化应激和神经炎症可能与黑质纹状体DA神经元的丢失有关[7,8]。目前,国内外研究者主要通过神经毒素模型、遗传基因模型等来模拟PD的发病的病理过程。其中应用最为广泛的是经典的6-OHDA、MPTP PD动物模型,可诱发大鼠黑质部的炎症反应,但却不能很好地描述神经炎症是否为DA神经元丢失的原因或者结果[9]。用LPS建立PD模型可以解释促炎、神经毒性因子促进了DA神经元的变性和坏死。LPS是重要的致炎因子,其本身对DA神经元并无损伤作用,但向SD大鼠黑质纹状体内注入一定剂量的LPS后可诱导小胶质细胞激活,释放大量的细胞炎症因子和一系列活性产物,同时小胶质细胞的活化早于DA神经元的改变,小胶质细胞激活丝裂原活化蛋白激酶(MAPK)、核因子-κB(NF-κB)等信号通路,活化其下游分子,选择性导致黑质纹状体DA神经元变性和减少以及DA神经递质浓度的下降,从而诱发PD的产生[10,11]。直接将LPS注入黑质纹状体常被用作制备PD炎症模型,但黑质直接注射LPS无法判断黑质DA神经元丢失是机械损伤还是LPS引起的炎症反应,亦或二者的共同作用而导致的结果,从而无法判断胶质细胞激活是DA神经元丢失的诱发因素还是伴随的病理现象[12]。研究显示,侧脑室注射LPS可以促进脑内炎症反应,同时可以避免黑质内注射导致的机械性损伤,更好的模拟PD的发病过程[13,14]。因此,本研究选择离黑质较远的右侧脑室作为LPS的注射位点,并在模型制备完成之后,对大鼠的行为学进行观察及检测。
本研究采用较为常用的转棒法和旋转法评估大鼠运动协调行为。转棒法作为广泛采用的检测运动协调性的方法之一,需要动物在滚轴上保持平衡并连续运动,在本实验中观察组大鼠潜伏期明显缩短,掉落次数显著增加,随术后时间的延长,大鼠运动障碍程度逐渐增加,症状持续时间延长,在棒时间也逐渐缩短。观察组与对照组比较,差异有统计学意义(P<0.05)。
本研究发现LPS注射后2周能够诱导大鼠向注射侧旋转,且随时间延长旋转次数增加。此结果与6-OHDA模型结果相反,在6-OHDA模型,大鼠一般向健侧旋转,其机制为6-OHDA破坏了注射区DA能神经元,使该侧纹状体DA受体的数量及敏感性提高;当给予DA受体激动剂APO时,可与同侧纹状体内大量增加的受体结合,出现受体超敏现象,导致大鼠产生旋转行为。本研究在第1周未诱发出旋转行为,可能黑质损害程度尚较轻;也可能是黑质DA神经元损毁后,其突触后膜大部分多巴胺D-2受体未在短期内出现超敏现象,故APO诱导后未出现旋转行为。LPS注入黑质对大鼠行为学的影响差异,可能与LPS和6-OHDA的神经毒性机制差异有关,6-OHDA可杀死DA神经元,在注射后短期内导致DA神经元严重损害;而LPS通过激活小胶质细胞,释放神经毒性物质间接导致DA变性[5]。本实验结果提示观察组大鼠的纹状体DA受体敏感度下降,应用DA激动剂APO诱导,出现向注射侧即患侧旋转行为,且随术后时间延长,出现旋转的大鼠数量增多且转速增快,直至术后6周数量和转速趋于稳定。
综上所述,LPS通过促进神经炎症发生发展,诱导黑质DA神经元变性,能较好的模拟PD发病机制中的炎症机制,转棒试验和旋转试验的阳性结果均有力的证实了模型复制成功的可靠性。对比其他PD动物模型,本模型具有耗时短、操作简单、经济等优点,为研究PD的发病机制及筛选以神经炎症为靶点的PD治疗药物提供了理论基础。
[1] Ted M.Dawson,Han Seok Ko,Valina L.Dawson.Genetic animal models of Parkinson's disease[J].Neuron,2010,4(34):646-661
[2] Tanaka K,Galduróz RF,Gobbi LT,et al.Ginkgo biloba extract in an animal model of Parkinson's disease:a systematic review[J].Curr Neuropharmacol,2013,11(4):430-435
[3] Zhou Y,Zhang Y,Li J,et al.A comprehensive study on long-term injury to nigral dopaminergic neurons following intracerebroventricular injection of lipopolysaccharide in rats[J].Neurochem,2012,123(5):771-780
[4] 吕风月,李军泉,张海燕,等.脑室内注射脂多糖致脑内炎症大鼠模型黑质多巴胺能神经元与胶质细胞的早期变化[J].中国老年学杂志,2009,29(1):1-4
[5] 黎 钢,孙圣刚,曹学兵,等.脂多糖注入黑质对大鼠黑质纹状体单胺类递质和行为的影响[J].中风与神经疾病杂志,2004,21(1):16-18
[6] 李丽波,王玉祥.帕金森病MPTP模型小鼠两种行为学检测方法的比较研究[J].齐齐哈尔医学院学报,2009,30(15):1809-1811
[7] Beal,M.F.Mitochondria take center stage in aging and neurodegeneration[J].Ann.Neurol,2005,58(4):495-505
[8] 张 辉,陶建峰,王爱军,等.小白菊内酯对帕金森病MPTP模型小鼠抗炎作用的研究[J].中风与神经疾病杂志,2015,32(2):158-160
[9] Ariza D,Lima MM,Moreira CG,et al.Intranigral LPS administration produces dopamine, glutathione but not behavioral impairment in comparison to MPTP and 6-OHDA neurotoxin models of Parkinson's disease[J].Neurochem Res,2010,35(10):1620-1627
[10] Hunter R L,Dragicevic N,SeifertK,et al.Inflammation induces mitochondrial dysfunction and dopaminergic neurodegeneration in the nigrostriatal system[J].Neurochem,2007,100(5):1375-1386
[11] Grzegorz C.A.,Magdalena C.,Chalimoniuk M.,et al.Role of nitric oxide in the brain during lipopolysaccharide-evoked systemic inflammation[J].Neurosci Res,2007,85(8):1694-1703
[12] Chung ES,Chung YC,Bok E,et al.Fluoxetine prevents LPS-induced degeneration of nigral dopaminergic neurons by inhibiting microglia-mediated oxidative stress[J].Brain Res,2010,1363(2):143-150
[13] 赵咏梅,李军泉,吕风月,等.低剂量脂多糖脑室注射对大鼠行为黑质小胶质细胞及多巴胺能神经元的长时程影响[J].中华行为医学与脑科学杂志,2011,20(12):1084-1087
[14] Iravani MM,Leung CC,Sadeghian M,et al.The acute and the long-term effects of nigral lipopolysaccharide administration on dopaminergic dysfunction and glial cell activation[J].Eur J Neurosci,2005,22(2):317-330
(2017-03-19 收稿)(张爱国 编辑)
LPSinducedParkinson'sdiseaseratsmodelandbehaviorevaluation
BIANYujie,WANGYingxue,CUIYishuang,etal
(NorthChinaUniversityofScienceandTechnology,Tangshan063000,China)
ObjectiveTo apply lipopoly saccharide (LPS) to establish a Parkinson's disease model in rats and evaluate its behaviors.MethodsA total of 60 male SD rats were randomly divided into the observation group (40) and the control group (20).Using stereotaxic technique to injected LPS into the right side of the brain of SD rats,the rotating rod test and rotation test to detect motor coordination behavior of rats, observing the behavioral changes in rats induced by LPS.Rats were injected with normal saline 20μL into the right ventricle of the control group at a rate of 1μL/min and 20 minutes.ResultsAfter using LPS to built model,31 of 40 rats (78%) in rotating rod experiment the time on rod were significantly shortened;35(88%) rotated to the injection side in rotation test, accompanied by brady kinesia, muscle rigidity,activity reduction,which intimated that the Parkinson's disease model were built successfully.ConclusionThe successful building of the Parkinson's animal model, providing a further direction to explore the pathogenesis of Parkinson's disease, behavioral testing for evaluation provide a new experimental animal models of Parkinson's disease.
Parkinson's disease.SD rats.Animal model. Behavioral evaluation
R 742.5
A
2095-2694(2017)06-426-04
河北省科技厅自然科学基金资助课题(编号:C200400689);唐山市科学技术研究与发展计划指令项目(编号:13130267z),河北联合大学科学研究基金(编号:Z201236),2013年河北省大学生创新创业训练计划项目(编号:201310081023),华北理工大学2015年大学生创新创业训练计划项目(编号:X2015147)。
卞育婕(1994-),女,本科生。研究方向:帕金森病。
王 茜。

