木聚糖对生物质组分水热碳化特性的影响研究
董向元 郭淑青 朱彩霞 韩洋洋 王折折
(中原工学院能源与环境学院, 郑州 450007)
木聚糖对生物质组分水热碳化特性的影响研究
董向元 郭淑青 朱彩霞 韩洋洋 王折折
(中原工学院能源与环境学院, 郑州 450007)

木聚糖; 纤维素; 木质素; 水热碳化
引言
生物质水热碳化技术是实现生物质高效清洁转化的有效方法之一[1-2],因其反应前物料无需特殊干燥处理,只以一定温度下的饱和液态水作为反应介质和催化剂,在一定程度上降低了生物质的转化成本,产物用途广泛,可以作为能源材料、化工原料或污染物吸附材料等[3-8],受到了国内外的普遍关注。
生物质主要组分为半纤维素、纤维素和木质素,三者在不同生物质中含量有所不同,结构存在很大差异。纤维素是由葡萄糖组成的多聚糖,木质素是复杂的芳香性高聚物,半纤维素主要是由木糖、阿拉伯糖等不同类型单糖构成的异质多聚体。研究者们[9-12]认为,在水热碳化过程中,3种组分相互作用,互相影响,生物质发生了水解、脱氢、脱氧、缩聚和芳香化等化学反应,首先,生物质中无定形且有支链结构的半纤维素发生水解[13],随后在水中H+和半纤维素水解形成的小分子有机酸的共同作用下,纤维素特征官能团断裂并发生水解[14],同时部分纤维素、木质素及中间态水溶物在水热环境下发生缩聚和碳化反应[15],最终形成固体产物水热焦和部分液体可溶有机物及少量气体。可见,半纤维素在生物质水热碳化过程中起着关键作用。目前虽有研究者研究了纤维素水热碳化产物的形成和理化特性[16],探索了木质素化合物的水热反应路径,解释了木质素复杂的断裂及缩聚反应竞争机制[17],但对于半纤维素的水热碳化过程,特别是其对纤维素和木质素水热碳化过程的影响研究较少。
基于此,本文选择半纤维素主要组成单元木聚糖作为模型化合物,并以小麦秸秆中半纤维素、纤维素和木质素的质量比[18]作为参照进行混合,结合元素分析、傅里叶红外光谱(FTIR)、X射线衍射分析(XRD)和热重分析仪(TG)的表征结果,研究木聚糖在不同反应温度下的水热碳化过程及其对纤维素和木质素水热碳化产物特性的影响,为理解生物质水热碳化机理与组分调控提供参考。
1 实验
1.1 实验样品
研究选用的木聚糖、纤维素及木质素均来自于上海蓝季科技发展有限公司。其中木聚糖样品为白色粉末,可溶于水,含水率0~3%;微晶纤维素样品也为白色粉末,平均粒径为25 μm;木质素为棕褐色粉末,含水率0~3%。
1.2 实验方法
所有水热碳化实验均在小型间歇式高压反应釜中进行,实验系统参照文献[18]。
具体实验过程为:将10 g实验样品与300 mL水混合均匀,放入反应釜中,密闭釜体,开始加热,为使物料均匀受热,同时启动磁力搅拌装置,当温度达到设定值时,在此温度下维持一定反应时间后,停止搅拌,反应结束,通入冷却水将釜内物料快速冷却至室温(20℃)和环境压力(1×105Pa)时,取出,并过滤分离。收集固体与液体样品,将固体样品于105℃干燥至质量恒定,待送样分析。据前期研究结果[19],反应温度选择为160~240℃,停留时间为120 min。
虽然不同生物质中半纤维素、纤维素和木质素含量不同,但在水热条件作用下,半纤维素较容易先分解,其对不同质量比的纤维素和木质素的作用机制相似。为了探索半纤维素对生物质主要组分纤维素和木质素水热碳化过程的影响,并对实际生物质组分相互作用的研究有指导意义,选取木聚糖为纤维素模型化合物,以实际生物质小麦秸秆中半纤维素、纤维素和木质素质量分数为依据,分别按照木聚糖与纤维素质量比2∶3,木聚糖与木质素质量比1∶2,样品总质量为10 g混合均匀,反应温度为220℃,停留时间为120 min,按照上述实验步骤进行水热碳化实验。实验中物料质量恒定,平衡误差小于5%。
原料和固体样品的元素组成分析采用Euro Vector EA3000型元素分析仪;化学官能团采用Bruker Tensor 27型傅里叶红外光谱仪进行表征,扫描范围4 000~500 cm-1,分辨率0.4 cm-1,用纯KBr作为背景;微晶结构采用X’Pert PRO型X射线衍射仪(荷兰PANALYTICAL公司),Cu 靶 kα 辐射(λ=0.154 2 nm) ,电压为40 kV,电流40 mA,扫描范围2°~80°,扫描间隔 0.03°;样品热稳定性采用TGA NETZSCH STA 409 C型热重分析仪分析,操作过程为:将约10 mg样品置于样品盘中,在氩气氛围下,以10℃/min的升温速率从环境温度加热至800℃。
固体水热焦和液体产物产率计算公式为(气体产物产率依据质量平衡算得)
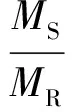
(1)
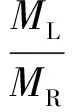
(2)
式中Y——产物产率
M——产物质量
下角标S、L、R分别代表固体、液体和原料。
2 实验结果与分析
2.1 水热碳化产物分布特性
木聚糖在不同反应温度下的水热碳化产物产率分布如图1所示。从图中可见,木聚糖水热碳化产物主要以液体产物为主,随温度的升高,液体产物产率从160℃时的94%下降至240℃时的77%;而固体产物直至温度达到200℃才开始出现,产率从3%增加至240℃时的13%;气体产物产率在实验温度范围内变化幅度较小,均未超过10%。从固体和液体产物产率的变化规律可以看出,其与小麦秸秆等[15]生物质水热碳化产物分布明显不同,在160~180℃温度范围内,木聚糖水热碳化尚无固体产物生成,液体产物产率变化不大;而当反应温度达到和超过200℃以后,固体产物产率增加,同时伴随液体产物产率的减少。这主要是因为,低于200℃时,木聚糖以水解和液化为主,高于200℃时,木聚糖水解和分解进入液相的小分子有机物进一步发生分解、重整和缩聚等反应,从而生成了不溶于水的固体产物。可见,反应温度200℃是木聚糖水热碳化的关键运行参数。
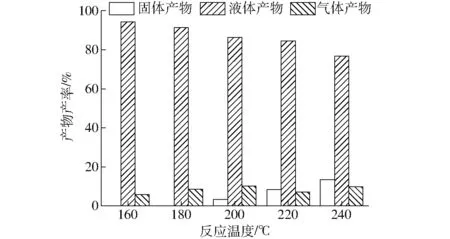
图1 不同反应温度下木聚糖水热碳化产物产率Fig.1 Product yields from hydrothermal carbonization of xylan
实际生物质水热碳化过程中,半纤维素、纤维素和木质素是共同存在并且相互作用的。为进一步了解木聚糖对另外2种组分水热碳化过程的具体影响,将木聚糖分别与纤维素和木质素按照小麦秸秆三组分质量比混合进行水热碳化。图2、3分别为纤维素、纤维素与木聚糖混合物、木质素、木质素与木聚糖混合物水热碳化产物产率分布。从图中可以看出,在相同反应条件下,纤维素水热碳化后,固、液和气体产物产率与添加木聚糖后的纤维素三相产物产率差别不大,纤维素水热焦和纤维素与木聚糖混合物水热焦产率均约为22%;而木质素与木聚糖混合水热碳化后,与纯木质素水热碳化相比,固体产物产率从60%下降至37%,液体产物产率则从31%增加至55%。

图2 木聚糖与纤维素水热碳化产物产率Fig.2 Product yields from hydrothermal carbonization of xylan and cellulose
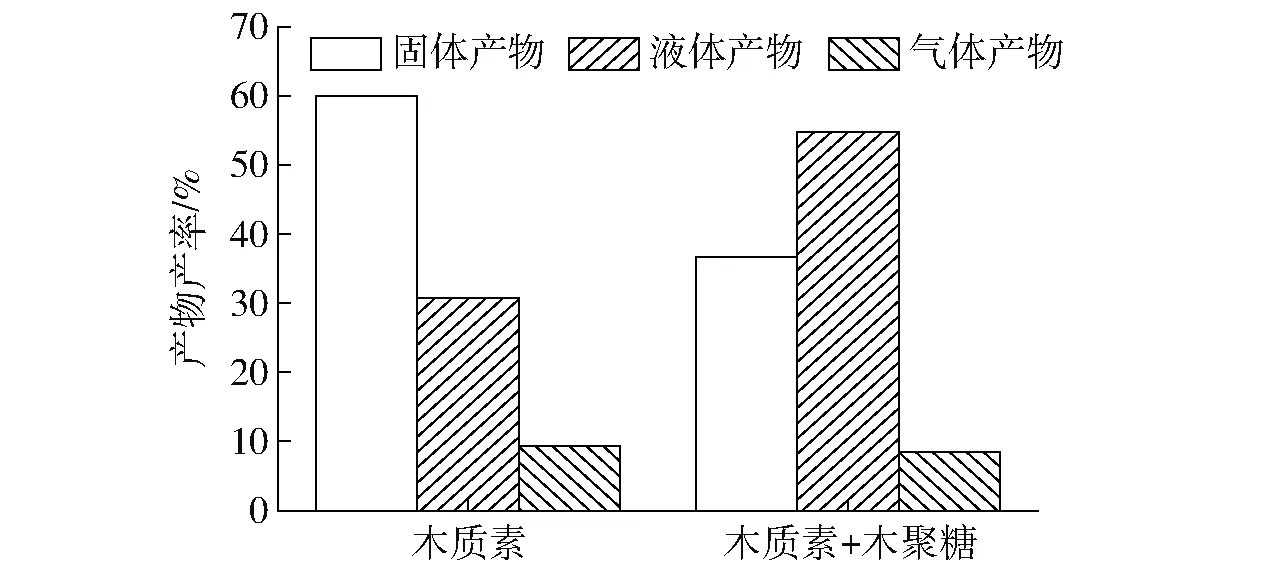
图3 木聚糖与木质素水热碳化产物产率Fig.3 Product yields from hydrothermal carbonization of xylan and lignin
为了进一步分析木聚糖对纤维素和木质素水热焦元素组成的影响,对纤维素、木质素及两者分别与木聚糖混合的水热碳化固体产物碳质量分数进行了分析。与纯纤维素水热碳化固体产物碳质量分数相比,纤维素与木聚糖混合水热碳化后,碳质量分数从42%增加至48%,而木质素及木质素和木聚糖混合物水热碳化固体产物碳质量分数则无明显差异,约为64%。可见,按照小麦秸秆三组分质量比混合后,木聚糖虽未对纤维素水热碳化产物分布有明显影响,但却使得固体产物碳质量分数有所增加,而对木质素而言,木聚糖促进了木质素的水热降解与解聚,使得木质素以可溶物形式进入液相的比例有所增加,但并未减弱固体产物的芳香化程度。这主要是因为木聚糖水热碳化液体产物中含有小分子有机酸[13],其对纤维素和木质素的水热碳化过程有催化作用,由于纤维素存在较难降解的晶体结构,有机酸的催化反应和木聚糖与纤维素共聚生成水热焦的反应达到平衡时,产物产率变化相对较小,而木聚糖和纤维素水热焦是在有机酸的催化作用下脱除了部分低热值组分聚合生成,在220℃、120 min条件下,木聚糖水热焦碳质量分数为66.25%,而纤维素水热焦碳质量分数为42.01%,从而导致木聚糖和纤维素混合水热焦碳质量分数增加。木质素存在无定形的分支结构,在有机酸催化作用下,分支结构较易降解,水热反应较为完全,且木聚糖在220℃时本身生成水热焦较少,因此木聚糖与木质素混合水热碳化后,液体产物明显增加,固体产物有所减少,而纯木质素水热焦碳质量分数较高,为63.98%,与其相比,木聚糖与木质素混合水热焦碳质量分数变化较小。
2.2 固体水热焦的化学结构

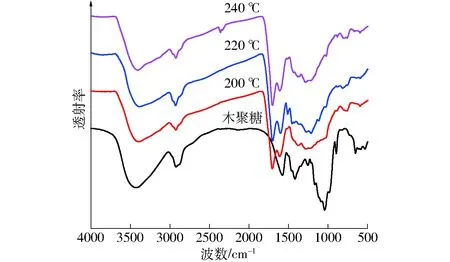
图4 木聚糖及其水热碳化固体产物FTIR谱图Fig.4 FTIR patterns of feedstock and solid products from hydrothermal carbonization of xylan
从图5图谱可以看出,纤维素有典型的多聚糖吸收峰,3 500~3 300 cm-1处的—OH,1 046 cm-1处代表吡喃环结构的C—O,897 cm-1处β-糖苷键吸收峰。经过220℃、120 min水热处理后,固体产物水热焦仍然有纤维素原料的多聚糖特性,但是吸收峰强度有所变化,并且经过处理后的固体产物均在1 705 cm-1处出现了羧基官能团吸收峰,与纯纤维素水热焦相比,纤维素与木聚糖混合水热焦此处吸收峰略强。这说明,在水热过程中,木聚糖分子的断裂和分解可以促进纤维素糖苷键断裂及吡喃环的开环,使得纤维素芳香化程度有所提高。
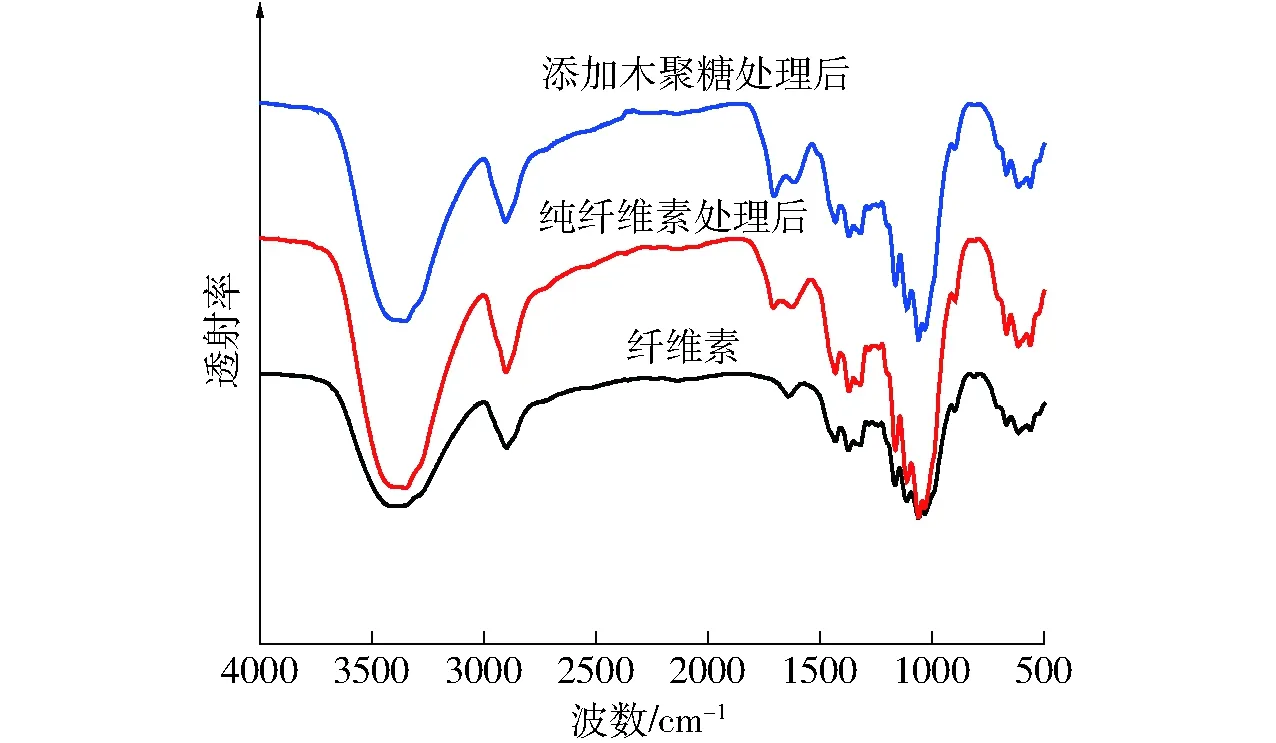
图5 纤维素及其水热碳化固体产物FTIR谱图Fig.5 FTIR patterns of feedstock and solid products from hydrothermal carbonization of cellulose

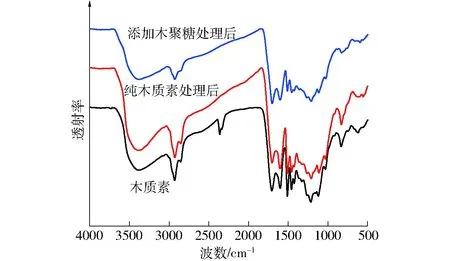
图6 木质素及其水热碳化固体产物FTIR谱图Fig.6 FTIR patterns of feedstock and solid products from hydrothermal carbonization of lignin
2.3 固体水热焦的微晶结构
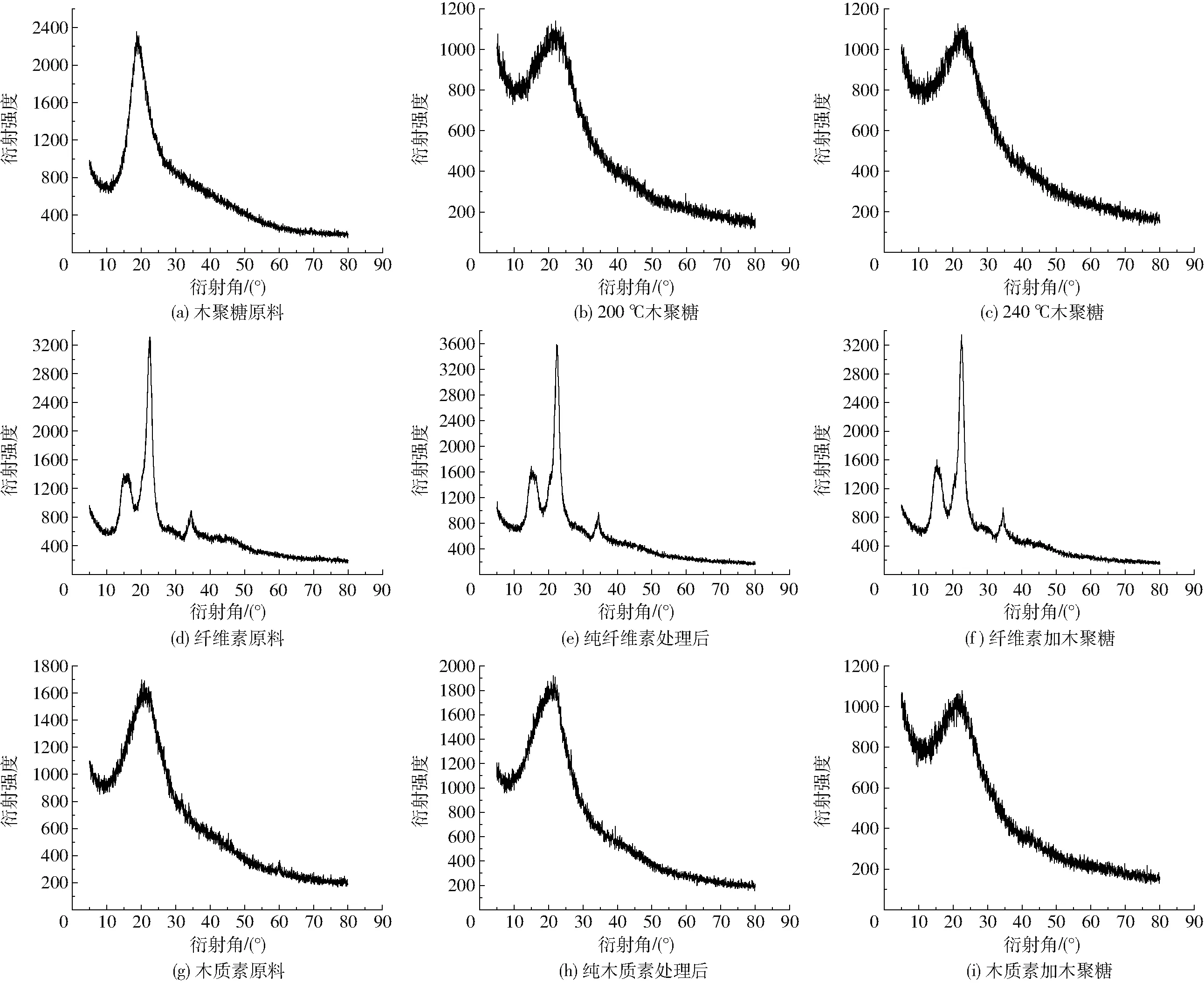
图7 生物质原料及水热焦XRD谱图Fig.7 XRD diffraction patterns of feedstock and hydrochar
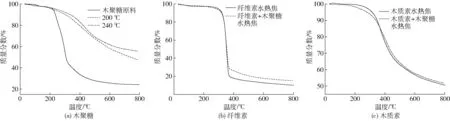
图8 木聚糖、纤维素和木质素水热焦TG曲线Fig.8 TG curves of hydrochars from hydrothermal carbonization of xylose, cellulose and lignin
为了进一步了解生物质水热碳化过程中结构特性的变化,对木聚糖、纤维素和木质素及其水热焦进行了XRD分析,如图7所示。从图7a可以看出,木聚糖在衍射角2θ为19°时有较强的衍射峰,经过水热处理后,衍射峰向右移动,在衍射角约为22°的位置出现衍射峰(图7b、7c),这与无定型碳的衍射峰相吻合[20]。而纤维素在衍射角2θ为15.5°、22.7°和34.3°处出现了明显的代表纤维素晶体结构的衍射峰(图7d),经过220℃、120 min水热处理后,晶体结构依然存在,但由于可溶性组分和一些无定形组分的溶解和去除,使得纤维素水热焦晶体结构的衍射峰变得尖锐,尤其木聚糖和纤维素混合后的水热焦,其在22.7°处衍射峰强度更强一些(图7e、7f),说明木聚糖促进了纤维素无定型结构的水热降解,这与FTIR分析结果相一致。木质素在衍射角21°出现了衍射峰(图7g),经过水热处理后,木质素水热焦衍射峰稍稍有所右移,而加入木聚糖后,其水热焦衍射峰强度有明显改变,更接近于木聚糖水热处理后水热焦的衍射峰,这说明木聚糖促进了木质素的水热降解,形成的产物结构接近于无定形碳。
2.4 固体水热焦的热稳定性
木聚糖及其水热焦、纤维素、木质素及与木聚糖混合后的水热焦失重(TG)曲线如图8所示。从图8a中可以看出,木聚糖原料及2种温度下的水热焦TG曲线变化规律有明显差异。木聚糖原料经历了3个阶段的失重:第1阶段,从30℃到200℃,由于固体中存在微量水分和少量不稳定小分子有机物,导致此阶段有一个轻微的失重,失重率为2%~5%,这与200℃和240℃的木聚糖水热焦失重相似;第2阶段,热解温度从200℃加热到400℃,木聚糖原料经历了快速的失重过程,失重率达77%,而对于200℃和240℃的木聚糖水热焦失重则相对较为缓慢,至热解温度400℃时,2种温度下的水热焦失重率约为20%,这主要是因为木聚糖单元在这一阶段大量分解,而木聚糖水热焦具有芳香结构,性质稳定,随热解温度的升高,缓慢开始分解,释放出挥发性气体,直至热解终温800℃,2种温度下的木聚糖水热焦仍有约50%的剩余量,可见木聚糖水热焦具有较好的热稳定性;第3阶段,针对木聚糖原料,在400~800℃之间,失重变得缓慢,失重率约为10%,至热解终温800℃时,木聚糖有约为24%的固体残留。
图8b、8c是纤维素和木质素及加入木聚糖后水热焦的TG曲线,从图中可以看出,纤维素水热焦与纤维素和木聚糖混合物水热焦的TG曲线变化规律相似,木质素水热焦与木质素和木聚糖混合物水热焦TG曲线变化规律也差别不大。与纤维素水热焦相比,纤维素和木聚糖水热焦至热解终温时,残留量稍高,约为15%。这说明,添加木聚糖后,纤维素和木聚糖水热焦中无定形碳结构稳定性稍有提高,而木质素由于其原本性质稳定,经过水热处理后,有无木聚糖添加对其热解特性影响不大,至800℃时,均有约1/2的固体残留,这与碳质量分数分析结构相一致。
3 结论
(1)木聚糖经反应温度为160~240℃、停留时间为120 min的水热碳化处理,固体水热焦产率从3%增加至13%,液体产物产率从94%下降至77%。
(2)按照小麦秸秆半纤维素、纤维素和木质素的质量比,将木聚糖分别与纤维素和木质素混合,经220℃、120 min水热处理后,纤维素水热焦和纤维素与木聚糖混合物水热焦产率相近,约为22%;而与木质素水热焦相比,木质素与木聚糖混合物水热焦产率为37%,减少了23个百分点。
(3)在 220℃、120 min反应条件下,与纤维素水热焦碳质量分数相比,木聚糖与纤维素混合水热焦碳质量分数有所增加,而木质素水热焦碳质量分数较高,为63.98%,加入木聚糖后,木聚糖与木质素混合水热焦碳质量分数变化不大。
(5)综合傅里叶红外光谱、X射线衍射分析和热重分析结果,在水热碳化过程中,木聚糖可以促进纤维素和木质素分子结构的断裂、聚合和芳香反应,提高水热焦的芳香特性。
1 ROMAN S, NABAIS J M V, LAGINHAS C, et al. Hydrothermal carbonization as an effective way of densifying the energy content of biomass[J]. Fuel Processing Technology, 2012, 103: 78-83.
2 GUO S Q, DONG X Y, WU T T, et al. Influence of reaction conditions and feedstock on hydrochar properties [J]. Energy Conversion and Management, 2016, 123: 95-103.
3 BASSO D, PATUZZI F, CASTELLO D, et al. Agro-industrial waste to solid biofuel through hydrothermal carbonization[J]. Waste Management, 2016, 47: 114-121.
4 KRUSE A, FUNKE A, TITIRICI M M. Hydrothermal conversion of biomass to fuels and energetic materials[J]. Current Opinion in Chemical Biology, 2013, 17: 515-521.
5 SOHI S P, KRULL E, LOPEZ C E, et al. A review of biochar and its use and function in soil[J]. Advances in Agronomy, 2010, 105(10): 47-82.
6 DUDDER H, WUTSCHER A, STOLL R, et al. Synthesis and characterization of lignite-like fuels obtained by hydrothermal carbonization of cellulose[J]. Fuel, 2016, 171: 54-58.
7 HOEKMAN S K, BROCH A, ROBBIONS C. Hydrothermal carbonization (HTC) of lignocellulosic biomass[J]. Energy amp; Fuels, 2011, 25: 1802-1810.
8 FUNKE A, ZIEGLER F. Hydrothermal carbonization of biomass: a summary and discussion of chemical mechanisms for process engineering[J]. Biofuels, Bioproducts amp; Biorefining, 2010, 4(2): 160-177.
9 NIZAMUDDIN S, MUBARAK N M, TIRIPATHI M, et al. Chemical, dielectric and structural characterization of optimized hydrochar produced from hydrothermal carbonization of palm shell[J]. Fuel, 2016, 163: 88-97.
10 WIEDNER K, RUMPEL C, STEINER C, et al. Chemical evaluation of chars produced by thermochemical conversion (gasification, pyrolysis and hydrothermal carbonization) of agro-industrial biomass on a commercial scale[J]. Biomass amp; Bioenergy, 2013, 59:264-278.
11 MAKELA M, BENAVENTE V, FULLANA A. Hydrothermal carbonization of lignocellulosic biomass: effect of process conditions on hydrochar properties[J]. Applied Energy, 2015, 155: 576-584.
12 TITIRICI M M, ANTONIETTI M. Chemistry and materials options of sustainable carbon materials made by hydrothermal carbonization [J]. Chemistry Society Reviews, 2010, 39: 103-116.
13 WAHYUDIONO M SASAKI, GOTO M. Conversion of biomass model compound under hydrothermal conditions using bath reactor[J].Fuel, 2009,88(9): 1656-1664.
14 SATHITSUKSANOH N, ZHU Z G, WI S, et al. Cellulose solvent-based biomass pretreatment breaks highly ordered hydrogen bonds in cellulose fibers of switchgrass[J]. Biotechnology and Bioengineering, 2011, 108(3): 521-529.
15 SINAG A, KRUSE A, MANIAM P. Hydrothermal conversion of biomass and different model compounds[J]. Journal of Supercritical Fluids, 2012,71: 80-85.
16 LU X W, PELLECHIA P J, FLORA J R V, et al. Influence of reaction time and temperature on product formation and characteristics associated with the hydrothermal carbonization of cellulose[J]. Bioresource Technology, 2013, 138: 180-190.
17 BARBIER J, CHARON N, DUPASSIEUX N, et al. Hydrothermal conversion of lignin compounds. A detailed study of fragmentation and condensation reaction pathways[J]. Biomass and Bioenergy, 2012, 46: 479-491.
18 郭淑青, 董向元, 刘开拓. 麦秆湿解反应水溶液循环对固形产物的影响[J/OL].农业机械学报,2015,46(5): 185-189. http:∥www.j-csam.org/jcsam/ch/reader/view_abstract.aspx?file_no=20150525amp;flag=1. DOI:10.6041/j.issn.1000-1298.2015.05.025.
GUO Shuqing, DONG Xiangyuan, LIU Kaituo. Effects of water recirculation on characterisctis of solid products from hydrothermal treated wheat straw[J/OL].Transactions of the Chinese Society for Agricultural Machinery, 2015, 46(5): 185-189. (in Chinese)
19 郭淑青,刘开拓,董向元. 温度对麦秆湿解产物特性的影响[J]. 中国电机工程学报,2014,34(26):4508-4514.
GUO Shuqing, LIU Kaituo, DONG Xiangyuan. Influence of temperature on product characteristics associated with the hydrothermal treatments of wheat-straw[J].Proceedings of CSEE, 2014,34(26):4508-4514. (in Chinese)
20 XIE Z, WHITE R J, WEBER J, et al. Hierarchical porous carbonaceous materials via ionothermal carbonization of carbohydrates[J]. Journal of Materials Chemistry, 2011, 21(20): 7434-7442.
HydrothermalCarbonization(HTC)ofXyloseandItsInfluenceonHTCProcessingofBiomassComponents
DONG Xiangyuan GUO Shuqing ZHU Caixia HAN Yangyang WANG Zhezhe
(SchoolofEnergyandEnvironment,ZhongyuanUniversityofTechnology,Zhengzhou450007,China)

xylose; cellulose; lignin; hydrothermal carbonization
10.6041/j.issn.1000-1298.2017.11.041
TK6
A
1000-1298(2017)11-0338-06
2017-03-06
2017-04-28
国家自然科学基金项目(51206194)、河南省高等学校重点科研项目(17A480002)和河南省科技厅科技攻关项目(162102210252)
董向元(1974—),男,副教授,博士,主要从事能源有效利用研究,E-mail: dongxiangyuan@163.com
郭淑青(1975—),女,教授,博士,主要从事生物质水热资源化利用研究,E-mail: shuqing.guo@163.com

