黄萎病对棉花叶片显微结构及光合特性的影响
陈兵 ,王静 ,李天南 ,林海 *,韩焕勇 ,王方永 ,王琼 ,马麒
(1.新疆农垦科学院棉花研究所/兵团棉花工程技术研究中心,新疆石河子832003;2.新疆石河子职业技术学院水利建筑工程分院,新疆石河子832003;3.中国农业大学,北京100081)
黄萎病对棉花叶片显微结构及光合特性的影响
陈兵1*,王静2*,李天南1,3,林海1**,韩焕勇1,王方永1,王琼1,马麒1
(1.新疆农垦科学院棉花研究所/兵团棉花工程技术研究中心,新疆石河子832003;2.新疆石河子职业技术学院水利建筑工程分院,新疆石河子832003;3.中国农业大学,北京100081)
【目的】揭示棉花对黄萎病胁迫的反应特征,探讨黄萎病不同发病程度对叶片显微结构和光合特性的影响。【方法】通过田间调查取样,设置5个发病水平(b0~b4),对棉叶进行光合能力测试并观察叶片显微结构。【结果】随着发病程度加重,棉花叶片逐渐失绿发黄,严重的区域产生坏死斑,并伴有叶缘焦枯上卷,直至干枯死亡。叶片气孔发育畸形,叶肉细胞间隙增大,叶片总厚度、上下表皮厚度、栅栏组织厚度和海绵组织厚度均逐渐减小,且差异显著,棉花叶片总厚度顺序为b0>b1>b2>b3>b4,棉花叶片上表皮厚度大小为b0>b1>b2>b3,下表皮、栅栏组织和海绵组织厚度大小为b0>b1>b2。叶片总厚度,上、下表皮厚度,栅栏组织厚度和海绵组织厚度均与叶片发病程度呈极显著负相关。叶片净光合速率、蒸腾速率、气孔导度逐渐降低,且均与b0达极其著差异,胞间CO2浓度呈现先降低后增加的变化趋势,但与b0的差异均不显著。【结论】黄萎病破坏了棉花叶片内部结构,降低了叶片光合能力。
棉花;黄萎病;叶片;显微结构;光合特性
新疆已成我国最大的产棉区和最大的商品棉基地,棉花生产已成为当地支柱产业之一[1-2]。由于新疆棉花种植面积大、连作时间长,各种病虫害连年加重,尤以棉花枯、黄枯萎病的危害为最,每年棉花产量损失达15%~20%,严重年份重病棉田可达50%以上,甚至绝收[3-5]。明确棉花黄萎病的发生发展情况是黄萎病预防防治的重要前提和基础。由于棉花黄萎病菌在植株体内繁殖生长,造成的植株内部细胞结构发生变化,与其他胁迫造成的植株叶片内部结构和光合能力变化存在一定的差异,但在外形尤其是叶片上表现明显的症状与不同胁迫类型有相同或相似的症状,往往给黄萎病诊断带来了难度[3]。因此,对病害发生后叶片内部结构进行显微观察,结合光合能力分析,可明确病害发生的机理,为病害诊断提供依据。
国内外学者针对不同作物叶片显微结构和光合能力变化做了一些研究。吴冬梅等[6]分析了准噶尔盆地沙漠增温效应对棉花光合速率、蒸腾速率的影响,三个区域之间的光合作用有效辐射差异不大;区域间Pn、Tr差异的主要因素是气温。Ephrath J E等[7]认为水分胁迫下玉米叶片伸长率减小,光合速率和蒸腾速率等都不同程度的下降。吴自明等[8]研究表明水稻灌浆期水分亏缺促使叶绿素和叶面积衰减加剧,加速Rubisco羧化活性和叶片光合功能衰退,叶片玉米素核苷含量下降。前人对水分亏缺、弱光、辐射、缺素、盐害、病虫害等胁迫对作物叶片显微结构和光合能力的影响也做了一些探索[9]。例如刘庆等[10]的研究表明红光叶片的净光合速率与蒸腾速率增加,而蓝光有减弱作用;气孔导度与胞间CO2浓度均以蓝光处理效果最为显著。Bai Liping等[11]研究发现干旱导致玉米叶片叶绿素下降,含水量降低,膜透性和酶的抗氧化性均不同程度的受到破坏。杜成凤等[12]发现苗期遮荫使得玉米叶片变薄,单位面积叶绿体数目减少,净光合速率降低,胞间CO2浓度增加。吴杏春等[13]发现在UV-B辐射增强条件下,水稻叶片气孔器受破坏,叶绿体结构变形,光系统Ⅱ活性受抑制,光合作用效率降低。张海鹏等[14]研究发现施用钾肥能不同程度提高不同转基因棉花品种叶绿素含量、叶面积指数、叶片净光合速率、气孔导度,从而提高棉叶光合性能。Yu Hongli等[15]利用电镜研究表明铜胁迫下小麦幼苗叶片细胞质浓缩,片状结构分散,内囊体分解,线粒体空泡化。陈志强等[16]采用盆栽方法研究表明适中土壤盐碱含量能促进西伯利亚白刺生物量、苗高绝对生长量的增加,高土壤盐碱含量下,净光合速率下降。段国琪等[17]发现美洲斑潜蝇幼虫潜食棉花栅栏组织后,叶片中叶绿素a、b及叶绿素总量都减少,光合速率、气孔导度和蒸腾速率呈下降趋势。陈威等[18]研究表明不同品种水稻可溶性糖含量降低,光合速率以及叶绿素含量也相应下降,但蒸腾速率、气孔导度和细胞间隙二氧化碳浓度变化不显著。CARVER[19]发现一些角质水解酶及半纤维素酶的抗体可与白粉菌孢子菌丝及吸器的分泌物结合,可以分泌角质水解酶及半纤维素酶。李照会等[20]用电镜观察发现,受侵染玉米叶内细胞中叶绿体的数量减少,液泡膜发生塌陷,绿体被膜破裂,细胞膜破裂。白志英等[21]采用光学和电子显微技术研究发现,在病原菌侵染早期,寄主细胞的超微结构变化并不明显,侵染中、后期变化明显。但黄萎病胁迫条件下棉花叶片显微结构和光合能力的变化少有报道,难以满足对黄萎病诊断的技术要求。
为了在解剖水平了解棉花黄萎病的形成机理同时明确光合机理,本研究在外观诊断的基础上对黄萎病棉花叶片进行更细致的显微观察,并对光合参数进行了相应分析,以更好地了解黄萎病对棉花叶片解剖结构和光合能力造成的影响。
1 材料与方法
1.1 种植情况及试验设计
试验于2013―2014年在新疆农垦科学院棉花所黄萎病病圃田中进行。土壤肥力中等,小区按随机区组设计,3个重复,每个重复约20 m2。棉花品种为金垦66-37、金垦86-29和新陆早42号。40 cm+20 cm宽窄行配置,株距9.5 cm。4月15―20日播种,膜上点播,膜下滴灌,生育期灌水量为4800 m3·hm-2, 施基肥硫磷二铵 (美国产)150 kg·hm-2,机施追肥尿素 600 kg·hm-2,磷酸二氢钾 450 kg·hm-2,随水滴施。全生育期灌溉 10~11次,灌溉周期为每8~10 d。其它按当地高产栽培模式管理。在143团14连自然发病棉田进行了部分大田试验。
1.2 测定项目和方法
在病害发生高峰期(7―8月)分别选取正常和受害棉株20株,每株选取顶部不同发病程度的棉叶2~3片(分级标准按陈兵等方法[22]进行),挂牌,对叶片进行光合测试,测试后迅速取回做切片显微观察。
1.2.1叶片光合测定。叶片净光合速率(A,μmol·m-2·s-1)、蒸腾速率(E,mmol·m-2·s-1)、气孔导度 (GH2O,mmol·m-2·s-1)、 胞间 CO2浓度(Ci,μmol·mol-1)等光合参数采用德国 WALZ 公司的GFS-3000便携式光合作用测定系统测定。选择晴朗无云的天气,于12:00―14:00进行(此时太阳高度角变化最小,太阳光源相对稳定)。测试方法是首先接好缓冲瓶,开机后进入Measure mode,测量头选择Standard head,预热30 min后设置测量参数,Flow设置为750,lmp为7,叶片面积为8 cm2,调零后夹上叶片开始光合测量,等光合速率A稳定后 (此时CO2abs在350~400 μmol·mol-1,PAR top 在 1 800 μmol·m-2·s-1左右采集数据1次,每个叶片不同部位测量3次,基本涵盖整个叶片,取平均值为整个叶片值。测定时间为2013年7月24日、8月27日,2014年7月26日、8月11日、8月23日和9月6日。
1.2.2叶片显微结构观察。将不同发病程度的新鲜棉叶代表性部位经中部主脉与边缘之间切取1~2 mm2作为显微结构观察材料。叶片显微结构的观察采用石蜡切片法[23],在电脑智能数字荧光显微镜(Upright Microscope ECLIPSE Ni-E)下观察并拍照,每个指标均为15个观测值的平均值。测定时间为2014年7月26日和8月23日。
1.3 数据分析方法
2013年和2014年分别采集了30和40个样本进行显微结构数据分析,利用显微镜自带的软件NIS-Elements D 4.00提取显微参数,MS Excel 2007对70个数据进行平均值处理和制图。利用SPASS 13.0软件Duncan法进行P<0.05和P<0.01水平的多重比较显著性分析,2年128个样本进行光合参数的方差分析和回归分析。
2 结果与分析
2.1 黄萎病对棉叶造成的可视化症状
棉叶是对黄萎病胁迫最敏感的器官,也是最易表现症状的器官。因此,棉叶内部结构和外部形态上的变化能直接反映出病害危害的情况,也是病害发病程度分级的依据。对黄萎病胁迫下棉叶外部形态的可视化症状诊断可知(图1),黄萎病发生后,随着病害发病程度增加,棉叶轻度发生时叶脉间开始失绿发黄,但叶脉仍然保持绿色,集中在点片(b1);中度发生时叶片失绿发黄面积开始逐渐扩大,出现“西瓜皮”症状[24],严重的区域产生坏死斑(b2);严重发生时失绿区域逐渐转化成黄褐色,坏死斑面积扩大,数量增加,并拌有叶缘焦枯上卷(b3);极严重时整个叶片变成黄褐色,叶缘焦枯上卷,干枯死亡(b4)。
2.2 黄萎病对棉叶内部显微结构的影响
观察正常棉叶非叶脉部位横切面可知,棉叶非叶脉部位由表皮、叶肉组成。表皮由上、下表皮组成,叶肉包括栅栏组织和海绵组织(图2b0)。叶片内部各部分排列有序,自上而下分别为上表皮、栅栏组织、海绵组织、下表皮,其中上、下表皮由薄壁细胞和气孔组成,各细胞成椭圆形或近圆形,排列紧密且有规则,栅栏组织是由一层长柱状薄壁细胞组成,各细胞排列紧密且有规则,海绵组织是由多层细胞组成,各细胞大小不一,排列疏松且无规则,各组织颜色均呈现一致的绿色,色调存在一些差异,栅栏组织绿色较浓,海绵组织绿色较淡,上、下表皮细胞透明颜色更淡。与正常叶片相比,病害叶片厚度变薄 (图2b1,b2,b3,b4),内部组织破坏严重。随着病害发病程度增加,细胞形状出现不规则,栅栏组织变薄,有不同程度纵向缩短,细胞间隙增大,排列由紧密到较紧密再到疏松直至杂乱无章;同时海绵组织变薄,海绵组织的叶肉细胞变小,细胞层数减少,细胞间隙增加,细胞排列由疏松直至杂乱无章;上、下表皮厚度变薄,细胞数目减少,体积减小,气孔发育畸形。叶片内部出现色斑,起初有个别细胞出现红棕色色斑,并逐渐变成黄棕色色斑,面积越来越大,并伴有死亡组织产生,单位面积死亡组织数目不断增加。病害严重时,所有组织细胞受到破坏,组织严重变形,上、下表皮细胞死亡,其他组织细胞混为一团,分不清组织类别。

图1 黄萎病对棉花叶片造成的可视化症状Fig.1 Verticillium wilt caused the visible symptoms of cotton leaf
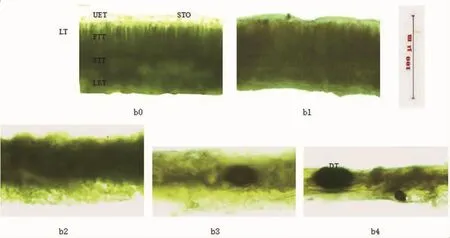
图2 正常和黄萎病危害后棉花叶片显微结构Fig.2 Microstructure of normal and disease cotton leaf
测定病害胁迫下不同发病程度棉叶总厚度和各组织厚度可知(表1),随着病害胁迫程度增加,叶片总厚度、上、下表皮厚度、栅栏组织厚度和海绵组织厚度均逐渐减小,且差异显著 (P<0.05)。 棉叶总厚度大小为 b0>b1>b2>b3>b4,正常叶片b0和胁迫叶片b1,b2,b3,b4间差异均达到极显著差异水平,各胁迫处理b1,b2,b3,b4之间差异均达到极显著差异水平;棉叶上表皮厚度大小为 b0>b1>b2>b3,正常叶(b0)和 b1,b2,b3叶片间差异均达到极其显著差异水平,胁迫处理b1与b2,b3间达到显著差异水平,而b2,b3间未达到显著差异水平;棉叶下表皮厚度大小为b0>b1>b2,正常b0和b1间差异均未达到极显著差异水平,与b2间达到显著差异水平,而b1,b2间未达到显著差异水平;栅栏组织厚度和海绵组织厚度大小变化和显著性差异均与下表皮一致。棉叶不同发病程度与叶片厚度相关性分析可知(表1),叶片发病程度均与总厚度、上、下表皮厚度、栅栏组织厚度和海绵组织厚度呈极显著负相关,相关系数绝对值均达到了0.6以上。其中与总厚度相关性最好,相关系数最高(|r∣>0.940),与上表皮厚度相关系数很高 (|r∣>0.920),与下表皮厚度、栅栏组织厚度相关系数较高(|r∣>0.768),与海绵组织厚度相关性最低(|r∣>0.716)。

表1 黄萎病对棉叶显微结构的影响Table 1 Effects of disease on the microstructure of cotton leaf
2.3 黄萎病对棉花叶片光合能力的影响
病害发生后,棉叶净光合速率、气孔导度、蒸腾速率和胞间CO2浓度等光合参数均发生了相应的变化(图3)。图3可知,随着病害发病程度增加,在棉花各生育时期,叶片净光合速率、气孔导度、蒸腾速率均下降,其中净光合速率下降幅度最大,极严重时甚至出现了负值;气孔导度下降幅度较大,蒸腾速率下降幅度较小。而胞间CO2浓度则呈现先降后升的趋势,病害轻度时下降幅度很小(10%以内),病害极其严重时上升尤其明显,比正常增加了约2倍。这些变化在棉花发病不同时期略有不同,棉叶净光合速率、气孔导度、蒸腾速率均在发病程度b2之前8月10日始终保持较高的值,8月23日和9月6日略低,7月26日最低;发病程度b2及以上,所有时期光合参数值差异很小。说明棉花生长的不同生育时期的叶片光合参数受病害的影响不同,发病程度较轻时不同生育时期对净光合速率、气孔导度、蒸腾速率影响较大,发病程度较重时不同生育时期对净光合速率、气孔导度、蒸腾速率的影响较小。而胞间CO2浓度在发病程度b3之前随着生育期增加略微增加,但不明显,发病程度b4则随着生育期增加而减小,较为明显。

图3 正常和黄萎病危害后棉花叶片光合参数变化Fig.3 the Change of photodynamic parameters of cotton leaf normal and disease

表2 棉花黄萎病不同发病程度叶片光合参数变化Table 2 Change of different treatments on photodynamic parameters in cotton leaf
方差分析后发现(表2),病害棉叶光合参数净光合速率、气孔导度和蒸腾速率所有处理(b1-b4)均与b0达极其著差异,净光合速率的病害各处理间(b1,b2,b3,b4)达到极显著差异, 蒸腾速率的病害各处理间(b1,b2,b3,b4)达到显著差异,气孔导度的病害处理b3和b4间未达显著性差异,其他病害处理间均达到显著差异。胞间CO2浓度在病害初期(b1)均与b0未达显著差异,病害后期(b3,b4)与b0达显著差异。胞间CO2浓度的病害处理b1和b2间未达显著性差异,但与b3,b4处理达到显著差异,b3,b4病害处理间亦达到显著差异。表明病害发生使叶片光合发生了较大的变化。进一步对不同发病程度棉花叶片光合参数与发病程度进行相关性比较可知,净光合速率、气孔导度和蒸腾速率均与叶片发病程度呈极显著负相关,相关系数绝对值均达到了0.800以上。其中与净光合速率相关性最好,相关系数最高,|r∣为0.970;与蒸腾速率相关系数很高,|r∣为0.957;与气孔导度相关系数较高,|r∣为0.886;与胞间CO2浓度呈极显著正相关,相关系数均达到了0.715。相关性大小顺序为净光合速率>蒸腾速率>气孔导度>胞间CO2浓度。
3 讨论
本文对棉花受黄萎病危害后的叶片显微结构及光合特性进行了深入的研究。从棉花叶片受到黄萎病胁迫外部形态来看,黄萎病发生后,导致棉花叶片叶脉间开始失绿发黄,叶脉仍然保持绿色,轻度发生时集中在点片,中度发生时开始逐渐扩大,严重发生时失绿区域逐渐转化成黄褐色,并拌有叶缘焦枯上卷产生,极其严重时整个叶片变成黄褐色,叶缘焦枯上卷,干枯死亡。可见,黄萎病对棉花叶片的危害在外部形态上已经发生了显著的变化。
从叶片显微结果来看,黄萎病菌破坏了棉花叶片内部各组织结构。随着病害发病程度加重,叶片内部各组织边界逐渐模糊,细胞间隙增加,细胞排列由紧密到较紧密再到疏松直至杂乱无章,大量细胞失水变小,细胞形状变形,体积减小,并伴有坏死现象,大量死亡组织产生,组织内部色素细胞由绿色向黄色转化,细胞层数和数目有所减少,气孔发育畸形。病害严重时,所有组织细胞受到破坏,组织严重变形,上、下表皮细胞死亡,其他组织细胞混为一团,分不清组织类别。随着病害程度增加,总厚度(LT),上、下表皮厚度(UET、LET),栅栏组织厚度(PTT)和海绵组织厚度(STT)均逐渐减小,且差异显著。病害对叶片LT的影响最大,其次是UET,再次是LET、PTT和STT。叶片 LT、UET、LET、PTT和STT均与叶片发病程度呈极显著负相关,相关系数均达到-0.6以上,总体上相关性高低按叶片由正面到背面自上而下顺序依次递减。说明病害迫害棉叶是从正面向背面发展的。这些变化与植物叶片干旱、低温胁迫变化相似,例如刘洋等[25]研究显示随着水分亏缺程度的不断增,番茄叶片厚度、栅栏组织厚度、海绵组织厚度、栅栏组织细胞长度、栅栏组织细胞宽则呈不断减小的趋势。安福全等[26]发现在低温弱光条件下,西葫芦叶片的上下表皮细胞密度、细胞直径、气孔大小及气孔密度均变小,栅栏组织厚度和叶片厚度均减小,海绵组织变得更加疏松,栅栏组织与海绵组织比值减小,细胞间隙变大。与盐害、缺素等胁迫造成的变化有些异同。项锡娜等[27]研究认为,盐浓度的增加导致石楠叶片栅栏组织厚度略有减低,但海绵组织和上下表皮厚度无明显变化。张英华等[28]探讨了不同小麦品种和不同器官耐热性差异机制,认为高温处理下两品种光合速率比正常温度下低,叶绿素含量低;旗叶、旗叶鞘、穗下节、颖片和籽粒的MDA含量和Pro含量均升高。本研究认为,不同胁迫类型对作物叶片内部造成的变化存在差异,黄萎病棉叶外部表现黄化等症状是由叶片内部及组织结构变化控制的,正是这些内部组织的变化引起了外部形态上变化。因此,观察黄萎病造成的棉叶内部的标志性显微结构异常及细胞器的损伤,可以初步区分不同胁迫对棉花叶片解剖结构造成的影响。
从叶片光合生理来看,病害对叶片净光合速率(A)、气孔导度(GH2O)、蒸腾速率(E)和胞间CO2浓度(Ci)均有一定的影响,病害胁迫使棉叶A、GH2O、E逐渐减小,Ci呈现先减后增趋势,这些变化与病害发生后棉叶内部结构叶片总厚度、上、下表皮厚度、栅栏组织厚度和海绵组织厚度等变化具有很好的一致性。病害对叶片A的影响最大,其次是GH2O、E,再次是Ci,且随棉花生育时期的不同影响程度有所不同,病害轻时光合参数受生育时期的影响较大,病害严重时光合参数受生育时期的影响较小。表明黄萎病破坏了棉花叶片内部组织细胞,造成了叶片光合性能的下降。表明病害对PSⅡ造成了伤害,导致光合作用减弱。Demmig-Adams等[29]认为,当高等植物吸收的光能超过所能利用的能量时,会启动非辐射能量耗散(NPQ)途径来耗散掉过剩的激发能,以免植物光合机构受到伤害。而较高的qN则有助提高叶片防止强光损伤光合器的保护能力,有利于减缓叶片衰老的进程,使叶片的光合功能期延长,对提高棉花的铃重具有重要作用。另一方面病害发生后叶片捕获光能减少,水分减少,CO2浓度减少,导致气孔开放程度减弱,GH2O下降,E随之下降,进一步导致叶片温度升高。由于病害初期叶片为抵御失水等造成的更多伤害,自我保护能力增强,细胞间排列精密,阻碍了更多的CO2进入,病害后期由于叶片组织受到严重迫害,无法自我保护,叶片内部细胞空隙加大,增加了CO2进入空间,导致Ci随病害发病程度增加呈现先减小后增加趋势。Farquhar等[30]认为Ci浓度是评判气孔限制和非气孔限制的依据,A、GH2O和Ci值同时下降时,A下降为气孔限制;相反,当叶片A伴随胞间CO2浓度值的提高,说明光合作用限制因素为非气孔限制。刘洋等[25]研究表明T1、T2处理的植株光合作用的限制因素比较接近气孔限制;而T3、T4处理的植株光合作用的限制因素则更接近非气孔限制。由于影响棉花叶片光合作用的因素不同,但一些胁迫因素的光合变化与病害不同发病程度下一些光合参数变化类似[25-26],尤其水分亏缺和低温弱光条件下保持一致,叶片A及叶绿素含量均下降较明显,表明病害导致的光合生理变化与低温和缺水引起的变化是一致的。
4 结论
研究发现,黄萎病发生后,导致棉花叶片颜色由绿逐渐变黄,变色区域由小到大,并伴有叶缘焦枯,直至干枯死亡,外部形态上发生了较大的变化。黄萎病菌破坏了棉花叶片内部各组织结构,随着病害程度增加,总厚度,上、下表皮厚度,栅栏组织厚度和海绵组织厚度均逐渐减小,导致内部组织结构发生显著的变化,引起了外部形态上变化。病害胁迫使棉叶净光合速率、气孔导度、蒸腾速率逐渐减小,胞间CO2浓度呈现先减后增趋势,表明黄萎病迫害了棉花叶片内部组织细胞,造成了叶片光合性能的下降。以上变化为棉花黄萎病发生后叶片生理特征进行了很好的解释。
[1]张佳喜,蒋永新,刘晨,等.新疆棉花全程机械化的实施现状[J].中国农机化,2012(3):33-35.Dai Xiaofeng,Guo Yuyuan.Research on integrated prevention and control technique of major cotton pests in China:Trend and strategy[J].Journal of Catastrophology,1997,12(2):82-86.
[2]毛树春,李亚兵,冯璐,等.新疆棉花生产发展问题研究[J].农业展望,2014(11):43-51.Mao Shuchun,Li Yabing,Feng Lu,et al.Study on the development of Xinxiang cotton production[J].Agricultural Outlook,2014(11):43-51.
[3]宋庆平,陈谦,陈红,等.新疆棉田病虫害防治策略与技术的展望[J].中国棉花,2002,29(12):7-9.Song Qingping,Chen Qian,Chen Hong,et al.Prospect on strategy and technology of protection and control diseases and insects in Xinjiang cotton fields[J].China Cotton,2002,29(12):7-9.
[4]李国英.新疆棉花主要病害发生趋势及对策[J].植物保护,2000(4):23-25.Li Guiying.Study on strategy and technology of cotton primary diseases in Xinjiang[J].Plant Protection,2000(4):23-25.
[5]戴小枫,郭予元.我国棉花主要病虫害综合防治技术研究的方向与对策[J].灾害学,1997,12(2):82-86.Dai Xiaofeng,Guo Yuyuan.Research on integrated prevention and control technique of major cotton pests in China:Trend and strategy[J].Journal of Catastrophology,1997,12(2):82-86.
[6]吴冬梅,赵强,张凤华,等.准噶尔盆地沙漠增温效应对棉花光合速率、蒸腾速率的影响[J].干旱区资源与环境,2007,21(3):125-129.Wu Dongmei,Zhao Qiang,Zhang Fenghua,et al.The Temperature improving effect of desert on photosynthetic and transpiration characteristicsofcotton in zhungarer basin[J].Journal of Arid Land Resources and Environment,2007,21(3):125-129.
[7]Ephrath J E,Hesketh J D.The effects of drought stress on leaf elongation,photosynthetic and transpiration rates in maize(Zea mays)leaves[J].Photosynthetica,1991,25:607-619.
[8]吴自明,王竹青,李木英,等.后期水分亏缺与增施氮肥对杂交稻叶片光合功能的影响[J].作物学报,2013,39(3):494-505.Wu Ziming,Wang Zhuqing,Li Muying,et al.Effect of water shortage and increasing nitrogen application on photosynthetic function of different hybrid rice combinations at grain filling stage[J].Acta Agronomica Sinica,2013,39(3):494-505.
[9]Levitt J.Responses of plants to environmental stresses.Volume II.Water,radiation,salt and other stresses[M].New York:Academic Press,1980:607.
[10]刘庆,连海峰,刘世琦,等.不同光质LED光源对草莓光合特性、产量及品质的影响[J].应用生态学报,2015,26(6):1743-1750.Liu Qing,Lian Haifeng,Liu Shiqi,et al.Effects of different LED light qualities on photosynthetic characteristics,fruit pro-duction[J].Chinese Journal of Applied Ecology,2015,26(6):1743-1750.
[11]Bai Liping,Sui Fanggong,Ge Tida,et a1.Effect of soil drought stress on leaf water status,membrane permeability and enzymatic antioxidant system of maize[J].Pedosphere,2006,16(3):326-332.
[12]杜成凤,李潮海,刘天学,等.遮荫对两个基因型玉米叶片解剖结构及光合特性的影响[J].生态学报,2011,31(21):6633-6640.Du Chengfeng,Li Chao Hai,Liu Tian Xue,et al.Response of anatomical structure and photosynthetic characteristics to low light stress in leaves of different maize genotypes[J].Acta E-cologiea Sinica,2011,31(21):6633-6640.
[13]吴杏春,林文雄,黄忠良.UV-B辐射增强对两种不同抗性水稻叶片光合生理及超显微结构的影响[J].生态学报,2007,27(2):554-564.Wu Xingchun,Lin Wenxiong,Huang Zhongliang.Influence of enhanced ultraviolet-B radiation on photosynthetic physiologies and ultrastructure of leaves in two different resistivity rice cultivars[J].Acta Ecologiea Sinica,2007,27(2):554-564.
[14]张海鹏,马健,文俊,等.施钾对不同转基因棉花品种光合特性及产量和品质的影响[J].棉花学报,2012,24(6):548-553.Zhang Haipeng,Ma Jian,Wen Jun,et al.Effects of potassium application on the photosynthetic characteristics,yield,and fiber properties of different transgenic cotton varieties[J].Cotton Science,2012,24(6):548-553.
[15]Yu Hongli,Yao Ruiqing,Xiao Xin.Influence of copper stress in Ultra structure of wheat seedlings[J].Agriculture Science and Techonlogy,2010,11(5):7-9,45.
[16]陈志强,李庆贱,时瑞亭,等.苏打盐碱胁迫对西伯利亚白刺光合和生长的影响[J].北京林业大学学报,2011,33(3):31-37.Chen Zhiqiang,Li Qingjian,Shi Ruiting,et al.Effects of soda saline-alkaline stress on photosynthesis and growth ofNitraria sibirica[J].Journal of Beijing Forestry University,2011,33(3):31-37.
[17]段国琪,梁素明,张一白,等.美洲斑潜蝇为害对棉花光合生理的影响[J].中国棉花,2014,41(8):17-18.Duan Guoqi,Liang Suming,Zhang Yibai,et al.Effect of leaf mining of liriomyza sativa larvae on photosynthetic physiology of cotton[J].China Cotton,2014,41(8):17-18.
[18]陈威,周强,李欣,等.不同水稻品种对虫害胁迫的生理响应[J].生态学报,2006,26(7):2161-2166.Chen Wei,Zhou Qiang,Li Xin,et al.Physiological responses of different rice cultivars under herbivore stress[J].Acta Ecologica Sinica,2006,26(7):2161-2166.
[19]Carver T L W,Ingersonmorris S M,Thomas B J,et al.Early interactions during powdery mildew infection[J].Canadian Journal of Bontany,1995,73(1):624-639.
[20]李照会,郭兴启,叶保华,等.感染玉米粗缩病毒后玉米植株的超微结构病变研究[J].中国农业科学,2002,35(3):264-266.Li Zhaohui,Guo Xingqi,Ye Baohua,et al.UItrastructural alteration of maize plants infected with maize rough dwarf virus[J].Scientia Agricultura Sinica,2002,35(3):264-266.
[21]白志英,王冬梅,侯春燕,等.小麦叶锈菌侵染过程的显微和超微结构[J].细胞生物学杂志,2003,25(6):393-397.Bai Zhiying,Wang Dongmei,Hou Chunyan,et al.Microstructure and ultrastructure infected by wheat rust fungus[J].Chinese Journal of Cell Biology,2003,25(6):393-397.
[22]Chen Bing,S Li haokun,Wang Keru,et al.Evaluating the Disease index level of cotton Verticillium using spectral signature analysis[J].International Journal of Remote Sensing.2012,33(9):2706-2724.
[23]李正理.植物组织切片学[M].北京:北京大学出版社,1996:130-139.LI Zhengli.Plant tissue slice[M].Beijing:Peking University Press,1996:130-139.
[24]马远莉,甘莉,吕金殿.棉花黄萎病株解剖[J].中国棉花,1990,17(5):44-45.Ma Yuanli,Gan Li,Li Jingdian.The anatomy of the cotton Verticillium wilt strains[J].China Cotton,1990,17(5):44-45.
[25]刘洋,齐红岩,刘海涛.不同水分亏缺程度对番茄叶片显微结构及光合作用的影响[J].北方园艺,2007(2):6-8.Liu Yang,Qi Hongyan,Liu Haitao.Effects of different water deficit levels on microstructure and photosynthesis of tomato leaves[J].Northern Horticulture,2007(2):6-8.
[26]安福全,于龙凤,李富恒.低温弱光对西葫芦叶片光合特性及显微结构的影响[J].作物杂志,2011(5):45-47.An Fuquan,Yu Longfeng,Li Fuheng.Influence of low light and low temperature on microstructure of summer squash's leaves[J].Crops,2011(5):45-47.
[27]项锡娜,陈泰豪,吴月燕,等.盐胁迫对红叶石楠‘鲁班’生理生化特性及叶片显微结构的影响[J].植物生理学报,2014,50(7):917-924.Xiang Xina,Chen Taihao,Wu Yueyan,et al.Effects of salt stress on physio-biochemical characteristics and leaf micro-structure inPhotinia glabra'rubens'seedling[J].Plant Physiology Journal,2014,50(7):917-924.
[28]张英华,杨佑明,曹莲,等.灌浆期高温对小麦旗叶与非叶器官光合和抗氧化酶活性的影响[J].作物学报,2015,41(1):136-144.Zhang Yinhua,Yang Youming,Cao Lian,et al.Effect of high temperature oil photosynthetic capability and antioxidant enzyme activity of flag leaf and non-leaf organs in wheat[J].Acta Agronomica S1nica,2015,41(1):136-144.
[29]Demmig-Adams A B,Adams III W W.Photoprotection and other responses of plants to high light stress[J].Annual Review of Plant Biology,2003,43(1):599-626.
[30]Farquhar G D,Sharkey T D.Stomatal conductance and photosynthesis[J].Annual Review of Plant Physiology,1982,33:317-342. ●
Effects of Verticillum Wilt on Leaf Microstructure,Photosynthesis of Cotton
Chen Bing1*,Wang Jing2*,Li Tiannan1,3,Lin Hai2**,Hang Huanyong1,Wang Fangyong1,Wang Qiong1,Ma Qi1
(1.Cotton Institute/Proving Ground,Xinjiang Academy Agricultural and Reclamation Science,Shihezi,Xinjiang832000,China;2.Institute of Water Conservation and Architectural Engineering,Xinjiang Shihezi Vocational College,Shihezi,Xinjiang832003,China;3.China Agricultural University,Beijing100081,China)
[Objective]The purpose of this study was to determine the change of microstructure and photosynthetic characteristics in cotton leaves under different disease index levels(b0~b4).[Method]Through investigation and sampling in cotton fields,five treatments were designed based on disease index levels of cotton leaf,and the leaf photosynthesis was tested by WFS-3000 and microstructure was observed with Microscope ECLIPSE Ni-E.[Result]With the increase in disease index levels,cotton leaf gradually lost green color,serious necrosis area occurred,with the leaf withered up till dried to death.The stomata of disease leaf incurred abnormally,increasing intercellular space in mesophyll tissue.Total thickness,upper and lower epidermis thickness,palisade tissue thickness and spongy tissue thickness all decreased significantly among all treatments;the trend showed as followed:total thickness was b0>b1>b2>b3>b4,upper epidermis thickness was b0>b1>b2>b3,lower epidermis thickness,palisade and spongy tissue thickness were consistent as b0>b1>b2.As a whole leaf of total thickness,upper,lower epidermis thickness,palisade and spongy tissue thickness were very significantly negatively correlated with leaf disease index levels,The correlation coefficient reached-0.6.The net photosynthesis rate,transpiration rate,stomata conductance gradually decreased and reached significant different with b0,leaf temperature increased,internal CO2first went up then down but no significant difference with b0.[Conclusion]The results indicated that Verticillum wilt damaged leaf microstructure and impaired photosynthesis of cotton leaf.
cotton;Verticillum wilt;leaf;microstructure;photosynthesis character
S562.03 文献标志码:A
1002-7807(2017)06-0570-09 DOI:10.11963/1002-7807.cblh.20171115
2016-09-08
陈兵 (1979―),男,博士,zyrcb@126.com。*同等贡献:zyrcb@126.com,jing108@126.com。**通信作者:xjlinh@126.com.
国家科技支撑计划 (2014BAD09B03-3);新疆农垦科学院引导计划 (83YYD201508);国家自然科学基金(41161068)

