纳米雄黄抗B细胞非霍奇金淋巴瘤Raji细胞的体外作用研究
姜 爽,王晓波,张治然,孙 岚,李劲草,张英鸽
(1. 解放军第210医院药剂科,辽宁 大连 116021;2. 军事医学科学院毒物药物研究所纳米药理毒理室,北京 100850)
在我国,非霍奇金淋巴瘤(non-Hodgkin’s lymphoma, NHL)占全部淋巴瘤病例的90%左右,其发病率和死亡率居恶性肿瘤第 5 位。其中,B细胞来源的淋巴瘤占NHL发病率的85%[1]。NHL患者常常需要接受大剂量的化疗和免疫治疗[2],尽管标准化疗和近些年出现的新药已经提高了NHL治疗的有效率[3-4],但该病复发率也高,且复发后再次治疗的缓解率低。探索和发现治疗恶性淋巴瘤新的策略,已成为目前亟待解决的问题。
在我国第一部药物学专著《神农本草经》上就有记载的我国传统中药雄黄是中医内治外用常用药之一,其主要成分为二硫化二砷(As2S2)或四硫化四砷(As4S4)。近现代研究表明,雄黄有镇痛、消炎、提高免疫力等功效,并且对多种血液系统肿瘤,尤其是白血病有较明显的治疗效果。我们课题组业已证明,雄黄纳米化可提高生物利用度、减毒增效[5-6]。不同粒径的雄黄诱导肿瘤细胞凋亡及毒副作用具有尺寸效应,即纳米颗粒越小,作用效果越强[7-9],并在一定的粒径范围具有某种程度的肝、脾和肿瘤组织靶向性。我院研究人员在纳米雄黄制备及抗肿瘤的作用机制上也进行了较深入的研究[10-11]。有关三氧化二砷(As2O3)对弥漫大B细胞淋巴瘤的临床疗效研究尚可见,但关于雄黄(主要成分为As2S2)对B细胞来源的NHL研究较少。由于广义上的淋巴瘤是包括白血病的,因此,本研究是在前期纳米雄黄抗白血病研究的基础上,深入研究纳米雄黄对B细胞淋巴瘤的作用,旨在探讨纳米雄黄对B细胞来源NHL作用的敏感性,对B细胞来源的NHL细胞株增殖和凋亡的影响, 为进一步完善B细胞淋巴瘤的治疗提供理论依据。
1 材料
1.1细胞株人Burkitt淋巴瘤 Raji细胞,购自中国科学院细胞库。
1.2试剂雄黄(As2S2,纯度为98%)购自湖北中药研究所,检测到雄黄的Zeta电位为(-20.6 ±1.50)mV。胎牛血清、RPMI 1640培养基,均购自Gibco公司;MTT细胞增殖及细胞毒性检测试剂盒、Annexin V-FITC 细胞凋亡检测试剂盒、Hoechst 33258细胞核染液,均购自碧云天试剂有限公司;二甲基亚砜(DMSO)、4%多聚甲醛等,购自北京赛驰生物科技有限公司。
1.3仪器H-7650透射电镜,日本日立公司;Zetasize 3000 HS激光粒度和Zeta电位分析仪,英国马尔文公司;SpectraMax M3多功能酶标仪,美国MD公司;Nanowizard 原子力显微镜,德国JPK公司;FACS Calibur 型流式细胞仪,美国BD公司。
2 方法
2.1纳米雄黄和水飞雄黄的制备按照文献[7]的方法,制备水飞雄黄和纳米雄黄。
2.2纳米雄黄和水飞雄黄的表征分别取上述制备的纳米雄黄和水飞雄黄各1 mg,溶解在5 mL乙二醇溶液中,室温超声30 min后,迅速用激光粒度仪分别检测纳米雄黄和水飞雄黄的粒径、聚合物分散性指数(polymer dispersity index,PDI);雄黄电势的测定溶剂为纯水。
透射电镜(transmission electron microscope,TEM)和原子力显微镜(atomic force microscope,AFM)评价纳米雄黄和水飞雄黄的形态特征。分别取上述制备的纳米雄黄和水飞雄黄各1 mg,溶解在10 mL无水乙醇溶液中,超声分散后,分别吸取10~30 μL滴在铜网和新鲜剥离的云母片上,在空气中自然晾干后,在TEM、AFM下观察形态。
2.3Raji细胞体外培养[12]Raji细胞培养于RPMI 1640培养液(含体积分数为10%的胎牛血清、100 kU·L-1青霉素、100 mg·L-1链霉素)中,置于37℃、含5% CO2的细胞培养箱中静置培养, 每2 d传代1次,并取对数生长期的细胞用于实验。
2.4AFM观察悬浮生长淋巴瘤细胞
2.4.1AFM扫描细胞样品的制备 ①制作多聚赖氨酸包被的盖玻片:称取12 mg的L-多聚赖氨酸,加6 mL灭菌的PBS,制备成2 g·L-1的多聚赖氨酸储液。在实验前,取1 mL L-多聚赖氨酸和1 mL PBS混合,放到培养皿中,加入用75%乙醇清洗过的盖玻片,室温浸泡2 h后,用三蒸水轻柔冲洗多余的L-多聚赖氨酸5次,将黏附处理过的盖玻片在酒精灯旁烤干,备用。②制作悬浮细胞AFM样品:1.5 mL的离心管收集6孔板(依次为对照组、加药各剂量组)中各孔培养的处于对数生长期的Raji细胞,800 r·min-1,离心3 min, 再用1 mL PBS洗涤1次细胞,离心弃PBS,再加1 mL PBS,制成细胞悬液,滴100 μL细胞悬液于上述制备好的L-Lys包被的盖玻片上,静置2 min, 用滤纸条吸走多余的PBS,加入100 μL 4%多聚甲醛固定液,固定15 mim, 用PBS冲洗5遍,三蒸水轻柔冲洗3遍,自然晾干。
2.4.2AFM 测定参数 扫描采用RTESP 硅的AFM针尖,扫描模式为轻敲模式,扫描频率为1 Hz,环境温度为25℃,湿度小于30%,图像处理采用AFM的脱机处理软件。
2.5光镜下细胞形态学观察分别将纳米雄黄和水飞雄黄配制成100 mg·L-1的PBS混悬液。将正常培养的Raji细胞传代至6孔板中培养,细胞密度为2.5×107·L-1,每孔接种细胞1.8 mL,在6孔板中培养24 h后,在给药孔中加入200 μL浓度为100 mg·L-1的纳米雄黄或水飞雄黄混悬液,使纳米雄黄或水飞雄黄对细胞的作用浓度为10 mg·L-1。分别在作用24、48、72 h后,对给药组和对照组进行显微镜拍照,观察细胞的聚集生长状态。
2.6MTT法检测Raji细胞增殖活力按MTT试剂盒的说明书操作,将生长活力良好的Raji细胞以每孔8 000个的密度铺在96孔板中,每孔细胞溶液为90 μL,待细胞生长12 h进入增殖期后,分别将配制好的梯度纳米雄黄或水飞雄黄混悬液依次加入各孔中,每个浓度的雄黄溶液均加入到6个复孔,每孔10 μL,其它步骤按说明书操作。将各组细胞培养44 h后,每孔加20 μL MTT,于培养箱继续培养4 h后,再每孔加入100 μL裂解液,在570 nm处测量各孔的吸光值。取6孔的平均值,按下列公式计算细胞生长存活率,实验重复3次。

2.7AFM观察Raji细胞的细胞膜表面细胞样品的制备和AFM的扫描参数与“2.4”相同。雄黄样品的配制与细胞给药方法与“2.5”相同,只是在共培养24 h时,将对照组细胞和给药组细胞用PBS洗涤,离心后收集,用多聚甲醛固定后,制成AFM细胞样品观察。
2.8TEM观察Raji细胞的超微结构将“2.5”中培养24 h的Raji细胞用PBS离心漂洗后,弃PBS,将沉积到离心管底部的细胞用2.5%戊二醛固定,制成电镜样品,于透射电镜下观察[13]。
2.9荧光显微镜观察Raji细胞的细胞核凋亡分别将处于对数生长期的Raji细胞吹成细胞悬液,依次接种1.8 mL Raji细胞悬液至6孔板中,使6孔板中各孔的细胞初始密度为每孔2.5×106个细胞。将载有细胞的6孔板在37℃、5% CO2的细胞培养箱中培养12 h后,将各孔细胞用含有纳米雄黄或水飞雄黄的培养基0.2 mL孵育,培养24 h后,离心,PBS洗涤2次,除掉多余的药物,浓缩细胞为100 μL,各组细胞混悬液中加入100 μL Hoechst 33258染液,染色10 min后,再将各组细胞用PBS洗2次,最后,将高度浓缩的细胞混悬液滴至载玻片上,甘油封片,置于荧光显微镜下观察[14]。
2.10流式双染检测Raji细胞的凋亡率取对数生长期的Raji细胞,加入终浓度均为10 mg·L-1的纳米雄黄和水飞雄黄,培养30 h。将上述细胞悬液离心,弃上清液,按照Annexin-Ⅴ-FITC/PI双染试剂盒操作。将细胞数调整到每毫升2×105~1×106个,在500 μL结合缓冲液中重新悬浮细胞,加入Annexin-V染液5 μL, 再加入PI染液5 μL,混匀并离心,于流式细胞仪上检测细胞凋亡率。
2.11Raji细胞周期变化的检测取对数生长期的细胞,以每孔1×106个的浓度接种于6孔板,实验分正常对照组、水飞雄黄组和纳米雄黄组,雄黄的终浓度为10 mg·L-1。作用30 h后,收集细胞,用PBS洗涤2次,70%冷乙醇-20℃冰箱固定过夜。固定后的细胞离心,弃上清,加入碘化丙啶(PI,终浓度为100 mg· L-1)和 RNase(终浓度为50 mg·L-1),4℃避光染色30 min后,流式细胞仪分析,并进行DNA倍体及细胞周期分析。

3 结果
3.1纳米雄黄的表征如Fig 1透射电镜结果所示,水飞雄黄的粒径在微米级,颗粒之间容易聚集;纳米雄黄颗粒是雄黄经长时间的低温球磨后得到的,粒径已经达到纳米级, 且颗粒分散性较好。如Fig 2所示,AFM的结果与TEM的结果相一致,Fig 2A、2C分别为水飞雄黄和纳米雄黄的高度图,Fig 2B、2D分别为水飞雄黄和纳米雄黄的三维图。如Fig 3所示,激光粒度仪检测的结果为水飞雄黄的粒径为(1.89±0.2)μm,PDI指数为(0.302±0.3);纳米雄黄的粒径为(79±8)nm,PDI指数为(0.278±0.2)。
3.2纳米雄黄和水飞雄黄对Raji细胞的抑制作用
3.2.1光镜实验 如Fig 4所示,培养24 h时,正常对照组Raji细胞呈通透的球形,表面不光滑,活力高的细胞聚集成团生长,呈葡萄状;水飞雄黄组的Raji细胞,细胞形态变化不明显,细胞数目略有减少;纳米雄黄组的Raji细胞,多数细胞孤立生长,细胞聚集生长状态完全被破坏,但单个细胞的折光性很好。培养48 h时,正常对照组Raji细胞,聚集生长的细胞数明显增多,成团块状生长,细胞的增殖活力大;水飞雄黄组的Raji细胞,细胞聚集生长的活力明显被抑制,只有少数的细胞聚集成串生长;纳米雄黄组的Raji细胞,细胞数量大幅减少,细胞折光性降低,细胞只有微弱的聚集生长能力。培养72 h时,正常对照组Raji细胞的数量持续增多,视野内均是聚集成大团块生长的细胞;水飞雄黄组的Raji细胞的数量略有增加,与正常对照组相比,细胞数量明显减少,只有少数细胞聚集生长,细胞生长受到了抑制。纳米雄黄组的Raji细胞的数量与相同培养时间的对照组和水飞雄黄组相比,细胞增殖数量最少,受到了最强的抑制杀伤作用,可看到一些细胞体积变小,皱缩,死亡。该结果证明了与相同剂量的水飞雄黄相比,纳米雄黄对Raji细胞的抑制作用更强,可明显抑制Raji细胞的聚集生长。
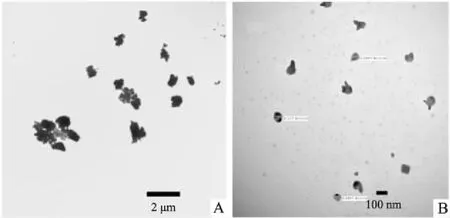
Fig 1 Characterization of crude realgar particles and realgar nanoparticles with TEM
A: Crude realgar particle; B: Realgar nanoparticles
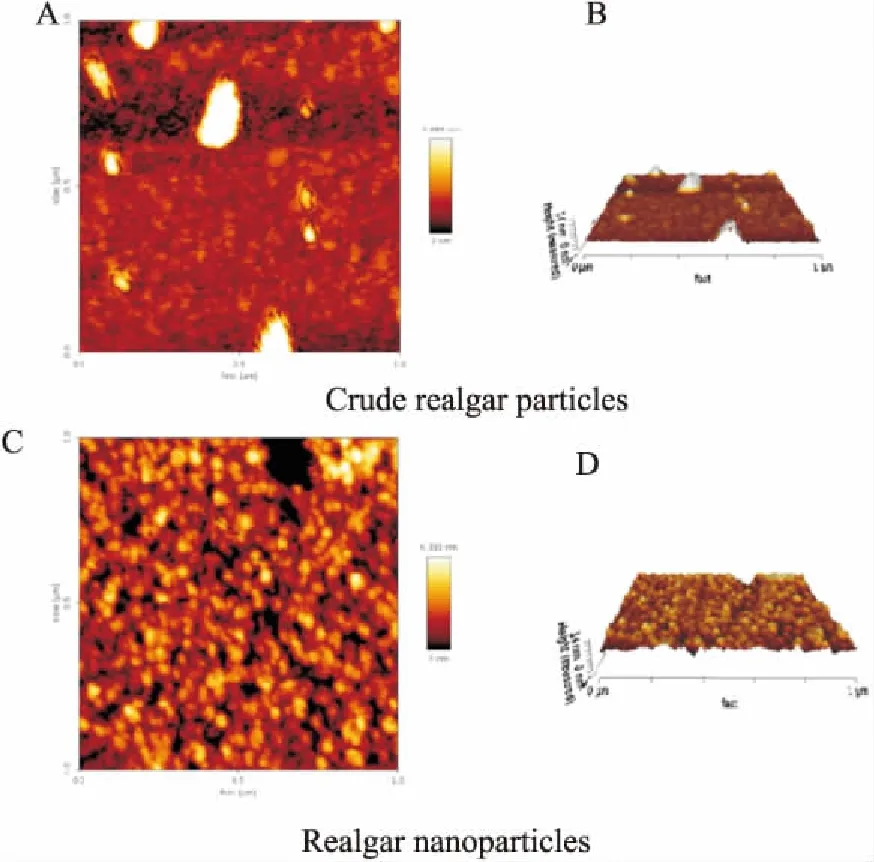
Fig 2 Characterization of crude realgar particles and realgar nanoparticles with AFM
A: Height image of crude realgar particles; B: 3D image of crude realgar particles; C: Height image of realgar nanoparticles; D: 3D image of realgar nanoparticles
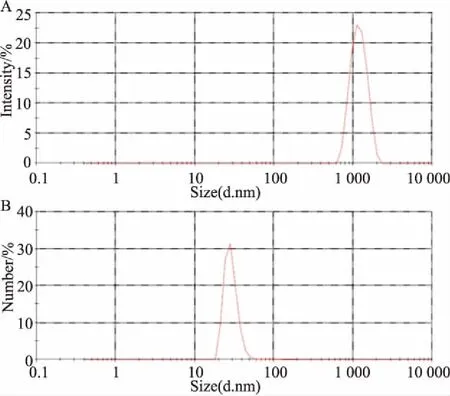
Fig 3 Particle size of crude realgar particles and realgar nanoparticles with laser particle size analyzer
A: Crude realgar particles; B: Realgar nanoparticles

Fig 4 Morphology of Raji cells under light microscopy
3.2.2AFM实验 如Fig 5所示,正常的Raji细胞为球形,细胞膜表面是粗糙的,细胞表面有孔洞,细胞膜表面还分泌有黏附物质向四周伸展,这是光镜所观察不到的,Fig 5A为高度图,Fig 5B为三维图,Fig 5C为正常的单个Raji细胞高度图,可清楚地看到向四周伸展的黏附物质,Fig 5D为单细胞三维图,可看到细胞膜表面有一些突起。相同剂量(10 mg· L-1)的纳米雄黄和水飞雄黄作用30 h后,水飞雄黄处理组的Raji细胞表面的黏附物质明显减少,这也是光镜下观察到细胞增殖受到抑制的原因(Fig 5E为高度图,Fig 5F为对应的三维图,Fig 5G为单细胞高度图,Fig 5H为单细胞对应的三维图)。纳米雄黄处理组的Raji细胞(Fig 5I为高度图,Fig 5J为对应的三维图)的体积明显皱缩,变小,单细胞图可见细胞凋亡(Fig 5K为高度图,Fig 5L为对应的三维图)。
3.2.3透射电镜实验 如Fig 6所示,正常的Raji细胞的细胞核和细胞器均未见异常,而纳米雄黄可引起Raji细胞内大量线粒体出现空泡,细胞核皱缩,而相同剂量的水飞雄黄对Raji细胞影响不明显。
3.2.4MTT实验 如Fig 7所示,纳米雄黄和水飞雄黄分别作用于Raji细胞24、48 h后,Raji细胞增殖抑制率明显升高,且呈现浓度和时间依赖性。24 h时,50 mg· L-1水飞雄黄作用下Raji细胞的存活率为(0.65±0.03)%,而相同剂量纳米雄黄作用下,Raji细胞的存活率为(0.40±0.02)%;48 h时,50 mg· L-1水飞雄黄作用下,Raji细胞的存活率为(0.42±0.02)%,而相同剂量纳米雄黄作用下,Raji细胞的存活率仅为0.10%。
3.2.5荧光显微镜实验 Fig 8为浓度均为10 mg· L-1的纳米雄黄和水飞雄黄与Raji细胞共培养30 h后,利用荧光显微镜观察到的Raji细胞核变化情况。正常Raji细胞核为圆形,没有高亮显示。在与水飞雄黄作用30 h后,Raji细胞的增殖数量与正常对照组相当,增殖能力未受到抑制,细胞核的变化不明显。与正常对照和水飞雄黄组相比,纳米雄黄与Raji细胞作用30 h后,细胞的数量明显降低,增殖的能力受到抑制,单个Raji细胞核明显皱缩,体积变小,细胞核密度分布不均匀,细胞核中部呈高亮显示,细胞核凋亡明显。
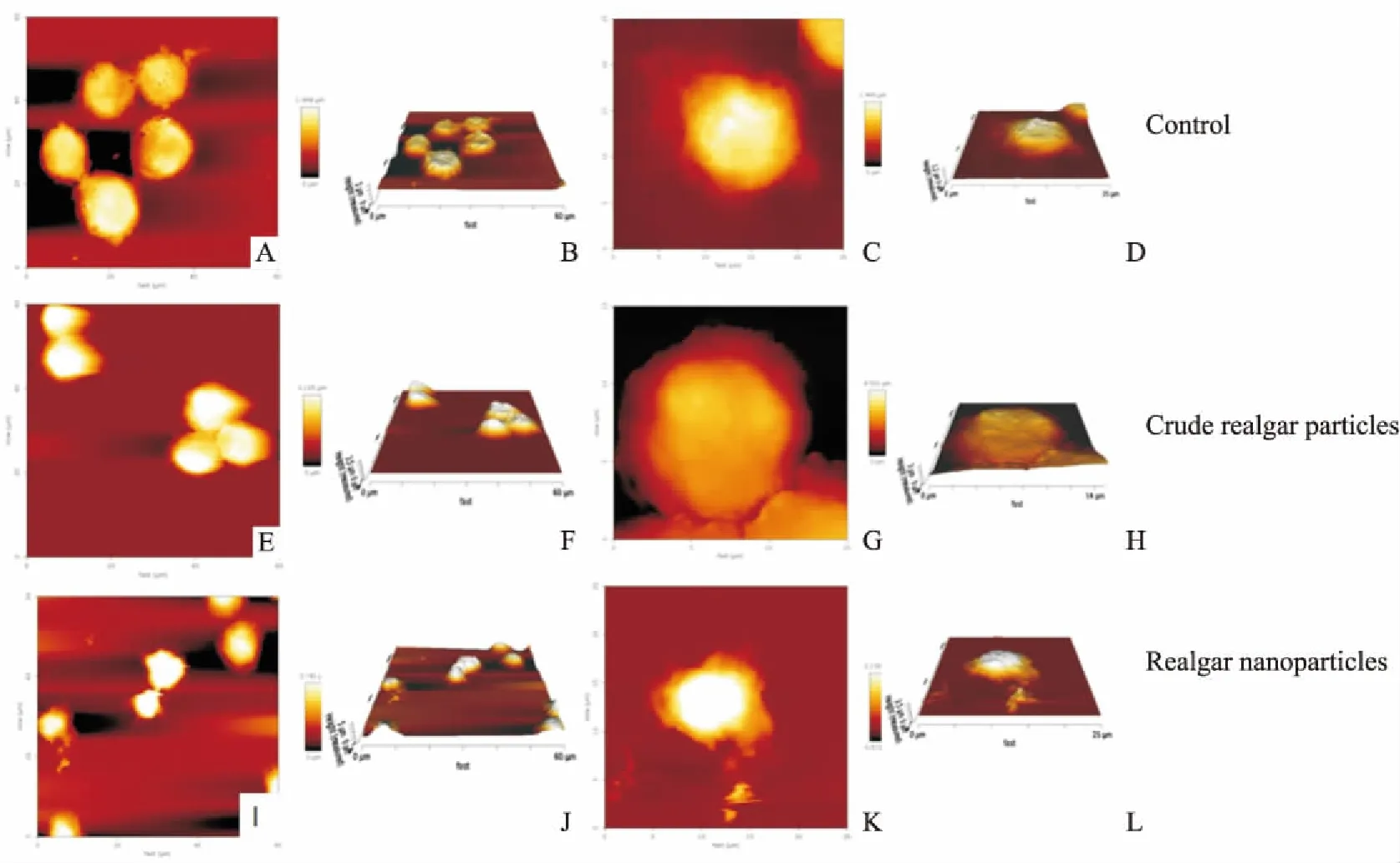
Fig 5 The membrane surface of Raji cells under AFM
A: Height image of control Raji cells; B: 3D images of control Raji cells; C: Height image of a single control Raji cell; D: 3D image of a single control Raji cell; E: Height image of Raji cells treated with crude realgar particles; F: 3D image of Raji cells treated with crude realgar particles; G: Height image of a single Raji cell treated with crude realgar particles; H: 3D image of a single Raji cell treated with crude realgar particles; I: Height image of Raji cells treated with realgar nanoparticles; J: 3D image of Raji cells treated with realgar nanoparticles; K: Height image of a single Raji cell treated with realgar nanoparticles; L: 3D image of a single Raji cell treated with realgar nanoparticles
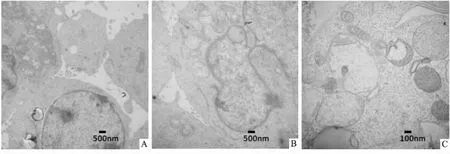
Fig 6 Ultra-microstructure of Raji cells under TEM A: Control; B: Crude realgar particles; C: Realgar nanoparticles

Fig 7 The cell viability of Raji cells with MTT
3.2.6流式细胞术检测细胞凋亡 Fig 9为纳米雄黄与水飞雄黄分别与Raji细胞共培养30 h后,用Annex-Ⅴ-FITC、PI双染色,流式细胞术检测到的Raji 细胞的凋亡率。正常的Raji细胞的早期凋亡率为3.44%,晚期凋亡率为2.46%。水飞雄黄作用30 h后,Raji细胞的早期凋亡率为5.17%,晚期凋亡率为5.97%,水飞雄黄作用下的Raji细胞总凋亡率为11.14%;纳米雄黄作用30 h后,Raji细胞的早期凋亡率为4.96%,晚期凋亡率为10.94%,纳米雄黄处理组的Raji细胞总凋亡率为15.9%。与正常对照组相比,纳米雄黄和水飞雄黄与Raji细胞作用30 h时, Raji细胞早期凋亡变化均不明显,纳米雄黄引起的晚期凋亡率明显升高。
3.2.7流式细胞术检测细胞周期分布 如Fig 10所示,10 mg· L-1纳米雄黄作用Raji细胞30 h后,在G1期的细胞为(88.37±3.89)%,G2期为(1.06±0.33)%,S期为(10.57±0.78)%;而相同剂量的水飞雄黄作用30 h后,G1期的细胞占(46.27±1.29)%,G2期为(24.89±0.82)%,S期为(28.84±1.05)%;对照组的细胞周期分布分别为G1期的细胞(40.12±2.16)%,G2期为(19.67±0.67)%,S期为(40.21±2.34)%。与水飞雄黄相比,纳米雄黄使Raji细胞在G1期的分布比例明显升高,S期分布比率下降。
4 讨论
早在1980年,我院以青黛、雄黄、丹参、太子参组方研制出的“复方黄黛片”,就以医院协定处方的形式用于临床各类白血病的治疗。上世纪90年代,我院科研团队进行了以雄黄、青黛为主要成分的复方黄黛片Ⅰ、II期及III期的系列研究,并于2009年7月获得国家食品药品监督管理局新药证书,且与As2O3相比,以其可经口服的独特优点而广泛地应用于急性早幼细胞白血病患者[15]。近年来,雄黄在抗肿瘤中的应用研究越来越广泛。除了对白血病细胞有很强的杀伤作用外,体外实验也证实雄黄对肝癌、乳腺癌、宫颈癌、卵巢癌等实体肿瘤也存在抑制肿瘤细胞生长及促进凋亡的作用。我们在前期的预实验中发现,相同剂量的纳米雄黄对淋巴瘤Raji细胞杀伤作用比对肺癌(A549)、肝癌(HepG2)和宫颈癌(HeLa)等贴壁癌细胞的作用强。由于广义的淋巴瘤是包括白血病的,水飞雄黄粒径大、生物利用度小,因此,我们近年尝试将复方黄黛的君药雄黄进行纳米化,以提高其生物利用度,考察其对淋巴瘤的治疗作用。因此,本研究以水飞雄黄为对照,直观地考察了纳米雄黄对B细胞淋巴瘤Raji细胞的形态学、细胞膜表面及其超微结构的影响。纳米雄黄可明显抑制Raji细胞的增殖,破坏细胞膜表面的黏附物质,破坏其亚细胞结构。在本研究中,我们只对雄黄抗Raji细胞的凋亡和周期影响做了初步的研究。
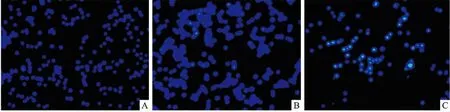
Fig 8 The nuclear apoptosis morphology of Raji cells measured with fluorescence microscope A: Control; B: Crude realgar particles; C: Realgar nanoparticles
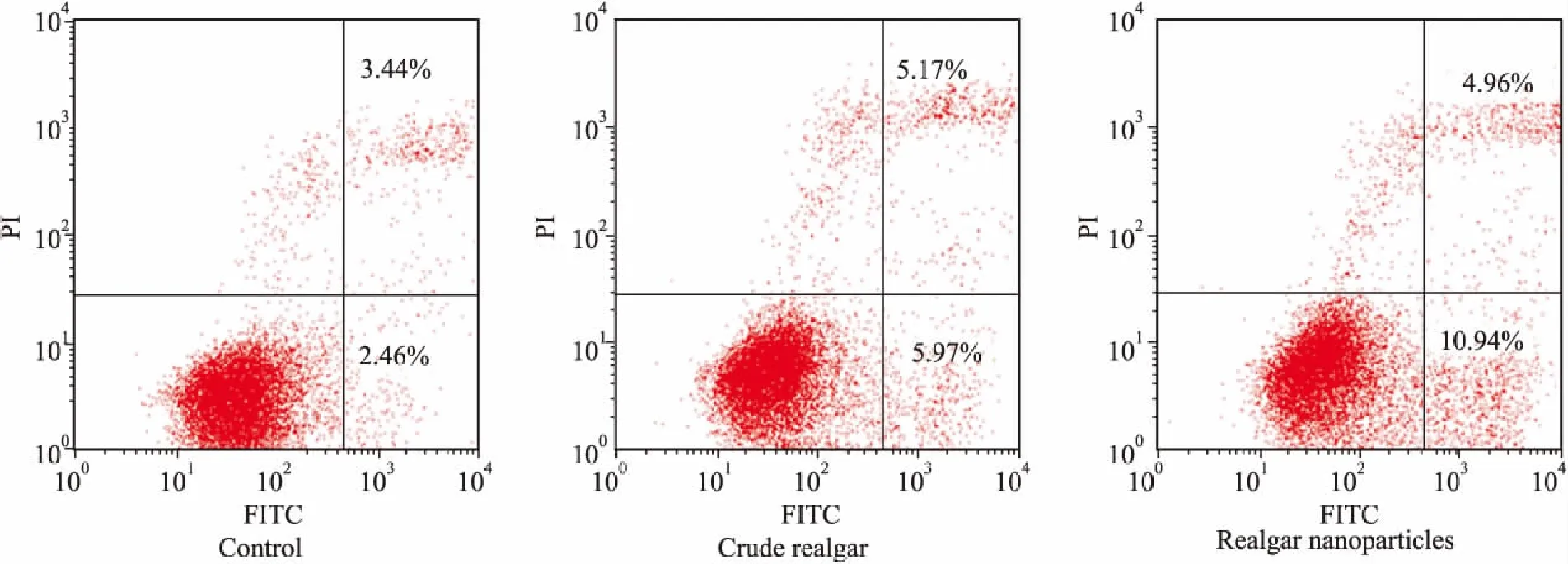
Fig 9 The apoptosis rates of Raji cell measured with Annex-Ⅴ-FITC, PI double staining
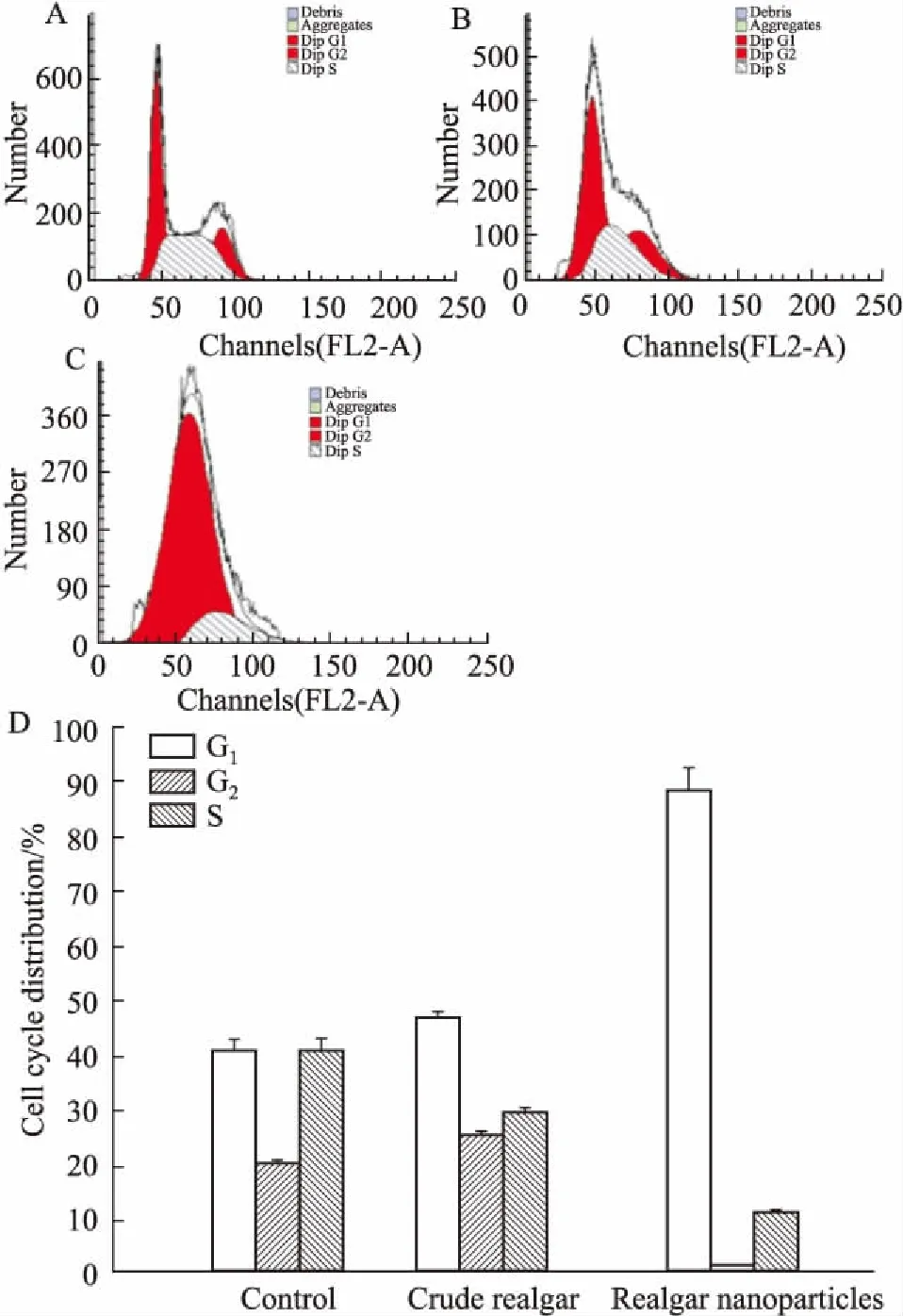
Fig 10 The cell cycle distribution of Raji cells measured with flow cytometry
A: Control; B: Crude realgar particles; C: Realgar nanoparticles; D: Cell cycle distributions of Raji cells.
通过光镜、AFM、TEM等显微学研究,我们发现纳米雄黄杀伤淋巴瘤的作用非常强大,但通过流式细胞术检测到细胞凋亡率仅为15.90%,说明雄黄杀伤Raji细胞的作用机制并不仅仅通过细胞凋亡的途径。我们在最近的研究中发现,纳米雄黄抗白血病K562细胞的机制是通过细胞凋亡和细胞自噬实现的[16]。文献报道,雄黄还可以下调多药耐药ABC家族基因的mRNA水平,降低化疗药物阿霉素(ADM)对耐药细胞系MCF-7/ADM细胞的IC50,部分逆转MCF-7/ADM细胞对阿霉素的抗药性,这就提示我们雄黄很可能是一种多药耐药抑制剂,在治疗肿瘤方面可发挥更好的疗效。因此,我们对纳米雄黄抗淋巴瘤的机制研究要从多条途径进行研究。关于纳米雄黄抗白血病、淋巴瘤等肿瘤的机制研究,要结合抗多药耐药、抗肿瘤干细胞的研究进行,目前,该项研究正在进行中。本研究重点是对纳米雄黄和水飞雄黄进行比较,对淋巴瘤细胞杀伤作用的形态学、超微结构等细胞和亚细胞水平的研究。
临床中用到的雄黄复方制剂是粒径在微米级的雄黄,存在临床用药量大、生物利用度低等缺点。采用物理或化学的方法制备纳米雄黄,将雄黄粒径控制在100~200 nm之间是较理想的粒径范围。处于这个粒径范围的纳米雄黄还具有淋巴趋向性和肿瘤表面吸附性,可以依靠肿瘤部位的生理、病理特点,使纳米雄黄能够有效蓄积在肿瘤部位,发挥被动靶向肿瘤组织的作用,这一特点在后期体内研究和临床研究中会有所体现。
本研究中的淋巴瘤Raji细胞是一种悬浮生长的细胞,在制备AFM样品时,需要将细胞先固定在基底上,再进行扫描。本研究中用自制的多聚赖氨酸黏附的玻璃片很好地解决了悬浮细胞的固定问题,可用于其他悬浮细胞AFM扫描。
尽管对纳米雄黄研究仍停留在实验阶段,离临床应用仍有相当距离。但该研究可为B细胞淋巴瘤的治疗提供理论依据。随着科技进步和研究的不断深入,相信不久的将来,纳米雄黄将成为高效低毒的临床常用高品质药物。
(致谢:该研究关于纳米雄黄细胞学部分完成于军事医学科学院张英鸽教授纳米药理毒理实验室,在此由衷感谢!)
[1] Sun J, Yang Q, Lu Z, et al. Distribution of lymphoid neoplasms in China: analysis of 4,638 cases according to the World Health Organization classification[J].AmJClinPathol, 2012,138:429-34.
[2] Cheah C Y, Fowler N H, Wang M L. Breakthrough therapies in B-cell non-Hodgkin lymphoma[J].AnnOncol, 2016,27(5):778-87.
[3] Shetty R K, Adams B H, Tun H W, et al. Use of rituximab for periocular and intraocular mucosa-associated lymphoid tissue lymphoma [J].OculImmunolInflamm, 2010,18(2):110-22.
[4] Esmaeli B, McLaughlin P, Pro B, et al. Prospective trial of targeted radioimmunotherapy with Y-90 ibritumomab tiuxetan(Zevalin) for front-line treatment of early-stage extranodal indolent ocular adnexal lymphoma[J].AnnOncol, 2009,20(4):709-14.
[5] 王晓波,袭荣刚,石 炎,等. 纳米级雄黄制备工艺的优化研究[J]. 解放军药学报,2008,24(6):471- 4.
[5] Wang X B, Xi R G, Shi Y, et al. Study on the optimization of the preparation of realgar nanoparticles[J].PharmJChinPLA, 2008,24(6):471-4.
[6] 王晓波, 石 焱, 袭荣刚, 等. 纳米雄黄的粒度分析方法[J]. 药学服务与研究, 2009,9(1): 52-4.
[6] Wang X B, Shi Y, Xi R G, et al. Particle size analysis methods of realgar nanoparticles[J].PharmCareRes, 2009,9(1): 52-4.
[7] Tian Y, Wang X B, Xi R G,et al. Enhanced antitumor activity of realgar mediated by milling it into nanosize[J].IntJNanomedicine, 2014,9(1):745-57.
[8] 周思彤,王永胜,易 娟,等. 纳米雄黄对白血病 K562 细胞及其干细胞的凋亡诱导作用[J]. 中药药理与临床, 2013,29(2):105-8.
[8] Zhou S T, Wang Y S, Yi J. The effect of apoptosis on leukemia K562 cells and stem cells induced by realgar nanoparticles[J].PharmacolClinChinMaterMed, 2013,29(2):105-8.
[9] 王 栋,周乐杜,曾 鹏,等. 纯化纳米雄黄制备方法探讨[J]. 中南药学, 2014,12(3):234-7.
[9] Wang D, Zhou L D, Zeng P, et al. The investigations of the purification methods of realgar nanoparticles[J].CentSouthPharm, 2014,12(3):234-7.
[10] Xi R G, Huang J, Li D, et al. Roles of PI3K/Akt pathways in nanoparticle realgar powders-inducedapoptosis in U937 cells [J].ActaPharmacolSin, 200829(3): 355-63.
[11] Wang X B, Gao H Y, Hou B L, et al. Roles of PI3K/Akt pathways in nanoparticle realgar powders-induced human histocytic lymphoma U937 cell death [J].ArchPharmRes, 2007,5(30):653-8.
[12] 李彩丽, 陈 静, 王 蓓, 等. 自噬在As2O3诱导Burkitt淋巴瘤Raji细胞死亡中的作用及机制研究[J]. 中国药理学通报, 2014,30(5): 719-24.
[12] Li C L, Chen J, Wang B, et al. Role and mechanism of autophagy in the arsenic trioxide induced death of Burkitt lymphoma Raji cells [J].ChinPharmacolBull, 2014,30(5): 719-24.
[13] 赵大海, 陆友金. 抑制自噬促进培美曲塞对A549细胞的增殖抑制作用[J]. 中国药理学通报, 2015,31(5):664-8.
[13] Zhao D H, Lu Y J. Autophagy inhibition facilitates the anti-proliferative effect of pemetrexed on A549 cells [J].ChinPharmacolBull, 2015,31(5): 664-8.
[14] 刘思妤,古 彬, 卢新华, 等.瓜蒌皮提取物对高糖诱导人脐静脉内皮细胞凋亡的影响及机制研究[J]. 中国药理学通报, 2015,31(7):988-93.
[14] Liu S Y, Gu B, Lu X H, et al. Effects of extractive pericarpium trichosanthes on apoptosis of HUVECs induced by high glucose[J].ChinPharmacolBull, 2015,31(7):988-93.
[15] 王晓波,黄世林. 复方黄黛制剂临床与作用机理[M]. 北京: 北京科学技术出版社, 2011.
[15] Wang X B, Huang S L.TheclinicalandmechanismofFuFangHuangDai[M]. Beijing: Beijing Science and Technology Press, 2011.
[16] Shi D, Liu Y, Xi R G, et al. Caveolin-1 contributes to realgar nanoparticle therapy in human chronic myelogenous leukemia K562 cells [J].IntJNanomedicine, 2016,11: 5823-35.

