Ets转录因子的生理作用研究进展
曾 红,杨 洋,安 输,郭晓汐,郝 倩,徐天瑞,刘 莹
(昆明理工大学生命科学与技术学院细胞信号传导实验室,云南 昆明 650500)
人们最早在鸟骨髓成红细胞增多症病毒E26所表达的融合蛋白中发现了癌基因v-ets。随后,一系列细胞Ets(c-ets)基因被发现,这些Ets基因与E26具有高度保守的同源序列[1]。并根据E26(E-Twenty-Six)的英文缩写而将该基因命名为Ets。Ets家族是细胞内最大的转录调控因子家族之一,该家族共包含30多个成员,大多数成员具有促进细胞增殖、分化、抑制细胞凋亡及细胞与细胞间的相互作用等生物学功能,在人类重要的生理和病理过程中发挥调控作用[2]。内皮细胞的迁移、增殖、管腔形态的分化,将导致肿瘤的血管生成。近年来的研究发现,Ets家族成员Ets-1参与调控肿瘤的血管生成,在肿瘤的发生和转移过程中扮演了非常重要的角色[1]。因此,研究Ets家族的生理作用,对肿瘤的临床治疗具有一定的理论指导作用。本文将对Ets转录因子家族的结构、分类、生物学特性、生理功能及其作用机制作一综述。
1 Ets家族的组成及结构
Ets转录因子家族由原癌基因v-ets编码,迄今已发现了30多个家族成员,包括:Ets-1、Ets-2、GABPα(GA-binding protein alpha)、Spi-1(salmonella pathogenicity island 1)等(Fig 1)。Ets转录因子家族通常包含两个主要的功能域:转录激活域(AD)和DNA结合域(Ets结构域)[3]。DNA结合域的结构特征为该结构域由85个氨基酸残基组成,定位于蛋白的羧基末端,由3个α-螺旋(α1-α3)和4个β-折叠(β1-β4)按照α1-β1-β2-α2-α3-β3-β4 的方式形成螺旋-转角-螺旋(winged helix-tum-helix, wHTH)这一独特的结构。由精氨酸和赖氨酸残基组成的DNA结合域可识别并结合GGAA/T这一富含嘌呤的DNA核心序列,该序列存在于许多基因的5′-侧翼调节区,具有反式激活功能。DNA结构域具有高度保守性,能够与特定序列结合并调控靶基因的表达和功能。例如,通过调节细胞的增殖、分化、凋亡及细胞与细胞间相互作用,进而调控许多生理和病理过程[1]。根据Ets结构域氨基酸序列的相似程度、位置和具有亚群特异性的氨基酸序列,人们将Ets基因家族分为Ets、Erg(Ets-related gene)、PEA3(polyomavirus enhancer activator 3)等多个亚族,其中Ets-Ⅰ是迄今研究较多的一个成员(Fig 1)。许多Ets结合域存在自身调节,导致DNA结合活性受到抑制。通常Ets结合域功能可被AML-1/CBFβ2增强,而被CAMKⅡ抑制[4]。Ets家族大部分成员都是转录激活因子,少部分是转录抑制因子,如TEL、TCF,少量既有转录激活又具有转录抑制作用的因子,如ELF4既可以转录激活炎症因子白细胞介素-8(interleukin-8, IL-8)的表达,也可以转录抑制IL-8的表达[5]。
2 Ets家族成员的生理作用
2.1Ets家族成员调节胚胎发育近年来,人们对Ets转录因子在胚胎不同阶段及成年后的表达模式有了较为全面的了解。Ets家族许多成员从细胞、组织、器官不同水平调控发育过程,尤其是在哺乳动物胚胎期和成年期的血液生成过程中发挥重要的调控作用[2]。在早期脊椎动物胚胎发生过程中,至少有13个Ets基因Ets-1、Ets-2、ETV2、ETV6、Fli-1、Erg、FEV、GABPα、Elf-1、Elf-2、Spi-1、Spi-B和Elk-4在造血或内皮细胞中表达[6]。此外,Ets-1蛋白在正常月经周期子宫内膜腺体中几乎呈阴性表达,而在子宫内膜血管上皮细胞呈阳性表达,并与mRNA表达水平一致,并且在排卵期表达最强,分泌期逐渐下降,提示Ets-1可能参与胚胎植入[1]。研究表明,Ets-2做为一个重要的转录因子,调控胚胎滋养层细胞的迁移和分化[2]。此外,在小鼠胚胎着床前,ESE-1高表达,而且当ESE-1缺失时,小鼠胚胎死亡率达到30%[7]。TEL基因亦是Ets家族成员之一,在TEL-/-小鼠中,发现卵黄囊受损,胚胎间充质细胞和神经细胞发生凋亡;2/3的胚胎组织缺乏卵黄囊血管,说明TEL与卵黄囊发育关系密切[8]。
2.2Ets家族成员调节细胞的生长Ets家族能够调控许多细胞特异性生长因子的表达,并调节生长因子受体和整合素家族介导的细胞增殖过程。细胞受到生长因子刺激后,大多数Ets家族蛋白会发生磷酸化,进而影响该家族成员的DNA结合活性、转录活性以及与其他转录因子的相互作用[9]。细胞对外界环境刺激做出的反应是由一系列级联信号将细胞外的信号从配体激活的细胞表面受体传导到核内。因此,Ets家族成员可以作为上游信号通路的效应器和下游信号转导通路的启动器。生长因子及其受体发出的信号最后通过MAP激酶或JAK/STAT信号,调节Ets家族蛋白的功能活性[2,9]。
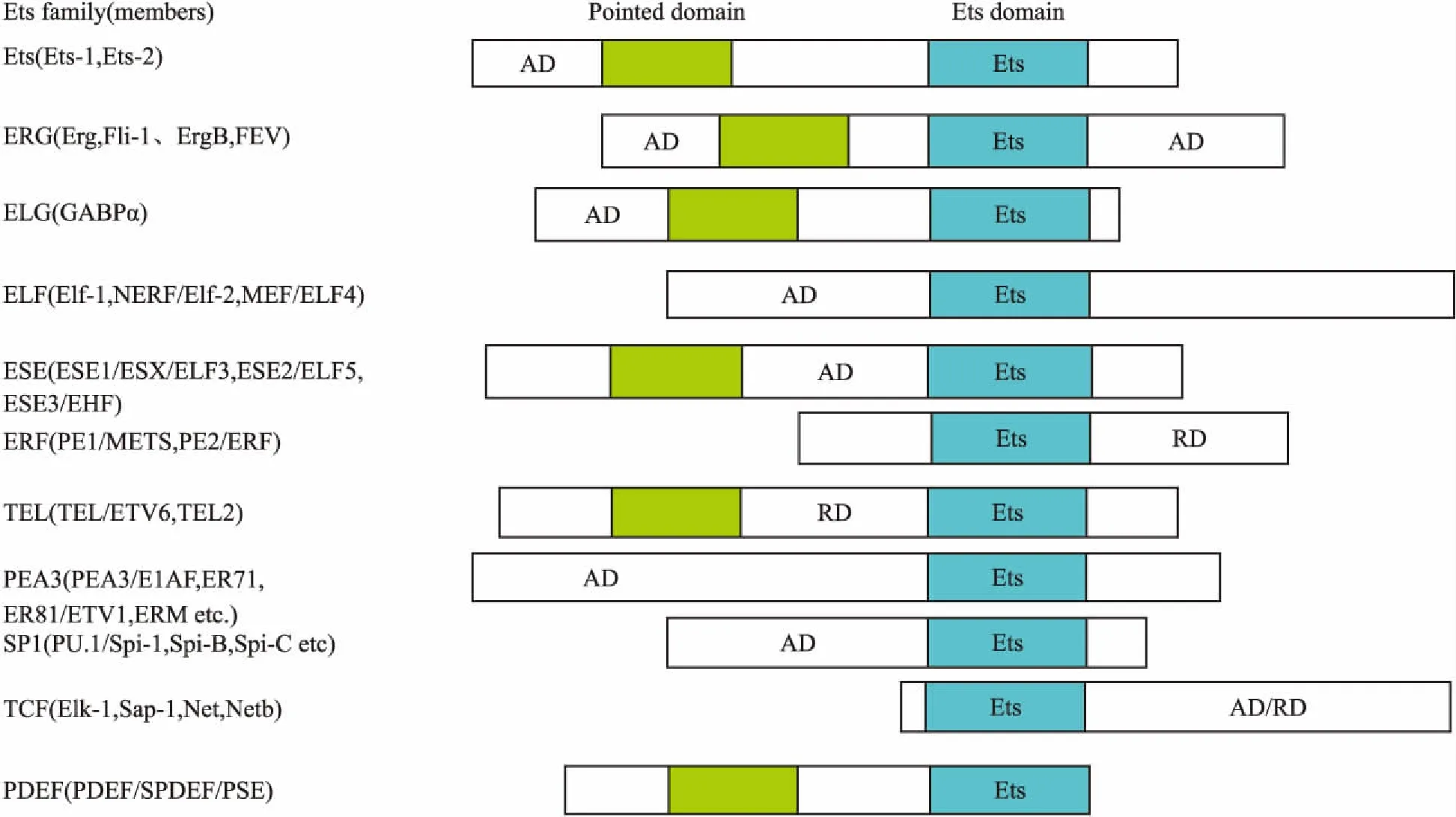
Fig 1 Classification of Ets family
Pointed domain: helix-loop-helix; Ets domain:DNA binding domain; AD: transcriptional activation domain; RD: transcriptional repression domain
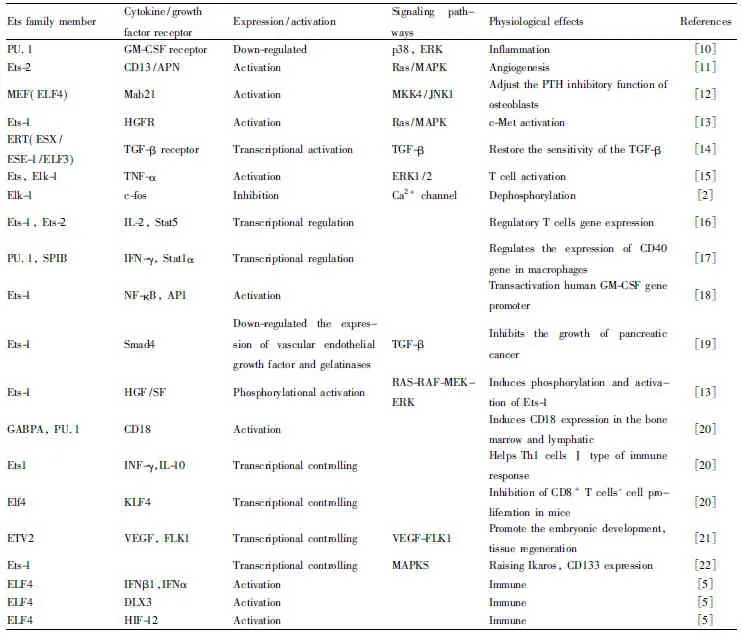
Tab 1 Regulation of Ets family members on growth factors and their receptors
HGF/SF: hepatocyte growth factor/scatter factor; Mab21: osteoblast differentiation inhibitory transcription factor; PTH: parathyroid hormone; KLF4:Krüppel like factor 4; FLK1: endothelial growth factor receptor; Ikaros: a specific lymphocyte transcription factor; DLX3: homeobox transcription factor 3
Ets家族蛋白参与调控细胞因子及其受体的表达或者激活,包括粒细胞巨噬细胞刺激因子受体(granulocyte macrophage stimulating factor receptor, GM-CSF受体)[10]、CD13/氨基肽酶N受体(CD13/APN receptor)[11]、成骨细胞分化转录抑制因子Mab21[12]、肝细胞生长因子受体(hepatocyte growth factor receptor, HGFR)[13]、即刻早期基因(c-fos)[2]、转化生长因子-β(transforming growth factor-β, TGF-β)受体[14]等(Tab 1)。
2.2.1对粒细胞巨噬细胞集落刺激因子(GM-CSF)的调控 Toll样受体(Toll-like receptors, TLR)是细菌或病毒化合物等微生物制剂的关键传感器,这些受体在炎症诱导中起关键作用,如感染性或慢性炎症性疾病。研究人员已对粒细胞巨噬细胞集落刺激因子(granulocyte-macrophage colony-stimulating factor, GM-CSF)在促进发热性中性粒细胞减少、克服患败血症相关的中性粒细胞减少、骨髓单核细胞免疫缺陷的免疫抑制能力进行了广泛的研究。人类单核细胞中,GM-CSF通过PU.1(同Spi-1),呈时间和剂量依赖性的方式,下调TLR1、TLR2、TLR4的表达,降低病原体识别受体的表达,并伴随着下游p38和细胞外信号调节激酶(extracellular regulated protein kinase, ERK)的表达下调,同时促进脂磷壁酸(lipoteichoic acid, LTA)和脂多糖(lipopolysaccharides, LPS)的结合,从而诱导受损炎症因子的产生[10]。
2.2.2对CD13/氨基肽酶N(CD13/APN)的调控 CD13/APN是一种重要的体内和体外血管生成调节因子。Ets家族中的一些转录因子在血管生成中发挥重要的调控作用,如Ets-1、Ets-2、Fli-1、Erg、NERF。在内皮细胞中,Ets-2的表达明显高于Ets-1。Ets-2发生酸磷化,激活Ras/MAPK通路,通过Ets结合域反式激活CD13/APN启动子活性,进而诱导CD13/APN基因转录[11]。
2.2.3对成骨细胞分化转录抑制因子Mab21的调控 应用甲状旁腺激素(parathyroid hormone, PTH)的连续治疗,或由原发性甲状旁腺功能亢进导致的过量内源性PTH分泌,会导致骨吸收增加,继而骨量减少。MEF(myeloid Elf-1-like factor)不仅抑制成骨细胞的分化,而且增加成骨细胞分化转录抑制因子Mab21的表达。过表达的MEF抑制了成骨细胞相关基因的表达,如碱性磷酸酶(alkaline phosphatase, ALP)、远端缺失同源盒5(distal-less homeobox 5, DLX5)、骨桥蛋白(osteopontin, OP)和骨钙素(osteocalcin, OC)。此外,MEF的特异性表达将通过抑制成骨细胞和促进破骨细胞形成,引起骨质疏松。研究发现,PTH通过激活丝裂原活化蛋白激酶激酶4/c-Jun氨基末端激酶(mitogen- activated protein kinase kinase 4/c-Jun N-teminal kinase 1, MKK4/JNK1),活化MEF,进而上调Mab21的表达,最终发挥其在成骨细胞分化中的抑制作用[12]。
2.2.4对肝细胞生长因子受体(HGFR)的调控 在巨噬细胞中,LPS刺激肿瘤坏死因子-α(tumor necrosis factor α, TNF-α)基因表达时,TNF-α启动子元件与Ets-1和Elk-1结合是必需的,该过程依赖细胞外信号调节ERK激酶活性。肝细胞生长因子(hepatocyte growth factor, HGF)刺激下,Ets-1促进肝细胞生长因子受体c-Met的表达,HGF诱导c-ets-1的转录过程主要依赖活化Ras/MAPK信号通路实现。以上结果表明,Ets-1是c-Met上游的关键调节因子。进一步研究发现,HGF通过诱导Ets-1 38位的苏氨酸磷酸化,进而活化ERK1 MAPK,发挥调控作用[13]。
2.2.5对早期表达基因(c-fos)基因的调控 Ca2+依赖的信号通路和MAPK通路均可以通过磷酸化作用调节Ets-1的活性。Ca2+依赖性信号通路的磷酸化位点位于Ets-1 DNA结合域附近第7外显子编码区的6个丝氨酸残基上。对6个丝氨酸的研究发现,与野生型丝氨酸相比,丝氨酸突变为丙氨酸后,Ets-1 DNA结合域的结合能力明显降低,Ca2+依赖的Ets-1磷酸化作用被抑制。与此一致的研究表明,Ets-1的7号外显子缺失,而其他6个磷酸化位点并未发生突变时,其DNA结合域的DNA结合能力比全长Ets-1明显增加。磷酸化作用抑制Ets-1与DNA结合的机制在于,磷酸化作用后可增加Ets-1折叠构象的稳定性,从而阻断其与DNA结合。Ca2+参与的信号通路既可以抑制Ets-1和DNA结合,亦可以对Elk-1活性进行负凋节。而Elk-1是MAPK级联反应的底物,MAPK级联反应能够诱导Elk-1磷酸化,进而Elk-1和血清响应因子(serum response factor, SRF)共同作用,激活c-fos的启动子。相反地,Ca2+/CaM激活的丝氨酸/苏氨酸磷酸酶(calcineuin)介导Elk-1的去磷酸化,并抑制其对c-fos启动子的作用,通过复杂的调控网络调节Elk-1的活性和功能[2]。
2.2.6对转化生长因子-β受体Ⅱ(TGF-β RⅡ)的调控 TGF-β介导了生长抑制[23],它涉及了一条由细胞表面受体和中间信号蛋白组成的复杂信号通路。TGF-β表面受体包含RI和RII两种亚型,TGF-β Ⅱ型受体的正常表达对于TGF-β介导的信号转导和细胞生长抑制作用至关重要。TGF-β配体与RII结合可以诱导RI反式磷酸化,从而启动信号转导级联反应。细胞表面受体失活将导致TGF-β抗增殖能力无效、细胞增殖失控,最终导致许多癌症的发生,比如肠癌、胃癌、乳腺癌等。Chang等[14]利用逆转录病毒传递技术,发现过表达的ERT能够提高TGF-β RⅡ表达,从而恢复Hs578T乳腺癌细胞对TGF-β的敏感性。
2.3Ets家族成员调节细胞的分化Ets家族蛋白参与调节许多细胞的分化,例如浆细胞、造血细胞、神经细胞、肌原和骨原细胞、血管内皮细胞等[9]。研究发现,Ets-1在B细胞和淋巴器官中高表达,并且抑制浆细胞的分化[20]。PU.1在髓样细胞如粒白细胞、红细胞和巨核细胞中高表达,促进细胞的增殖和分化,抑制成红血细胞分化为红细胞。此外,PU.1在成红血细胞中高表达能诱导其无限生长,而后转化为红白血病。TEL在胚胎的卵黄囊和成人的血细胞生成过程中发挥促进血管生成的作用[8]。据报道,巨噬细胞中TEL的过表达可抑制其分化,加速红系的分化,其机制可能与TEL和Fli-1之间的相互作用相关[24]。另一研究发现[1],血管生成需要内皮细胞出芽、管腔形成和小管生成,该过程是一个复杂的过程,通过不同的转录因子的协同作用完成。许多转录因子参与了血管的发展,并且大多数没有内皮特异性。这些转录因子之间的相互作用能促进血管内皮细胞的分化以及获得动脉,静脉和淋巴的属性。转录因子两大家庭——Foxs(forkhead box factors)和Ets,在该过程中发挥了重要的调控作用,它们参与胚胎和成人血管生成。Foxs能够抑制内皮细胞过度生长,诱导胚胎和成年小鼠内皮细胞凋亡。Ets因子则主要参与早期内皮细胞分化与血管生成。Ets家族的许多成员在早期发展的脉管系统中表达,几乎所有的内皮细胞特异性基因启动子中都存在Ets结合结构域。
Ets家族蛋白亦可以参与调节软骨和骨的形成过程。检测结果表明,Ets-1在前成骨细胞中高表达,而在分化成熟的成骨细胞中只检测到Ets-2 的表达。此外,Erg-1、ck-erg被证明是颅骨发育的重要调节因子[1]。ELF4通过促进脂肪细胞分化而抑制成骨细胞的形成,其具体的机制是过氧化物酶体增生物激活受体γ(peroxisome proliferator-activated receptor γ, PPAR γ)失活导致骨丢失和骨髓肥胖的增加,而ELF4能够结合并激活PPAR γ,促进脂肪细胞分化[5]。
2.4Ets家族成员参与细胞的凋亡部分Ets家族成员已被证明参与细胞凋亡过程,Ets家族的大多数成员表现为抗凋亡作用。Ets-1通过GGAA元件调节p21启动子转录,进而调控血管平滑肌细胞凋亡[25];然而,在血管平滑肌细胞中,Ets-1通过p21旁路系统,发挥抑制细胞凋亡和促进细胞增殖的作用。近期研究发现,缺氧能快速诱导Ets-1表达,随后Ets-1通过调控其下游血管内皮生长因子(vascular endothelial growth factor, VEGF)、尿激酶纤维蛋白溶酶原激活剂(uridylyl phosphate adenosine, uPA)和基质金属蛋白酶(matrix metalloproteinases, MMP)等一系列“缺氧基因”的表达,增加细胞对缺氧的耐受[26],Ets-1对缺氧诱导的胰岛β-细胞凋亡起到保护作用。PU.1+/-Spi-B-/-的老鼠体内实验表明,Rel/NF-κB家族的成员c-rel的表达明显降低,并且在B细胞中PU.1和Spi-B反式激活c-rel的启动子[12]。宋伟等[27]在红白血病的前期工作中取得重要突破,发现在红白血病细胞系中Fli-1发挥促进细胞增殖,抑制细胞凋亡的作用。深入研究发现,含有SH2结构的5′肌醇磷酸酶-1(SH2-containing inositol phosphatase-1,SHIP-1)为Fli-1直接调控的靶基因,Fli-1通过抑制SHIP-1的转录活性,抑制红细胞分化,诱导红白血病的发生。这些研究表明,Fli-1在肿瘤发生、发展中具有癌基因的功能,提示其可能是一个潜在的治疗靶点。
另一方面,Ets家族成员Ets-1和Ets-2在一定条件下表现为促凋亡作用。凋亡抑制基因(survivin)是目前发现的凋亡抑制蛋白(inhibitor of apoptosis protein, IAP) 中最强的凋亡抑制因子。杨东霞等[28]报道,Elf-1在非小细胞肺癌中的表达与survivin呈正相关,并采用免疫组化及原位末端标记法(TUNEL) 证明 Elf-1 在非小细胞肺癌组中表达,且与肿瘤细胞的凋亡呈负相关。PU.l可能通过抑制癌基因c-myc和抗凋亡因子Bcl-2 基因表达、诱导钙依赖钙调蛋白激酶样激酶(calmodulin-dependent protein kinases or CaM kinases, CKLiK)活化或抑制PU.l与cAMP反应元件结合,介导小鼠红白血病(mouse erythroleukemia, MEL)细胞的生长抑制以及凋亡的发生[24]。此外,Ets-1还可以促进BH3结构域凋亡诱导蛋白(BH3 interacting death agonist, Bid)、细胞色素 P450、caspase-4、细胞周期依赖性激酶抑制因子p27和细胞周期依赖性激酶抑制因子p21等凋亡相关基因的表达上调,抗凋亡基因如抗细胞凋亡因子-1(defender against cell death 1, DAD-1)、环氧合酶-2 (cyclooxygenase-2, COX-2)、AXL受体酪氨酸激酶(AXL receptor tyrosine kinase, AXL)、凋亡抑制蛋白2(inhibitor of apoptosis protein 2, IAP-2)和MDM2癌基因等表达下调,促进内皮细胞凋亡[1,29]。
因此,Ets家族中部分成员不仅可以单独调控细胞生长、分化和凋亡过程,而且可以同时调控两种或以上过程。如Ets-1、Ets-2在不同时期或不同细胞中可发挥不同的作用。Ets家族成员在同种细胞的不同时期,也有可能发挥不同的转录调控作用。
3 展望
本文主要总结了Ets家族成员在胚胎发育、细胞生长、分化、凋亡等过程中的调控作用,以及该家族成员在生理和病理过程中的调节作用。研究Ets家族成员参与的生物学过程有助于了解人类疾病,尤其是癌症的发生与发展过程。在了解癌症的分子基础后,对以后癌症的早期检测、诊断、预防以及新的治疗策略提供可能。目前的研究主要集中在转录抑制Ets-1,从而抑制其下游多种基因所介导的肿瘤细胞浸润转移、血管生成及增殖等[30]。相信在不久的将来,人们通过对Ets家族转录因子的深入研究,对其在癌症发生发展中的作用机制更加明确,为指导临床应用、癌症基因治疗提供新靶点。虽然Ets家族各成员在人体生理和病理过程中的重要作用已被逐渐证实,但具体的机制尚不清楚,比如Ets家族调控的信号通路及作用的靶基因等。因此,通过阐明已知的Ets家族基因及其靶基因的相互作用,并进一步研究新的与Ets家族成员相互作用的基因,有助于了解Ets家族成员在生理病理过程以及恶性肿瘤中的发展规律,并在分子水平为肿瘤的研究和临床的诊断治疗提供新的理论依据。
[1] 肖晓辉, 温海霞, 刘国艺.Ets转录因子家族的研究进展[J].哈尔滨医科大学学报,2008,42(2):211-2.
[1] Xiao X H, Wen H X, Liu G Y. Research progress of Ets transcription factor family[J].JHarbinMedUniv, 2008,42(2):211-2.
[2] 张 健,高福禄,刘芝华.Ets转录因子家族在发育和肿瘤发生中作用的研究进展[J].世界华人消化杂志,2003,11(10):1624-7.
[2] Zhang J, Gao F L, Liu Z H. Progress in the role of Ets transcription factor family in development and tumorigenesis[J].WorldChinJDigestol, 2003,11(10):1624-7.
[3] Russell L, Garrett-Sinha L A. Transcription factor Ets-1 in cytokine and chemokine gene regulation[J].Cytokine, 2010,51(3):217-26.
[4] Sharrocks A D, Brown A L, Yan L, et al. The ETS-domain transcription factor family[J].IntJBiochemCellBiol, 1997,29(12):1371-87.
[5] Suico M A, Shuto T, Kai H. Roles and regulations of the ETS transcription factor ELF4/MEF[J].JMolCellBiol, 2017,9(3):168-77.
[6] Craig M P, Sumanas S. ETS transcription factors in embryonic vascular development[J].Angiogenesis, 2016,19(3):275-85.
[7] Mi L C, Jing W, Yi X, et al. ESE-1 in early development: approaches for the future[J].FrontCellDevBiol, 2016,4:73.
[8] Wang L C, Kuo F, Fujiwara Y, et al. Yolk sac angiogenic defect and intra-embryonic apoptosis in mice lacking the Ets-related factor TEL[J].EMBOJ, 2014,16(14):4374-83.
[9] Oikawa T, Yamada T. Molecular biology of the Ets family of transcription factors[J].Gene, 2003,303(1-2):11-34.
[10] Sadeghi K, Wisgrill L, Wessely I, et al. GM-CSF down-regulates TLR expression via the transcription factor PU.1 in human monocytes[J].PLoSOne, 2016,11(10):e0162667.
[11] Petrovic N, Bhagwat S V, Ratzan W J, et al. CD13/APN transcription is induced by RAS/MAPK-mediated phosphorylation of Ets-2 in activated endothelial cells[J].JBiolChem, 2003,278(49):49358-68.
[12] Kim B G, Park Y J, Libermann T A, et al. PTH regulates myleoid ELF-1-like factor(MEF)-induced MAB-21-like-1(MAB21L1) expression through the JNK1 pathway[J].JCellBiochem, 2011,112(8):2051-61.
[13] Paumelle R, Tulasne D, Kherrouche Z, et al. Hepatocyte growth factor/scatter factor activate the ETS1 transcription factor by a RAS-RAFMEK-ERK signaling pathway[J].Oncogene, 2002,21(15):2309-19.
[14] Chang J, Lee C, Hahm K B, et al. Over-expression of ERT (ESX/ESE-1/ELF3), an ets-related transcription factor, induces endogenous TGF-beta type II receptor expression and restores the TGF-beta signaling pathway in Hs578t human breast cancer cells[J].Oncogene, 2000,19(1):151-4.
[15] Tsai E Y, Falvo J V, Tsytsykova A V, et al. A lipopolysaccharide-specific enhancer complex involving Ets, Elk-1, Sp1, and CREB binding protein and p300 is recruited to the tumor necrosis factor alpha promoterinvivo[J].MolCellBiol, 2000,20(16):6084-94.
[16] Rameil P, Lécine P, Ghysdael J, et al. IL-2 and long-term T cell activation induce physical and functional interaction between STAT5 and ETS transcription factors in human T cells[J].Oncogene, 2000,19(17):2086-97.
[17] Nguyen V T, Benveniste E N. Involvement of STAT-1 and ets family members in interferon-gamma induction of CD40 transcription in microglia/macrophages[J].JBiolChem, 2000,275(31):23674-84.
[18] Thomas R S, Tymms M J, Mckinlay L H, et al. ETS1, NF kappa B and AP1 synergistically transactivate the human GM-CSF promoter[J].Oncogene, 1997,14(23):2845-55.
[19] Duda D G, Sunamura M, Lefter L P, et al. Restoration of SMAD4 by gene therapy reverses the invasive phenotype in pancreatic adenocarcinoma cells[J].Oncogene, 2003,22(44):6857-64.
[20] Liu M, Gao W, Velkinburgh J C, et al. Role of Ets proteins in development, differentiation, and function of T-cell subsets[J].MedResRev, 2016,36(2):193-220.
[21] Zhao H, Xu C, Lee T, et al. ETS transcription factor ETV2/ER71/Etsrp in hematopoietic and vascular development, injury, and regeneration[J].DevDyn, 2017,246(4):318-27.
[22] Zhang L, Li H, Ge C, et al. Inhibitory effects of transcription factor Ikaros on the expression of liver cancer stem cell marker CD133 in hepatocellular carcinoma[J].Oncotarget, 2014,5(21):10621-35.
[23] 王丹姝,方莲花,杜冠华.转化生长因子β1在肺动脉高压中作用的研究进展[J].中国药理学通报, 2017,33(6):741-3.
[23] Wang D S, Fang L H, Du G H. Research progress on role of TGF-β1 in pulmonary artery hypertension[J].ChinPharmacolBull, 2017,33(6):741-3.
[24] 洪 玮, 刘南植. 肿瘤治疗的新靶点Ets基因家族[J]. 临床与病理杂志, 2005,25(5):415-8.
[24] Hong W, Liu N Z. The new target of tumor therapy the Ets gene family[J].JClinPatholRes,2005,25(5):415-8.
[25] 张翠丽. Ets-1通过激活p21防止血管平滑肌细胞凋亡[D]. 哈尔滨:哈尔滨医科大学, 2004.
[25] Zhang C L.Ets-1 prevents apoptosis of vascular smooth muscle cells by activating p21[D]. Harbin: Harbin Medical University, 2004.
[26] Chan Y C, Khanna S, Roy S, Sen C K. miR-200b targets Ets-1 and is down-regulated by hypoxia to induce angiogenicresponse of endothelial cells[J].JBiolChem, 2011,286(3):2047-56.
[27] 宋 伟. Fli-1通过调控TGFβ/smad信号通路促进小细胞肺癌发生发展的分子机制[D].长春:吉林大学, 2014.
[27] Song W.Fli-1 regulates the molecular mechanism of small cell lung cancer progression by regulating the TGF beta /smad signaling pathway[D]. Changchun: Jilin University, 2014.
[28] 杨东霞,李乃娥. Elf-1 在非小细胞肺癌中的表达与肿瘤细胞凋亡及患者预后的关系[J]. 临床与实验病理学杂志,2012,28(7):768-71.
[28] Yang D X, Li N E. Expression of Elf-1 in non-small cell lung cancer and its relationship with tumor cell apoptosis and prognosis[J].ChinJClinExpPathol, 2012,28(7): 768-71.
[29] 蔡辉华,赵翰林. Ets家族与恶性肿瘤的关系研究进展[J]. 国际外科学杂志, 2007,34(2):124-8.
[29] Cai H H, Zhao H L. Advance of the relationship between Ets family and malignanttumor[J].IntJSurg, 2007,34(2):124-8.
[30] Haoyang W U, Wang S. Expression and its significance of transcription factor Ets-1 in oral squamous cell carcinoma[J].JMedForum, 2009,30(4):31-3.

