长链非编码RNA在肿瘤耐药中的作用
高梦如,魏小丽,顾康生
(安徽医科大学第一附属医院肿瘤内科,安徽 合肥 230022)
早期的恶性肿瘤由于缺少特征性临床症状,确诊患者大部分已有转移,无法直接接受手术治疗,因此,化疗就成为治疗肿瘤的重要途径。然而,中晚期恶性肿瘤由于先天性或者后天性耐药的存在,患者对化疗敏感性不佳,治疗效果大打折扣。近年来,长链非编码RNA(long non-coding RNA, lncRNA) 不仅在调控正常细胞增殖分化过程中发挥重要作用,在恶性肿瘤的发生、发展、耐药等过程中同样显示出很多潜在的作用。本文对近几年lncRNA在肿瘤耐药性方面的文章进行综述,期待找出克服肿瘤耐药性的相关分子机制,提高肿瘤化疗敏感性。
1 lncRNA与肿瘤
从本质上说恶性肿瘤是一种遗传性疾病,它通过修改细胞遗传信息,破坏细胞内稳态并促进细胞增殖。过去的研究表明,蛋白质编码基因突变、原癌基因激活或者抑癌基因沉默可以驱动恶性肿瘤的产生。基于这个原理开发出了恶性肿瘤的靶向治疗,例如酪氨酸激酶抑制剂伊马替尼治疗BCR-ABL型白血病[1]。然而,在人类的基因组序列中转录的编码序列小于2%,人类生物生物功能复杂程度和非编码RNA(non-coding RNA, ncRNA)更相关。同样,在肿瘤的发生发展过程中,ncRNA的功能越来越被关注。这些非编码RNA中转录长度大于200个核苷酸,缺少特定开放阅读框,无编码蛋白质功能的即为lncRNA。根据lncRNA和邻近编码基因的位置关系分为正义(sense)、反义(antisense)、双向(bidirectional)、基因内(intronic)及基因间(intergenic)5类[2]。来源上,lncRNA可能来自于基因复制过程中出现反位移、局部串联复制以及转座子插入、蛋白质编码基因中断或者染色质重组。lncRNA在调控蛋白编码基因表达发挥重要作用,包括参与了 X染色体沉默和激活,作为转录因子和表观遗传修饰因子活化的“支架”与蛋白结合,进而引导其定位于基因组上特定位点等[3],lncRNA自身可以作为mRNA的前体或作海绵靶向降解mRNA抑制翻译[4]。
2 lncRNA和肿瘤耐药
肿瘤细胞对抗癌药物产生耐药性是化疗失败的主要原因之一。不管是预先存在的先天性耐药,还是获得的次级耐药,细胞内信号通路的异常激活与肿瘤耐药性密切相关。lncRNA可以改变药物外排系统,增加药物代谢、细胞周期的改变、细胞凋亡异常、上皮-间质转化(epithelial-mesenchymal transition, EMT)等方式诱导耐药性(Fig 1)。另外,有靶向结合位点的lncRNA可以和微小RNA(microRNA, miRNA)形成内源性竞争性RNA(competing endogenous RNAs, ceRNA)参与耐药性[5]。
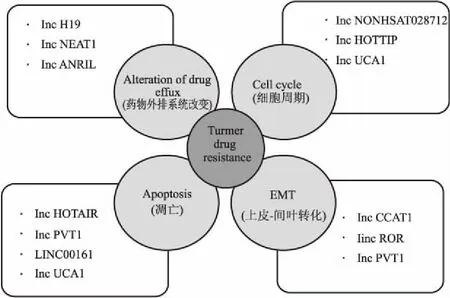
Fig 1 Mechanisms of cancer drug resistance mediated by alterations of drug efflux, cell cycle, apoptosis, as well as EMT
2.1药物外排系统改变相关的lncRNA与肿瘤耐药性药物外排系统的改变是肿瘤耐药机制中最常见的一种。由于药物流出的增加,导致细胞内药物浓度低于细胞杀伤阈值,引起肿瘤耐药。ATP结合盒蛋白(ATP-binding cassette protein, ABC)、多药耐药相关蛋白(multi-drug resistant associate protein, MRP)和铜转运体1(Copper transport protein, CTR1)等药物外排相关转运体的表达会受到多种lncRNA影响。人类中已知的49种ABC转运蛋白被分为从ABCA到ABCG的7个亚类,ABCG2、MRP都是ABC转运蛋白家族的成员[6]。Jiang等[7]在69例接受替莫唑胺(temozolomide ,TMZ)化疗的脑胶质瘤患者中检测出3种lncRNA H19的转录本变体,并鉴定出最长的变体1在耐药组织比敏感组织明显升高。同样,在脑胶质瘤细胞系U87和U251及其TMZ耐药系U87/TMZ和U251/TMZ中,H19在耐药系中高表达,敲除耐药系中H19,MDR、MRP和ABCG2的mRNA和蛋白质表达明显下调。因此,高表达的H19使多种耐药相关基因(multidrug resistance, MDR)、MRP和ABCG2表达增多,TMZ外排增加,耐药性增强。Jiang等[8]在多种非小细胞肺癌(non-small cell lung cancer,NSCLC)体内和体外研究中均证实,绿茶多酚(epigallocatechin gallate, EGCG)通过诱导CTR1表达,促进铂在细胞中积累,增强肿瘤细胞顺铂的敏感性。再进一步的机制研究中发现EGCG使通过lncRNA NEAT1(nuclear paraspeckle assembly transcrip 1)和hsa-miR-98-5p形成ceRNA,促进CTR1表达。不仅在实体瘤中,在白血病中NEAT1也存在表达失调。Gao等[9]在多种白血病细胞以及患者组织相对正常细胞或组织,NEAT1明显低表达,表明NEAT1在白血病中具有肿瘤抑制功能。NEAT1在多种白血病细胞系中过表达可以抑制ABCG2,减少硼替佐米和Alisertib外排,从而减轻耐药性。Lan等[10]不仅在5-氟尿嘧啶(5-fluorouracil,5-FU)和顺铂耐药胃癌患者的组织中发现INK4基因座的反义非编码RNA—lncRNA ANRIL(antisense non-coding RNA in the INK4 locus)高表达,并且在顺铂耐药的细胞(BGC823/DDP)和5-FU耐药细胞(BGC823/5-FU)也具有相同的上调趋势。敲低ANRIL表达,抑制MDR1和MRP1,从而限制胃癌多药耐药性的发展。
2.2细胞周期相关lncRNA与肿瘤耐药性阿糖胞苷能干扰DNA的合成,对恶性肿瘤细胞的S期(DNA合成期)有特异性杀伤作用,被称为细胞周期依赖性抗肿瘤药物,对此类药物的耐药性被称为化疗相对不敏感[11]。周期依赖性蛋白激酶(cyclin-dependent protein kinase, CDK)是调控细胞周期的重要因子,通过阻断CDK可以导致细胞周期停滞,降低化疗疗效。He等[12]分析了阿霉素耐药细胞(MCF-7/ADM)和乳腺癌细胞(MCF-7/WT)的lncRNA表达谱,并发现了一组失调的lncRNA。在初步研究中,lncRNA NONHSAT028712在MCF-7/ADM细胞和MCF-7/PTX细胞中均明显增加,其邻近基因CDK2在多种耐药细胞中也高表达,在ADM细胞中抑制NONHSAT028712,CDK2的mRNA水平明显降低,并且G1期细胞周期停滞增多。因此,NONHSAT028712顺式调节CDK2,促进阿霉素耐药性,具体机制需要进一步探索。Li等[13]在骨肉瘤体内和体外实验均存在,肿瘤组织相对正常组织lncRNA HOTTIP(HOXA transcript at the distal tip)明显高表达。用不同剂量的顺铂处理骨肉瘤细胞,HOTTIP高表达促进细胞进入S期,促进细胞对顺铂耐药。机制研究证实,HOTTIP可以通过激活Wnt/β连环蛋白(β-catenin)途径,增加骨肉瘤细胞对顺铂耐药性。尿路上皮癌相关抗原1(urothelial carcinoma associated 1,UCA1)是一种在乳腺癌中具有致癌作用的lncRNA。Li等[14]在研究中发现,在雌激素受体(estrogen receptor,ER)阳性乳腺癌细胞(MCF-7)中,UCA1上调导致停滞于G0/G1期的细胞减少,凋亡减少,肿瘤细胞增殖活跃,他莫昔芬抗性明显升高;另一方面,他莫昔芬通过miR-18a-HIF1α反馈环也可以诱导UCA1上调,产生耐药性。在耐药细胞LCC2、LCC9、BT474中,敲低UCA1使细胞周期停滞增多,内分泌治疗敏感性增加。因此,UCA1上调导致ER阳性乳腺癌细胞获得性他莫昔芬耐药。UCA1含有miR-18a靶点,可以形成ceRNA,是缺氧诱导因子1α(hypoxia inducible factor 1α,HIF-1α)的负调节因子。miR-18a抑制剂降低MCF-7细胞对他莫昔芬的敏感性,而miR-18a类似物使耐药的BT474细胞对他莫昔芬致敏。miR-18a下调也部分地促成癌细胞中获得性的他莫昔芬抗性。他莫昔芬通过miR-18a-HIF1α反馈环也可以诱导UCA1上调,产生耐药性。
2.3细胞凋亡相关lncRNA与肿瘤耐药性大多数药物通过激活细胞凋亡途径抑制癌细胞生长[19],凋亡的异常调控可能有助于肿瘤细胞增殖产生耐药性。lncRNA通过上调Bcl-2、核因子-κB (nuclear factor-kappaB, NF-κB)、凋亡抑制蛋白(inhibitor of apoptosis protein, IAP)等促生存因子,获得凋亡抗性,或者抑制caspase、p53等抑癌基因表达,产生耐药性。Öze等[15]观察到复发性铂耐药卵巢肿瘤相对原发性卵巢肿瘤lncRNA HOTAIR(hox transcript antisense)水平升高,并且HOTAIR的上调可以诱导卵巢癌发生铂耐药。在铂诱导的DNA损伤修复过程中,HOTAIR使DNA损伤修复持续激活,NF-κB表达,白细胞介素-6(interleukin-6,IL-6)分泌和活化细胞周期检测点激酶1(checkpoint kinase 1,CHK1)-p53-p21途径,抑制凋亡,产生化疗耐药性。在DNA损伤修复期间,驱动NF-κB-HOTAIR轴正反馈环级联有助于细胞凋亡和化疗敏感[15]。Liu等[16]的研究中,与顺铂敏感的卵巢癌患者组织相比,顺铂耐药患者的肿瘤组织中lncRNA PVT1(plasmacytoma variant translocation 1)过表达。顺铂耐药细胞(SKOV-3/DDP、A2780/DDP)相比顺铂敏感细胞(SKOV-3和A2780),同样存在PVT1高表达。敲低PVT1,使转化生长因子-β1(transforming growth factor-β1,TGF-β1)、p-Smad4、caspase-3的mRNA和蛋白均明显升高,肿瘤细胞凋亡百分比增加,细胞活力减低,可以逆转顺铂耐药细胞株的顺铂耐药性;PVT1过表达则使TGF-β1、p-Smad4、caspase-3的mRNA和蛋白均明显降低,肿瘤细胞凋亡百分比减少,细胞活力升高。可见,PVT1通过调节细胞凋亡途径参与卵巢癌顺铂耐药性产生。Wang等[17]发现,顺铂敏感的骨肉瘤细胞中,LINC00161通过竞争性结合miR-645和上调四肽重复的干扰素诱导蛋白(interferon-induced protein with tetratricopeptide repeats 2,IFIT2)表达,促进凋亡,化疗敏感。另一方面,LINC00161在顺铂耐药细胞中下调,使骨肉瘤细胞产生顺铂耐药性。Pan等[18]发现,在膀胱癌细胞中lncRNA UCA1表达减少,抑制细胞增殖和诱导细胞凋亡,降低顺铂/吉西他滨敏感性,而UCA1的过表达增加了膀胱癌细胞敏感性。UCA1和环磷腺苷效应元件结合蛋白(cAMP-response element binding protein,CREB)启动子结合,激活miR-196a-5p表达。miR-196a-5p可以直接靶向p27 kip1,诱导细胞凋亡,参与顺铂/吉西他滨耐药。这提供了一种新型的UCA1-CREB-miR-196a-5p模式,可以部分解释UCA1在顺铂/吉西他滨耐药中的作用。Shang等[18]研究了过表达UCA1在胃癌对阿霉素耐药中的作用。沉默UCA1可以明显抑制胃癌BGC-823和SGC7901细胞的增殖。 UCA1沉默抑制SGC7901/ADR细胞对阿霉素的耐药性,阿霉素的IC50明显下降。在SGC7901/ADR细胞中,UCA1沉默明显促进DNA修复酶PARP(poly ADP-ribose polymerase)蛋白表达,抑制抗凋亡蛋白Bcl-2的表达,诱导凋亡产生。这些结果表明,UCA1沉默诱导的化疗耐药性变化可能由细胞凋亡途径介导。Fang等[20]研究同样发现UCA1在胃癌组织中明显上调,并且其表达与miR-27b表达水平呈负相关。抑制UCA1明显提高胃癌多药耐药细胞(SGC7901/ADR)中miR-27b的表达。耐药细胞中,敲低UCA1和miR-27b过表达,降低了ADR、DDP和5-FU的IC50,并增加了ADR诱导的细胞凋亡。胃癌细胞SGC7901中,UCA1过表达和miR-27b抑制,增加了ADR、DDP和5-FU的IC50,降低了ADR诱导的细胞凋亡。蛋白质印迹分析显示,UCA1敲低和miR-27b过表达,也降低抗凋亡蛋白Bcl-2表达,增加促凋亡蛋白caspase-3的表达。因此,UCA1-miR-27b轴参与胃癌细胞化学敏感性的调节。Bian等[21]在2个结直肠癌队列中发现UCA1上调,通过抑制凋亡,促进生长,并降低对5-FU的敏感性,且与患者生存时间负相关。以前报道的2种UCA1转录物NR_015379.3(~1.4 kb)和GU799565(~2.3 kb),在结直肠癌(colorectal cancer, CRC)中只有前者作为UCA1的主要转录物。5-FU是细胞周期特异性抗肿瘤药物,但UCA1不影响CRC细胞的细胞周期。UCA1和miR-204-5p形成ceRNA,恢复CRC细胞中miR-204-5p靶基因Bcl-2、RAB22A和CREB1表达,从而促进CRC细胞的增殖和化疗耐药性。UCA1的过表达可通过抑制5-FU诱导的细胞凋亡,促进CRC细胞对5-FU的耐药性,而沉默UCA1增加细胞凋亡,使CRC细胞对5-FU敏感。表明UCA1或miR-204-5p影响5-FU敏感性主要通过诱导凋亡,而不是细胞周期停滞。
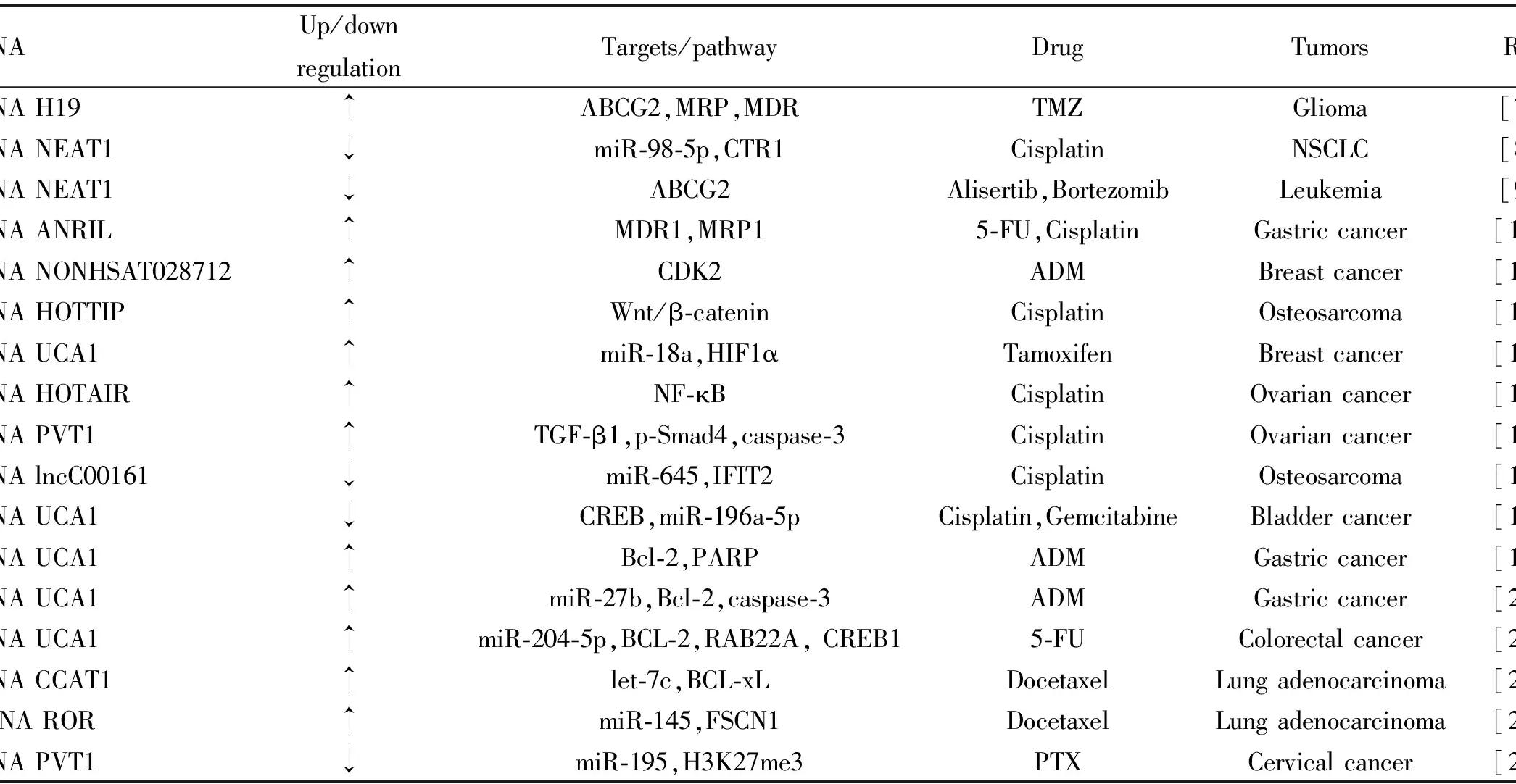
Tab 1 lncRNA involved in drug resistance of tumor
2.4EMT相关lncRNA与肿瘤耐药性EMT是一种与基底膜相连的上皮细胞丧失细胞极性和细胞-细胞间黏附能力,成为间充质细胞,这种生物学性状的改变使细胞获得迁移和侵袭能力。维持干细胞特性、肿瘤进展、转移和化疗耐药性与EMT相关[21]。多种肿瘤细胞在经过化疗后会发生EMT,这种适应性变化的产生使肿瘤细胞继发性耐药。Chen等[23]发现,多西紫杉醇耐药性肺腺癌细胞具有EMT表型。结肠癌相关转录物-1(colon cancer-associated transcript-1,CCAT1)是一种在多西他赛耐药肺腺癌细胞中上调的lncRNA。此外,CCAT1的下调降低了多西他赛耐药性肺腺癌细胞的耐药性,抑制增殖,增强细胞凋亡和逆转EMT表型。CCAT1在多西他赛耐药性肺腺癌细胞中的致癌作用取决于let-7c的海绵状结构。反过来,CCAT1的let-7c扩散释放出Bcl-xl(let-7c靶),从而促进了多西紫杉醇肺腺癌细胞中化疗抗性和EMT表型的获得。Pan等[24]的实验室中建立的多西紫杉醇肺腺癌细胞具有化疗耐药和间充质特征。首先在诱导性多能干细胞(induced pluripotent stem cells, iPSCs)中发现长的基因间非编码RNA—lncRNA ROR,并在多西他赛耐药的肺腺癌细胞中上调。在研究肺腺癌中获得化疗耐药性基于EMT的lncRNA相关机制中,发现在多西他赛耐药的肺腺癌细胞中,ROR的表达降低有效地逆转了EMT,并使其化疗敏感。肺腺癌细胞中ROR的功能取决于和miR-145形成的海绵状结构,释放miR-145靶标FSCN1,从而有助于获得耐多西紫杉醇LAD细胞的化学耐药性和EMT表型。lncRNA PVT1在宫颈癌中对化疗敏感性具有调节作用。Shen等[25]采用HPV16阳性CaSki和SiHa细胞作为体外细胞模型。敲除HPV16 E7明显抑制PVT1,并恢复miR-195的表达。 PVT1与miR-195启动子区域中的EZH2和复合锚点直接相互作用。 PVT1过表达导致miR-195启动子区域H3K27me3水平升高,而PVT1敲低可降低启动子区域的H3K27me3水平。此外,PVT1可以与miR-195竞争结合。 miR-195过表达抑制了癌细胞中的PVT1表达。 PVT1和miR-195均可抑制紫杉醇(paclitaxel,PTX)诱导的EMT,并使CaSki细胞对PTX敏感。推测PVT1通过增强miR-195启动子区域中的组蛋白H3K27me3水平以及和miR-19形成ceRNA,直接降低miR-195的表达。此外,PVT1/miR-195轴可通过调节EMT,调节癌细胞对PTX的反应性。
3 总结与展望
尽管对肿瘤药物抗性机制的研究不断进展,但是对由lncRNA介导的耐药机制的认识仍然相当有限。在本综述中,我们尝试总结lncRNA在肿瘤耐药性中发挥的作用以及机制(Tab 1)。 这些结果表明,多种lncRNA在化疗敏感性和耐药性细胞中表达不同,其中大多数与化学抗性正相关,通过调节基因表达直接或间接影响化疗疗效。 不仅1种lncRNA可以调节许多药物抗性,而且1种药物抗性可以被许多lncRNA调节。lncRNA在耐药性相关的分子机制正在被不断研究,这将会为更有效的治疗肿瘤带来新的希望。
[1] Morris K V, Mattick J S. The rise of regulatory RNA[J].NatRevGenet, 2014,15(6):423-37.
[2] Ponting C P, Oliver P L, Reik W. Evolution and functions of long noncoding RNAs[J].Cell, 2009,136(4):629-41.
[3] Brunner A L, Beck A H, Edris B, et al. Transcriptional profiling of long non-coding RNAs and novel transcribed regions across a diverse panel of archived human cancers[J].GenomeBiol, 2012,13(8):R75.
[4] Shi X, Sun M, Liu H, et al. Long non-coding RNAs: a new frontier in the study of human diseases[J].CancerLett, 2013,339(2):159-66.
[5] 魏小丽, 顾康生, 高梦如. MicroRNA与肿瘤铂类耐药的研究[J]. 中国药理学通报, 2017,33(5):593-7.
[5] Wei X L, Gu K S, Gao M R. Study on platinum resistance of microRNA and tumor[J].ChinPharmacolBull, 2017,33(5):593-7.
[6] Borst P, Evers R, Kool M, et al. A family of drug transporters: the multidrug resistance-associated proteins[J].JNatlCancerInst,2000,92(16):1295-302.
[7] Jiang P, Wang P, Sun X, et al. Knockdown of long noncoding RNA H19 sensitizes human glioma cells to temozolomide therapy[J].OncotargetsTher, 2016,9:3501-9.
[8] Jiang P, Wu X, Wang X, et al. NEAT1 upregulates EGCG-induced CTR1 to enhance cisplatin sensitivity in lung cancer cells[J].Oncotarget, 2016,7(28):43337-51.
[9] Gao C, Zhang J, Wang Q, et al. Overexpression of lncRNA NEAT1 mitigates multidrug resistance by inhibiting ABCG2 in leukemia[J].OncolLett, 2016,12(2):1051-7.
[10] Lan W, Xu D, Xu C, et al. Silencing of long non-coding RNA ANRIL inhibits the development of multidrug resistance in gastric cancer cells[J].OncolRep, 2016,36(1):263-70.
[11] Shah M A, Schwartz G K. Cell cycle-mediated drug resistance: an emerging concept in cancer therapy[J].ClinCancerRes, 2001,7(8):2168-81.
[12] He D, Zhang G, Gu X, et al. Genome-wide profiling of long non-coding RNA expression patterns in anthracycline-resistant breast cancer cells[J].IntJOncol, 2016,49(4):1695-703.
[13] Li Z, Zhao L, Wang Q. Overexpression of long non-coding RNA HOTTIP increases chemoresistance of osteosarcoma cell by activating the Wnt/beta-catenin pathway[J].AmJTranslRes, 2016,8(5):2385-93.
[14] Li X, Wu Y, Liu A, et al. Long non-coding RNA UCA1 enhances tamoxifen resistance in breast cancer cells through a miR-18a-HIF1alpha feedback regulatory loop[J].TumourBiol, 2016,37(11):14733-43.
[15] Ozes A R, Miller D F, Ozes O N, et al. NF-kappaB-HOTAIR axis links DNA damage response, chemoresistance and cellular senescence in ovarian cancer[J].Oncogene, 2016,35(41):5350-61.
[16] Liu E, Liu Z, Zhou Y, et al. Overexpression of long non-coding RNA PVT1 in ovarian cancer cells promotes cisplatin resistance by regulating apoptotic pathways[J].IntJClinExpMed, 2015,8(11):20565-72.
[17] Wang Y, Zhang L, Zheng X, et al. Long non-coding RNA LINC00161 sensitises osteosarcoma cells to cisplatin-induced apoptosis by regulating the miR-645-IFIT2 axis[J].CancerLett, 2016,382(2):137-46.
[18] Pan J, Li X, Wu W, et al. Long non-coding RNA UCA1 promotes cisplatin/gemcitabine resistance through CREB modulating miR-196a-5p in bladder cancer cells[J].CancerLett, 2016,382(1):64-76.
[19] Shang C, Guo Y, Zhang J, et al. Silence of long noncoding RNA UCA1 inhibits malignant proliferation and chemotherapy resistance to adriamycin in gastric cancer[J].CancerChemotherPharmacol, 2016,77(5):1061-7.
[20] Fang Q, Chen X, Zhi X. Long non-coding RNA(LncRNA) urothelial carcinoma associated 1 (UCA1) increases multi-drug resistance of gastric cancer via downregulating miR-27b[J].MedSciMonit, 2016,22:3506-13.
[21] Bian Z, Jin L, Zhang J, et al. LncRNA-UCA1 enhances cell proliferation and 5-fluorouracil resistance in colorectal cancer by inhibiting miR-204-5p[J].SciRep, 2016,6:23892.
[22] Xia H, Hui K M. MicroRNAs involved in regulating epithelial-mesenchymal transition and cancer stem cells as molecular targets for cancer therapeutics[J].CancerGeneTher, 2012,19(11):723-30.
[23] Chen J, Zhang K, Song H, et al. Long noncoding RNA CCAT1 acts as an oncogene and promotes chemoresistance in docetaxel-resistant lung adenocarcinoma cells[J].Oncotarget, 2016,7(38):62474-89.
[24] Pan Y, Chen J, Tao L, et al. Long noncoding RNA ROR regulates chemoresistance in docetaxel-resistant lung adenocarcinoma cells via epithelial mesenchymal transition pathway[J].Oncotarget, 2017,8(20):33144-58.
[25] Shen C, Cheng Y, Wang C. LncRNA PVT1 epigenetically silences miR-195 and modulates EMT and chemoresistance in cervical cancer cells[J].JDrugTargeting, 2017,25(7):637-44.

