泽泻汤对高脂血症大鼠脂代谢及PPARα和ACO基因和蛋白表达的影响
韩 雪,张睦清,常 冰,王 茜,郝 蕾,刘 宇,石 铖,郭秋红,张一昕
(1. 河北中医学院药学院临床中药学教研室,河北 石家庄 050200;2. 河北省中医院心血管内科,河北 石家庄 050017;3.石家庄市中医院心血管内科,河北 石家庄 050017)
高脂血症(hyperlipidemia,HLP)主要是指血浆中胆固醇(total cholesterol,TC)和(或)甘油三酯(triglyceride,TG)水平升高,其本质是人体内脂质代谢、转运的紊乱,属于代谢性疾病,是导致脂肪肝、冠心病、动脉粥样硬化等多种心脑血管疾病的重要因素之一[1-2]。近年来,人们摄入脂肪增多,但体力运动减少,使高脂血症的发病率日益攀高。中医药在防治高脂血症方面较西药有明显优势,研究发现[3],泽泻、白术作为药对单独使用或与他药配伍使用治疗高脂血症的情况尤其多见。本实验主要从肝脏过氧化物酶体增殖物激活受体α(peroxisome proliferator activated receptor-α,PPARα)途径入手,观察泽泻汤(Rhizoma Alismatis decoction,RAD)对肝脏PPARα和其下游基因乙酰辅酶A氧化酶(acyl CoA oxidase,ACO)基因和蛋白表达的影响,并对其作用机制进行初步探讨。
1 材料
1.1动物健康♂ SD大鼠50只,体质量160~180 g,购自河北省实验动物中心,实验动物质量合格证号为1209029。
1.2药物泽泻、白术两味中药,购于石家庄市乐仁堂药店,水煎浓缩至所需浓度。血脂康胶囊(批号:20120701),以蒸馏水配制所需浓度。
1.3试剂TC、TG、高密度脂蛋白胆固醇(high-density lipoprotein-cholesterol ,HDL-C)、低密度脂蛋白胆固醇(low-density lipoprotein-cholesterol,LDL-C)试剂盒(北京中山生物技术有限公司);TRIzol(Invitrogen公司);DEPC(Sigma公司);RT Reagents、PCR Reagents、DNA Marker(TaKaRa公司);兔抗PPARα抗体(美国Bioworld公司)、兔抗ACO抗体(美国Santa Cruz公司)。
1.4仪器VANOX AHB-LB型显微镜(日本OLYMPUS公司);RM2345石蜡切片机(LEICA公司);PE9600型PCR扩增仪(美国PE公司);凝胶图像分析系统(法国VL公司BIO-PROFIF)等。
2 方法
2.1动物分组及造模将50只大鼠随机分为5组,即:空白对照组(Control)、模型对照组(Model)、泽泻汤高剂量组(H-RAD)、泽泻汤低剂量组(L-RAD)、血脂康对照组(XZK),每组10只。空白组喂饲普通饲料,其余以高脂饲料(参照文献[4]1.5%胆固醇、0.5%猪胆酸钠、88%普通饲料、10%猪油)喂饲造模,共4周。
2.2给药方法及标本采集自造模d 1开始,泽泻汤各剂量组和血脂康组分别给予相应药物灌胃,用药剂量为21.0、10.5、0.2 g·kg-1,空白组和模型组灌服等量蒸馏水,每日1次,用药体积为10 mL·kg-1。4周末,10%水合氯醛麻醉,股动脉取血,分离血清。同时迅速剖取肝脏,取部分肝组织,液氮冻存,另取大小适宜的肝组织固定于4%多聚甲醛液中。
2.3检测指标及方法
2.3.1血清脂质含量的检测 酶法测定血清TC、TG、HDL、LDL的含量。
2.3.2肝组织形态学的观察 取在4%多聚甲醛中固定的肝组织,HE染色,光镜下观察肝组织形态的改变。
2.3.3肝组织PPARα mRNA、ACO mRNA表达的检测 采用逆转录聚合酶链式反应(RT-PCR)方法测定肝脏PPARα mRNA和ACO mRNA的表达。细胞总RNA提取采用TRIzol一步法。实验重复3次,以β-actin作为内对照,计算相对含量。
2.3.4肝组织PPARα、ACO蛋白表达的检测 按照试剂盒说明书,提取肝组织细胞核蛋白,常规方法进行SDS-PAGE 凝胶电泳,采用半干转的方式转至PVDF膜,小心取出转移膜置于封闭液中,室温、摇床上缓慢摇动状态下封闭2 h。加入一抗孵育过夜,PBST洗涤3次,每次10 min,加入二抗孵育90 min,PBST洗涤3次,每次10 min,应用ECL 发光试剂盒反应,经X线片曝光,显影液、定影液显色后,根据条带的亮度以及背景情况可以再次选择曝光时间进行二次曝光。用Tanon Gis软件分析X线片上的条带灰度值。

3 结果
3.1各组大鼠血清脂质水平模型组大鼠血清TC、TG和LDL的含量均高于空白组(P<0.01),HDL含量低于空白组(P<0.01);用药后,泽泻汤各剂量组及血脂康组大鼠血清TC、TG、LDL含量均明显降低(P<0.01),HDL含量均明显升高(P<0.01)。其中,低剂量组TC和TG含量均高于血脂康组和高剂量组(P<0.01);低剂量组的LDL含量高于血脂康组和高剂量组(P<0.01)。见Tab 1。
3.2各组大鼠肝组织形态学变化如Fig 1所示,空白组大鼠肝小叶清晰可见,肝细胞结构正常,排列成肝索。模型组大鼠肝细胞呈现弥漫性脂肪变性,可见大泡型脂肪滴,细胞核偏离中心。泽泻汤各剂量组与血脂康组大鼠肝细胞脂肪变性程度均有所减轻。

Tab 1 Content of TC, TG, HDL and LDL in serum of HLP rats(±s,n=10)
##P<0.01vscontrol;**P<0.01vsmodel;△△P<0.01vsXZK
3.3各组大鼠肝组织PPARα和ACOmRNA的表达如Fig 2所示,模型组大鼠PPARα和ACO mRNA的表达均弱于空白组(P<0.01)。用药后,泽泻汤各剂量组和血脂康组PPARα和ACO mRNA的表达均强于模型组(P<0.01)。
3.4各组大鼠肝组织PPARα和ACO蛋白的表达如Fig 3所示,模型组大鼠PPARα和ACO的蛋白表达均弱于空白组(P<0.01)。用药后,泽泻汤各剂量组和血脂康组PPARα和ACO的蛋白表达均强于模型组(P<0.01)。
4 讨论
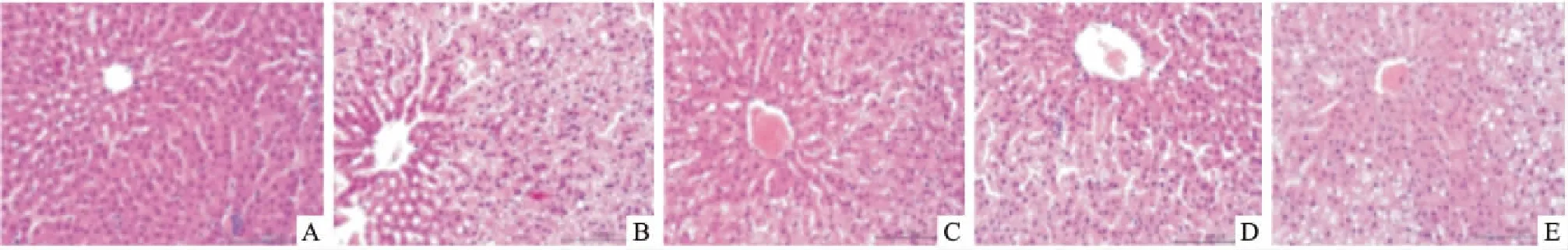
Fig 1 Effects of RAD on histopathological changes of rat heart stained with HE
A: Control group; B Model group; C: H-RAD 21.0 g·kg-1group; D: L-RAD 10.5 g·kg-1group; E: XZK 0.2 g·kg-1group

Fig 2 Expression of PPARα mRNA and ACO mRNA in hepatic tissues of HLP rats(±s,n=10)
1: Control group; 2: Model group; 3: H-RAD 21.0 g·kg-1group; 4: L-RAD 10.5 g·kg-1group; 5: XZK 0.2 g·kg-1group.##P<0.01vscontrol;**P<0.01vsmodel
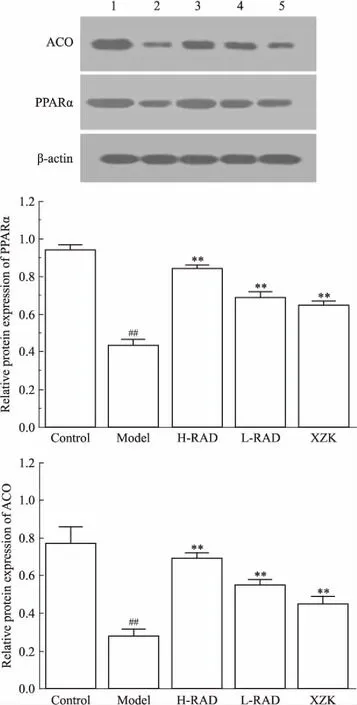
Fig 3 The protein expression of PPARα and ACO in hepatic tissues of HLP rats(±s, n=10)
1: Control group; 2: Model group; 3: H-RAD 21.0 g·kg-1group; 4: L-RAD 10.5 g·kg-1group; 5: XZK 0.2 g·kg-1group.##P<0.01vscontrol;**P<0.01vsmodel
高脂血症为西医病名,从中医学的理论进行分析,高脂血症可归属“痰浊”、“血瘀”等范畴,尤其是与内生痰浊关系密切。笔者认为,高脂血症的发病之所以呈逐年上升趋势,其原因在于生活水平的提高,人们摄入过多的高脂高热量食物;久坐(卧)少动,身体缺乏锻炼;工作压力的增大和欲望的日益增多,情绪失衡,致使肝气失于条畅等,渐至戗伐正气,脾失健运,肝失疏泄,气血津液运行失常,体内津液的输布或代谢出现障碍,则湿聚为饮生痰,痰湿脂浊稽留于里,注入血液,遂致血脂不断升高。因此,脾虚痰湿内盛为本病的主要病理基础,健脾祛湿消痰为本病标本兼治的有效方法。临床资料表明[3],泽泻与白术作为高频药对应用于临床治疗高脂血症,取得了较好的治疗效果。经方泽泻汤原主治“心下有支饮,其人苦冒眩”的病症,从其组成分析,泽泻功能利水渗湿消痰,白术有健脾燥湿利水之效,两药合用健脾、祛湿、化痰,与高脂血症的发病机制颇为吻合,故选用其作为治疗高脂血症的基本方剂开展实验研究。
由于进食过多的热量,促进TG的合成导致肥胖,而肥胖者体内的脂肪堆积使脂肪分解更加活跃,释放更多的游离脂肪酸(free fatty acids,FFA),血中FFA 增加引发血脂紊乱[5]。PPARs作为核受体超家族的一员,是一类由配体激活的核转录因子,有3种亚型,包括PPAR-α、PPAR-β/δ及PPAR-γ[6-7]。其中,PPARα在肝细胞中高水平表达,可参与众多生化反应及生物调节过程,调节脂类的摄取、氧化和脂肪的生成[8-9],还可通过调控基因编码线粒体脂肪酸β-氧化途径保护心肌[10]。当PPARα被活化后与配体形成异二聚体[11],可调控参与脂代谢的多种基因编码的蛋白质,如脂肪酸转位酶、乙酰辅酶A氧化酶等[12],从而介导TG和脂肪酸的分解代谢[13]。乙酰辅酶A氧化酶就是其中一个受PPARα调控的酶,也是β-氧化的关键酶,能增强β氧化,减少TG合成所需的乙酰辅酶A酯,进而影响TG的合成。PPARα被激活后,可直接增加脂肪酸的氧化,减少脂肪的积聚,维持内环境的稳定[14],同时激活其下游基因ACO的表达,进而减少TG的合成。
本研究结果显示,模型组大鼠血清TC、TG、LDL含量均明显升高,HDL含量及肝组织PPARα、ACO的基因和蛋白表达明显降低;治疗后,泽泻汤各剂量组大鼠血清TC、TG、LDL含量明显降低,而HDL含量及肝细胞PPARα和ACO的表达明显升高,提示该方具有调节血脂作用,其作用机制可能是通过增强PPARα的表达,激活其下游基因ACO的表达,促进脂肪氧化分解,减少脂质合成,以调节脂质代谢,进而达到调节血脂的目的,但其深入的作用机制有待进一步探讨。
(致谢:本实验在河北中医学院实验中心开展,感谢各位老师和同学的帮助与支持。)
[1] Jain K S, Kathiravan M K, Somani R S, et al. The biology and chemistry of hyperlipidemia[J].BioorgMedChem, 2007,15(14):4674-99.
[2] 卓俊城,曾晓会,曾巧煌,等. Trition WR-1399通过影响VLDL-C代谢通路和RCT诱导急性 HLP小鼠模型的研究[J].中国药理学通报,2017,33(3):433-9.
[2] Zhuo J C,Zeng X H,Zeng Q H, et al. Study on hyperlipidemia mice models induced by Trition WR-1399 via VLDL-C metabolic pathway and reverse cholesterol transport[J].ChinPharmacolBull,2017,33(3):433-9.
[3] 侯明奇, 崔 亮, 薛 洁. 近10年高脂血症中医证治用药规律的文献研究[J].新疆中药,2011,29(2):83-5.
[3] Hou M Q,Cui L,Xue J. Literature-based research on medication law of hyperlipemia in recent 10 years[J].XinjiangTraditChinMed, 2011,29(2):83-5.
[4] 张 东,武海军,陈士萍,等.大鼠实验性高脂血症5种造模方法的比较[J].中国药理学通报,2007,23(9):1254-6.
[4] Zhang D,Wu H J,Chen S P, et al.Comparison of the five models on experimental hyperlipidemia rats[J].ChinPharmacolBull, 2007,23(9):1254-6.
[5] 秦 佑, 杨瑞仪, 陈梅果,等. 树豆酮酸A抑制 3T3-L1细胞脂肪合成与分解的作用研究[J].中国药理学通报, 2016,32(2):189-93.
[5] Qin Y,Yang R Y, Chen M G, et al.Inhibitory effect of cajanonic acid A on lipogenesis and lipolysis in 3T3-L1 adipocytes[J].ChinPharmacolBull, 2016,32(2):189-93.
[6] 马晶晶, 章 涛. PPAR-γ功能与疾病关系研究进展[J].中国药理学通报, 2012,28(5):601-4.
[6] Ma J J,Zhang T. Function of PPARγ and its relationship with diseases: a present review[J].ChinPharmacolBull, 2012,28(5) : 601-4.
[7] Qi C, Zhu Y, Reddy J K, et al. Peroxisome proliferator-activated receptors, coactivators, and downstream targets[J].CellBiochemBiophys, 2000,32:187-204.
[8] 邢立国,吴英良.过氧化物酶体增殖物激活受体激动剂类药物的致癌性和致癌机制研究进展[J].中国药理学与毒理学杂志,2014,28(3): 455-61.
[8] Xing L G, Wu Y L. Progress of carcinogenesis and possible mechanisms of peroxisome proliferator-activated receptor agonists[J].ChinJPharmacolToxicol,2014,28(3): 455-61.
[9] Leone T C,Weinheimer C J,Kelly D P. A criticall role for the peroxisome proliferator-activated receptor alpha(PPARalpha) in the cellular fasting response: the PPARaIpha-null mouse as a model of fatty acid oxidation disorders[J].ProcNatlAcadSciUSA,1999,96(13):7473-8.
[10] 李叶丽,王颖婉,李意奇,等. 蛇床子素可能通过上调PPARα和PPAR-γ的表达减轻野百合碱所致大鼠右心室重构[J].中国药理学通报, 2015,31(9) : 1270-2.
[10] Li Y L, Wang Y W, Li Y Q, et al. Osthole could attenuate right ventricle remodeling in monocrotaline-treated rats by up-regulating PPARα and PPAR-γ[J].ChinPharmacolBull, 2015,31(9):1270-2.
[11] Lee C K, Klopp R G, Weindruch R, et al. Gene expression profile of aging and its retardation by caloric restriction[J].Science, 1999,285(5432): 1390-3.
[12] 师凌云,田 蜜,常 伟,等. 小檗碱对脂质代谢相关基因PPARα和CPTIA表达的影响[J].中国药理学通报, 2008,24(11):1461-4.
[12] Shi L Y, Tian M, Chang W, et al. Effect of berberine on the expression of lipid metabolism-associated gene PPARα and CPTIA[J].ChinPharmacolBull, 2008,24(11):1461-4.
[13] Rubins H B, Robins J, Collins D, et al. Gemfibrozil for the secondary prevention of coronary heart disease in men with low levels of high-density lipoprotein cholesterol[J].NEnglJMed, 1999,341(6): 410-8.
[14] Zardi E M, Navarini L, Sambataro G, et al. Hepatic PPARs: their role in liver physiology, fibrosis and treatment[J].CurrMedChem, 2013,20(27):3370-96.

