西洋参茎叶皂苷对糖尿病大鼠氧化损伤和血管内皮功能的影响
李吉萍,袁 野,张文友
(1. 扬州大学医学院药理教研室,江苏 扬州 225001;2. 雅安职业技术学院药学检验系,四川 雅安 625000)
糖尿病是当今社会中较常见的一种慢性非感染性疾病,已成为继恶性肿瘤、心脑血管疾病的第三大致死性疾病,而心血管并发症是糖尿病患者死亡的主要原因之一[1]。糖尿病患者主要的临床表现为体内持续的高血糖,除了血糖异常外,还伴随着氧化应激和血管内皮功能的改变。内皮功能障碍不仅是糖尿病血管病变的始动因素,同时也是动脉粥样硬化形成的早期表现之一。研究显示,高糖、高脂、胰岛素抵抗以及氧化应激均能导致血管内皮损伤,并产生功能障碍,加速糖尿病的发生和发展[2]。故糖尿病的治疗应考虑综合治疗的方式,除了降低血糖以使其达到正常范围外,如何减少体内氧化应激以及改善内皮功能也非常重要。
中药防治糖尿病一直是近些年国内外研究的热点,大量的研究报道表明中药在防治糖尿病血管并发症中的优势[3-4]。西洋参又名西洋人参、花旗参、广东人参,为五加科植物,主要产于美国、加拿大等国,我国在早些年便已引进并大面积栽培。因其广泛的药理作用和生物活性[5],国内外不少学者致力于其使用和开发。近年来,不少研究均证实西洋参根、茎、叶、果中的提取物——皂苷和多糖等成分具有明显的降糖作用[6],且有文献报道,其能够改善冠心病血糖异常患者β细胞功能[7]。相比现在已经上市的其他一些西药以及相关中药提取物,西洋参茎叶皂苷(Panax quinquefolium saponins,PQS)同时还具有对大鼠心肌缺血、脑缺血以及抑制脑组织神经细胞凋亡等广泛的药理作用[8-9]。
本人前期工作中已发现PQS对氧化低密度脂蛋白(oxidized low density lipoprotein,ox-LDL)刺激的离体血管环损伤有一定的保护作用[10],故本次设立糖尿病大鼠体内实验,研究PQS对糖尿病大鼠血糖值,血清、心、肾组织中过氧化脂质(lipid peroxide,LPO)和超氧化物歧化酶(superoxide dismutase,SOD)含量变化以及胸主动脉内皮依赖性舒张反应的影响,探讨PQS干预糖尿病大鼠氧化损伤和血管保护可能的作用机制,并为该药后期的开发利用提供理论依据。
1 材料
1.1实验动物Wistar大鼠224只,♂,体质量180~220 g,购于扬州大学比较医学实验中心,实验动物生产许可证:SCXK(苏)2012-0004,使用许可证号:SYXK(苏)2012-0029。实验中死亡及不符合实验要求的动物数为12只。
1.2药品与试剂西洋参茎叶皂苷,由吉林大学化学院天然药物化学研究室提供,批号20150615;Vitamin E,天津市中央药业有限公司,批号150901;链脲佐菌素(streptozocin,STZ),Sigma公司,批号S-10130; LPO及SOD试剂盒均购自上海信裕生物科技有限公司。
1.3仪器BT3000-PLUS型全自动生化分析仪,意大利Biotecnica公司;BP110S型电子天平,德国塞多厉斯公司公司;TGL-16G型台式离心机、TDL-5型台式离心机,上海安亭科学仪器厂;UV-265FW紫外可见分光光度计,日本岛津公司;张力换能器、二道生理记录仪,由扬州大学机能实验室提供。
2 方法
2.1模型的建立及分组大鼠适应性饲养3 d,禁食12 h后,一次性腹腔注射STZ(30 mg·kg-1)诱导糖尿病大鼠模型,正常对照组注射等量的柠檬酸盐缓冲液。3 d后尾静脉取血,测定血糖,空腹血糖(Fasting blood glucose detection,FBG)>16 mmol·L-1即认为模型构建成功,再将糖尿病大鼠随机分为模型组、PQS组和Vitamin E组。
2.2给药方法正常对照组和糖尿病模型组给予生理盐水灌胃,PQS组按100 mg·kg-1灌胃给药,Vitamin E按100 μmol·kg-1灌胃给药,每日1次。连续给药4、8、16周后禁食12 h,用乙醚麻醉大鼠,腹主动脉采血,制备血清,然后迅速摘取心脏和肾脏置于4℃生理盐水洗净残血,剥去被膜,精确称重后,用电动匀浆器制成10%的组织匀浆,低温离心,吸取上清后冷冻备用。
2.3生化指标检测(1)空腹血糖:葡萄糖氧化酶法(操作方法按试剂盒说明书);(2)血浆、心脏、肾组织SOD活性:黄嘌呤氧化酶法(操作方法按试剂盒说明书);(3)血浆、心脏、肾组织LPO含量:TBA比色法(操作方法按试剂盒说明书)。
2.4胸主动脉离体血管环舒张反应检测连续给药4、8、16周后,禁食12 h,腹腔注射3%戊巴比妥钠(30 mg·kg-1)麻醉大鼠,迅速打开胸腔取出胸主动脉,置于通以95% O2∶5% CO2混合气体的Krebs-Henseleit液中,仔细分离血管周围组织,清除血管内血液,剪成3 mm长血管环,钢钩固定于含Krebs-Henseleit液的浴皿中,并通过张力换能器连于二道生理记录仪,给予血管环2 g的静息张力,平衡90 min后,先以苯肾上腺素(1×10-6mol·L-1)收缩血管环,然后分别用累加剂量的乙酰胆碱(10-8~10-4.5mol·L-1)舒张血管,记录血管舒张反应,并以硝普钠作为内皮非依赖性舒张反应的对照。浴皿在整个实验过程中始终通以95% O2∶5% CO2的混合气体,并保持Krebs-Henseleit液恒温(37±0.5)℃。

3 结果
3.1PQS对糖尿病大鼠血糖水平的影响Tab 1结果显示,糖尿病模型组与Vitamin E组大鼠给药前后血糖与正常对照组相比明显升高(P<0.01);与糖尿病模型组大鼠比较,连续给予PQS 8~16周后可明显降低糖尿病大鼠血糖(P<0.05或P<0.01)。
3.2PQS对糖尿病大鼠血清、心、肾LPO的影响Tab 2、3结果显示,糖尿病模型组大鼠给药前后血清、心、肾组织LPO含量与正常对照组相比明显升高(P<0.01);与糖尿病模型组比较,连续给予PQS 4~16周后,可明显降低大鼠血清、心、肾组织LPO含量(P<0.05、P<0.01);给予阳性对照药Vitamin E后也可明显降低糖尿病模型大鼠血清、心、肾组织LPO含量(P<0.01)。

Tab 1 Effect of PQS treatment on blood glucose in rats(±s,n=10,mmol·L-1)
*P<0.05,**P<0.01vscontrol;#P<0.05,##P<0.01vsmodel

Tab 2 Effect of PQS treatment on serum LPO in rats(±s, n=10, mmol·L-1)
**P<0.01vscontrol;##P<0.01vsmodel

Tab 3 Effect of PQS treatment on LPO in heart and kidney of rats(±s, n=10, mmol·kg-1)
*P<0.05,**P<0.01vscontrol;#P<0.05,##P<0.01vsmodel

Tab 4 Effect of PQS treatment on serum SOD in rats(±s, n=10, kU·L-1)
**P<0.01vscontrol;#P<0.05,##P<0.01vsmodel

Tab 5 Effect of PQS treatment on SOD in heart and kidney of rats(±s,n=10, U·g-1)
**P<0.01vscontrol;#P<0.05,##P<0.01vsmodel
3.3PQS对糖尿病大鼠血清、心、肾SOD的影响Tab 4、5结果显示,糖尿病模型组大鼠给药前后血清、心、肾组织SOD活性与正常对照组相比明显降低(P<0.01);连续给予PQS 4~16周后,与糖尿病模型组比较,可明显升高糖尿病模型大鼠血清、心、肾组织SOD活性(P<0.05,P<0.01);给予阳性对照药Vitamin E后也可明显升高糖尿病模型大鼠血清、心、肾组织SOD活性(P<0.05,P<0.01)。
3.4PQS对糖尿病大鼠胸主动脉内皮依赖性舒张反应的影响Fig 1A结果显示,与正常对照组比较,模型组大鼠随时间推移,胸主动脉内皮依赖性舒张反应逐渐降低;Fig 1B、1C显示,糖尿病大鼠长期给予(8~16周)PQS或阳性对照药Vitamin E灌胃后,其胸主动脉内皮依赖性舒张反应明显提高(P<0.05,P<0.01),并逐渐趋近正常值。
4 讨论
糖尿病是一种多因素引起的内分泌代谢紊乱性疾病,可分为1型、2型、妊娠糖尿病和其他特殊类型糖尿病。STZ是目前构建糖尿病模型常用的化学药物,它能选择性的破坏胰岛β细胞,且其产生的自由基能够直接损伤胰腺,降低体内胰岛素水平,破坏体内血糖稳态[11]。
近年来研究表明,糖尿病及其并发症的产生与体内自由基增多以及氧化应激反应有关[12]。人体内存在大量的不饱和脂肪酸,可以和氧自由基通过脂质自动氧化反应生成LPO。LPO是糖尿病的主要特征之一,是脂质氧化产生的脂毒性物质,其含量高低反映了机体脂质受活性氧和自由基作用后的受损程度。它可以通过改变膜结合的酶和受体的活性,使生物膜变性,导致细胞膜功能损伤,并且对动脉及中枢神经系统等都可产生一定的损伤。本实验结果显示,随着给药时间的延长,PQS组大鼠血清、心和肾组织中LPO含量与模型组大鼠相比明显下降,表明PQS可以减轻糖尿病大鼠体内脂质氧化程度。
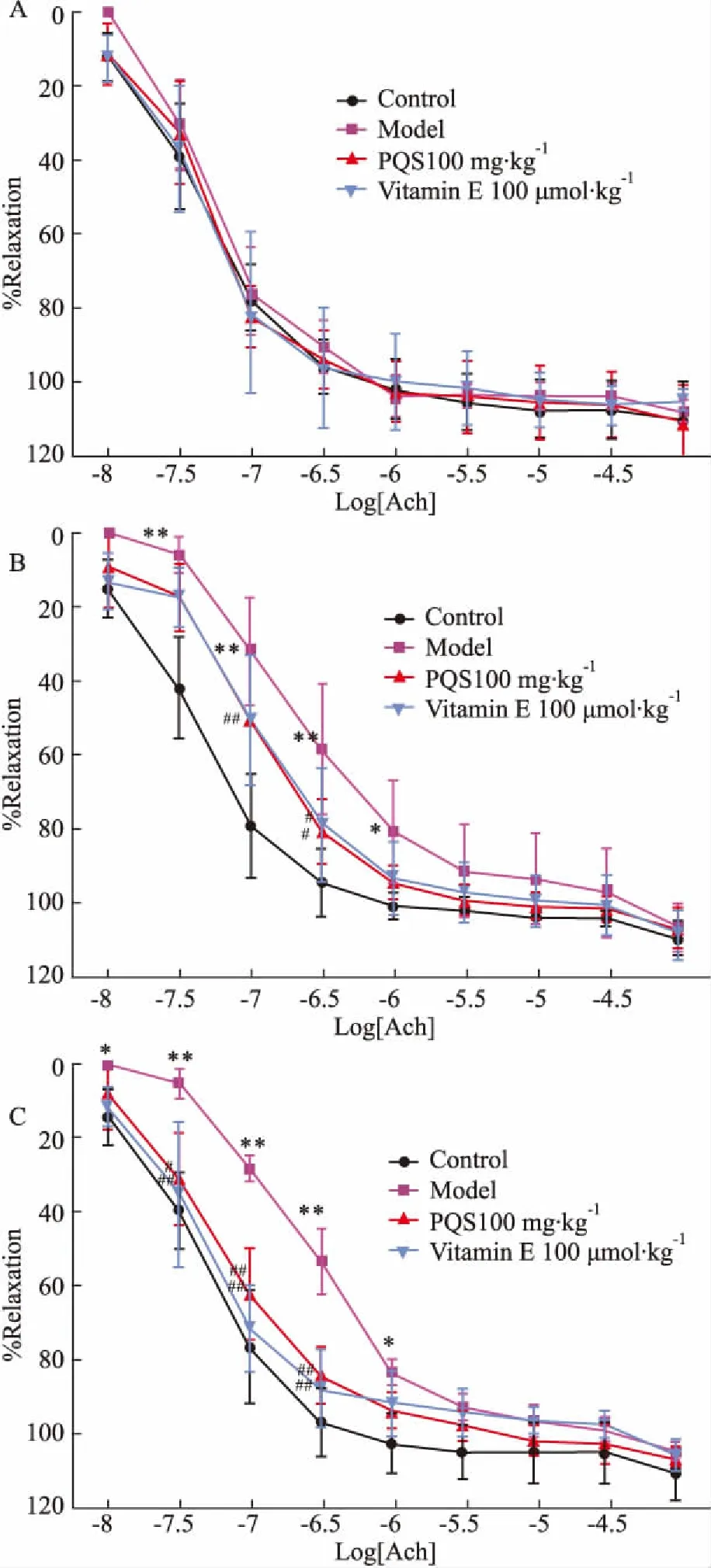
Fig 1 Effect of PQS on endothelium dependent dilation of thoracic aorta in rats(±s, n=10)
A: After-administration for 4 weeks; B: After-administration for 8 weeks; C: After-administration for 16 weeks.*P<0.05,**P<0.01vscontrol;#P<0.05,##P<0.01vsmodel
在正常的生理条件下,体内抗氧化能力与氧自由基产生能力保持相对平衡,而在糖尿病患者中,持续的高糖以及游离脂肪酸的刺激会加速葡萄糖自动氧化、多元醇代谢途径活化等的一系列氧化催化反应的发生,导致体内活性氧和LPO等含量增高,而机体抗氧化酶如SOD等的活性降低,从而使氧化-抗氧化平衡失调,体内氧化产物不能被及时清除而对内皮细胞产生损伤[13]。SOD作为机体内重要的氧自由基清除剂,能够发挥抗氧化作用,其活性高低反映出机体清除氧自由基的能力[14]。在糖尿病患者体内,高浓度的血糖会同SOD活性部位的赖氨酸相结合并发生糖基化,导致SOD活性下降,进而减弱其将体内毒性物质超氧阴离子自由基歧化为O2和H2O2的能力,致使自由基堆积,产生的自由基又进一步与不饱和脂肪酸反应形成LPO,加剧内皮细胞损伤。本研究结果显示,与正常对照组相比,糖尿病模型组大鼠血清、心、肾组织中的SOD活性明显降低。PQS组与模型组相比较,能够明显提高体内SOD活性,表明PQS降低糖尿病大鼠血糖可能与其发挥抗氧化作用和清除氧自由基有关。
离体血管环实验是评价血管功能的经典实验,可以用来反映血管内皮依赖性和非依赖性的舒张功能。糖尿病产生早期,体内血管内皮依赖性的舒张功能即发生异常[15-16],如内皮细胞产生的舒张因子NO等的活性降低。本实验研究表明,与正常对照组相比较,糖尿病模型组大鼠主动脉环对Ach的舒张反应明显下降,而经过PQS处理后的大鼠胸主动脉血管环舒张反应明显提高,表明PQS对血管内皮具有保护作用。
本研究结果显示,PQS不仅对STZ诱导的糖尿病大鼠血糖升高有治疗作用,还能明显抑制脂质过氧化和减轻机体内氧化损伤,并且能够恢复血管内皮依赖性舒张功能,对糖尿病血管并发症起到一定的防治作用。提示PQS降糖机制可能与抑制脂质过氧化、降低体内氧化损伤、恢复血管内皮功能有关,其详细的药理作用和作用机制还有待深入研究。
(致谢:本实验是在扬州大学医学院药理实验室完成的,谨向全体课题组实验人员表示衷心感谢。同时也感谢吉林大学化学院天然药物化学研究室提供的药品及各种帮助。)
[1] Yang W, Lu J, Weng J, et al. Prevalence of diabetes among men and women in China[J].NEnglJMed, 2010,362(12):1090-101.
[2] Kim J, Montagnani M, Koh K K, et al. Reciprocal relationships between insulin resistance and endothelial dysfunction[J].Circulation, 2006,113(15):1888-904.
[3] Sohn E, Kim J, Kim C S, et al. Extract of polygonum cuspidatum attenuates diabetic retinopathy by inhibiting the high-mobility group box-1 (HMGB1) signaling pathway in streptozotocin-induced diabetic rats[J].Nutrients, 2016,8(3):140.
[4] 杨海光, 方莲花, 杜冠华. 芒果苷的药理作用研究进展[J]. 中国药理学通报, 2016,32(1):5-8.
[4] Yang H G, Fang L H, Du G H. Research progress of pharmacological effectsof Mangiferin[J].ChinPharmacolBull, 2016,32(1):5-8.
[5] 王承龙, 殷惠军, 史大卓, 等. 西洋参茎叶皂苷心血管药理研究概述[J]. 中药新药与临床药理, 2006,17(1):76-8.
[5] Wang C L, Yin H J, Shi D Z, et al. [J]. Summary of cardiovascular pharmacological studies on Panax quinquefolium saponins[J].TraditChinDrugResPharmacol, 2006,17(1):76-8.
[6] 张酉珍, 苏光悦, 夏晓艳, 等. 天然达玛烷型皂苷降血糖作用的研究进展[J]. 中草药, 2016,47(15): 2758-63.
[6] Zhang Y Z, Su G Y, Xia X Y, et al. Research progress in hypoglycemic effect of natural dammarane saponins[J].ChinTraditHerbalDrugs, 2016,47(15):2758-63.
[7] 张 颖,陆 曙,刘育英,等. 西洋参茎叶总皂苷对冠心病血糖异常患者胰岛素敏感性的影响[J]. 中国中西医结合杂志, 2007,12(27):1066-9.
[7] Zhang Y, Lu S, Liu Y Y, et al. Effect of panax Quinquefolius saponin on insulin sensitivity in patients of coronary heart disease with blood glucose abnormality[J].ChinJIntegrTradWestMed, 2007,12(27):1066-9.
[8] 孙 莉,荀 平. 西洋参茎叶皂苷抗大鼠心肌缺血/再灌注损伤的作用及机制[J]. 中国实验方剂学杂志, 2014,20(24):176-9.
[8] Sun L, Xun P. Protective effects and mechanism of Panax quinquefolius Saponins on myocardial ischemia of rats[J].ChinJExpTraditMedForm, 2014,20(24):176-9.
[9] 关利新, 翟凤国, 聂 影, 等. 西洋参茎叶皂苷对脑缺血大鼠细胞凋亡及caspase-3表达的影响[J]. 中药药理与临床, 2008,24(1):30-2.
[9] Guan L X, Zhai F G, Nie Y, et al. Effect of Panax quinquefolium saponins from steams and leaves on neuronal apoptosis and the expression of caspase-3 in focal cerebral ischemia injury rats[J].PharmacolClinChinMaterClinMed, 2008,24(1):30-2.
[10] Li J, Huang M, Teoh H, et al. Panax quinquefolium saponins protects low density lipoproteins from oxidation[J].LifeSci,1998,64(1):53-62.
[11] 刘德慧, 邢翔飞. 2型糖尿病大鼠模型的特点及评价[J]. 中国实验方剂学杂志, 2010,16(12):212-4.
[11] Liu D H, Xing X F. Evaluation and characteristic of rat model of type 2 diabetes[J].ChinJExpTraditMedForm, 2010,16(12):212-4.
[12] 王文清, 陶 枫, 陆 灏, 等. 糖尿病中药抗氧化实验研究进展[J]. 上海中医药大学学报, 2012,26(5):105-8.
[12] Wang W Q, Tao F, Lu H, et al. Experimental research progress on antioxidative effect of antidiabetic herbs[J].ActaUnivTraditMedSinPharmacolShanghai, 2012,26(5): 105-8.
[13] Vessby J, Basu S, Mohsen R, et al. Oxidative stress and antioxidant status in type 1 diabetes mellitus[J].JInternMed, 2002,251(1):69-76.
[14] Xiong Z, Liu C, Wang F, et al. Protective effects of breviscapine on ischemic vascular dementia in rats[J].BiolPharmBull, 2006,29(9):1880-5.
[15] Dogra G, Rich L, Stanton K, et al. Endothelium-dependent and independent vasodilation studied at normoglycaemia in type I diabetes mellitus with and without microalbuminuria[J].Diabetologia, 2001,44(5): 593-601.
[16] Caballero A E, Arora S, Saouaf R, et al. Microvascular and macrovascular reactivity is reduced in subjects at risk for type 2 diabetes[J].Diabetes, 1999,48(9):1856-62.

