三七超临界CO2萃取物对谷氨酸损伤PC12细胞的保护作用
段贤春,周 安,彭代银,鲍金云,夏伦祝
(安徽中医药大学1.药学院;2.第一附属医院药学部,安徽 合肥 230038)
脑缺血是致残和致死的主要原因之一,其发生概率随年龄的增长而增加[1]。研究表明,脑缺血缺氧后神经细胞的损伤与谷氨酸(glutamate, Glu) 介导的兴奋性毒性密切相关[2-3]。脑缺血缺氧后突触前膜会过度释放谷氨酸,突触间隙堆积的谷氨酸引起Ca2+大量内流,从而导致神经细胞损伤。α-氨基羟甲基异恶唑丙酸(amino-3-hydroxy-5-methylisoxazole-4-propionic acid, AMPA)受体上的谷氨酸受体2(glutamate receptors 2,GluR2)亚基可以阻断Ca2+内流,绝大部分神经元突触表面的AMPA受体上含有GluR2亚基,对Ca2+的通透性很低[4-5]。研究表明,膜转运蛋白(protein that interacts with C kinase Ⅰ, PICK1)的PDZ结构域与GluR2 C末端紧密结合可以调节突触AMPA受体GluR2亚基的表达,进而影响到AMPA受体对Ca2+通透性[6]。
三七为五加科多年生草本植物三七Panaxnotoginseng(BurK.)F. H. Chen的干燥根,收录于《本草纲目》,具有活血化瘀、消肿止痛的作用[7]。三七总皂苷通过促进脑缺血/再灌注大鼠脑组织血管内皮生长因子(vascular endothelial growth factor,VEGF)的表达来发挥神经保护作用[8]。除皂苷类成分外,课题组前期研究发现,三七超临界萃取物(supercritical fluid extract, SFE)主要含有人参炔醇、斯巴醇等脂溶性成分。三七中的脂溶性成分如人参炔醇对损伤的神经细胞也有保护作用[9],但其脂溶性部位对损伤的神经细胞的保护作用机制尚不明确。故本实验采用谷氨酸损伤PC12细胞为体外缺血性脑损伤模型,研究三七SFE是否可以干扰或阻断PICK1与GluR2亚基的相互作用,为PICK1成为一个可能的药靶蛋白提供实验基础。
1 材料
1.1药物与试剂三七超临界CO2萃取物(实验室自制);FSC231抑制剂(纯度>96.66%,美国Calbiochem公司,批号2769360);L-谷氨酸(Sigma公司进口分装);胎牛血清(杭州四季青生物工程材料有限公司);DMEM培养基(美国Hyclone公司);胰蛋白酶(Gibco进口分装,武汉生命技术有限公司);MTT、DMSO(Sigma公司);LDH试剂盒(南京建成生物工程研究所);Hoechst 33342染色试剂盒(上海贝博生物公司);Fluo-3/AM荧光染料(日本株式会社同仁化学研究所);PICK1抗体、GluR2抗体和β-actin抗体(Abcam公司)
1.2仪器CO2培养箱(MCO-175型,日本Sanyo公司);倒置显微镜(CK2型,日本Olympus公司);酶标仪(ELX800uv型,美国Bio-Tek公司);水平离心机(LD4-8型,北京医用离心机厂);荧光显微镜(BX-60型,日本Olympus公司);激光共聚焦显微镜(IX-81型,日本Olympus公司);凝胶成像系统(Gel DOC XR型,美国Bio-Rad公司);纯水机(Milli-Q Advantage A10型,美国Millipore公司)。
2 方法
2.1细胞培养PC12细胞培养于含1%青霉素-链霉素溶液、10%胎牛血清的DMEM培养液中,置5% CO2培养箱中培养,温度为37 ℃,隔天换液,3~4 d传代1次,取处于对数生长期的细胞应用于实验。
2.2模型的建立取对数生长期的PC12细胞,以2×104个/孔接种于96孔培养板,待细胞完全贴壁后,弃除原培养液,再以含不同浓度(5、10、15、20、25、30 mmol·L-1)谷氨酸的完全培养基继续培养,正常对照组不加谷氨酸,每组设6个复孔,置5% CO2培养箱、温度为37 ℃的条件下,分别培养24、48、72 h后,MTT法检测PC12细胞存活率。实验重复3次,按公式计算生长抑制率:抑制率(IR)/%=(1-模型组OD值/正常组OD值)×100 %,根据IC50确定最佳造模的时间与浓度。
2.3实验分组与处理将细胞分为7组:对照组(不加谷氨酸的正常细胞组)、模型组(谷氨酸损伤的细胞组)、三七SFE给药组(25、50、100 mg·L-1)、PICK1抑制剂组(100 μmol·L-1FSC231)、三七SFE+抑制剂组(100 mg·L-1SFE+100 μmol·L-1FSC231),药物预处理1 h后,加谷氨酸共同孵育24 h,应用倒置显微镜观察PC12细胞形态。
2.4MTT法检测细胞活力取对数生长期的PC12细胞,以2×104个/孔接种于96孔培养板,每孔100 μL。置5% CO2培养箱、温度为37 ℃的条件下培养过夜后,按实验要求给予不同方法处理,每组为6个复孔。培养24 h后,每孔加入5 g·L-1的MTT 20 μL,继续孵育4 h后,弃除上清液,每孔加入DMSO 150 μL,置恒温振荡器上振荡10 min后,酶标仪检测490 nm处各孔吸光度值。细胞存活率/%=处理组OD值/对照组OD值×100%,重复实验3次。
2.5LDH活性检测将“2.3”项各组细胞培养24 h后,分别收集培养上清液20 μL,按照说明书测定各组细胞上清LDH的活力。
2.6Hoechst33342染色检测细胞损伤“2.3”项各组细胞用PBS液洗3遍,每孔中加入用PBS配置好的Hoechst 33342染料1 mL,室温避光20 min,用4%多聚甲醛固定5 min,荧光显微镜下观察。
2.7Fluo-3/AM荧光染色法检测细胞内钙离子浓度“2.3”项各组细胞用PBS液洗3遍,各组加入浓度为5 μmol·L-1的Fluo-3/AM染色液,置5% CO2培养箱、温度为37 ℃的条件下,避光孵育30 min。为充分除去残留的Fluo-3/AM染色液,用PBS液洗3次,然后加入PBS液覆盖细胞。用激光共聚焦扫描显微镜观察并拍照。激发波长488 nm,发射波长525 nm,计算机自动分析处理,计算细胞内游离钙相对含量。
2.8Westernblot检测PICK1、GluR2蛋白表达同“2.3”项实验分组与处理方法,以细胞裂解液提取细胞总蛋白,用BCA试剂盒进行蛋白定量。运用5%浓缩胶和10%分离胶进行SDS-PAGE电泳,再将蛋白转移到硝酸纤维素膜上,以5%脱脂奶粉室温封闭2 h,PBST洗涤3次,每次10 min,加入一抗(1 ∶1 000)孵育过夜。次日,PBST洗涤3次,每次10 min,加入标记有HRP的二抗稀释液(1 ∶10 000)孵育2 h,再以PBST洗涤3次,每次10 min。最后用ECL试剂盒显影,以凝胶成像系统采集图片,蛋白表达情况运用AlphaView SA软件分析。

3 结果
3.1谷氨酸的细胞毒性作用不同浓度(5、10、15、20、25、30 mmol·L-1)谷氨酸分别作用PC12细胞24、48、72 h后,MTT法检测细胞存活率变化情况。Fig 1结果显示,浓度在5~30 mmol·L-1范围内,谷氨酸对PC12细胞的生长具有明显抑制作用,且呈现一定的量效关系。25 mmol·L-1谷氨酸作用24 h对细胞生长的抑制率接近50%,故选择该作用时间和浓度为后续实验的模型。
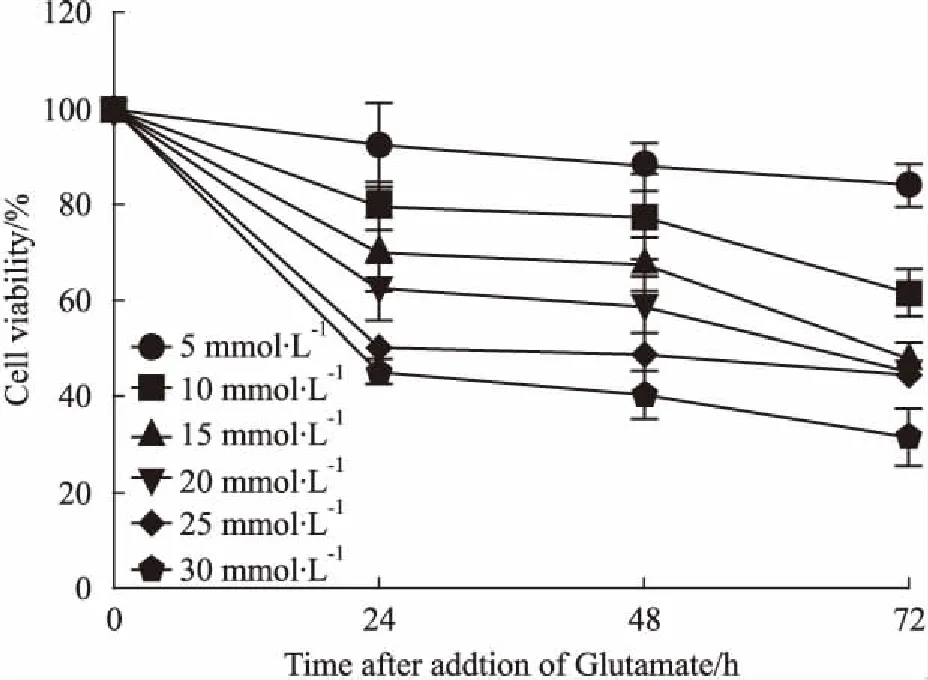
Fig 1 Effects of glutamate on proliferation of PC12 cells(n=6)
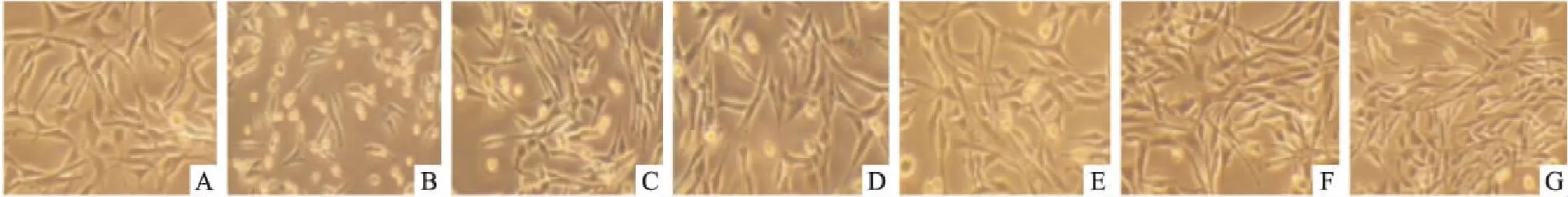
Fig 2 Morphological changes of PC12 cells observed by inverted-microscope(×200)
A:Control group;B:25 mmol·L-1Glu group;C:25 mg·L-1SFE+25 mmol·L-1Glu group;D:50 mg·L-1SFE+25 mmol·L-1Glu group;E:100 mg·L-1SFE+25 mmol·L-1Glu group;F:100 μmol·L-1FSC231+25 mmol·L-1Glu group;G:100 mg·L-1SFE+100 μmol·L-1FSC231+25 mmol·L-1Glu group
3.2细胞形态学观察倒置显微镜下观察发现,正常PC12细胞大多呈长梭形、多边形贴壁生长,有类似神经突触的细胞突起。25 mmol·L-1谷氨酸作用PC12细胞24 h后,细胞变圆,突起减少,贴壁不牢,细胞间隙增大,折光度下降。而三七SFE和FSC231预处理后能减轻谷氨酸对PC12细胞的损伤,与模型组比较,细胞密度明显增大,细胞突起增多,贴壁细胞增多,折光性增强(Fig 2)。
3.3三七SFE增加谷氨酸损伤PC12细胞的存活率Fig 3的MTT实验结果显示,与正常组(98.75±7.02)%比较,单用三七SFE组、单用PICK1抑制剂组的细胞存活率(94.63±4.84)%、(95.46±2.30)%差异均没有显著性。25 mmol·L-1谷氨酸作用PC12细胞24 h后,细胞的生长受到明显抑制,与正常组比较,细胞存活率下降为(50.27±2.87)%(P<0.05)。与模型组相比,三七SFE(25、50、100 mg·L-1)、FSC231、三七SFE+FSC231预处理PC12细胞1 h后能明显提高PC12细胞存活率,分别为(60.76±1.83)%、 (69.13±2.72)%、 (78.39±5.04)%、(85.89±6.83)%、(86.90±6.07)%(P<0.01)。
3.4三七SFE降低谷氨酸损伤PC12细胞的LDH活性25 mmol·L-1谷氨酸作用PC12细胞24 h后,与正常组LDH活性(131.23±4.42)U·L-1比较,培养基上清液中的LDH活性(522.85±26.67)U· L-1明显增加(P<0.05)。三七SFE(25、50、100 mg·L-1)、FSC231、三七SFE+FSC231预处理PC12细胞1 h后,与模型组相比,上清液中LDH活性分别为(400.84±20.84)、(246.12±22.86)、(201.26±3.33)、(150.94±21.01)、(143.40±6.66)U·L-1,明显减少(P<0.01)。不同浓度的三七SFE、FSC231、三七SFE+FSC231能够减轻谷氨酸导致的神经细胞损伤(Fig 4)。
3.5三七SFE降低谷氨酸损伤PC12细胞的凋亡率Hoechst 33342染色法检测细胞凋亡情况。Fig5结果显示,正常组的细胞核呈均匀的蓝色荧光,凋亡细胞较少。谷氨酸损伤后部分细胞呈浓染的碎块状,并发出高亮度的荧光,与正常组细胞凋亡率(9.78±0.96)%相比,凋亡细胞明显增多,凋亡率为(64.71±7.47)%(P<0.05)。与模型组相比,三七SFE(25、50、100 mg·L-1)、FSC231、三七SFE+FSC231预处理PC12细胞1 h后,各组细胞核固缩现象减少,凋亡细胞也明显减少,凋亡率分别为(58.99±3.55)%、(47.76±6.53)%、(38.81±2.05)%、(19.22±3.18)%、(19.78±2.72)%(P<0.01)。不同浓度的三七SFE、FSC231、三七SFE+FSC231均可抑制谷氨酸诱导PC12细胞的凋亡。
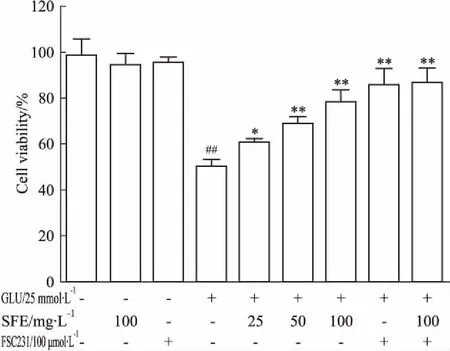
Fig 3 Effects of SFE on viability of glutamate injured PC12 cells measured by MTT assay(±s,n=6)
##P<0.01vscontrol group;*P<0.05,**P<0.01vsmodel group

Fig 4 Effects of SFE on glutamate injured LDH release in PC12 cells(±s,n=6)
##P<0.01vscontrol group;*P<0.05,**P<0.01vsmodel group
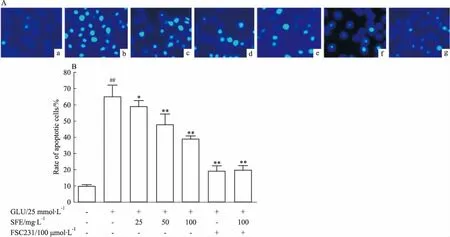
Fig5EffectsofSFEonglutamate-inducedapoptosisinPC12cells
A:Apoptosis changes of PC12 cells observed by fluorescence microscopy.a:Control group;b:25 mmol·L-1Glu group;c:25 mg·L-1SFE+25 mmol·L-1Glu group;d:50 mg·L-1SFE+25 mmol·L-1Glu group; e:100 mg·L-1SFE+25 mmol·L-1Glu group; f:100 μmol·L-1FSC231+25 mmol·L-1Glu group; g: 100 mg·L-1SFE+100 μmol·L-1FSC231+25 mmol·L-1Glu group.B:Effects of SFE on glutamate-induced apoptosis in PC12 cells.##P<0.01vscontrol group;*P<0.05,**P<0.01vsmodel group

Fig6EffectsofSFEonglutamate-inducedPC12intracellularCa2+concentration
A:Fluorescence intensity changes of Ca2+of PC12 cells observed by laser confocal microscopy. a: Control group;b:25 mmol·L-1Glu group;c:25 mg·L-1SFE+25 mmol·L-1Glu group; d:50 mg·L-1SFE+25 mmol·L-1Glu group; e:100 mg·L-1SFE+25 mmol·L-1Glu group; f:100 μmol·L-1FSC231+25 mmol·L-1Glu group; g: 100 mg·L-1SFE+100 μmol·L-1FSC231+25 mmol·L-1Glu group. B:Effects of SFE on glutamate-induced PC12 intracellular Ca2+concentration.##P<0.01vscontrol group;*P<0.05,**P<0.01vsmodel group
3.6三七SFE减少谷氨酸损伤PC12细胞内Ca2+浓度25 mmol·L-1谷氨酸作用PC12细胞24 h后,与正常组细胞内Ca2+浓度(99.18±20.48)nmol·L-1比较,细胞内Ca2+浓度(628.02±53.64)nmol·L-1明显升高(P<0.05)。三七SFE(25、50、100 mg·L-1)、FSC231、三七SFE+FSC231预处理PC12细胞1 h后,与模型组相比,细胞内Ca2+浓度(570.85±19.59)、(423.76±30.27)、(363.08±7.18)、(314.86±23.40)、(303.62±10.42)nmol·L-1,明显降低(P<0.01)。不同浓度的三七SFE、FSC231、三七SFE+FSC231可以减少谷氨酸诱导PC12细胞外钙离子的内流(Fig 6)。
3.7三七SFE抑制PICK1和增加GluR2蛋白表达Western blot结果表明,谷氨酸作用于PC12细胞24 h后,与正常组相比,PICK1、GluR2蛋白表达明显降低(P<0.05)。三七SFE(25、50、100 mg·L-1)、FSC231、三七SFE+FSC231预处理PC12细胞1 h后,与模型组相比,PICK1蛋白表达明显降低(P<0.01)(Fig 7),GluR2蛋白表达明显增多(P<0.01)(Fig 8),且三七SFE+FSC231组与FSC231抑制剂组PICK1、GluR2两种蛋白表达无明显差异。三七SFE可能通过增加GluR2蛋白表达、降低PICK1蛋白表达,抑制谷氨酸损伤PC12细胞的凋亡。
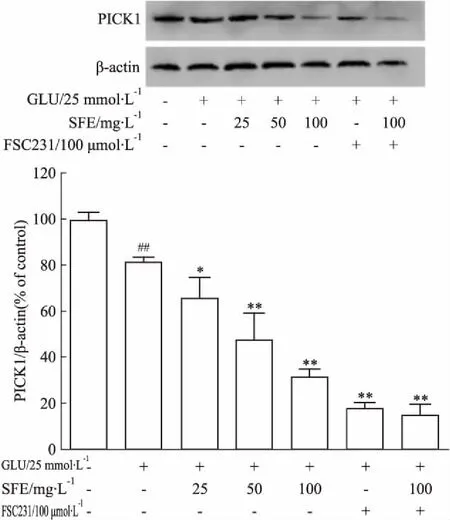
Fig 7 Effect of SFE on expression levels of PICK1 in PC12 cells
##P<0.01vscontrol group;*P<0.05,**P<0.01vsmodel group
4 讨论
谷氨酸是脑组织中一类重要的兴奋性氨基酸,脑缺血缺氧时,突触前膜释放大量的谷氨酸并堆积导致钙超载,继而对神经细胞产生致命的损伤[10]。AMPA受体上的GluR2亚基可以阻断Ca2+内流,而膜转运蛋白PICK1可以影响GluR2亚基的表达。病理状态下,PICK1蛋白的PDZ结构域与GluR2 C末端紧密结合,导致膜表面GluR2亚基含量降低,引起缺乏GluR2亚基的AMPA受体增多,后者对Ca2+有很高的通透性,引起Ca2+内流,导致神经细胞损伤[11-12]。三七中皂苷类成分对损伤的神经细胞的保护作用已有大量文献报道,除皂苷类成分外,三七中的脂溶性成分如人参炔醇,对损伤的神经细胞也有保护作用。课题组前期研究发现,三七SFE主要含有人参炔醇、斯巴醇等脂溶性成分,脂溶性成分极性小,可能比水溶性成分更容易透过血脑屏障,但其脂溶性部位对损伤的神经细胞保护作用机制尚不明确。故本实验以谷氨酸损伤PC12细胞为缺血性脑损伤研究模型,观察三七SFE对谷氨酸损伤PC12细胞的保护作用并初步探讨其可能作用机制。
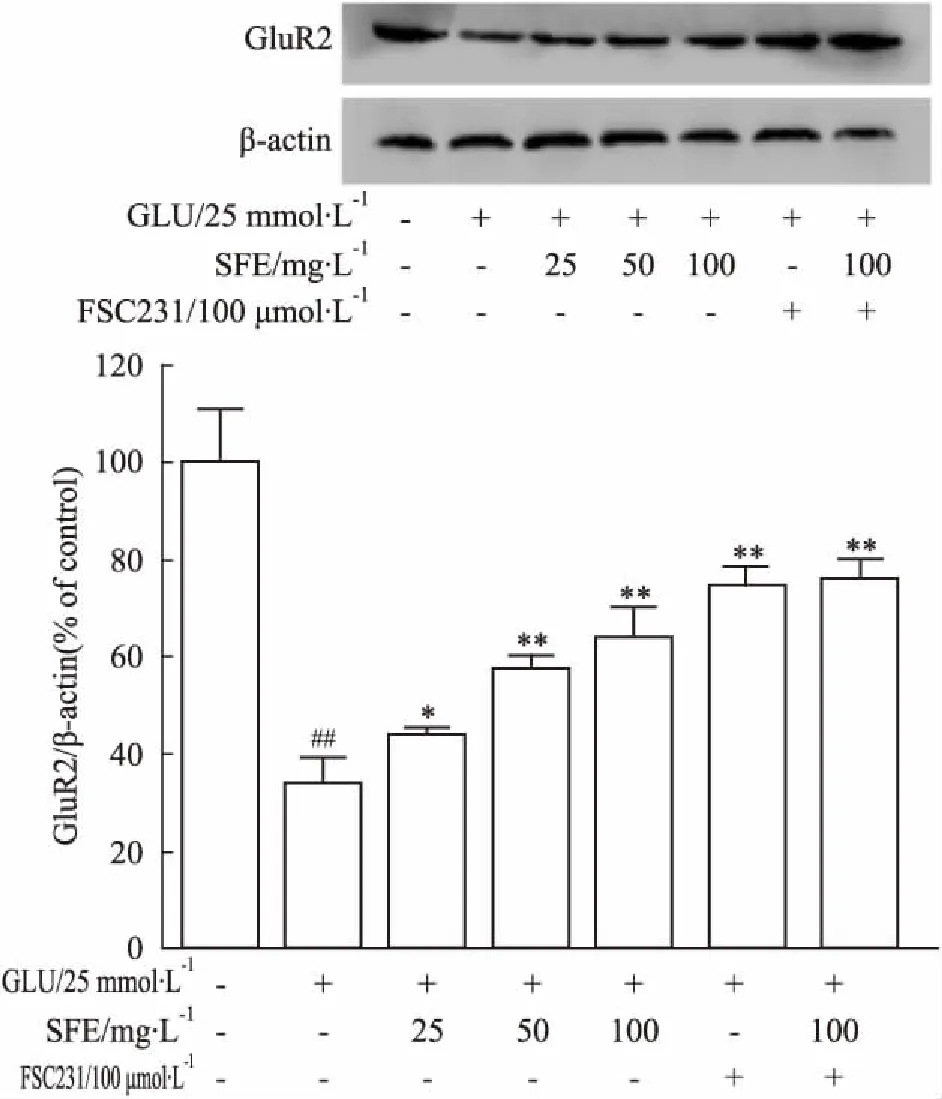
Fig 8 Effect of SFE on expression levels of GluR2 in PC12 cells
##P<0.01vscontrol group;*P<0.05,**P<0.01vsmodel group
本实验结果表明,单用三七SFE和单用PICK1抑制剂对细胞存活率影响不大,后期检测指标主要以正常对照组做参照。25 mmol·L-1谷氨酸作用于PC12细胞后,与正常对照组比较,细胞存活率降低、LDH漏出率升高、细胞凋亡率升高、细胞内钙离子浓度升高、PICK1与GluR2蛋白表达均降低;三七SFE(25、50、100 mg·L-1)、FSC231、三七SFE+FSC231可以提高细胞存活率、降低LDH漏出率、减少细胞凋亡、减少细胞内钙离子浓度、降低PICK1蛋白表达、增加GluR2蛋白表达,并在三七SFE浓度为25~100 mg·L-1时呈一定的量效关系。此外,三七SFE+FSC231组与FSC231抑制剂组PICK1、GluR2两种蛋白表达差异无显著性,表明三七SFE很有可能通过抑制PICK1和GluR2间相互作用来发挥神经保护作用。
本实验初步从分子水平探讨了三七SFE的神经保护作用,其机制可能与抑制PICK1、增加GluR2蛋白表达、减少钙离子内流有关,但三七SFE对PICK1与GluR2蛋白共表达是否有影响及萃取物中何种成分发挥作用有待于进一步研究。
[1] 赖文芳, 张小琴, 洪海棉, 等. 红景天苷对大鼠局灶性脑缺血/再灌注损伤的神经保护作用[J]. 中国药理学通报, 2015,31(6):775-80.
[1] Lai W F, Zhang X Q, Hong H M, et al. Neuroprotective effects of salidroside against focalcelebral ischemia/reperfusion injury in rats[J].ChinPharmacolBull, 2015,31(6):775-80.
[2] 张 雯, 宋俊科, 何国荣, 等. 银杏二萜内酯对缺血/再灌注大鼠脑组织中神经递质的影响[J]. 中国药理学通报, 2016,32(12):1648-56.
[2] Zhang W, Song J K, He G R, et al. Effects of diterpene ginkgolides meglumine injection on neurotransmitters in cerebral ischemia-reperfusion injury rats[J].ChinPharmacolBull,2016,32(12):1648-56.
[3] Jiang G, Wu H, Hu Y, et al. Gastrodin inhibits glutamate-induced apoptosis of PC12 cells via inhibition of CaMKII/ASK-1/p38 MAPK/p53 signaling cascade[J].CellMolNeurobiol, 2014,34(4):591-602.
[4] Sanderson J L, Gorski J A, Gibson E S, et al. AKAP150-anchoredcalcineurin regulates synaptic plasticity by limiting synaptic incorporation of Ca2+-permeable AMPA receptors[J].JNeurosci,2012,32(43):15036-52.
[5] Descalzi G, Li X Y, Chen T, et al. Rapid synaptic potentiation within the anteriorcingulate cortex mediates trace fear learning[J].MolBrain,2012,5(1): 1-14.
[6] Ammendrup-Johnsen I,Thorsen T S,Gether U, et al. Serine 77 in the PDZ domain of PICK1 is a protein kinase Cα phosphorylation site regulated by lipid membrane binding[J].Biochemistry, 2012,51(2):586-96.
[7] 李 光, 邢小燕, 张美双, 等. 中药三七对缺血/再灌注损伤的保护作用及应用前景[J]. 中国药理学通报, 2015,31(10): 1340-4.
[7] Li G, Xing X Y, Zhang M S, et al. Panax notoginseng in treatment of myocardial ischemia/reperfusion injury and its application prospect[J].ChinPharmacolBull, 2015,31(10): 1340-4.
[8] 孙文卿, 刘志辉, 徐萍萍, 等. 三七总皂甙对脑缺血/再灌注模型大鼠神经行为学及海马区VEGF表达的影响[J]. 潍坊医学院学报, 2016,38(2): 81-3.
[8] Sun W Q, Liu Z H, Xu P P, et al. Effects of the Panax Notoginsen saponins on expression of vscular endothelial growth factor in the hippocsampus of rats with ischemia reperfusion rats[J].ActaAcadMedWeifang,2016,38(2): 81-3.
[9] 段贤春, 夏伦祝, 汪永忠, 等. 人参炔醇对氧糖剥夺神经细胞损伤的保护作用[J]. 中国实验方剂学杂志, 2011,17(16): 180-3.
[9] Duan X C, Xia L Z, Wang Y Z,et al. Protective effects of panaxynol on nerve cells under oxygen and glucose deprivation[J].ChinJExpTraditMedForm, 2011,17(16): 180-3.
[10] Gharibani P M, Modi J, Pan C, et al. The mechanism of taurine protection against endoplasmic reticulum stress in an animal stroke model of cerebral artery occlusion and stroke-related conditions in primary neuronal cell culture[J].AdvExpMedBiol, 2013,776:241-58.
[11] Sanderson J L,Gorski J A,Gibson E S, et al. AKAP150-anchored calcineurin regulates synaptic plasticity by limiting synaptic incorporation of Ca2+-permeable AMPA receptors[J].JNeurosci,2012,32(43):15036-52.
[12] Thomas G M, Huganir R L. Palmitoylation-dependent regulation of glutamate receptors and their PDZ domain-containing partners[J].BiochemSocTrans,2013,41(1): 72-8.

